Похожие презентации:
Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік
1. С.Ж. Асфендияров атындағы ҚазҰМУ химия кафедрасы
Сулы ерітінділер.Тірі ағза сұйықтықтарындағы тепе-теңдік
Дәріскер:
кафедра меңгерушісі,
АҚШ академигі,х.ғ.д., профессор Әлиев Н.Ө.
2. Дәріс жоспары
1. Су әмбебап еріткіш ретінде. Ағза тіршілігіндеерітінділердің маңызы
2. Ерітінділердің коллигативтік қасиеттері және
осмостық шиеленіс теориясы. Биологиялық
жүйелердегі осмос және осмостық қысымның рөлі
3. Протолиттік тепе-теңдік және қышқылдық-негіздік
гомеостазды бір қалпында ұстап тұру үшін
буферлік жүйелердің атқаратын рөлі
4. Биохимиялық тотығу-тотықсыздану процестерінің
ерекшеліктері. Тотықтырғыштар мен
тотықсыздандырғыштардың медициналық-санитарлық
тәжірибеде қолданылуы
3.
Тірі ағзада судың атқаратын ролі:ағзада зат алмасу процестеріне белсене қатыса отырып
қоректік
заттардың
тасымалдануы
мен
сіңірілуін
қамтамасыз етеді;
адам ағзасының 60% судан тұрады;
ағзадағы судың 42% жасушаның ішкі сұйықтығын құраса,
қалғаны - сыртқы (жасушааралық) сұйықтықты құрайды;
су тіршілік процестерінде, атап айтқанда ісіну, осмос т.б.
белсенді роль атқарады, қанда және ұлпаларда
онкотикалық қысымның белгілі бір шамасын құрайды;
күнделікті судың қажеттілігі 1 кг дене салмағына ересек
адам үшін 35 г, сәби үшін 100-130 г құрайды;
Адам ағзасы 20%
суды жоғалтқанда жасушаларда
болатын қайтымсыз өзгерістердің нәтижесінде адам
қазаға ұшырайды.
4. Ерітінді
Ерітінді – екі немесе одан да көп компоненттерден(жеке заттардан) тұратын гомогенді жүйе.
Қанықпаған ерітінді – концентрациясы каныққан
ерітіндінің концентрациясынан төмен болатын,
берілген жағдайлар өзгеріссіз болғанда еріген
заттың қосымша мөлшерін еріте алатын ерітінді.
Қаныққан ерітінді –еритін зат тұнбасымен динамикалық
тепе-теңдік күйде болатын, заттың еру жылдамдығы мен
кристалдану жылдамдығы тең болатын ерітінді.
Аса қанық ерітінді - концентрациясы каныққан ерітіндінің
концентрациясынан жоғары болатын, термодинамикалық
тұрақсыз ерітінді.
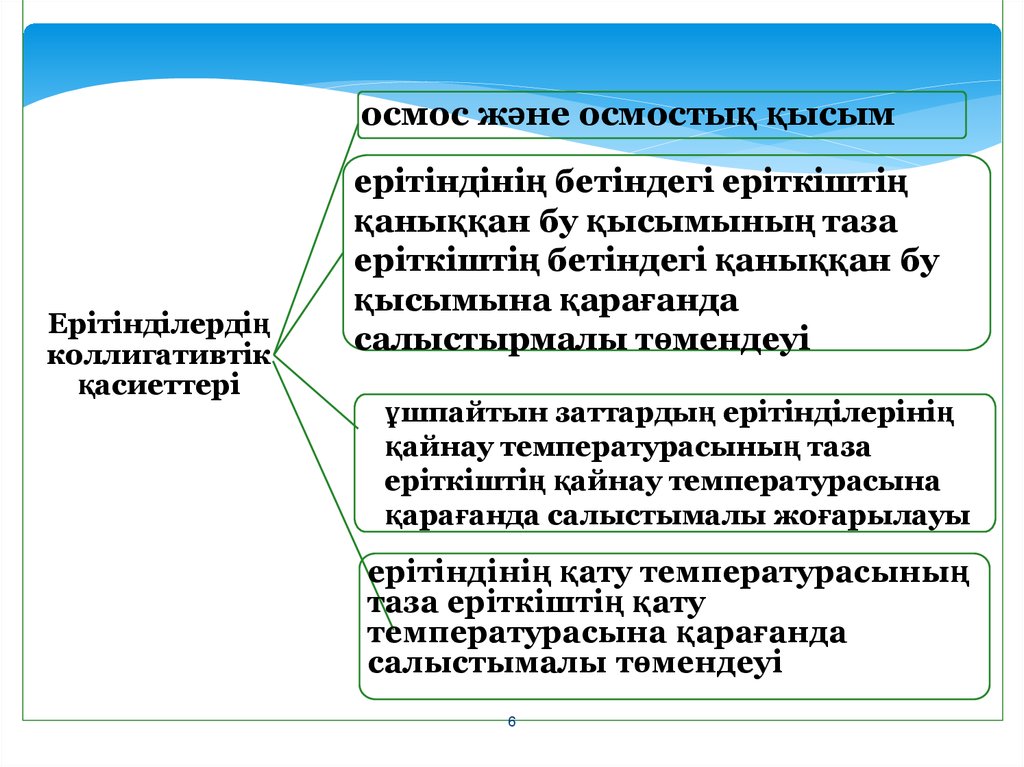
5.
Ерітінділердіңколлигативтік қасиеттері
- салыстырмалы сипаттамалары
еріген заттың табиғатына
тәуелсіз, тек бөлшектерінің
санына ғана тәуелді қасиеттері
6.
осмос және осмостық қысымЕрітінділердің
коллигативтік
қасиеттері
ерітіндінің бетіндегі еріткіштің
қаныққан бу қысымының таза
еріткіштің бетіндегі қаныққан бу
қысымына қарағанда
салыстырмалы төмендеуі
ұшпайтын заттардың ерітінділерінің
қайнау температурасының таза
еріткіштің қайнау температурасына
қарағанда салыстымалы жоғарылауы
ерітіндінің қату температурасының
таза еріткіштің қату
температурасына қарағанда
салыстымалы төмендеуі
6
7. Сұйылтылған бейэлектролит ерітінділерінің коллигативтік қасиеттері
Осмос – еріткіш молекулаларының өздігіненжартылай өткізгіш мембрана арқылы
сұйылтылған ерітіндіден концентрлі ерітіндіге
қарай бағытталған түрде өтуі
Осмос
8. Сұйылтылған бейэлектролит ерітінділерінің коллигативтік қасиеттері
Осмостық қысым ( ) – осмосты тоқтату үшінерітіндіге қажет қысым, яғни, осмос құбылысын
туғызатын күш
9.
Росм (адам қанының) = const және 370С-та740 – 780 кПа-ға немесе 7,4-7,8 атм –ға тең
10.
Рауль заңы:Сұйылтылған бейэлектролит ерітіндісінің бетіндегі
қаныққан бу қысымының салыстырмалы төмендеуі
еріген заттың табиғатына тәуелсіз және
ерітіндідегі еріген заттың мольдік үлесіне тең
болады. p
p0 p
n
( x ) немесе ,
p0
p0
n N
мұндағы
p = p0 - p
p0 – таза еріткіштің үстіндегі қаныққан бу қысымы, Па;
р – ерітіндінің үстіндегі еріткіштің қаныққан бу қысымы, Па;
(x) – еріген заттың мольдік үлесі;
n – еріген зат мөлшері, моль;
N – еріткіштің зат мөлшері , моль.
11.
Рауль заңынан туындайтынбірінші салдар:
Ерітіндінің қату температурасының еріткіштің қату
температурасына қарағанда салыстырмалы
төмендеуі еріген заттың моляльдық
концентрациясына тура пропорционал болады:
Тқату = К.в(х),
мұндағы
в(х) – ерітіндідегі еріген заттың моляльдық
концентрациясы, моль/кг;
К – еріткіштің криоскопиялық тұрақтысы,
К.кг/моль;
Тқату = Тқату(ер-ш) – Тқату(ер-ді)
12.
Рауль заңынан туындайтынекінші салдар:
Ерітіндінің қайнау температурасының еріткіштің қайнау
температурасына қарағанда салыстырмалы
жоғарылауы еріген заттың моляльдық
концентрациясына тура пропорционал болады:
Тқайнау = Е.в(х),
мұндағы
в(х) – ерітіндідегі еріген заттың моляльдық
концентрациясы, моль/кг;
Е – еріткіштің эбуллиоскопиялық тұрақтысы,
К.кг/моль;
Тқайнау = Тқайнау(ер-ді) – Тқайнау(ер-ш)
13.
Вант-Гофф заңы:Берілген температурада сұйылтылған ерітіндінің
осмостық қысымы еріген заттың молярлық
концентрациясына тура пропорционал.
Р осм. =СМRT –
мұндағы
C- ерітіндінің молярлық концентрациясы, моль/л;
R - 8,314 Дж/(моль.К) тең болатын универсалды
газ тұрақтысына сәйкес шама
T - температура, К.
14.
Физиологиялық ерітінділерБұл қан плазмасына изотонды ерітінділер
0,9 % NaCl
4,5 – 5 % глюкоза ерітіндісі
Физиологиялық емес ерітінділер
Росм (ер-ді) > Росм (плазма), ерітінді гипертонды
болады
Росм (ер-ді) < Росм (плазма), ерітінді гипотонды
болады
www.themegallery.com
15.
123456қышқыл
7
бейтарап
8 9 10 11 12 13 14
сілтілік
16. БУФЕРЛІК ЖҮЙЕЛЕР
Буферлік жүйелер – сырттан әсерболғанда өзінің қандай да бір параметрінің
шамасын өзгертпей, тұрақты қалпында
сақтайтын жүйелер
17. Қанның буферлік жүйелері
АтауыҚанның буферлік жүйелері
Гидрокарбонатты
Құрамы
Н2СО3; НСО3-
Буферлік әсерді сипаттайтын
тепе-теңдік
НСО 3 Н Н 2 СО3
Н 2СО3 ОН НСО 3 Н 2О
СО2 Н 2О Н 2СО3
Фосфатты
Н2РО4-; НРО42-
СО2 Н 2О Н 2СО3
Н 2 РО 4 ОН НРО 24 Н 2О
Гемоглобинді
(окси
гемоглобинді)
ННb; Нb(ННbО2; НbО2-)
Hb H HHb
HHb OH Hb - H2O
HbO -2 H HHbO 2
HHbO 2 OH HbO 2 H 2O
ақуызды
PtCOОH; PtСOONa
HHb O2 HHbO 2
PtCOO- H PtCOOH
PtCOOH OH PtCOO- H2O
18.
Буферлік ерітінділердің әсер ету механизміНА Н+ + А–
а/
А– + Н+ НА [күшті қышқыл қосқанда]
б/
НА + ОН– Н2О + А– [сілті қосқанда]
19.
Гидрокарбонатты буферлік жүйенің әсер ету механизміГидрокарбонатты буферлік жүйеге күшті
қышқыл немесе сілті қосқанда:
HCl + NaHCO3
NaOH + H2CO3
NaCl + H2CO3
H 2O
CO2
NaHCO3 + H2O
Жүйеге күшті қышқыл қосқанда Н+ иондары тұз
аниондарымен әрекеттесіп нашар диссоциацияланатын Н2СО3
түзіледі, нәтижесінде күшті қышқылға эквивалентті
мөлшерде әлсіз қышқыл түзіледі , көмір қышқылының
концентрациясы көбейеді, дисоцияциалану дәрежесі
төмендейді, сондықтан рН мәні өзгеріссіз қалады.
Сілті қосқанда гидроксил-иондары (ОН-) көмір
қышқылының Н+иондарымен әрекеттеседі. нәтижесінде сілті
эквивалентті мөлшерде , ерітінідінің рН мәнін өзгертпейтін, әлсіз
қышқылдың тұзына ауысады.
20.
,Буферлік сиымдылық
Ерітіндінің буферлік сиымдылығы (В) - бір литр
буферлік
ерітіндінің
рН-ң мәнін
бір бірлікке
өзгерту
үшін
мұндағы
Сa– күшті
қышқыл эквивалентінің
молярлық
концентрациясы,
моль/л;
қосылатын
күшті күшті
қышқылдың
немесе
күшті негіздің молVa– қосылған
қышқыл көлемі,
мл;
Vб – буферлік
ерітіндінің
көлемі,тең
мл; болатын шама
эквивалентінің
сандық
мәніне
ΔрН – күшті қышқыл қосқан кездегі буферлік ерітіндінің сутектің көрсеткішінің
өзгерісі.
мұндағысиымдылықты
Сa– күшті қышқыл эквивалентінің
концентрациясы,
Буферлік
қышқылмолярлық
бойынша
анықтау
моль/л;
С a Va
Ва
Vб ΔpH
(Ва)
мұндағы Сa– күшті қышқыл эквивалентінің молярлық концентрациясы,
моль/л;
Va– қосылған күшті қышқыл көлемі, мл;
Vб – буферлік ерітіндінің көлемі, мл;
ΔрН – күшті қышқыл қосқан кездегі буферлік ерітіндінің сутектің
көрсеткішінің өзгерісі.
Буферлік сиымдылықты негіз бойынша анықтау (Вb)
С b Vb
Вb
Vб ΔpH
21.
Механизм действия гидрокарбонатнойбуферной
системы
Ацидоз – физиологиялық
жүйенің
қышқылдық-сілтілік
тепе-теңдігінің сутек иондарының
Действие гидрокарбонатного буфера при попадании в него
концентрацияларының
өсуіне
(рН-тың
кемуіне)
және
сильной кислоты или щелочи
можно
записать
реакциями:
сілтілік резервінің кемуіне қарай ығысуы
H 2O
+ NaHCO3
NaClжүйенің
+ H2COқышқылдық-сілтілік
3
Алкалоз HCl
– физиологиялық
CO2
тепе-теңдігінің
иондарының
NaOH + Hсутек
NaHCO3 + H2O
2CO3
Ағза
тіршілігі үшін қанның рН-ңкемуіне
өзгеру шегі
концентрацияларының
(рН-тың өсуіне) және
При резервінің
добавлении картуына
системе қарай
сильнойығысуы
кислоты ионы Н+
сілтілік
взаимодействуют с анионами соли, образуя слабодиссоциирующую
Н2СО3. Сильная кислота заменяется эквивалентным количеством
Ағза
тіршілігі
үшін
қанның рН-ң
слабой кислоты,
диссоциация
которой
подавлена.
При добавлении щелочи
гидроксил-ионы
(ОН-)
өзгеру
шегі
взаимодействуют с ионами Н+ угольной кислоты.Щелочь заменяется
эквивалентным количеством соли, почти не изменяющей величину рН
раствора.
22.
• Тотығу-тотықсыздану электроды –редокс жүйемен үйлескен инертті
металл, бұл электродта пайда болатын
потенциал редокс потенциал деп
аталады. Инертті металл
тотықсызданған түрден (Red) тотыққан
түрге (Ox) электрондардың
тасымалдану кезінде делдалдық қызмет
атқарады
23.
Ағзадағы тотығу-тотықсыздану процестердіңсипаттамасы:
биологиялық тотығу – ағзаның тіршілігіне керекті
энергия АТФ-ң макроэргиялық байланыстарында
нәтижесінде бөлініп, от алады;
тотығатын субстраттан оттекке қарай
электрондардың және протондардың
тасымалдануы әрқайсысы белгілі бір редокспотенциал мәнімен сипатталатын редоксжүйелердің тізбегі бойынша жүзеге асырылады;
тізбектегі редокс-жүйелердің қатаң реттілігі
потенциалдар арасында үлкен айырмашылықты
болдырмау нәтижесінде тотығу энергиясы үнемі
бөлініп отырады .
24.
25.
Эквивалентті нүктені анықтау26.
Тотықтырғыштар мен тотықсыздандырғыштардыңмедициналық-санитарлық тәжірибеде қолданылуы
Хлор, озон (суды озондау), сутегі асқын тотығы, йод
ерітіндісі тәрізді көптеген тотықтырғыштар
микроорганизмдерді жою үшін бактериялық құрал
ретінде қолданылады;
Тотықтырғыштармен уланғанда (мысалы броммен),
аммиакты, яғни, тотықсыздандырғышты қолданады;
Тотықсыздандырғыштармен уланғанда (мысалы
күкіртсутекпен) хлорлы әктің дымқыл буын
қолданады;
Фосфор ағзаға енгенде асқазанда калий
перманганатымен немесе мыс сульфатымен жуады;
Тотығу-тотықсыздану реакциялары диагностика
үшін де қолданылады. Алкоголь ішкен-ішпегендігін білу
үшін этил спиртін тотықтыратын хром (VI) оксидін
пайдаланады.


























 Химия
Химия








