Похожие презентации:
Потенциал действия
1.
Раздел «Потенциал действия»В 1939 г. А. Ходжкин и А. Хаксли зарегистрировали потенциал действия (ПД)
от гигантского аксона кальмара. Оказалось, что потенциал мембраны аксона
при возбуждении меняет знак (становится положительным), так же как и в
экспериментах Ю. Бернштейна, выполненных на мышце.
HODGKIN, A. L. AND A. F. HUXLEY Action potentials recorded from inside a nerve fibre. Nature 1939, 144: 710–711
А. Ходжкин (A. Hodgkin, 1949 г.)
А. Хаксли (A. Huxley, 1974 г.)
2.
Нобелевскую премию кальмару за его гигантский аксон !!!В 1936 г. английский зоолог Дж. Янг описал особые длинные тяжи у кальмаров и каракатиц, которые оказались необычайно толстыми аксонами,
а не кровеносными сосудами, как считалось ранее. Они получили название гигантских аксонов и стали излюбленным объектом для изучения функций.
Young JZ (1936) Structure of nerve fibres and synapses in some
invertebrates. Cold Spring Harb Symp Quant Biol 4:1–6
Кальмар Loligo и его гигантские аксоны. Благодаря своим крупным размерам эти аксоны
быстро проводят возбуждение, обеспечивают
тем самым синхронную активацию мышц мантии. Сокращаясь, эти мышцы вызывают резкий
выброс воды, благодаря чему кальмар делает
бросок назад.
3. Гигантский аксон кальмара
(A) Diagram of a squid, showing the location of its giant nerve cells. Different colors indicate
the neuronal components of the escape circuitry. The first- and second-level neurons
originate in the brain, while the third-level neurons are in the stellate ganglion and innervate
muscle cells of the mantle.
(B) Giant synapses within the stellate ganglion. The second-level neuron forms a series of
fingerlike processes, each of which makes an extraordinarilylarge synapse with a single
third-level neuron.
(C) Structure of a giant axon of athird-level neuron lying within its nerve. The enormous
difference in the diameters of a squid giant axon and a mammalian axon are shown below.
4.
Потенциал действияПД, зарегистрированные А. Ходжкином и А. Хаксли от гигантского аксона
кальмара, помещенного в морскую воду.
HODGKIN, A. L. AND A. F. HUXLEY Action potentials recorded from inside a nerve fibre. Nature 1939, 144: 710–711
2 мс
5.
Потенциал действияПД, зарегистрированные А. Ходжкином и А. Хаксли от гигантского аксона
кальмара, помещенного в морскую воду.
HODGKIN, A. L. AND A. F. HUXLEY Action potentials recorded from inside a nerve fibre. Nature 1939, 144: 710–711
~110 мВ
-8 мВ
-58 мВ
2 мс
1 мс
6.
Оказалось, что амплитуда ПД зависела отконцентрации ионов Na+ во внешнем растворе. При этом потенциал покоя практически не изменялся.
Таким образом, предположения Э. Овертона были подтверждены прямыми экспериментами.
аксон кальмара
миелинизированный нерв лягушки
I – потенциал покоя; II – потенциал действия (по Ходжкину, 1951)
7.
Натриевая гипотезаПри отсутствии ионов Na+ в наружной среде ПД не возникает. На основании таких результатов было высказано предположение, что фаза
подъема и «вершина» ПД (overshoot) обусловлены временным повышением проницаемости мембраны для ионов Na+ и его входом в клетку.
Следует отдать должное современнику Ю. Бернштейна Э. Овертону, который в 1902 г. сделал важное открытие, состоящее в том, что для генерации ПД в нерве необходим Na+. На основании своих результатов он
впервые выдвинул предположение о том, что развитие ПД обусловлено
Na+-проводимостью. Однако результаты Э. Овертона остались без
должного внимания со стороны современников.
Концентрация ионов Na+ во внеклеточной среде примерно в 10 раз выше, чем внутри клетки, поэтому ENa+ составляет +50-60 мВ. Абсолютное значение потенциала на вершине ПД в экспериментах А. Ходжкина
и А. Хаксли находилось в этих пределах.
[Na+]out
RT
ENa+ =
ln
nF
+
[Na ]in
58 мВ
8.
9. Изменения потенциала мембраны во время генерации ПД обуславливаются несколькими токами:
Na+- и К+-проводимости (gNa и gK) и результирующие токи (INa иIK) сложным образом зависят как от времени t, так и от изменяющегося во времени мембранного потенциала V(t):
INa(V,t) = gNa(V,t) [V(t) – ENa],
IK(V,t) = gK(V,t) [V(t) – EK],
Быстрый ионный тока Iion, текущий через мембрану, представляет собой сумму Na+- и K+-токов:
Iion(V,t) = INa(V,t) + IK(V,t).
10. Изменения потенциала мембраны во время генерации ПД обуславливаются несколькими токами:
В мембранах нейронов присутствует также так называемый токутечки IL (от англ. leak), протекающий через другие (потенциалнезависимые) каналы. В мембранах аксонов (например, аксона
кальмара) этот ток слабо выражен и вклад его в изменение потенциала относительно незначим. Однако в мембранах нейронов
этот ток сопоставим с потенциал-зависимыми токами, поэтому
его также необходимо учитывать при расчете потенциала:
IL(V,t) = gL(V, t) [V(t) – EL].
11. Изменения потенциала мембраны во время генерации ПД обуславливаются несколькими токами:
Быстрые изменения потенциала при развитии ПД приводят к генерацииемкостного тока IC, который обуславливает заряд и разряд мембранной
емкости Cm:
IС(t) = Cm dV(t)/dt.
Необходимо отметить, что этот ток
зависит только от времени.
Таким образом, общий ток IM(V,t) при генерации ПД представляет собой
сумму перечисленных токов:
IM(V,t) = INa(V,t) + IK(V,t) + IL(V,t) + IС(t)
12. Проблема измерения токов
Разделение перечисленных токов, зависимых как от времени, так и
самого потенциала, представляет собой трудную задачу и требует
использования нескольких специальных методов одновременно.
Например, чтобы доказать, что в основе ПД лежат изменения
проводимостей для Na+ и К+, необходимо напрямую измерить эти
показатели. Однако чтобы решить эту задачу необходимо
преодолеть две проблемы:
1) токи, протекающие через мембрану, приводят к изменению
мембранного потенциала, что в свою очередь вызывает изменения
проводимостей. Эта проблема была решена при использовании
методики фиксации потенциала, разработанной К. Коулом. При
неизменном уровне потенциала токи будут отражать изменения
проводимости мембраны, которые не зависят от потенциала.
2) чтобы исследовать токи Na+ и К+, а также ток утечки в
отдельности, их надо разделить. В ранних исследованиях Na+ во
внешнем растворе заменяли на катионы большого размера
(холин), не проникающий через мембрану. Затем стали
использовать селективные блокаторы для каждого типа ионных
каналов.
13.
Эквивалентная электрическая схема мембраны аксонаИонный ток, который протекает через
единицу площади мембраны во время генерации ПД, описывается уравнением:
Im = Cm V/ t + Ii
Im - общий ток, протекающий через
мембрану;
Cm - емкость мембраны;
V - потенциал
t
- время
Ii
- ионный ток.
Заряд мембранной емкости записан
в частных производных, так как ПД
распространяется по волокну, то
есть изменяется как во времени, так
и в пространстве.
14.
Фиксация пространстваИспользуя длинные стимулирующий (внутри
аксона), регистрирующий (внутри аксона) и
внешний электроды, можно исключить распространение ПД по волокну, и ПД (так называемый «мембранный ПД») возникает во всех
фрагментах волокна одновременно. Уравнение в частных производных заменяется уравнением в обычных производных:
Im = Cm dV/dt + Ii
15.
Фиксация потенциалаЕсли потенциал зафиксировать на обкладках мембранного конденсатора
(производная постоянной величины равна 0, т.е. dV/dt = 0), то мембранная емкость «выключается», и уравнение упрощается до:
Im = Ii
16.
Принцип работы электрической схемы для фиксации потенциала на мембране аксонаРазность потенциалов по разные стороны мембраны фиксируется с помощью электронной системы с обратной связью. При этом потенциал можно
ступенчато изменять на любую величину.
Такой метод позволяет измерять ионные токи, протекающие через мембрану через каналы, которые активируются при изменении потенциала.
17.
Принцип работы электрической схемы для фиксации потенциала на мембране аксонаВ соответствии с законом Ома, если напряжение на мембране постоянно,
изменения тока однозначно связаны с изменениями проводимости g (обратной сопротивлению R), которые в свою очередь связаны с открыванием
и закрыванием ионных каналов.
V = I*R = I/g const
18.
Принцип работы электрической схемыдля фиксации потенциала
При помощи усилителя-регулятора внутриклеточный потенциал сравнивают с управляющим потенциалом.
Отклонение мембранного потенциала от управляющего усиливается, и
на выходе усилителя возникает управляющий ток.
Этот ток течет через электроды, расположенные по разные стороны
мембраны, в таком направлении, что мембранный потенциал вновь становится равным управляющему.
19.
Принцип работы электрической схемыдля фиксации потенциала (продолжение)
В ответ на ступенчатую деполяризацию открываются натриевые (или какиелибо другие) каналы, соответствующие ионы входят в аксон по электрохимическому градиенту и переносят с собой электрические заряды.
Эти заряды сдвигают мембранный потенциал в сторону деполяризации, однако, это отклонение компенсируется в результате удаления из клетки избыточных зарядов с помощью усилителя-регулятора.
При этом записывается ток, который подается усилителем для поддержания
мембранного потенциала на необходимом уровне. Этот противоположный по
знаку ток равен по абсолютной величине ионному току, протекающему через
мембрану.
20. Этот метод оказался революционным для своего времени, поскольку предоставил ряд принципиальных возможностей для исследования возбудимос
Этот метод оказался революционным для своего времени, посколькупредоставил ряд принципиальных возможностей для исследования
возбудимости клеточных мембран:
Емкостной ток IС был удален из общего тока, поскольку он имеет место
только во время быстрых процессов и развивается в первые несколько мкс.
При длительном поддержании потенциала на постоянном уровне
дифференциал dV(t)/dt=0, и, следовательно, IС=0. Относительно медленные
(порядка нескольких мс) ионные токи более продолжительны и поэтому
могут быть измерены независимо от IС.
Мембранный потенциал может быть зафиксирован на любом тестовом
уровне и оставаться на этом постоянном уровне сколь угодно долго. При
этом представляется возможным регистрировать временную динамику
результирующих потенциал-зависимых токов, активируемых изменением
потенциала.
Варьируя амплитудой приращения потенциала, выявляют зависимость
ионной проводимости от мембранного потенциала.
21. Этот метод оказался революционным для своего времени, поскольку предоставил ряд принципиальных возможностей для исследования возбудимос
Этот метод оказался революционным для своего времени,поскольку предоставил ряд принципиальных возможностей
для исследования возбудимости клеточных мембран:
Фиксируя на мембране определенный (кондиционирующий) уровень
потенциала для стабилизации ее состояния, можно исследовать процессы
активации и инактивации ионных каналов в зависимости времени и
потенциала.
Изменяя концентрации ионов по обе стороны мембраны и/или устраняя
определенную ионную проводимость с помощью нейротоксинов,
специфически блокирующих ионную проводимость, можно установить
относительный вклад INa и IK в общий ионный ток.
Существенным дальнейшим развитием метода явилось применение
длинных внутренних и внешних электродов, что позволило «зафиксировать
пространство» - так называемый прием «фиксации пространства». Это
обеспечивало постоянный уровень трансмембранного потенциала и
одновременное протекание одинаковых процессов в любой точке
внутриклеточного и внеклеточного пространствах без искажений, которые
могли иметь место при распространении локальных изменений потенциала
и, соответственно, ионных токов вдоль мембраны.
22. Схема усилителя с обратной связью
Hodgkin AL, Huxley AF,Katz B (1952)
Measurement of currentvoltage relations in the
membrane of the giant
axon of Loligo.
J Physiol (Lond) 116:
424–448
23. Ионные токи во время генерации ПД в аксоне кальмара
Hodgkin AL, Huxley AF, Katz B (1952)Measurement of current-voltage relations
in the membrane of the giant axon of
Loligo.
J Physiol (Lond) 116:424–448
24.
Ионные токи во время генерации ПД в аксоне кальмараМетодика фиксации потенциала позволяет регистрировать ионные
токи, проходящие через возбудимую мембрану во время генерации
ПД. Таким образом можно получить «вольт-амперные» характеристики мембраны аксона. С использованием этого метода в 1952 г.
А. Ходжкин, А. Хаксли и Б. Катц впервые измерили ионные токи,
проходящие через мембрану во время возбуждения.
Hodgkin AL, Huxley AF, Katz B
(1952)
Measurement of current-voltage
relations in the membrane of the
giant axon of Loligo.
J Physiol (Lond) 116:424–448
25.
Ионные токи во время генерации ПД в аксоне кальмараМетодика фиксации потенциала позволяет регистрировать ионные
токи, проходящие через возбудимую мембрану во время генерации
ПД. Таким образом можно получить «вольт-амперные» характеристики мембраны аксона. С использованием этого метода в 1952 г.
А. Ходжкин, А. Хаксли и Б. Катц впервые измерили ионные токи,
проходящие через мембрану во время возбуждения.
26.
Фармакологическое разделение мембранных токовА. Потенциал в нормальных условиях.
В. Блокирование Na+-тока тетродотоксином (ТТХ).
С. Блокирование К+-тока тетраэтиламмонием (ТЕА).
27. Временные динамики развития ПД (V) и определяющих его ионных проводимостей (gNa и gK), рассчитанные А. Ходжкиным и А. Хаксли на основе результат
Временные динамики развития ПД (V) и определяющих его ионныхпроводимостей (gNa и gK), рассчитанные А. Ходжкиным и А. Хаксли
на основе результатов экспериментов на гигантском аксоне
кальмара с использованием методики фиксации потенциала.
ENa и EK – обозначают уровни равновесных потенциалов для
соответствующих ионов.
28.
Временные динамики развития ПД (V) и определяющих его ионныхпроводимостей (gNa и gK), рассчитанные А. Ходжкиным и А. Хаксли
на основе результатов экспериментов на гигантском аксоне
кальмара с использованием методики фиксации потенциала.
29.
Инактивация натриевой проводимости мембраныМембранный потенциал предварительно фиксировали на определенном уровне (от -46 мВ, гиперполяризация
относительно
потенциала покоя (-65 мВ), до
+29 мВ, деполяризация).
Затем мембрану деполяризовали
на 44 мВ. В результате регистрировали входящий Na+-ток. Амплитуда тока увеличивалась с гиперполяризацией и уменьшалась
с деполяризацией.
30.
Инактивация натриевой проводимости мембраныА. Мембранный ток при фиксации потенциала на уровне потенциала покоя
(-65 мВ).
То же при фиксации потенциала на уровне:
-78 мВ (В);
-59 мВ (С);
-45 мВ (D).
31.
Инактивация натриевой проводимости мембраны(продолжение)
График зависимости пронормированной амплитуды тока от уровня мембранного потенциала, на котором мембрану предварительно фиксировали. «1» по оси ординат соответствует амплитуде тока при потенциале
покоя. По оси абсцисс - влево - гиперполяризация, вправо – деполяризация относительно потенциала покоя (-65 мВ).
При увеличении гиперполяризации амплитуда тока возрастает, что объясняется увеличением числа неинактивированных (потенциально «готовых» к активации) Na+-каналов.
При деполяризации, напротив, число неинактивированных каналов
уменьшается и, соответственно,
увеличивается число инактивированных каналов.
При гиперполяризации на ~30 мВ
все Na+-каналы неинактивированы
(т.е. потенциально готовы к активации).
32.
Инактивация натриевой проводимости мембраны(продолжение)
График зависимости пронормированной амплитуды тока от уровня мембранного потенциала, на котором мембрану предварительно фиксировали. «1» по оси ординат соответствует амплитуде тока при потенциале покоя. По оси абсцисс - вправо - гиперполяризация, влево – деполяризация
относительно потенциала покоя (принят за «0»).
При увеличении гиперполяризации амплитуда тока возрастает, что объясняется увеличением числа неинактивированных (потенциально «готовых» к активации) Na+-каналов.
При деполяризации, напротив, число неинактивированных каналов
уменьшается и, соответственно,
увеличивается число инактивированных каналов.
При гиперполяризации на ~30 мВ
все Na+-каналы неинактивированы
(т.е. потенциально готовы к активации).
33. Активационные и инактивационные механизмы проводимости мембраны
34. Активация калиевой проводимости
25 мВПП
gK = IK (V - VK)
HODGKIN, A. L. & HUXLEY, A. F. (1952)
The components of membrane conductance in the giant axon of Loligo
J. Physiol. 116, 473-496.
35.
Активация калиевой проводимости36.
Модель активации калиевой проводимостиЗависимость величины GK от времени. Вставленный
рисунок – то же в течение 1-ой секунды
37.
Кривая активации калиевой проводимостиЗависимость величины n∞ от потенциала
деполяризация
ПП
гиперполяризация
38.
Кривая активации калиевой проводимостиЗависимость величины n∞ от потенциала
гиперполяризация
ПП
деполяризация
39. Активация калииевой проводимости мембраны
• Для K+-проводимости А. Ходжкин и А. Хаксли ввели переменнуюn, которая отражает зависимость проводимости К+ от времени и
потенциала. Они использовали уравнение:
• gK = n4*GK
• В уравнении GK - максимальная проводимость для K+, когда все
K+-каналы открыты и способны пропускать ионы.
• Значения переменной n изменяются между «0» и «1» как функция
от времени и потенциала.
• n4 представляет долю от максимальной K+-проводимости в
данный момент времени.
40. Активация натриевой проводимости
6-109 мВПП
gNa = INa (V - VNa)
41.
Инактивация натриевой проводимостиgNa = INa (V - VNa)
42.
Активация и инактивация натриевой проводимости43.
Кривая активации натриевой проводимостиЗависимость величины m∞ от потенциала
деполяризация
ПП
гиперполяризация
44.
Кривая активации натриевой проводимостиЗависимость величины m∞ от потенциала
ПП
гиперполяризация
деполяризация
45.
Кривая инактивации натриевой проводимостиЗависимость величины h∞ от потенциала
деполяризация
ПП
гиперполяризация
46.
Кривая инактивации натриевой проводимостиЗависимость величины h∞ от потенциала
ПП
гиперполяризация
деполяризация
47.
АктивацияИнактивация
48. Активация и инактивация натриевой проводимости мембраны
• Для Na+-проводимости А. Ходжкин и А. Хаксли ввели переменныеm и h, которые отражают зависимость проводимости Na+ от
времени и потенциала. Они использовали уравнение:
• gNa = m3h*GNa
• В уравнении GNa - максимальная проводимость для Na+, когда все
Na+-каналы открыты и способны пропускать ионы.
• Значения переменных m и h изменяются между «0» и «1» как
функция от времени и потенциала.
• Произведение m3h представляет долю от максимальной Na+проводимости в данный момент времени.
49.
Активация и инактивация натриевойпроводимости мембраны
• Сначала они исследовали зависимость величин m
и h от потенциала, зафиксированного на мембране
в течение долгого времени.
50.
Активация и инактивация натриевойпроводимости мембраны
• Затем они описали зависимость
величин m и h от времени.
• В клетке в течение долгого
времени поддерживали
потенциал на некотором
постоянном уровне.
• Затем уровень потенциала
смещали ступенчатым образом
и фиксировали на некотором
другом уровне.
• При этом величины m и h
переходили на другой
стабильный уровень.
51. Инактивация натриевой проводимости мембраны (продолжение)
А. Ходжкин и А. Хаксли предложили простую умозрительную физическую
модель, которая в некоторой степени могла бы отражать реальность. Такая
модель помогает продемонстрировать, как входящий Na+-ток зависит от
времени и потенциала.
Na+-ток изменялся таким образом, что если бы он имел двое ворот, т.е. два
механизма, управляющих проводимостью. «Активационные» ворота быстро
открываются, когда клетка деполяризована до порогового уровня их активации.
«Инактивационные» ворота медленно закрываются, когда клетка
деполяризована выше порога их активации.
Допустим, что каждый Na+-канал имеет 3 активационных (m) и 1
инактивационные (h) ворота.
52. Инактивация натриевой проводимости мембраны (продолжение)
• Для отдельного канала переменная m отражает вероятность того,что одни m-ворота находятся в открытом состоянии. m3 –
вероятность того, что все трое m-ворот открыты.
• Для отдельного канала переменная h отражает вероятность того,
что h-ворота находятся в открытом состоянии.
• Произведение m3h отражает вероятность того, что все ворота (m и
h) открыты, и канал может пропускать ионы.
• Проводимость Na+-канала описывается уравнением:
• gNa = m3h*GNa
• gNa отражает долю от общего числа потенциально отрытых каналов
(GNa).
53.
Активация и инактивация натриевойпроводимости мембраны
• Схема чередования различных возможных состояний m и h-ворот
во время разных фаз генерации ПД (цикл А. Ходжкина):
54.
Активация и инактивация натриевойпроводимости мембраны
Фазы генерации ПД.
Числами отмечены фазы
ПД: 1 – ПП, 2 – восходящая,
3 нисходящая фазы ПД.
Vna и Vk - равновесные
потенциалы для
соответствующих ионов.
Схематическое отображение цикла А. Ходжкина.
Состояние активационных (для Na+ и K+) и
инактивационных (для Na+) ворот во время
различных фаз генерации ПД. Числами отмечены
фазы ПД.
55.
Активация и инактивация натриевойпроводимости мембраны
Схематическое отображение цикла
А. Ходжкина. Состояние
активационных (для Na+ и K+) и
инактивационных (для Na+) ворот во
время различных фаз генерации
ПД. Числами отмечены фазы ПД
(1 - А, 2 – Б, 3 – В).
56.
Схема чередования различных возможных состояний m, h и n-воротво время разных фаз генерации ПД (цикл А. Ходжкина)
m-ворота
каналы тока утечки
(leak channels)
n-ворота
h-ворота
57.
Активация и инактивация натриевойпроводимости мембраны
Зависимость состояния m- и h-ворот потенциал-зависимых Na+-каналов от
мембранного потенциала (МП, мВ).
В цикле А. Ходжкина доли открытых m- и h-ворот реципрокно изменяются в
зависимости от потенциала мембраны. При деполяризации примерно от -50
мВ и выше доля открытых m-ворот резко увеличивается, достигая уровня 50%
при деполяризации около -26 мВ (отмечено пунктиром, V50%), однако в это
время доля открытых инактивационных h-ворот уменьшается до 0. Модель
объясняет кратковременный характер входящего Na+-тока.
58. Воротные механизмы потенциал-зависимых Na+-каналов
А. Ходжкин и А. Хаксли предположили, что активация Na+-каналов связана соткрытием специальных «ворот», представляющих собой заряженные частицы
(диполи). Поворот диполя приводит к генерации воротного тока.
59.
Асимметричный ток смещенияВ условиях пониженной концентрации ионов Na+ в ответ на деполяризацию регистрируется малый по амплитуде выходящий ток, отражающий заряд мембранной емкости. Однако, в ответ на гиперполяризацию этот емкостной ток
меньше, чем в ответ на деполяризацию такой же амплитуды. Разность этих токов (воротный ток, или асимметричный ток смещения) соответствует перемещению зарядов, например, повороту диполя.
Воротный и Na+ токи
+ TTX
60.
Асимметричный ток смещенияВ условиях пониженной концентрации ионов Na+ в ответ на деполяризацию регистрируется малый по амплитуде выходящий ток, отражающий заряд мембранной емкости. Однако, в ответ на гиперполяризацию этот емкостной ток
меньше, чем в ответ на деполяризацию такой же амплитуды. Разность этих токов (воротный ток, или асимметричный ток смещения) соответствует перемещению зарядов, например, повороту диполя.
61.
Асимметричный ток смещенияА. Ходжкин высказал предположение, что при деполяризации происходит поворот белковой воротной (активационной) частицы (m-ворота), и таким образом открывается ионный канал. При возрастании деполяризации в результате
генерации ПД происходит поворот другой (инактивационной) частицы (hворота), и канал закрывается (инактивируется).
62.
Основные состояния натриевых каналов (цикл Ходжкина)В покое (мембрана не деполяризована) канал не пропускает ионы Na+,
поскольку закрыты m-ворота.
При деполяризации открываются m-ворота (активационные), и канал активируется (начинает пропускать ионы Na+).
При длительной деполяризации закрываются
h-ворота (инактивационные), расположенные
у внутренней стороны
мембраны,
и
канал
инактивируется (перестает пропускать ионы
Na+).
Реполяризация
мембраны до уровня ПП
вновь приводит к открыванию h-ворот и закрыванию m-ворот.
63.
Фазы рефрактерности потенциала действияПовторная стимуляция в период фазы абсолютной рефрактерности не вызывает генерации потенциала действия.
Красным обозначена величина порога активации мембраны.
Повторная стимуляция в период фазы относительной рефрактерности вызывает потенциал действия меньшей амплитуды.
64. Фазы рефрактерности потенциала действия
• Протеолитические ферменты (например, проназа или папаин),введенные внутриклеточно, ослабляют или даже устраняют Na+инактивацию, что приводит к аномально продолжительной Na+активации и, соответственно, к продолжительной деполяризации.
• Абсолютный рефракторный период ограничивает максимальную
частоту генерации ПД в нейронах и волокнах, тем самым
препятствуя нарушению ионного баланса между клеткой и
внеклеточной средой.
65. Фазы рефрактерности потенциала действия
• Воздействие деполяризации мембраны на процессы активации иинактивации Na+-проводимости имеет важное физиологическое
значение:
• 1) Ограничивает частоту ПД. Поскольку после развития ПД
следует период абсолютной рефрактерности, существует некий
минимальный временной интервал, по истечении которого может
генерироваться следующий ПД. Следовательно, этот интервал
ограничивает максимальную частоту ПД, генерируемых нейроном.
• 2) Приводит к аккомодации. Когда нервное волокно слабо
деполяризуется медленно нарастающим потенциалом (в отличие
от ступенчатой деполяризации), Na+-инактивация развивается
параллельно с Na+-активацией. Такая постепенно нарастающая
инактивация Na+-каналов препятствует генерации ПД вообще.
• 3) Имеет отношение к различным клиническим проявлениям.
Например, процесс аккомодации вызывает нервный, мышечный и
кишечный паралич, который обусловлен длительной
деполяризацией (деполяризационный блок).
66.
Механизм аккомодацииа – быстрое нарастание раздражающего стимула;
б – медленное нарастание раздражающего стимула;
v – потенциал; u – уровень порога
Если крутизна нарастания тока меньше некоторой критической
величины, то возбуждение вообще не возникает, независимо от того,
до какой величины доводится сила тока.
67.
Механизм аккомодацииAccommodation of the nerve membrane. Five superimposed traces show the
membrane response to linearly varing electrical stimuli with rates of rise
decreasing from a to e. Note that the critical firing level changes from a 21-mV
hypopolarization in a to a 28-mV hypopolarization in d, and no spike occurs in e.
Note also that the amplitude of the spike falls with decreasing rate of rise
(Frankenhaeuser and Vallbo, Acta Physiol Scand 63:1-20, 1965)
68.
В мембране перехвата Ранвье!!! у млекопитающих (А) К+ токи не регистрируются
у земноводных (В) К+ токи регистрируются.
69.
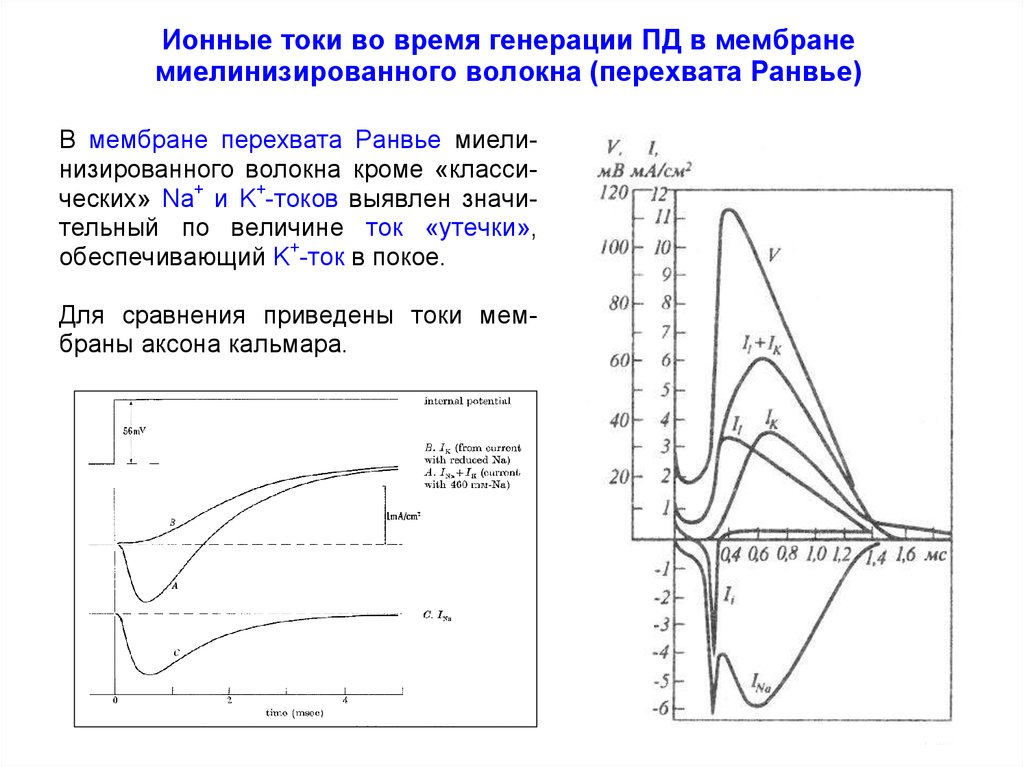
Ионные токи во время генерации ПД в мембранемиелинизированного волокна (перехвата Ранвье)
В мембране перехвата Ранвье миелинизированного волокна кроме «классических» Na+ и K+-токов выявлен значительный по величине ток «утечки»,
обеспечивающий K+-ток в покое.
Для сравнения приведены токи мембраны аксона кальмара.
70.
Проводимость во время генерации ПД в мембранемиелинизированного волокна (перехвата Ранвье)
В мембране перехвата Ранвье миелинизированного волокна проводимость
для K+ значительно меньше, чем в аксоне кальмара, и значительный вклад в
реполяризацию
обеспечивает
ток
«утечки».
Для сравнения приведены проводимости ионов в мембране аксона кальмара.
71. Генерация ПД в нейронах
Аксоны представляют собой относительно простое мембранное
образование, обеспечивающее проведение ПД по нервному волокну, и для
выполнения этой функции двух основных проводимостей (Na+ и K+) вполне
достаточно.
Нейроны выполняют в значительной степени больше разнообразных
функций, связанных с обработкой нервных сигналов, и поэтому
характеризуются сложной конфигурацией ионных каналов, обеспечивающих
им избыточные вариации импульсной активности.
В мембранах нейронов кроме известных в мембранах аксонов
• потенциал-зависимых Na+- и K+-каналов найдены
• потенциал-зависимые Ca2+-каналы,
• Са2+-активируемые К+-каналы,
• каналы, активируемые гиперполяризацией,
• ион-неселективные катионные токи
• и некоторые другие.
Разнообразные конфигурации ионных каналов в мембранах нейронов
позволяют изменять форму ПД и паттерны импульсных разрядов. Такие
модуляции импульсной активности, в частности, важны в пресинаптических
аксонных терминалях, где через вход Са2+ регулируется выброс медиатора.
72.
• Разнообразие форм ПД• a – схематичное
представление ПД с его
фазами развития.
• b – ПД гигантского аксона
кальмара. Этот ПД примерно
в 100 раз короче, чем ПД в
клетках сердечной мышцы (c)
или гладкой мускулатуры (d).
• Короткая восходящая фаза
обеспечивается Na+-проводимостью, а продолжительная
фаза деполяризации – Ca2+проводимостью.
• Бета-клетки поджелудочной
железы также генерируют ПД
(e), обусловленные Ca2+-проводимостью, и тем самым
запускают экзоцитоз
инсулина.
73. Метод внутриклеточного диализа
Метод разработан в Институте физиологии АН УССР (г. Киев) в начале1960-х г.г. под руководством академика АН СССР (РАН)
П.Г. Костюка (1924-2010).
74.
Метод внутриклеточного диализаМетод разработан в Институте физиологии
АН УССР в начале 60-х г.г. под руководством академика АН СССР П.Г. Костюка.
Изолированная нервная клетка помещается в пору, разделяющую два
отсека с независимыми контурами
перфузии.
Данная методика позволяет регистрировать электрические процессы на
мембране, внутренняя и внешняя
стороны которой находятся в контакте, соответственно, с вне- и внутриклеточными растворами.
Недостаток метода –
большое последовательное
сопротивление, создаваемое
порой.
75.
76. Метод внутриклеточного диализа
a.Baker PF, Hodgkin AL, Shaw TI (1962)
Replacement of the axoplasm of giant nerve
fibres with artificial solutions.
J Physiol 164:330–354
b,c.
Kostyuk PG, Krishtal OA, Pidoplichko VI
(1981) Intracellular perfusion.
J Neurosci Methods 4:201–210
77. Модификация метода внутриклеточного диализа
Strickholm A (1962)Excitation currents and impedance of a small
electrically isolated area of the muscle cell
surface.
J Cell Comp Physiol 60:149–167
78.
Модификация метода внутриклеточного диализаВместо поры на плоской мембране использовали пластиковую пипетку с порой
на ее кончике. Клетку погружали во внешний раствор, а через две пипетки осуществляли перфузию внутриклеточного раствора.
Одну пипетку использовали для
регистрации мембранного потенциала, а через другую подавали ток обратной связи.
79. Мультиионная природа токов в мембранах нейронов моллюсков
Neher E, Lux HD (1969)Voltage clamp on Helix pomatia neuronal membrane; current
measurement over a limited area of the soma surface.
Pflugers Arch 311:272–277
80. Мультиионная природа токов в мембранах нейронов моллюсков
Neher E, Lux HD (1969)Voltage clamp on Helix pomatia neuronal membrane; current
measurement over a limited area of the soma surface.
Pflugers Arch 311:272–277
81.
Герасимов В.Д., Костюк П.Г., Майский В.А. Возбудимость гигантских нервных клетокразличных представителей легочных моллюсков в растворах, не содержащих ионов
натрия // Бюлл. эксперим. биологии. 1964. - Т. 58, № 9. - С. 3-7.
82.
Мультиионная природа токов в мембранахнейронов моллюсков
В 1964 г. (Герасимов и др., 1964) на мембране сомы нейронов виноградной улитки выделены два входящих (Na+-ток, быстрый и Ca2+-ток ,
медленный,) и два выходящих тока (быстрый и задержанный К+-токи). В
1968 г. эти результаты были воспроизведены на морском моллюске
Aplisia в США.
83.
Мультиионная природа токов в мембранахнейронов позвоночных
Кроме токов, обнаруженных в нейронах моллюсков, зарегистрирован
дополнительный Na+-ток, который не блокировался ТТХ и обнаруживался у 10-15% изученных нейронов. По кинетике этот ток напоминал
медленный Ca2+-ток.
84.
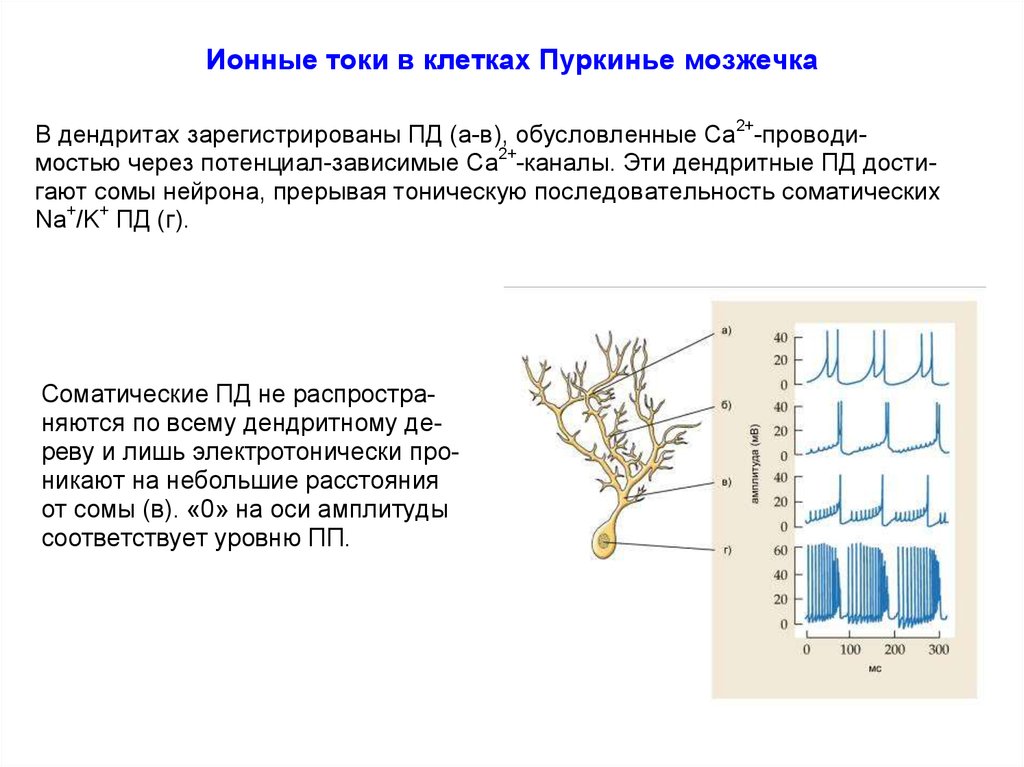
Ионные токи в клетках Пуркинье мозжечкаВ дендритах зарегистрированы ПД (а-в), обусловленные Са2+-проводимостью через потенциал-зависимые Са2+-каналы. Эти дендритные ПД достигают сомы нейрона, прерывая тоническую последовательность соматических
Na+/K+ ПД (г).
Соматические ПД не распространяются по всему дендритному дереву и лишь электротонически проникают на небольшие расстояния
от сомы (в). «0» на оси амплитуды
соответствует уровню ПП.


















































































 Биология
Биология








