Похожие презентации:
Обмен белков. Источники и пути обезвреживания аммиака. (Лекция 15)
1.
Источники и путиобезвреживания
аммиака
2.
В процессе эволюции сформировалисьразличные типы азотистого обмена, которые
классифицируются по основному конечному
продукту:
1) аммониотелический тип, главный
конечный продукт — аммиак (рыбы);
2) урикотелинеский тип, главный конечный
продукт — мочевая кислота (рептилии,
птицы);
3) уреотелический тип, главный конечный
продукт — мочевина (млекопитающие).
3.
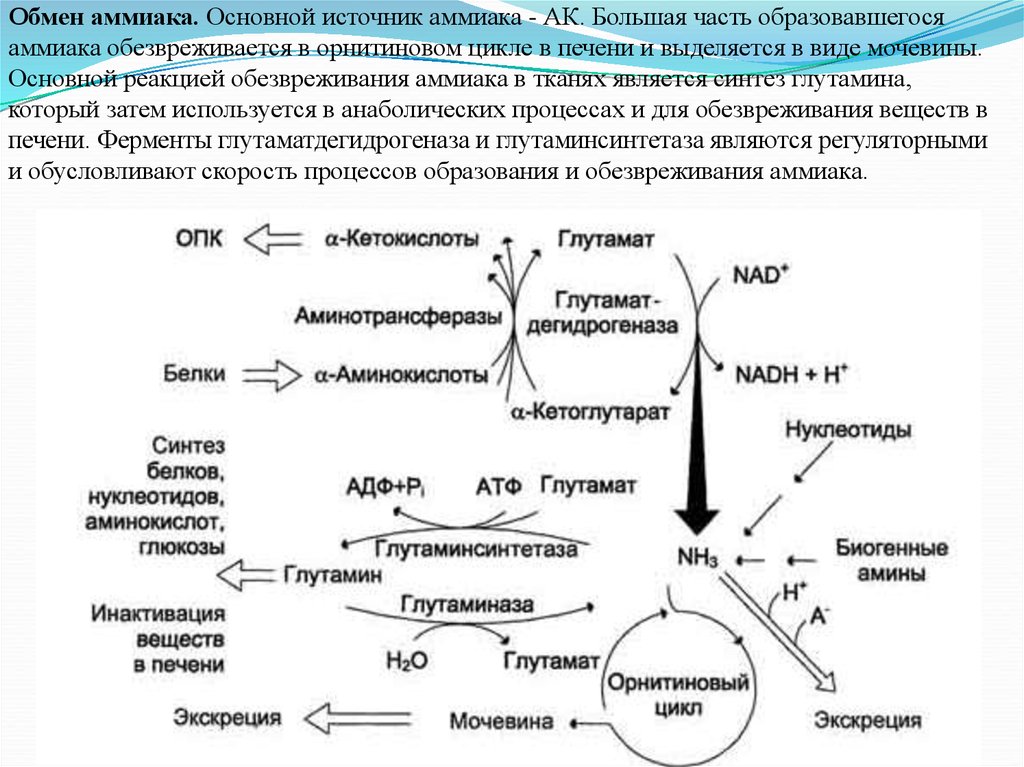
Обмен аммиака. Основной источник аммиака - АК. Большая часть образовавшегосяаммиака обезвреживается в орнитиновом цикле в печени и выделяется в виде мочевины.
Основной реакцией обезвреживания аммиака в тканях является синтез глутамина,
который затем используется в анаболических процессах и для обезвреживания веществ в
печени. Ферменты глутаматдегидрогеназа и глутаминсинтетаза являются регуляторными
и обусловливают скорость процессов образования и обезвреживания аммиака.
4.
Количество азотсодержащих веществ в моче (%) принормальном белковом питании.
5.
ИсточникПроцесс
Ферменты
Локализация процесса
Аминокислоты Непрямое дезаминирование
Аминотрансферазы,
Все ткани
(основной путь
ПФ
дезаминирования аминокислот) Глутаматдегидрогеназа,
NAD+
Окислительное
дезаминирование глутамата
Биогенные
амины
АМФ
Глутаматдегидрогеназа, Все ткани
NAD+
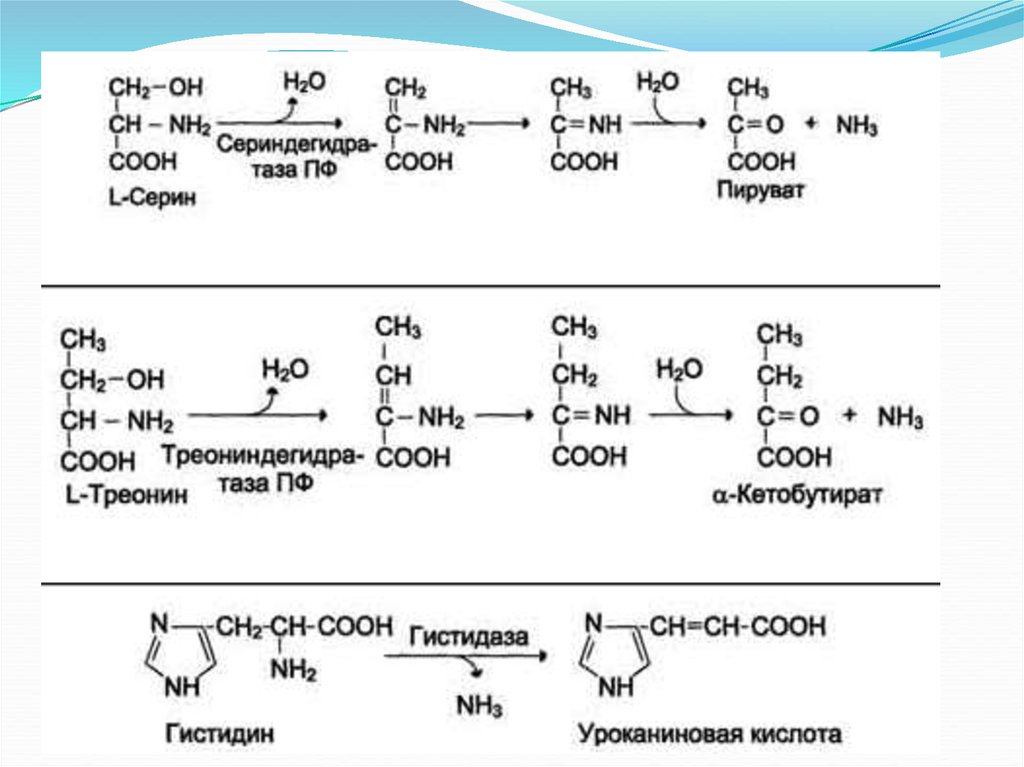
Неокислительное
Гистидаза-Серин,
дезаминирование Гис, Сер, Тре треониндегидратазы,
ПФ
Окислительное
Оксидаза Lдезаминирование аминокислот аминокислот, FMN
(малозначимый путь
дезаминирования)
Преимущественно
печень
Окислительное
дезаминирование (путь
инактивации биогенных
аминов)
Гидролитическое
дезаминирование
Аминооксидазы, FAD
Все ткани
АМФ-дезаминаза
Интенсивно
работающая мышца
поступление аммиака из кишечника в портальную вену
Печень и почки
6.
7.
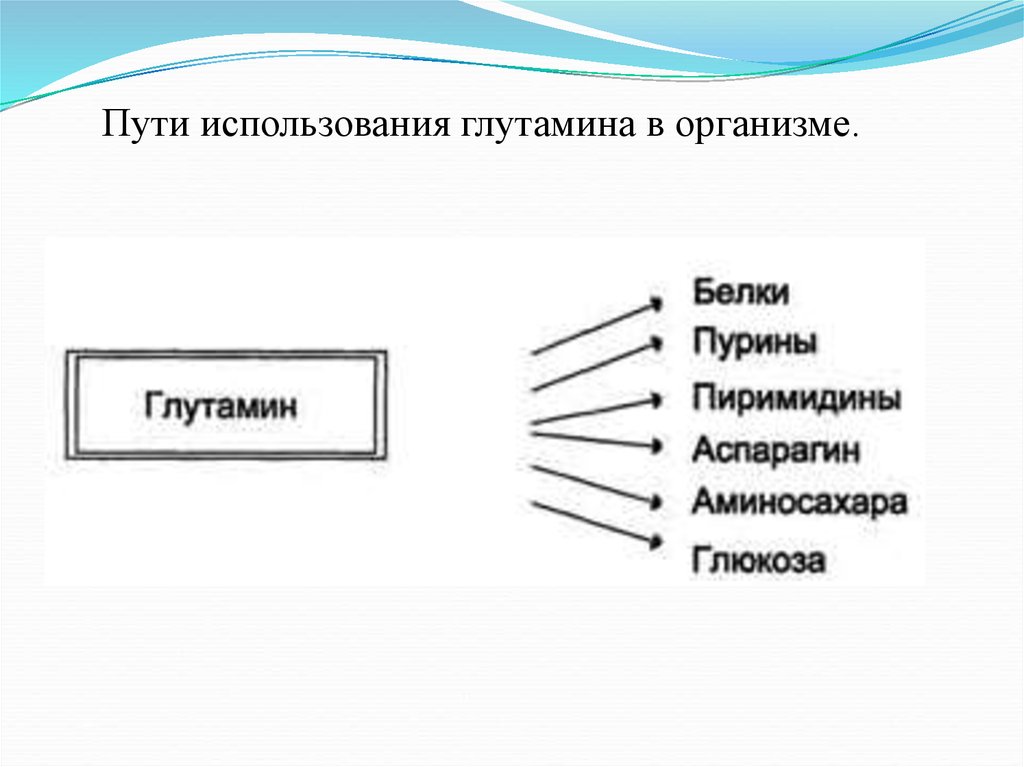
Функции аммиакаАммиак вовлекается (непосредственно
или через глутамин) в синтез многих
компонентов организма: заменимые
аминокислоты, пурины, пиримидины,
аминосахара и т. д.
8.
Аммиак - токсичное соединение. Даже небольшое повышение егоконцентрации оказывает неблагоприятное действие на организм, и прежде
всего на ЦНС. Так, повышение концентрации аммиака в мозге до 0,6
ммоль вызывает судороги. К симптомам гипераммониемии относят
тремор, нечленораздельную речь, тошноту, рвоту, головокружение,
судорожные припадки, потерю сознания. В тяжёлых случаях развивается
кома с летальным исходом.
Механизм токсического действия аммиака на мозг и организм в целом,
очевидно, связан с действием его на несколько функциональных систем.
Аммиак легко проникает через мембраны в клетки и в
митохондриях сдвигает реакцию, катализируемую
глутаматдегидрогеназой, в сторону образования глутамата:
α-Кетоглутарат + NADH + Н+ + NH3 → Глутамат + NAD+.
Уменьшение концентрации α-кетоглутарата вызывает:
1) угнетение обмена аминокислот (реакции транса-минирования) и,
следовательно, синтеза из них нейромедиаторов (ацетилхолина,
дофамина и др.);
2) гипоэнергетическое состояние в результате снижения скорости ЦТК.
9.
Недостаточность α-кетоглутарата приводит к снижению концентрации метаболитовЦТК, что вызывает ускорение реакции синтеза оксалоацетата из пирувата,
сопровождающейся интенсивным потреблением СО2. Усиленное образование и
потребление диоксида углерода при гипераммониемии особенно характерны для
клеток головного мозга.
Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону
(вызывает алкалоз). Это, в свою очередь, увеличивает сродство гемоглобина к
кислороду, что приводит к гипоксии тканей, накоплению СО2 и гипоэнергетическому
состоянию, от которого главным образом страдает головной мозг.
Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в
нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3Р04.
Накопление глутамина в клетках нейроглии приводит к повышению осмотического
давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк
мозга. Снижение концентрации глутамата нарушает обмен аминокислот и
нейромедиаторов, в частности синтез ϒ-аминомасляной кислоты (ГАМК), основного
тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается
проведение нервного импульса, возникают судороги.
Ион NH4+ практически не проникает через цитоплазматические и митохондриальные
мембраны. Избыток иона аммония в крови способен нарушать трансмембранный
перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что
также влияет на проведение нервных импульсов.
10.
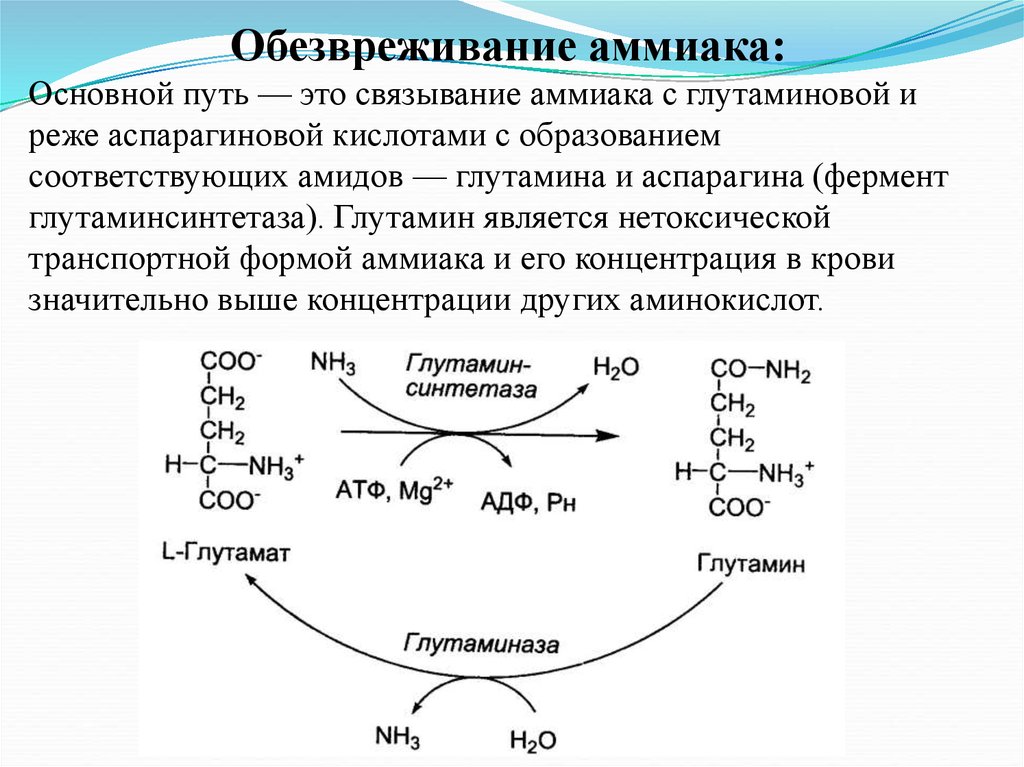
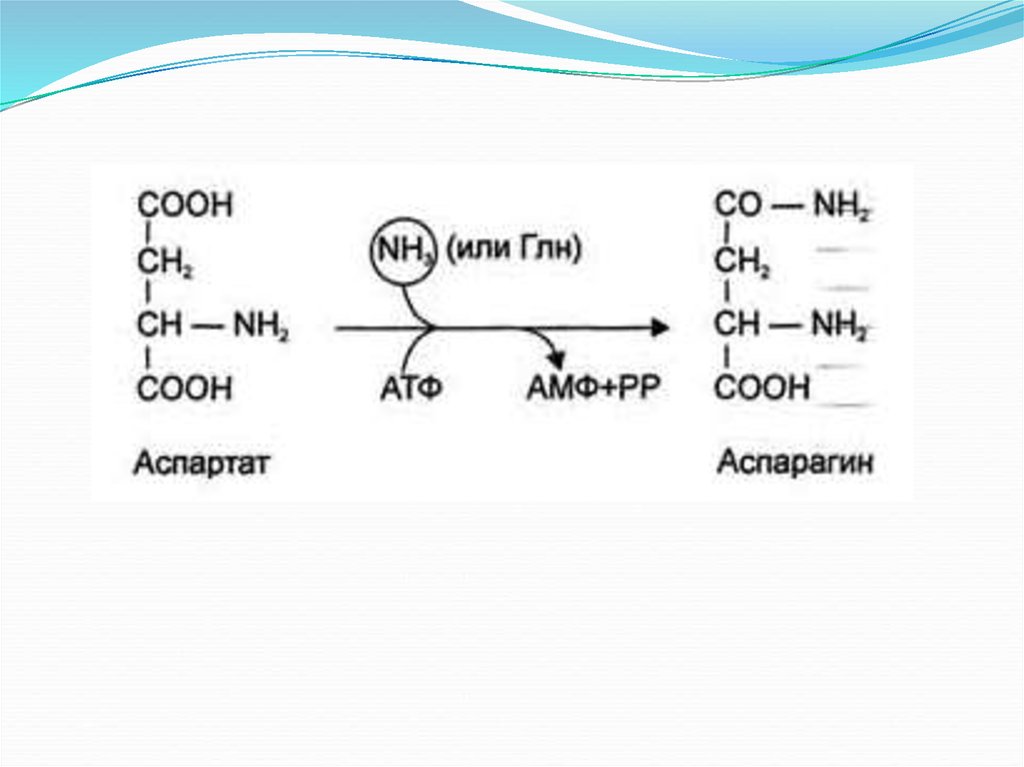
Обезвреживание аммиака:Основной путь — это связывание аммиака с глутаминовой и
реже аспарагиновой кислотами с образованием
соответствующих амидов — глутамина и аспарагина (фермент
глутаминсинтетаза). Глутамин является нетоксической
транспортной формой аммиака и его концентрация в крови
значительно выше концентрации других аминокислот.
11.
Пути использования глутамина в организме.12.
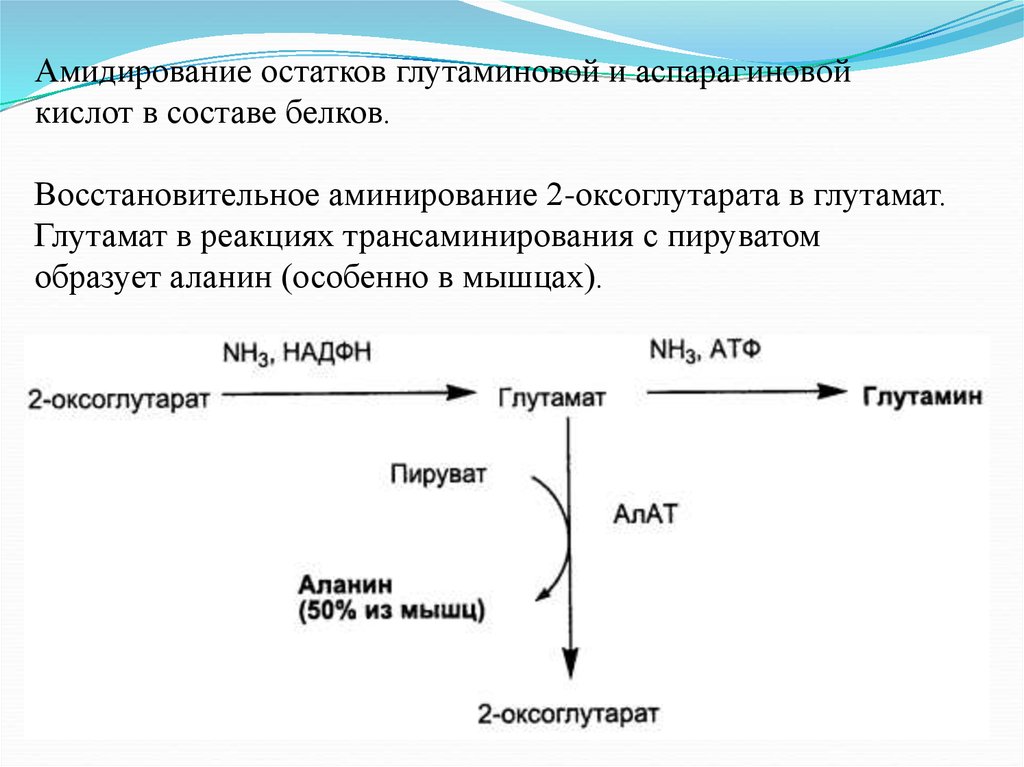
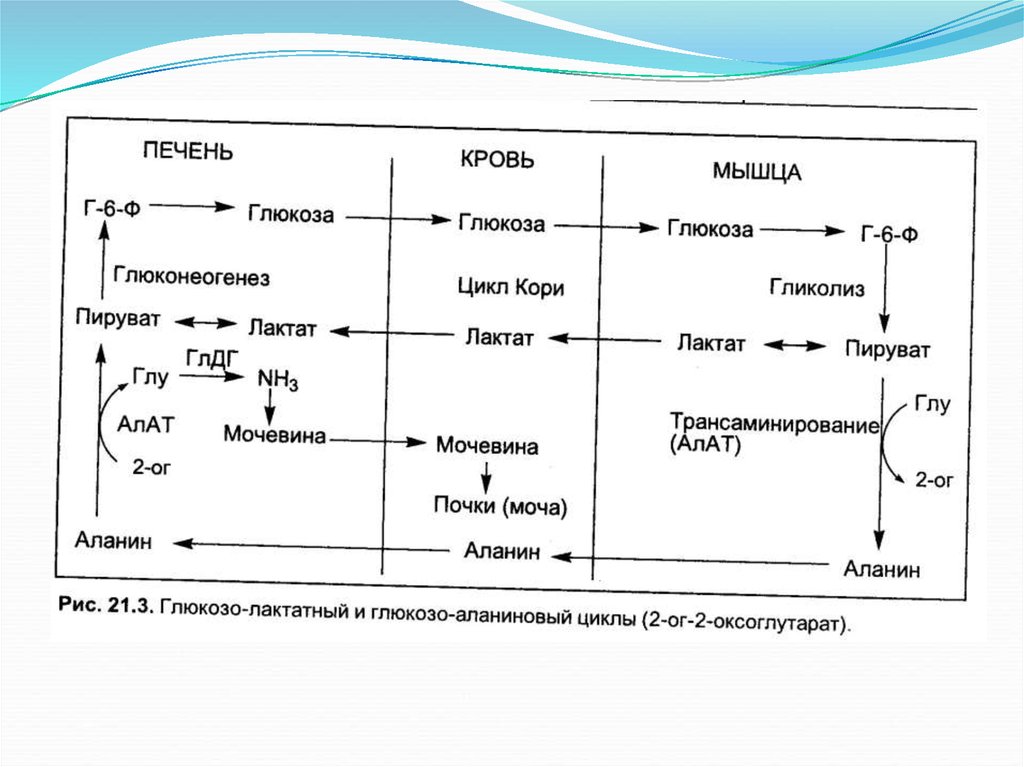
Амидирование остатков глутаминовой и аспарагиновойкислот в составе белков.
Восстановительное аминирование 2-оксоглутарата в глутамат.
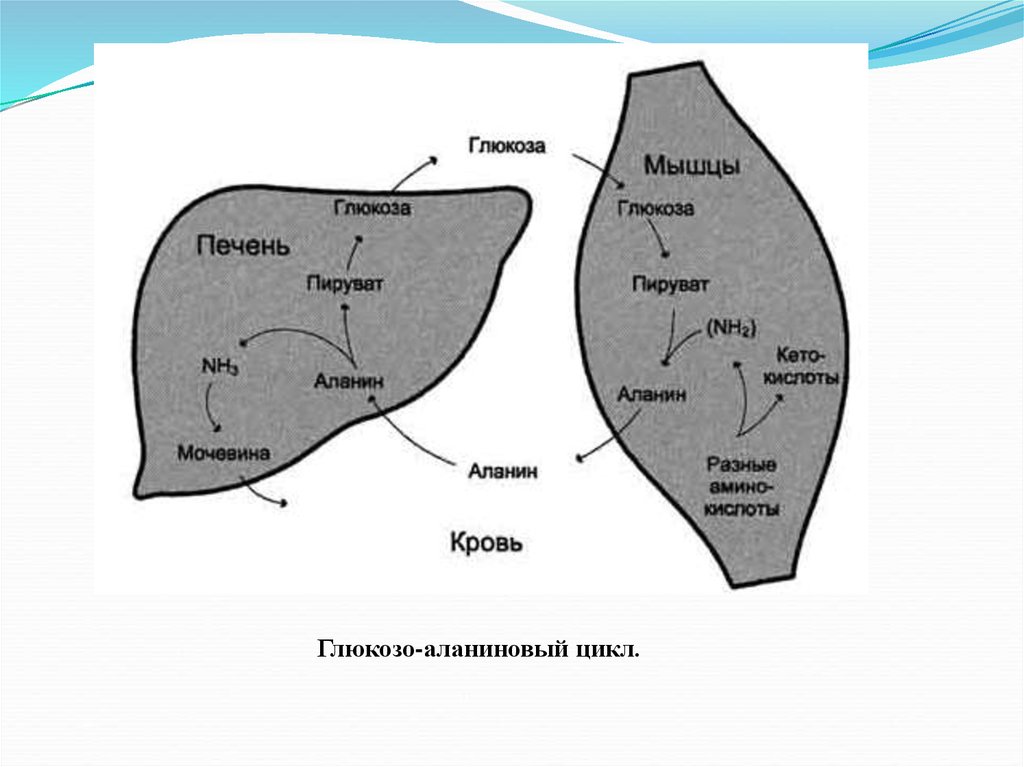
Глутамат в реакциях трансаминирования с пируватом
образует аланин (особенно в мышцах).
13.
14.
15.
16.
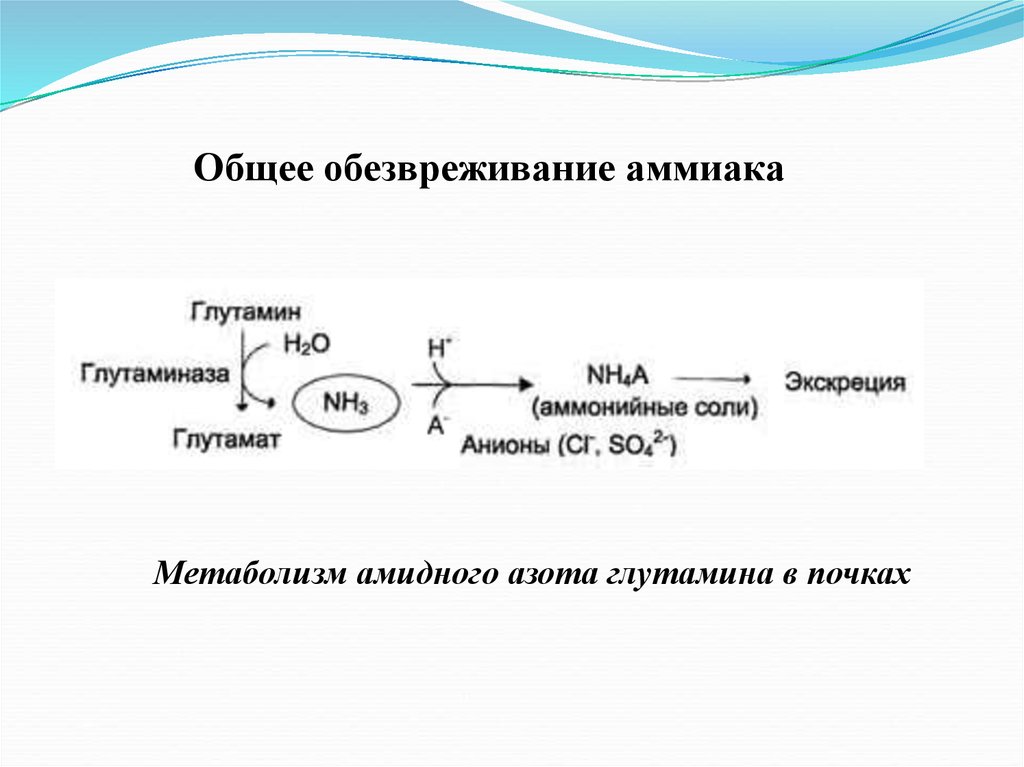
Общее обезвреживание аммиакаМетаболизм амидного азота глутамина в почках
17.
Глюкозо-аланиновый цикл.18.
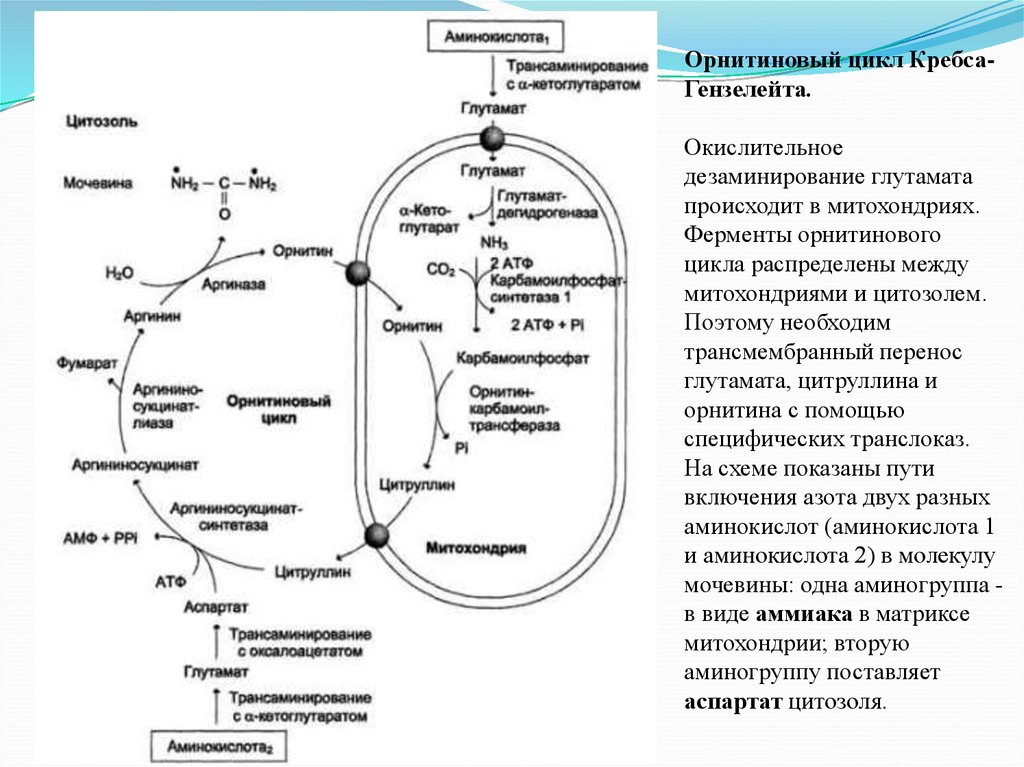
Орнитиновый цикл КребсаГензелейта.Окислительное
дезаминирование глутамата
происходит в митохондриях.
Ферменты орнитинового
цикла распределены между
митохондриями и цитозолем.
Поэтому необходим
трансмембранный перенос
глутамата, цитруллина и
орнитина с помощью
специфических транслоказ.
На схеме показаны пути
включения азота двух разных
аминокислот (аминокислота 1
и аминокислота 2) в молекулу
мочевины: одна аминогруппа в виде аммиака в матриксе
митохондрии; вторую
аминогруппу поставляет
аспартат цитозоля.
19.
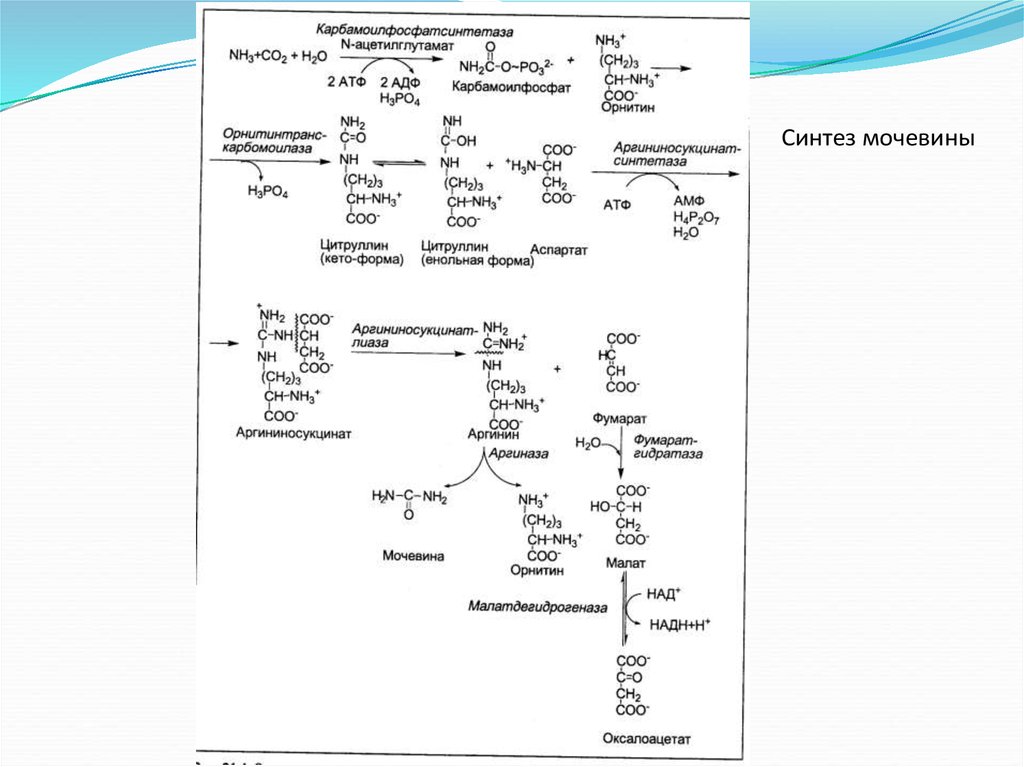
Синтез мочевины20.
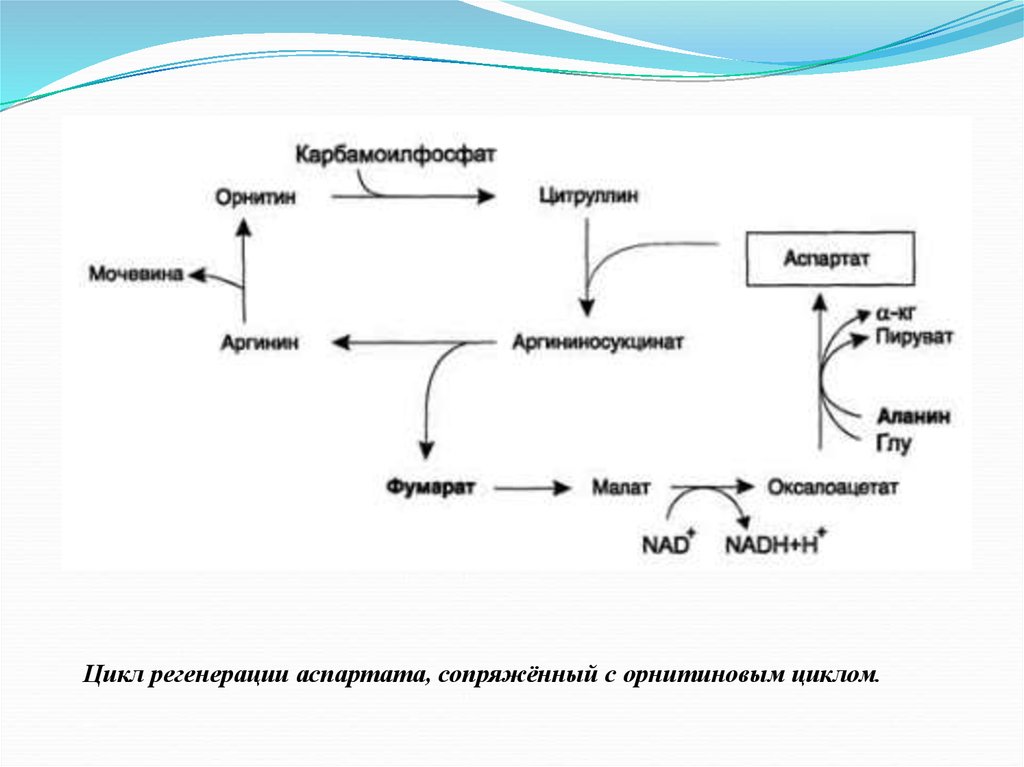
Цикл регенерации аспартата, сопряжённый с орнитиновым циклом.21.
Орнитиновый цикл в печени выполняет 2 функции:превращение азота аминокислот в мочевину, которая
экскретируется и предотвращает накопление токсичных
продуктов, главным образом аммиака;
синтез аргинина и пополнение его фонда в организме.
Регуляторные стадии процесса - синтез карбамоилфосфата,
синтез цитруллина и заключительная стадия, катализируемая
аргиназой.
Эффективность работы орнитинового цикла при нормальном
питании человека и умеренных физических нагрузках
составляет примерно 60% его мощности. Запас мощности
необходим для избежания гипераммониемии при изменениях
количества белка в пище. Увеличение скорости синтеза
мочевины происходит при длительной физической работе или
длительном голодании, которое сопровождается распадом
тканевых белков. Некоторые патологические состояния,
характеризующиеся интенсивным распадом белков
22.
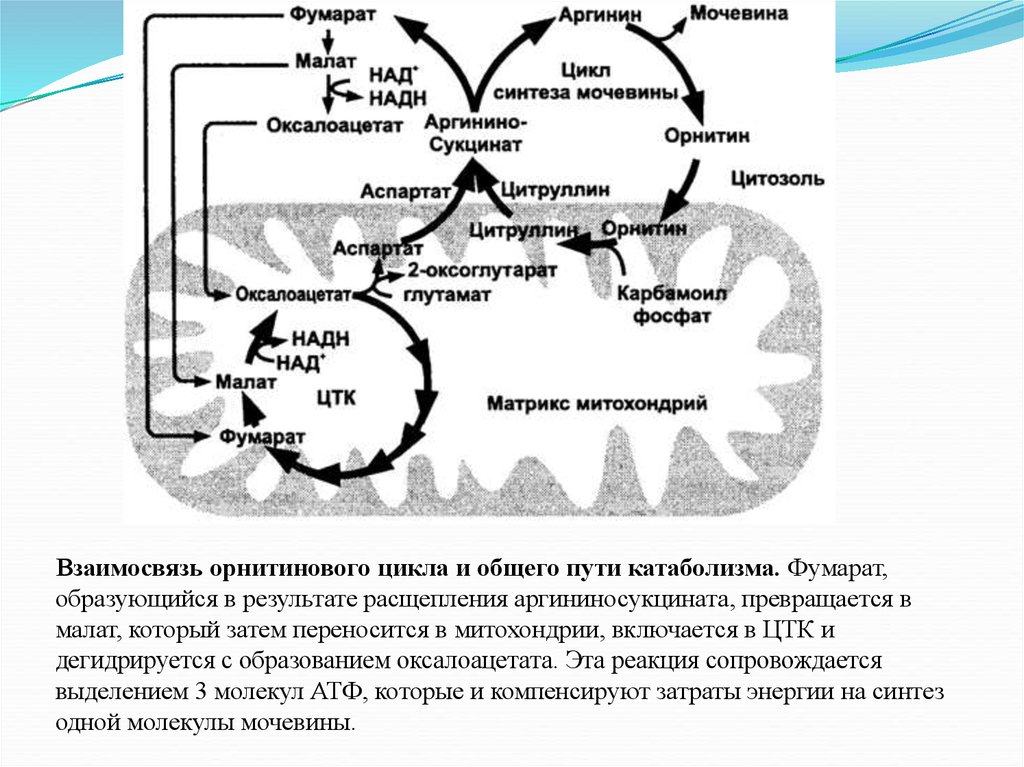
Взаимосвязь орнитинового цикла и общего пути катаболизма. Фумарат,образующийся в результате расщепления аргининосукцината, превращается в
малат, который затем переносится в митохондрии, включается в ЦТК и
дегидрируется с образованием оксалоацетата. Эта реакция сопровождается
выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез
одной молекулы мочевины.
23.
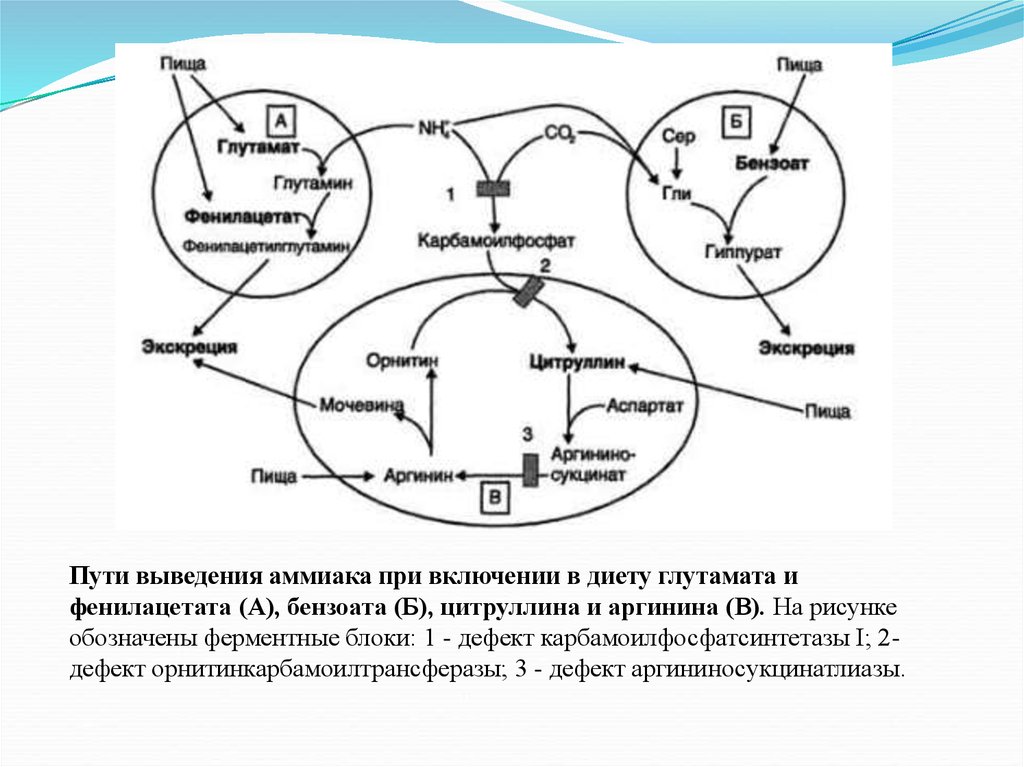
Пути выведения аммиака при включении в диету глутамата ифенилацетата (А), бензоата (Б), цитруллина и аргинина (В). На рисунке
обозначены ферментные блоки: 1 - дефект карбамоилфосфатсинтетазы I; 2дефект орнитинкарбамоилтрансферазы; 3 - дефект аргининосукцинатлиазы.
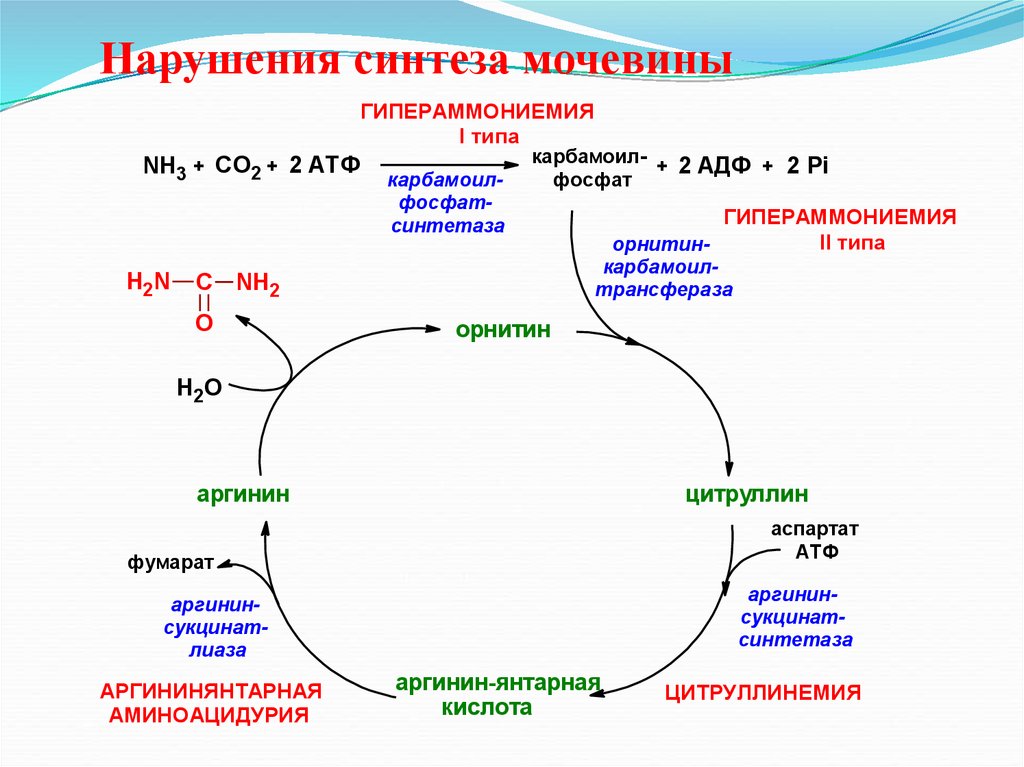
24. Нарушения синтеза мочевины
ГИПЕРАММОНИЕМИЯI типа
NH3 + СО2 + 2 АТФ
H2 N
карбамоилфосфатсинтетаза
карбамоил+ 2 АДФ + 2 Рi
фосфат
карбамоилтрансфераза
С NH2
O
ГИПЕРАММОНИЕМИЯ
II типа
орнитин-
орнитин
Н2О
аргинин
цитруллин
аспартат
АТФ
фумарат
аргининсукцинатсинтетаза
аргининсукцинатлиаза
АРГИНИНЯНТАРНАЯ
АМИНОАЦИДУРИЯ
аргинин-янтарная
кислота
ЦИТРУЛЛИНЕМИЯ
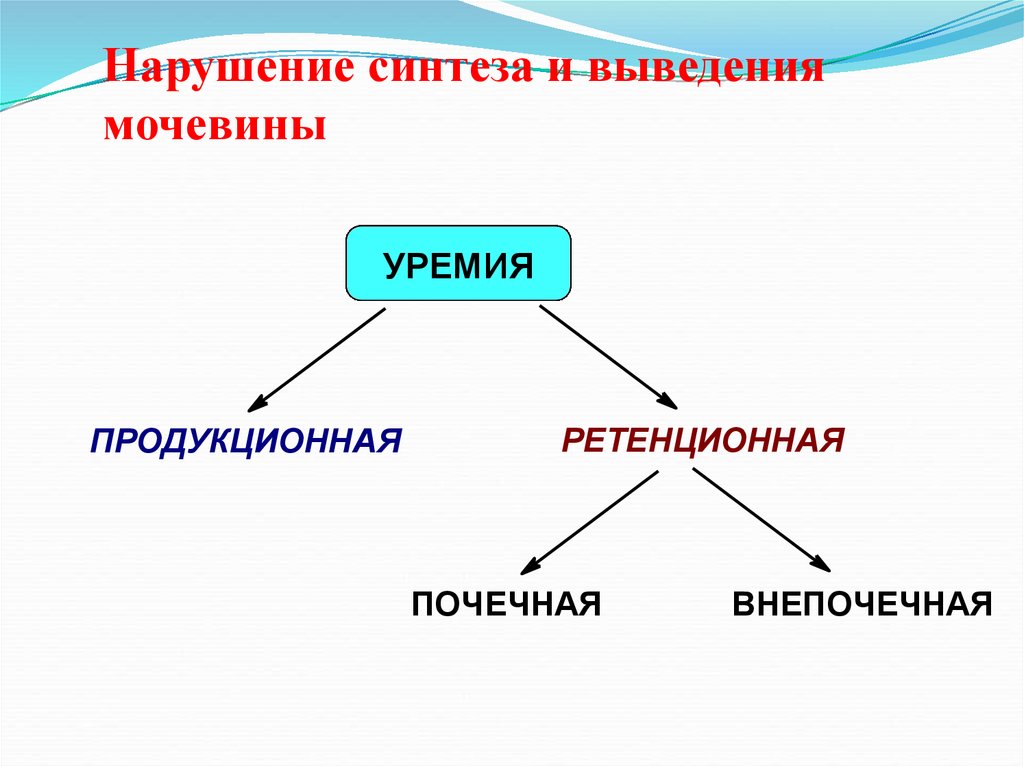
25. Нарушение синтеза и выведения мочевины
УРЕМИЯПРОДУКЦИОННАЯ
РЕТЕНЦИОННАЯ
ПОЧЕЧНАЯ
ВНЕПОЧЕЧНАЯ
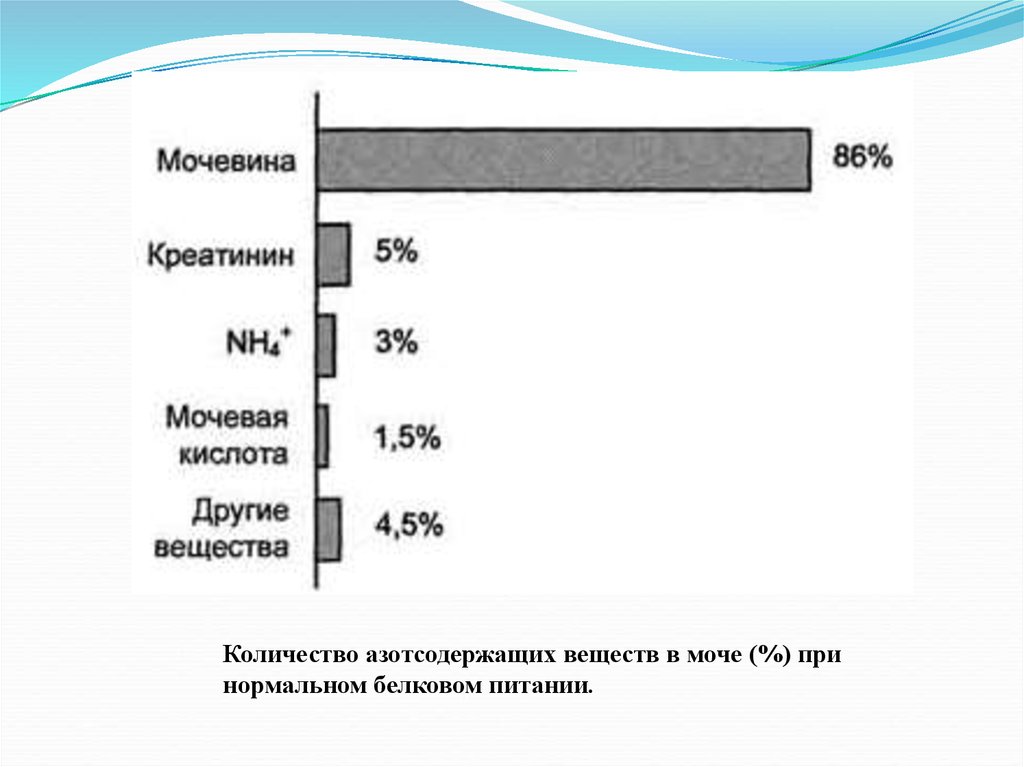
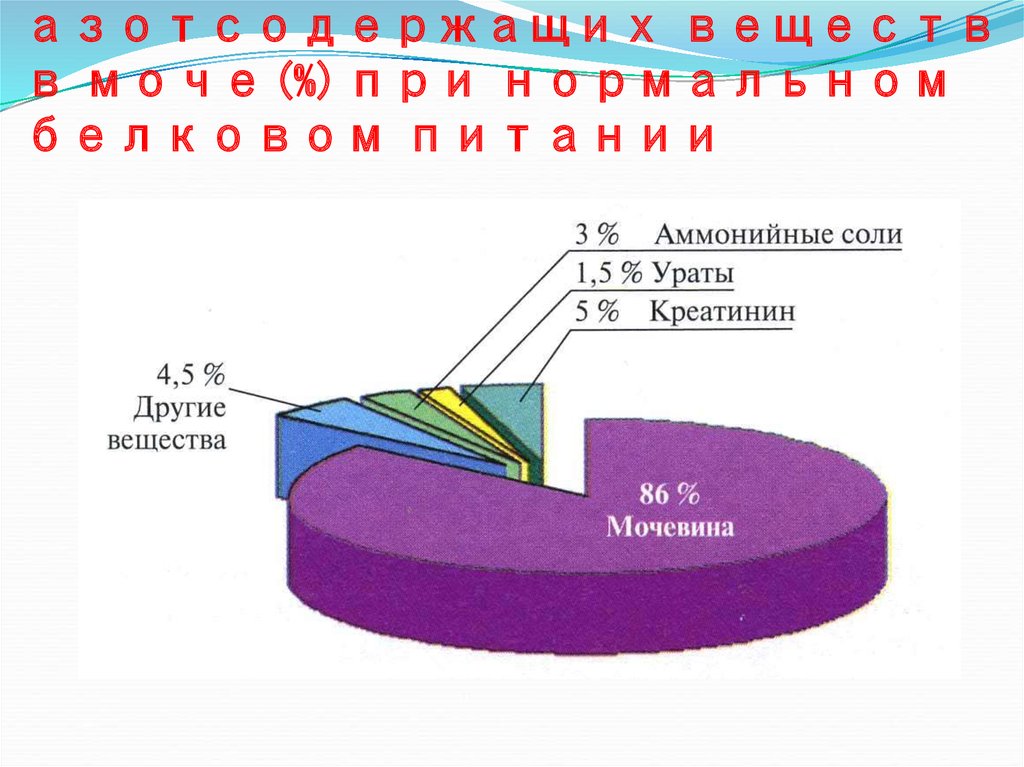
26. Количество азотсодержащих веществ в моче (%) при нормальном белковом питании
азотсодержащих веществв моче (%) при нормальном
белковом питании
27.
Синтез и распадпуриновых и
пиримидиновых
оснований
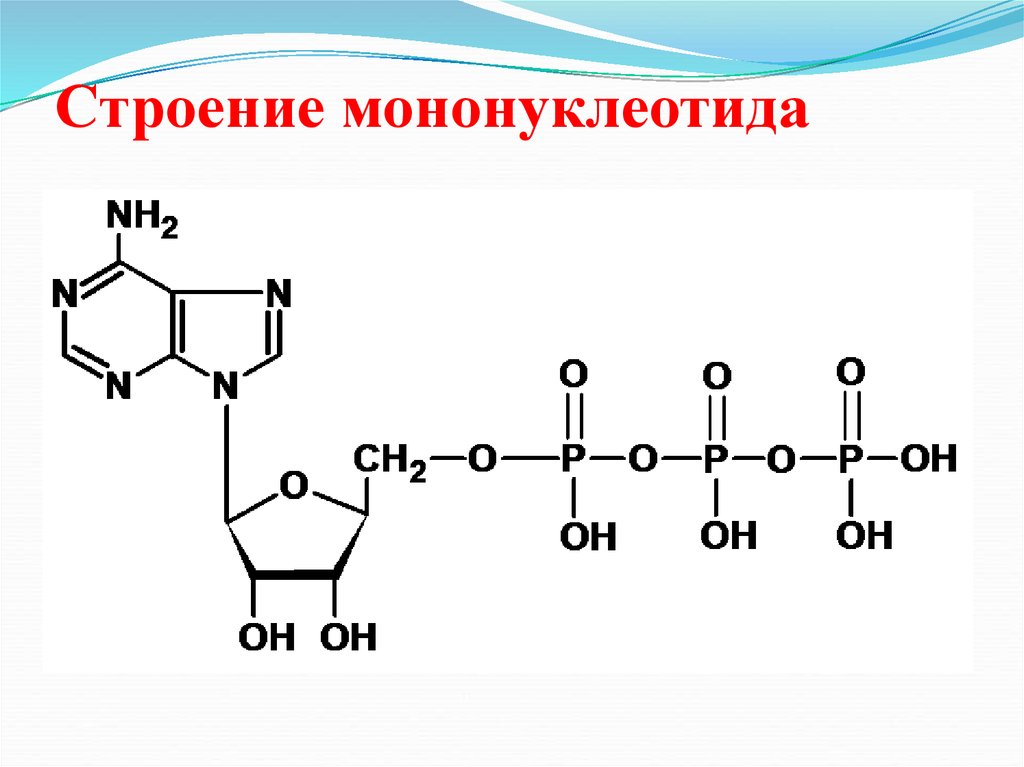
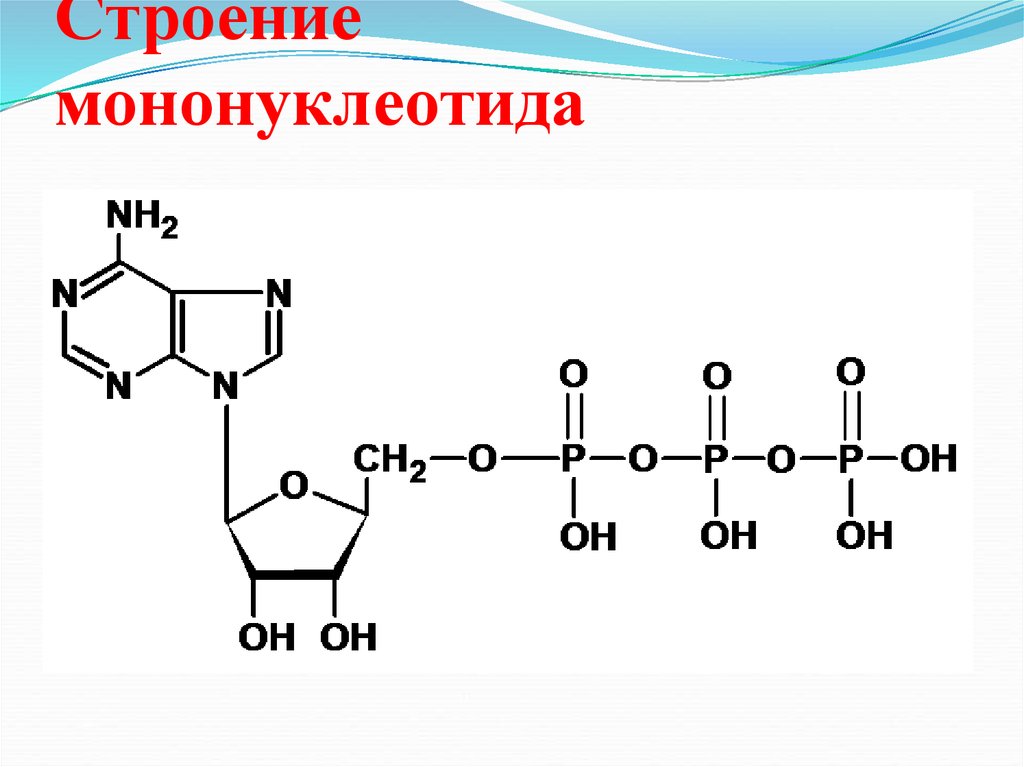
28. Строение мононуклеотида
NH2N
N
N
O
N
O
СН2
O
P
OH
OH OH
O
O
O
P O
P OH
OH
OH
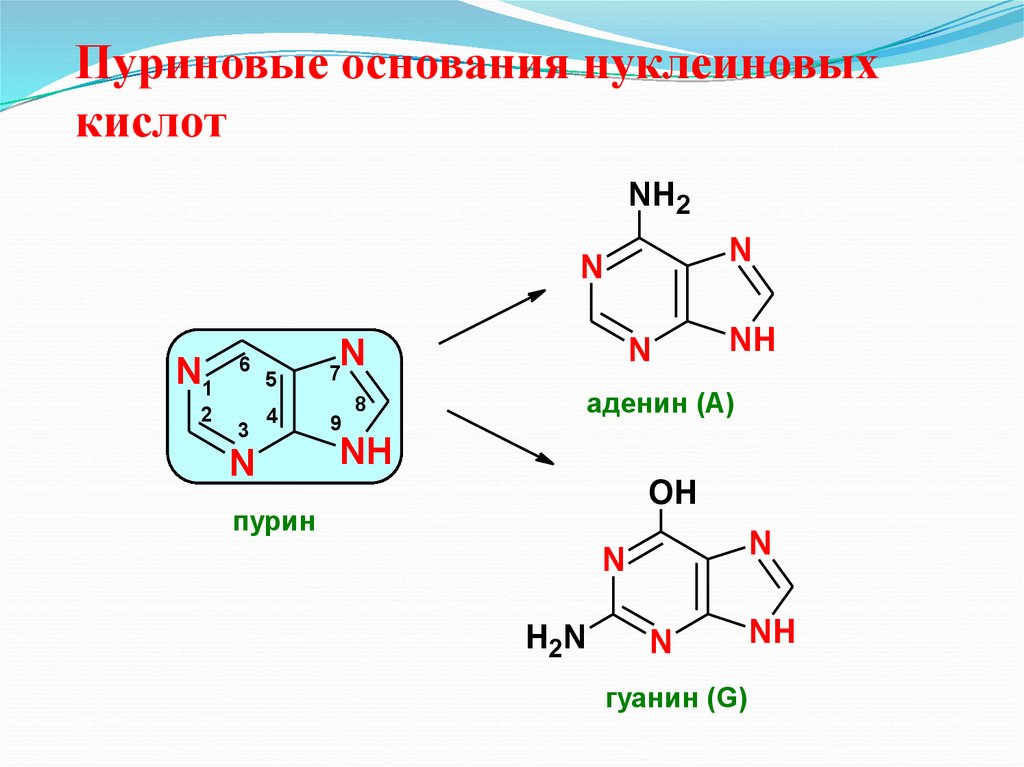
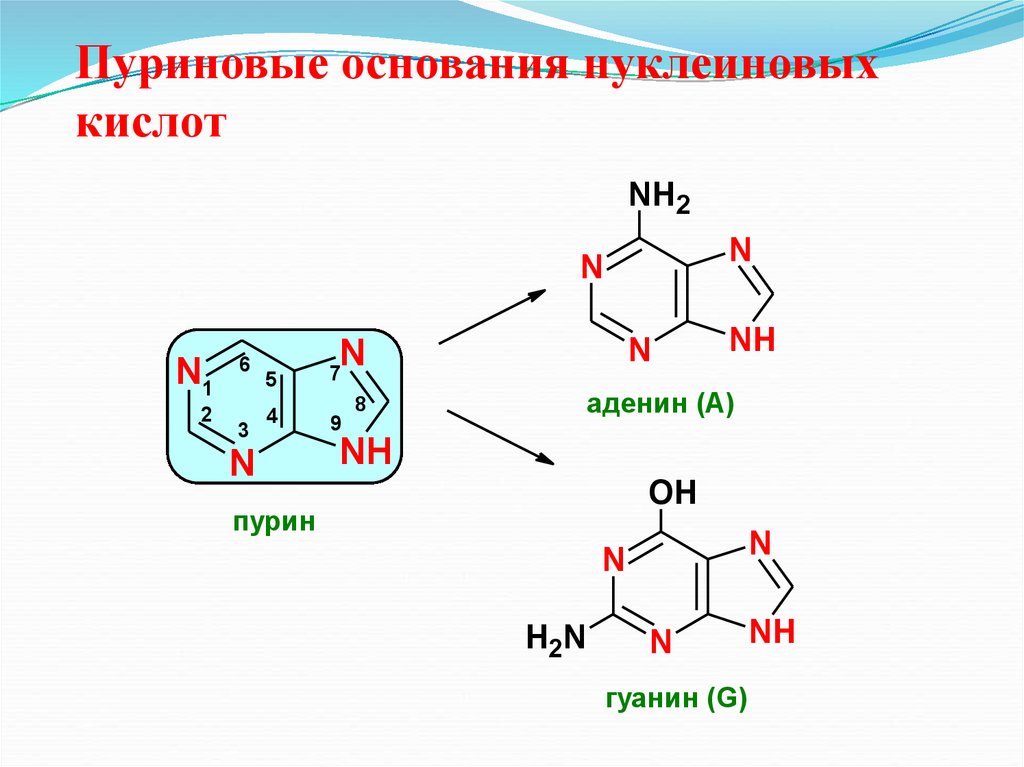
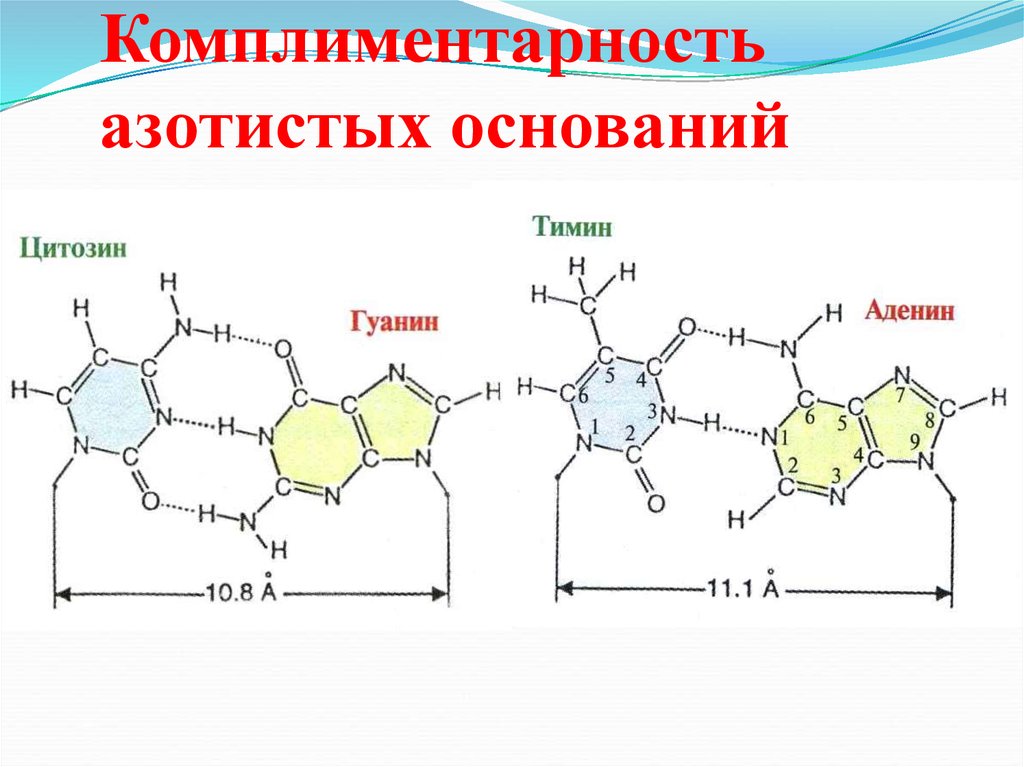
29. Пуриновые основания нуклеиновых кислот
NH2N
N
N1
2
6
3
5
N
7
4
9
N
N
NH
аденин (А)
8
NH
OH
пурин
N
N
H2N
N
гуанин (G)
NH
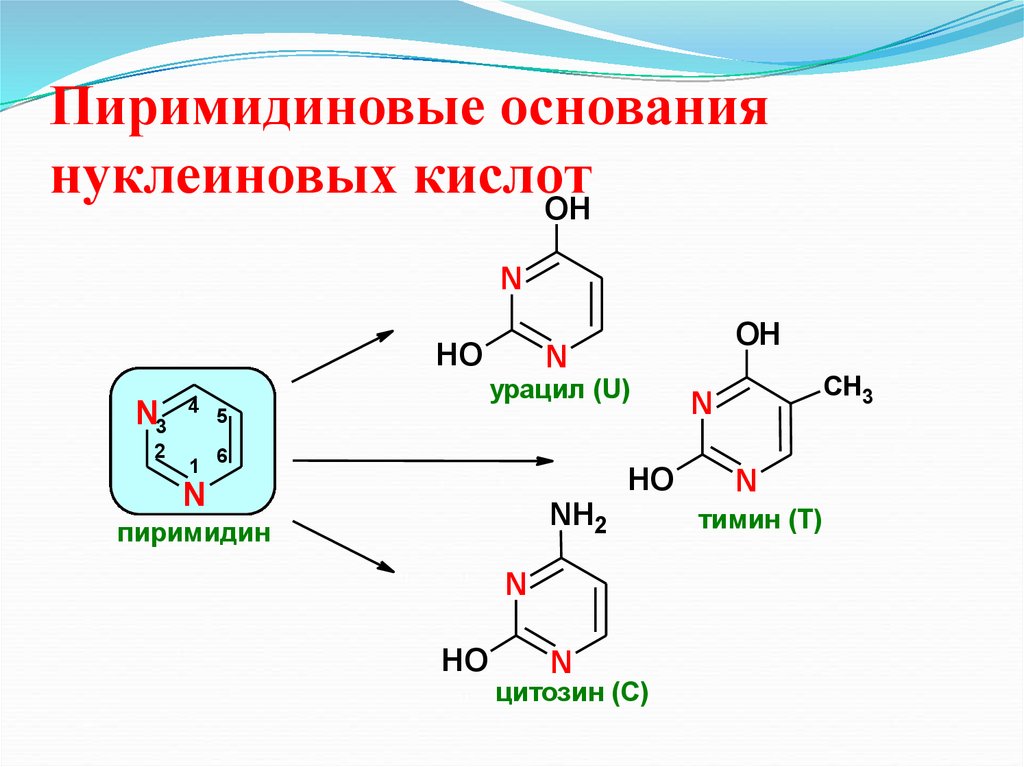
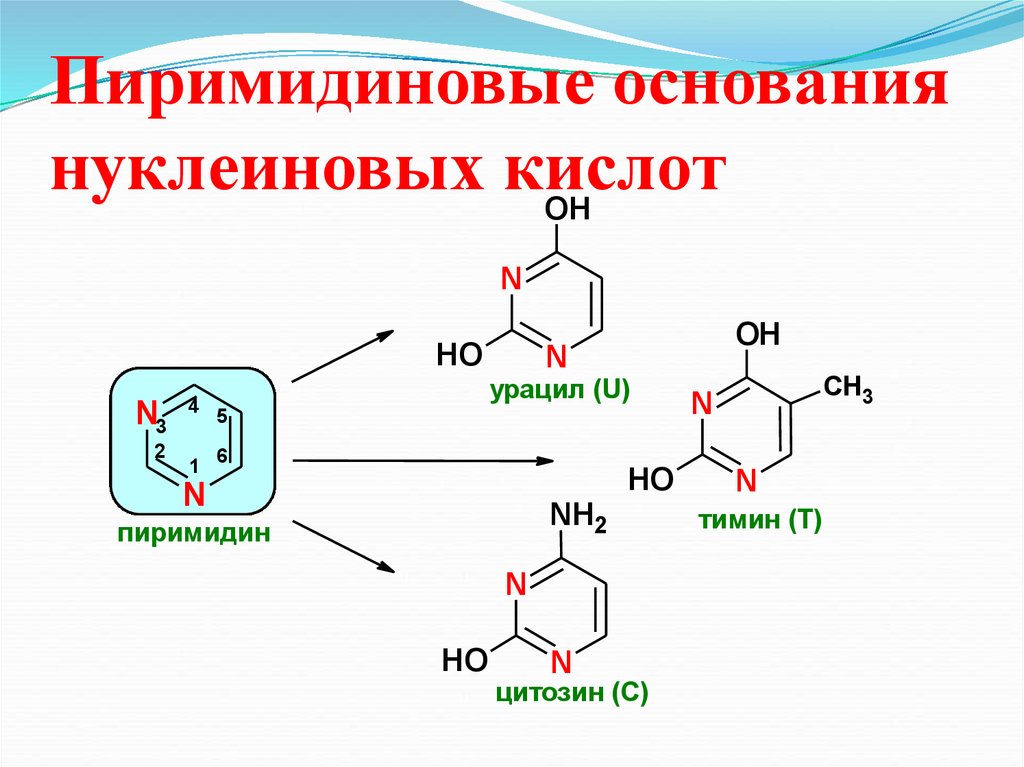
30. Пиримидиновые основания нуклеиновых кислот
OHN
HO
N3
2
4
1
OH
N
урацил (U)
5
CH3
N
6
HO
N
NH2
пиримидин
N
HO
N
цитозин (С)
N
тимин (Т)
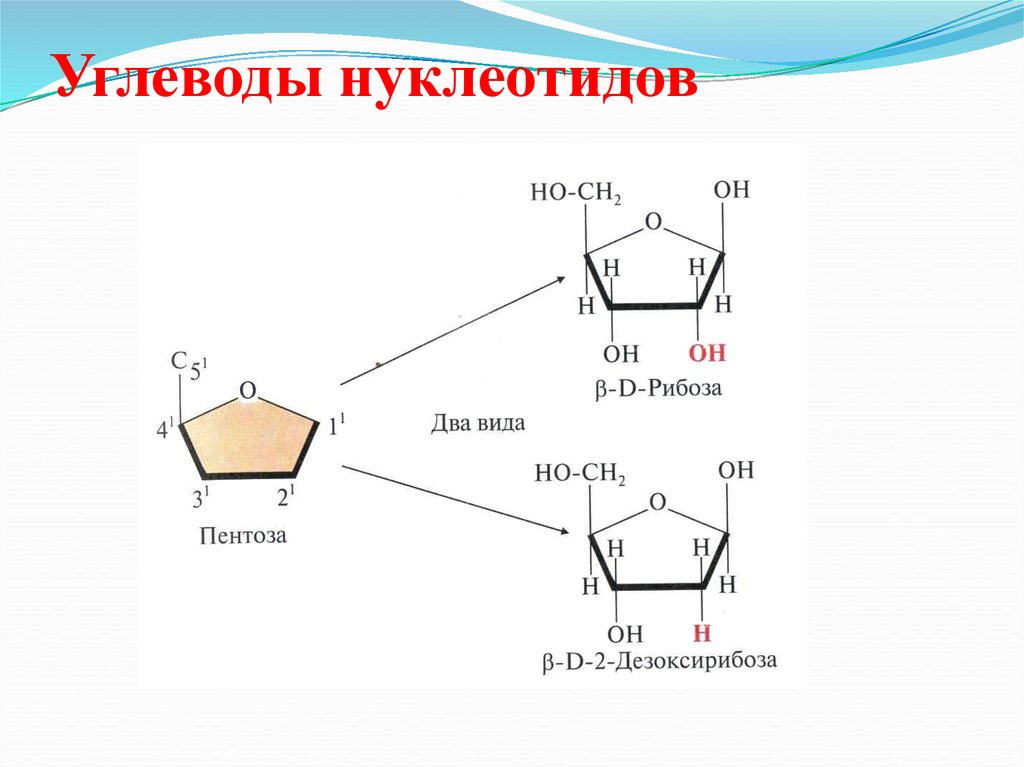
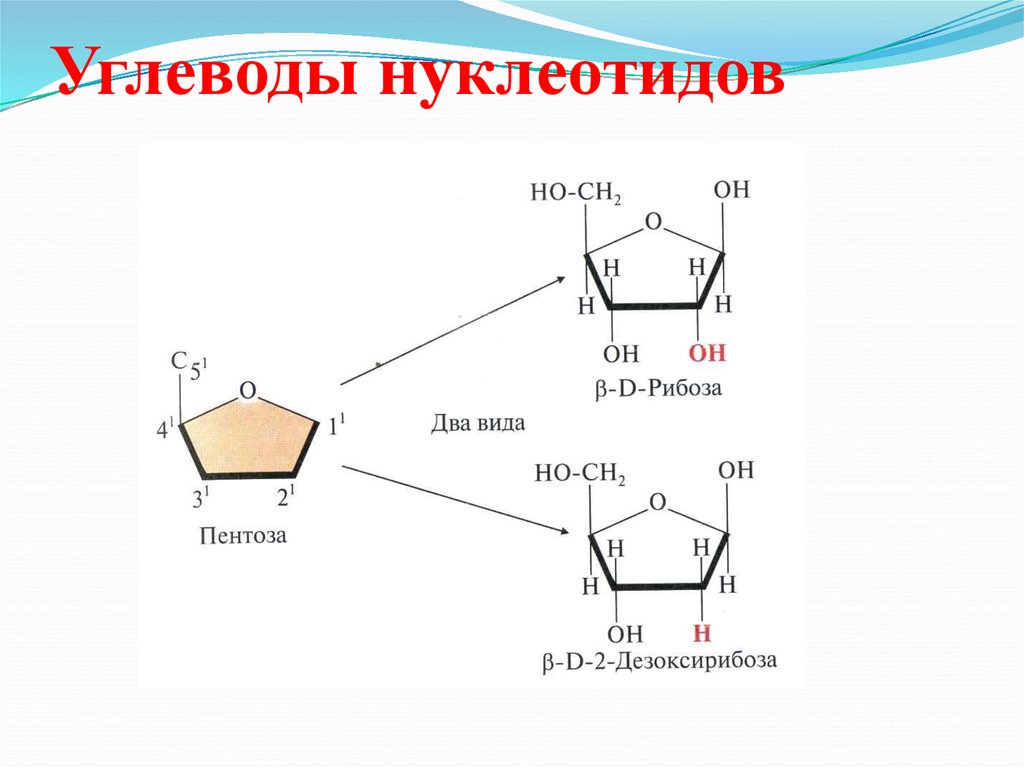
31. Углеводы нуклеотидов
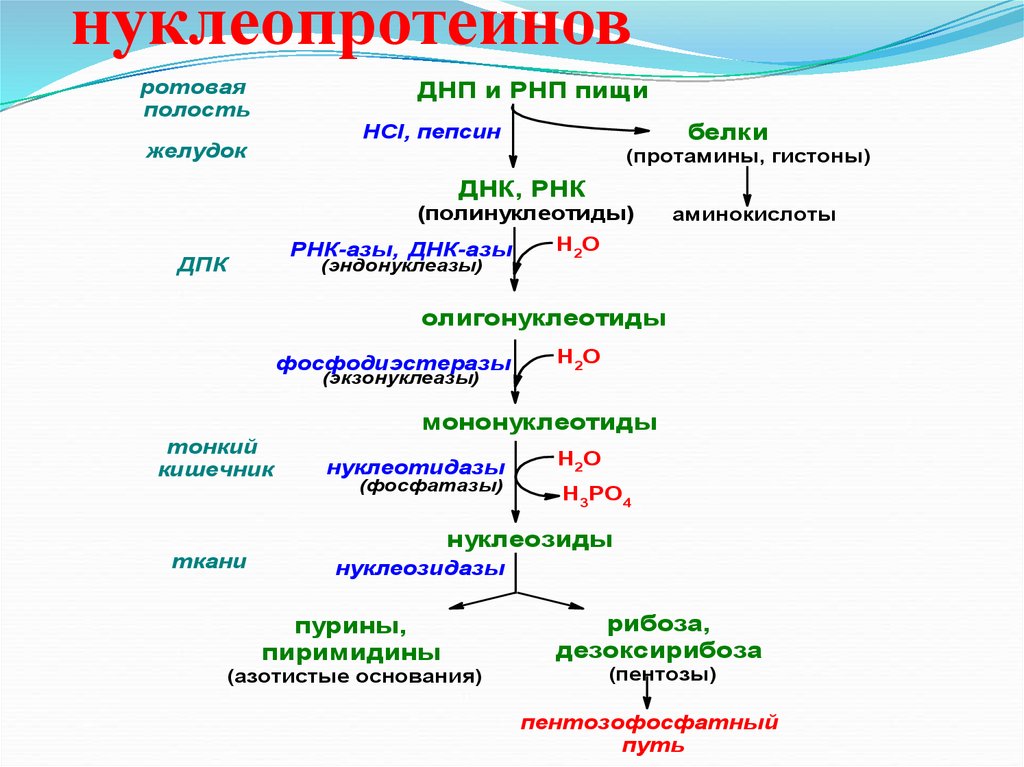
32. Гидролиз нуклеопротеинов
нуклеопротеиновротовая
полость
ДНП и РНП пищи
белки
НСl, пепсин
желудок
(протамины, гистоны)
ДНК, РНК
(полинуклеотиды)
РНК-азы, ДНК-азы
ДПК
(эндонуклеазы)
аминокислоты
Н2О
олигонуклеотиды
фосфодиэстеразы
(экзонуклеазы)
Н2О
мононуклеотиды
тонкий
кишечник
ткани
нуклеотидазы
(фосфатазы)
Н2О
Н3РО4
нуклеозиды
нуклеозидазы
пурины,
пиримидины
(азотистые основания)
рибоза,
дезоксирибоза
(пентозы)
пентозофосфатный
путь
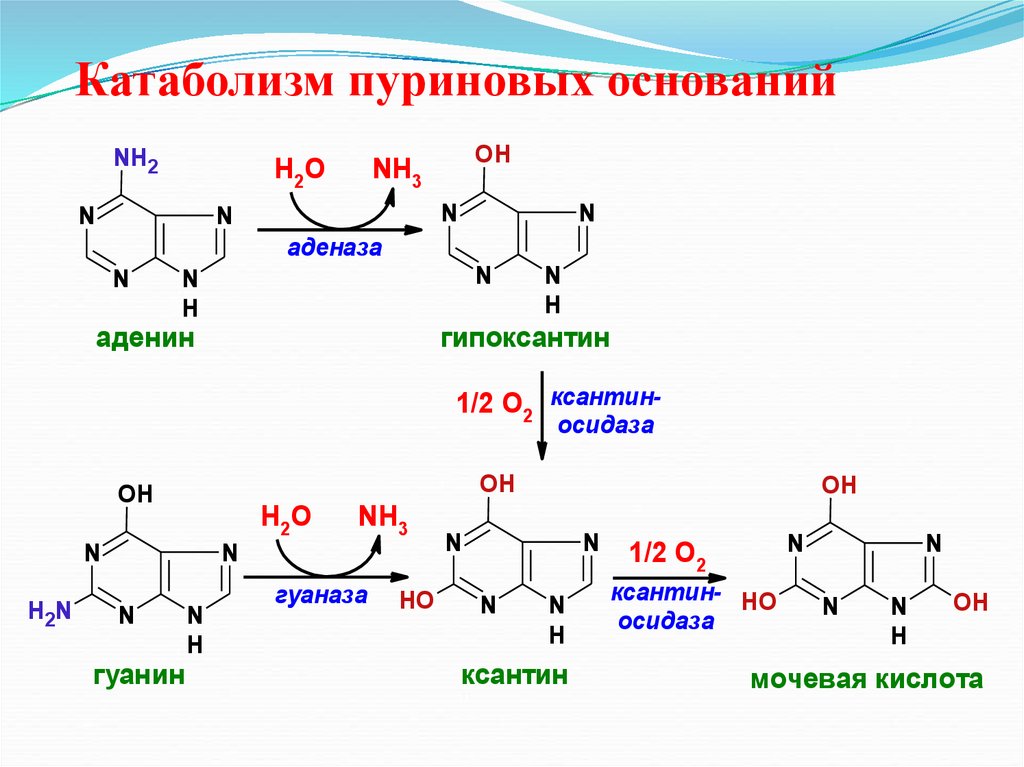
33. Катаболизм пуриновых оснований
NH2Н2О
N
OH
NH3
N
N
N
аденаза
N
N
N
H
аденин
N
H
гипоксантин
1/2 О2 ксантиносидаза
OH
OH
Н2О
N
H2N
NH3
N
N
гуанин
N
H
гуаназа
HO
OH
N
N
N
N
H
ксантин
N
1/2 О2
ксантин- HO
осидаза
N
N
N
H
OH
мочевая кислота
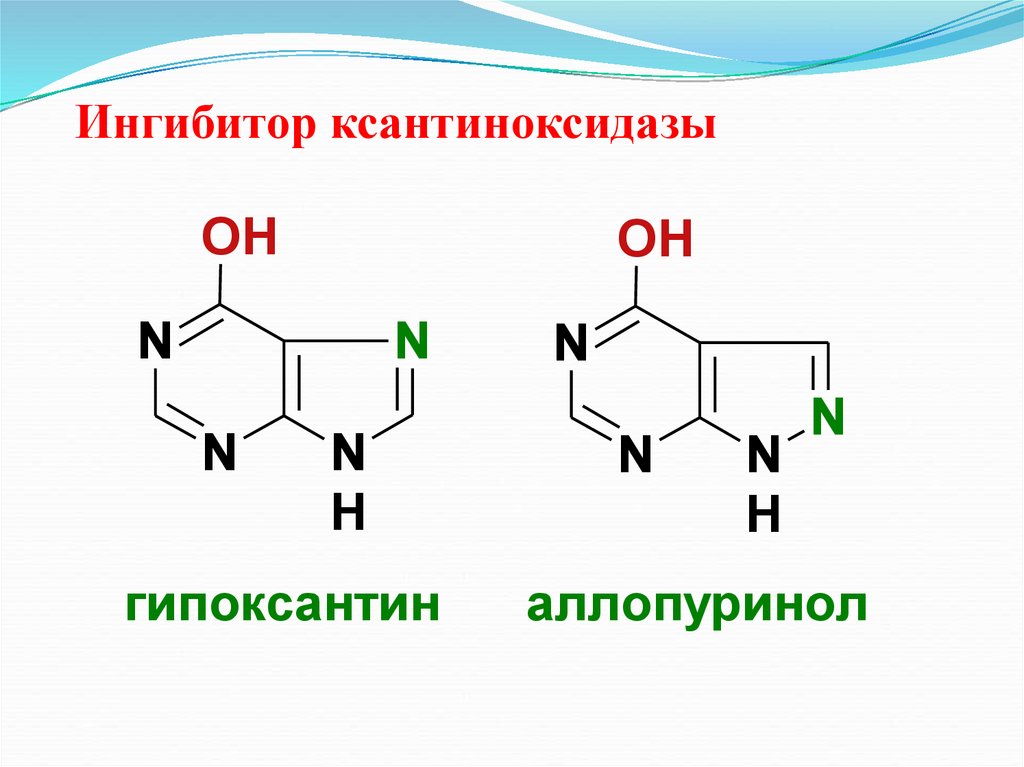
34. Ингибитор ксантиноксидазы
OHOH
N
N
N
N
H
гипоксантин
N
N
N
H
N
аллопуринол
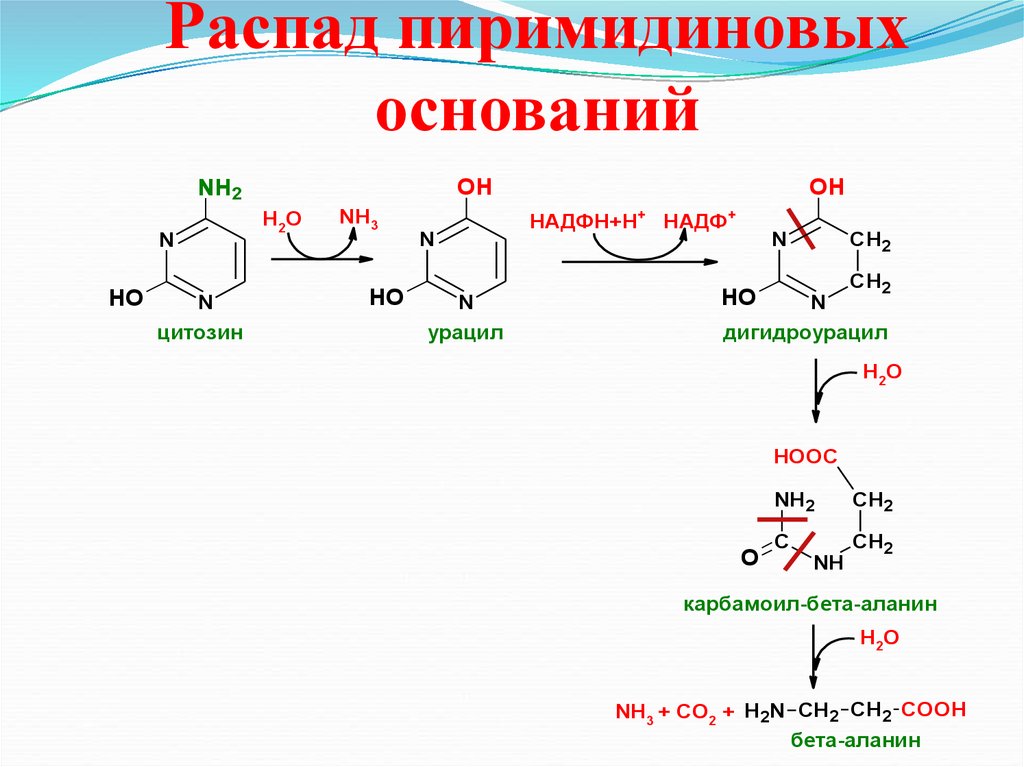
35. Распад пиримидиновых оснований
OHNH2
H2O
N
HO
N
цитозин
NН3
HO
OH
HАДФН+Н+ НАДФ+
N
N
урацил
СН2
N
HO
N
СН2
дигидроурацил
Н2О
HOOC
O
NH2
CH2
C
CH2
NH
карбамоил-бета-аланин
Н2О
NН3 + CО2 + H2N CH2 CH2 COOH
бета-аланин
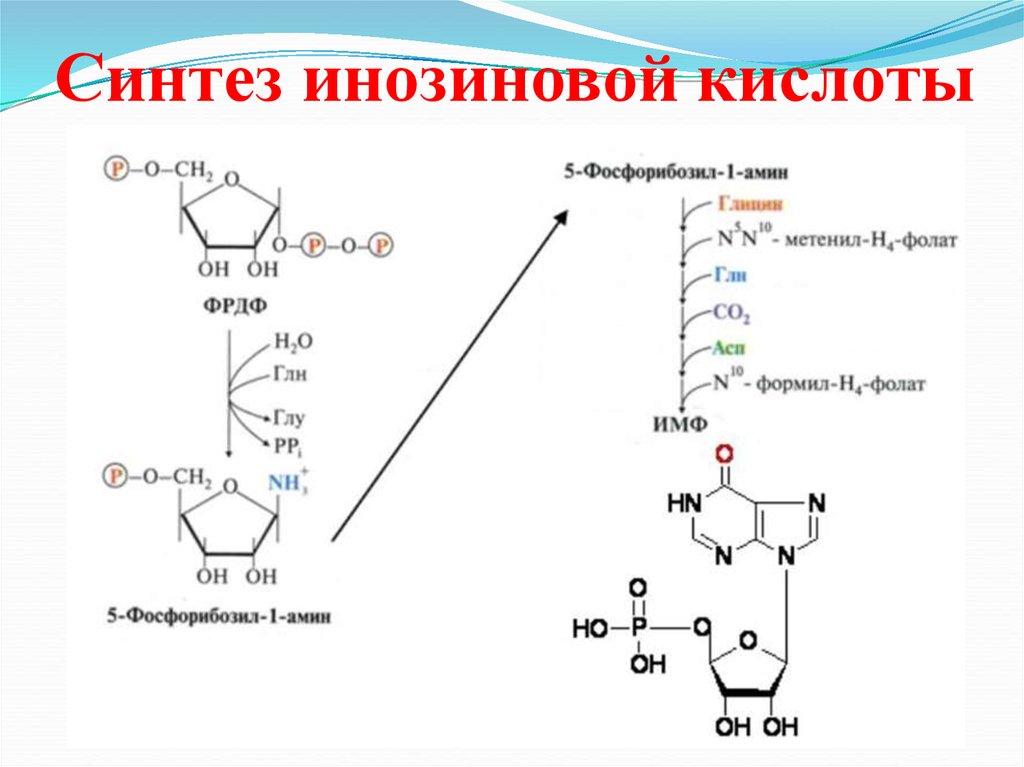
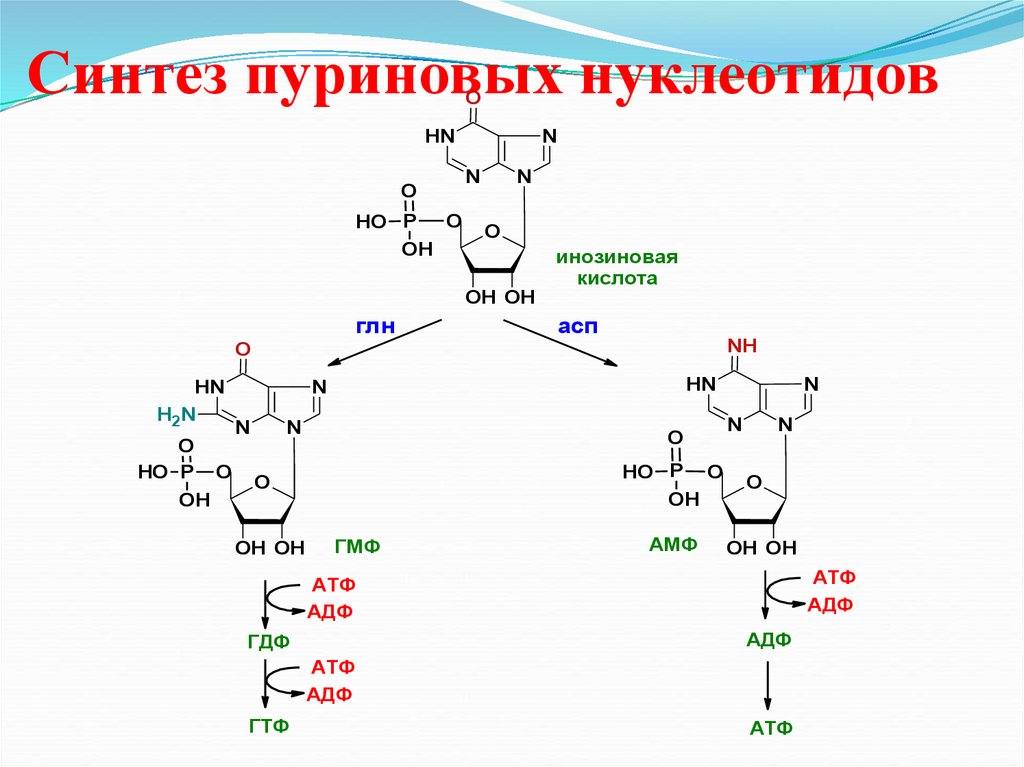
36. Синтез инозиновой кислоты
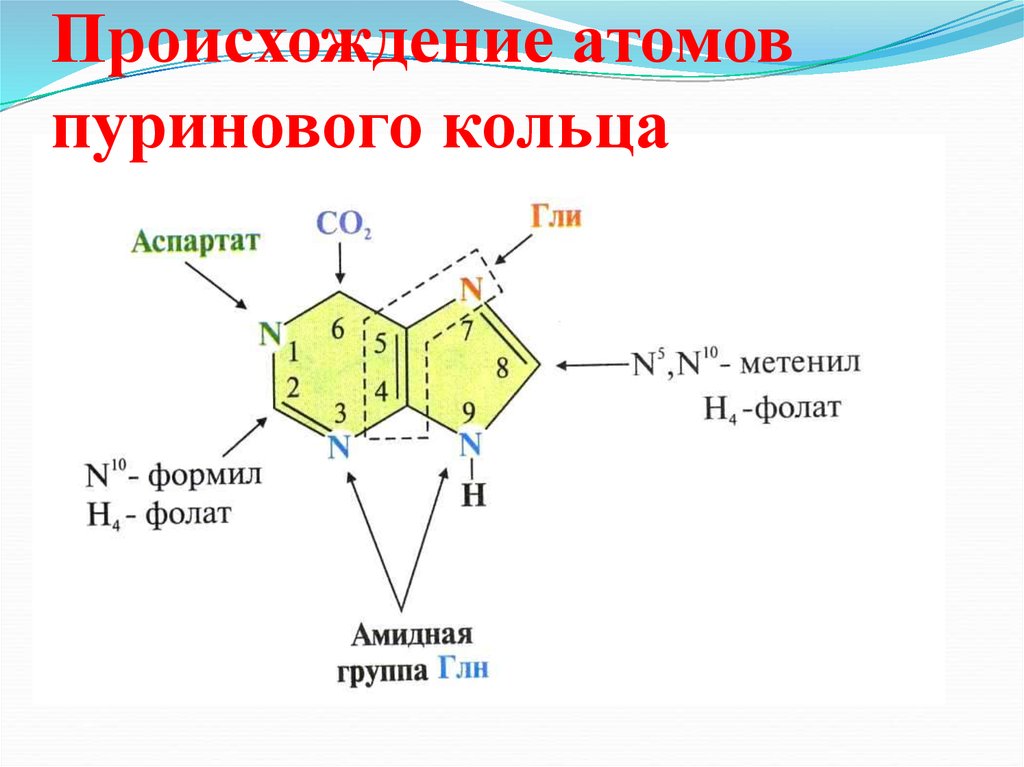
37. Происхождение атомов пуринового кольца
38. Синтез пуриновых нуклеотидов
OHN
O
O
HO P
OH
N
N
N
O
инозиновая
кислота
OH OH
глн
асп
NH
O
HN
H2 N
O
HO P
O
N
N
O
HO P O
OH
O
OH
OH OH
N
HN
N
ГМФ
АМФ
N
N
O
OH OH
АТФ
АДФ
АТФ
АДФ
АДФ
ГДФ
АТФ
АДФ
ГТФ
АТФ
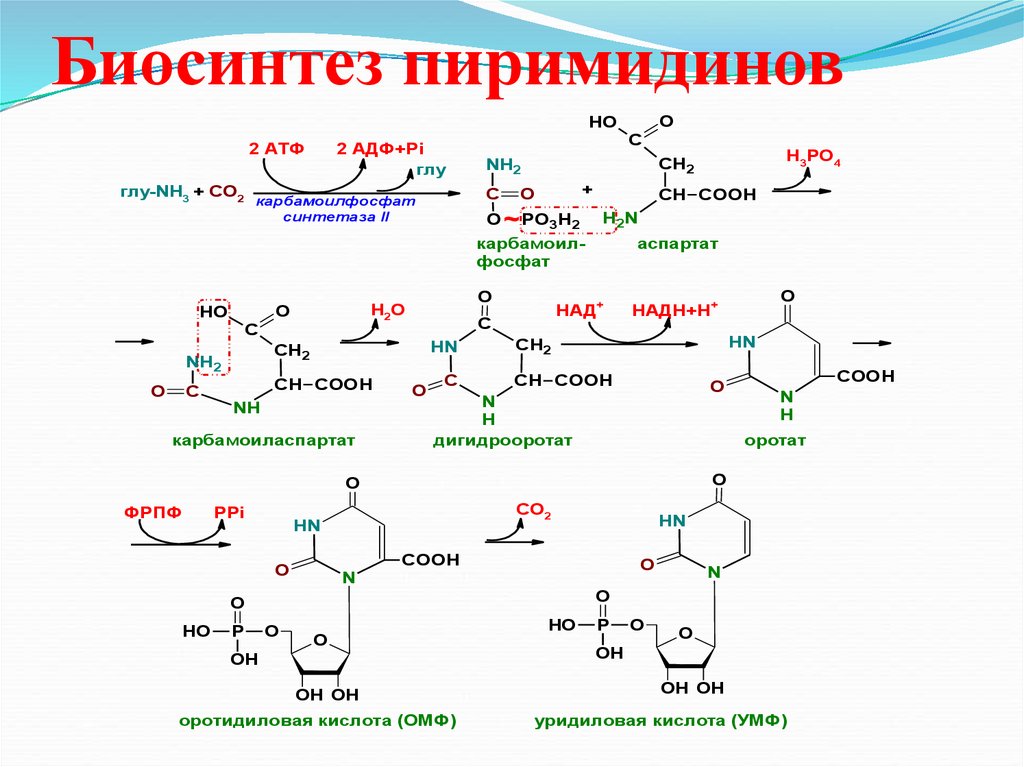
39. Биосинтез пиримидинов
OHO
2 АТФ
глу-NН3 + CО2
2 АДФ+Рi
глу
C
С
карбамоилфосфат
синтетаза II
+
O
O ~ PO3H2
СН COOH
H2 N
карбамоилфосфат
O
H2O
O
HO
СН COOH
С
O
HN
СН2
NH2
NH
карбамоиласпартат
O
С
аспартат
НАД+
C
C
РРi
HN
СН2
СН COOH
O
N
H
дигидрооротат
оротат
СО2
P
HN
COOH
O
N
N
O
O
HO
COOH
N
H
O
HN
O
O
HАДН+Н+
O
ФРПФ
Н3РО4
СН2
NH2
O
HO
O
OH
OH OH
оротидиловая кислота (ОМФ)
P
O
O
OH
OH OH
уридиловая кислота (УМФ)
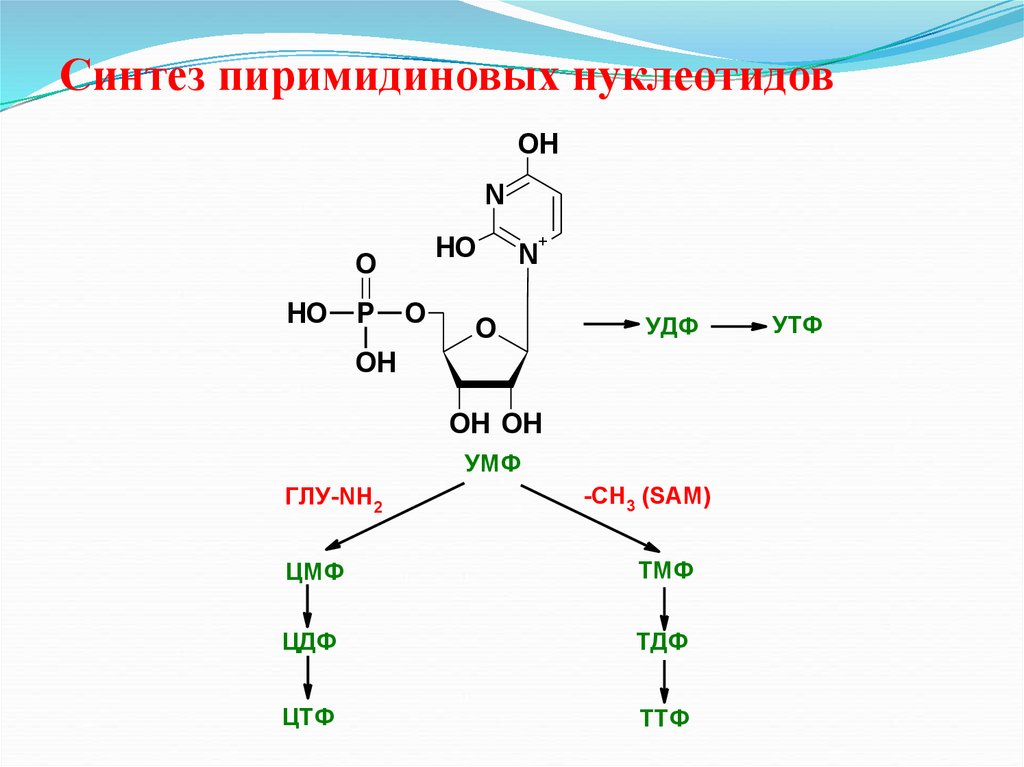
40. Синтез пиримидиновых нуклеотидов
OHN
HO
O
HO
P
O
+
N
O
УДФ
OH
OH OH
УМФ
ГЛУ-NH2
-CH3 (SAM)
ЦМФ
ТМФ
ЦДФ
ТДФ
ЦТФ
ТТФ
УТФ
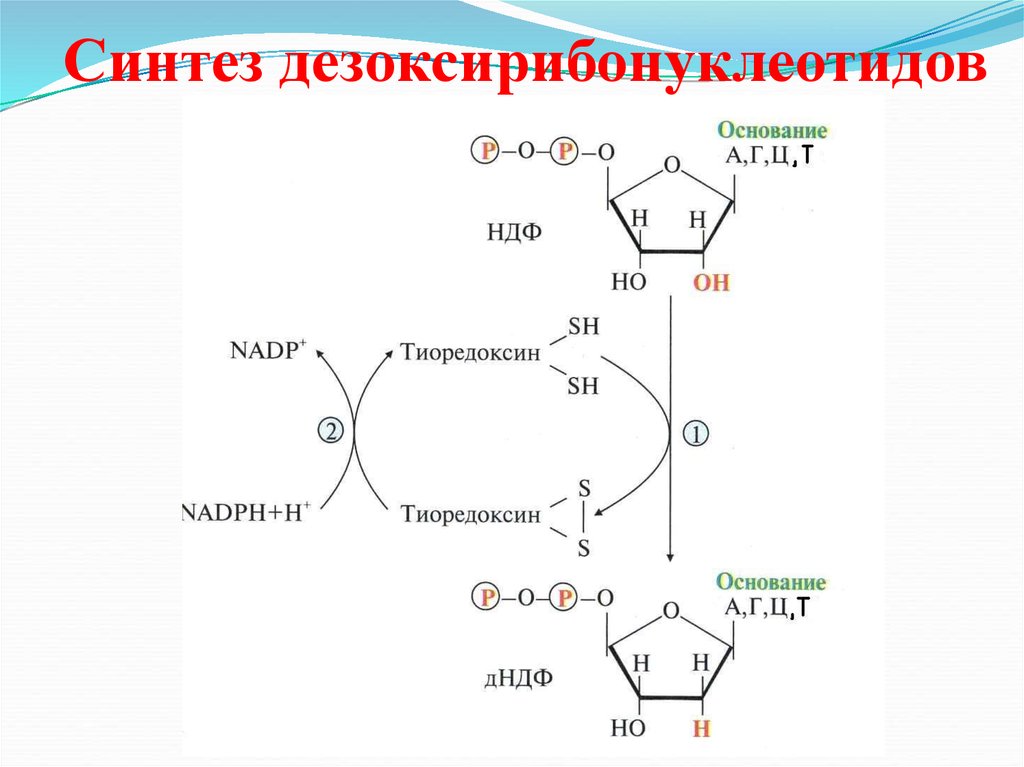
41. Синтез дезоксирибонуклеотидов
42. Пуриновые основания нуклеиновых кислот
NH2N
N
N1
2
6
3
5
N
7
4
9
N
N
NH
аденин (А)
8
NH
OH
пурин
N
N
H2N
N
гуанин (G)
NH
43. Пиримидиновые основания нуклеиновых кислот
OHN
HO
N3
2
4
1
OH
N
урацил (U)
5
CH3
N
6
HO
N
NH2
пиримидин
N
HO
N
цитозин (С)
N
тимин (Т)
44. Углеводы нуклеотидов
45. Строение мононуклеотида
NH2N
N
N
O
N
O
СН2
O
P
OH
OH OH
O
O
O
P O
P OH
OH
OH








 Биология
Биология Химия
Химия








