Похожие презентации:
Методи одержання нанодисперсних порошкових матеріалів
1. МЕТОДИ одержання нанодисперсних порошкових матеріалів
• Оксиди• Карбіди
• Нітріди
2. Основні хімічні методи отримання нанодисперсних порошків оксидів
Прямі методиПерероблення водних розчинів солей
• Розпилювальне
• Сушіння
• Розпилювальний
Термоліз
• Плазмохімічний синтез
• Кріокристалізація
• Висалювання
Методи, основані
на утворенні та переробці гідроксидів
(карбонгатів, оксалатів)
• Співосадження
• Золь-гель процес
• Гідроліз
• термоліз
• Гідротермальний
синтез
3. Фізико-хімія процесів прямого перероблення водних розчинів солей
Технологічні стадіїПриготуванн Розпилюван
я розчинів
ня в
теплоносій
Розділення
продуктів
сушіння
Термічне
оброблення
Дезагрегація
Помел
Фізико-хімічні процеси
Фізикохімічні явища
в розчинах:
гідратація,
комплексоут
ворення,
полімеризація
Видалення
розчинника:
кристалізація
солей,
часткова
дегідратаці
Фільтрація:
виділення
продуктів
сушки з
пило-газової
суміші
Термічне
Процеси
розкладання дезагрегації і
суміші солей, подрібнення
утворння
кристалічної
фази ZrO2
4. Структура гідроксокомплексів Zr(IV) в водних розчинах (аналіз літературних даних)
ОляціяТетрамір Zr(IV)
Оксоляція
Н
О
H2O
H2O
Zr
Zr
Zr
Zr
H2O
Zr
Zr
Zr
Zr
H2O
4
О
Н
O2
HO
z+
2
H
O2
H
O2
H
O2 H
H2O
О
H2O
Zr
Zr
Zr
Zr
H2O
Zr
Zr
Zr
Zr
О
H2O
n
а)
б)
Двумірні поліядерні структури
а) комплекс К1-1
б) комплекс К1-2
Моделі полімерізації тетрамірних
комплексів: Клірфілда- а); Рейнтена -б); в) комплекс К2-3
Блюменталя -в),г).
O2H
O2H
O2H
Процеси полімерізації
в)
z+
n
5. Разпилювальне сушіння
(1 – сосуд с исходным реагентом, 2 – насос, 3 –
предварительное сопло, 4 – основное сопло, 5 –
спрей, 6 – поток воздуха, 7 – камера, 8 – сборник,
9 – циклон, 10 – блокировка, 11 – ввод сжатого
воздуха, 12 – нагреватель, 13 – вентилятор, 14 –
ввод сжатого воздуха, 15 – отходящий газ, 16 –
сушилка, 17 – ввод воды)
Распылительная сушка - самый
распространенный промышленный
процесс сушки и формирования частиц.
Он приспособлен для непрерывной
переработки жидкого сырья в сухой
продукт в форме порошка, гранулята
или агломерата.
Сырьем могут служить растворы,
эмульсии и перекачиваемые суспензии.
Распылительная сушка начинается с
распыления (атомизации) жидкого
сырья на капли.
В сушильной камере эти капли
контактируют с горячим воздухом.
Испарение влаги из капель и
формирование сухих частиц происходит
при регулировании температуры и
воздушного потока.
6. Лабораторна установка розпилювального сушіння
7. Нанопорошки оксидов алюминия и циркония, полученные на нанораспылительной сушке
8.
Переробка водних розчинів в термічній плазміСхеми взаємодії плазмового потоку з
диспергованою рідиною в камері змішання
реактора (а – г) і багатоструминевого
плазмохімічного реактора для термолізу
розчинів солей (д):
Схема плазмохімічної установки
для отримання порошків оксидів
термолізом водних розчинів солей
Цирконію(IV):
1, 2 – вузли блоку живлення; 3 – баластні опори; 4
плазмотрони; 5 – форсунка; 6 – плазмохімічний реактор; 7
контрольно-вимірювальна система; 8 – циклон; 9 – фільтр; 10
конденсатор-холодильник; 11 – поглинальна колона;12
вентилятор
–
–
–
–
1 –форсунка; 2 – камера змішання; 3 –
реактор
8
9.
9Схема фізико-хімічних процесів перетворення
водних розчинів Цирконію(IV) в
низькотемпературній плазмі
Диспергуван
ня розчинів
солей Zr4+ +
Men+
Термічне
розкладання
солей
Нагрівання і
випаровуван
ня
розчинників
Кристалізаці
я солі Zr4+ і
Men+
Формування
кристалічної
структури стаб.
ZrО2
Модель взаємодії диспергованої
рідини з потоком плазмового
теплоносія
10.
10ПЕМ знімки плазмохімічних порошків
Схема поведінки краплі розчину солі
порошків стабілізованого діоксиду цирконію
цирконію(IV) в потоці плазмового теплоносія
складу
Критерій
Вебера
We
2a 0q v 2
.
де ρк– щільність рідини;
δ – поверхневий натяг рідини; а – діаметр
краплі; ; v – швидкість газу.
11.
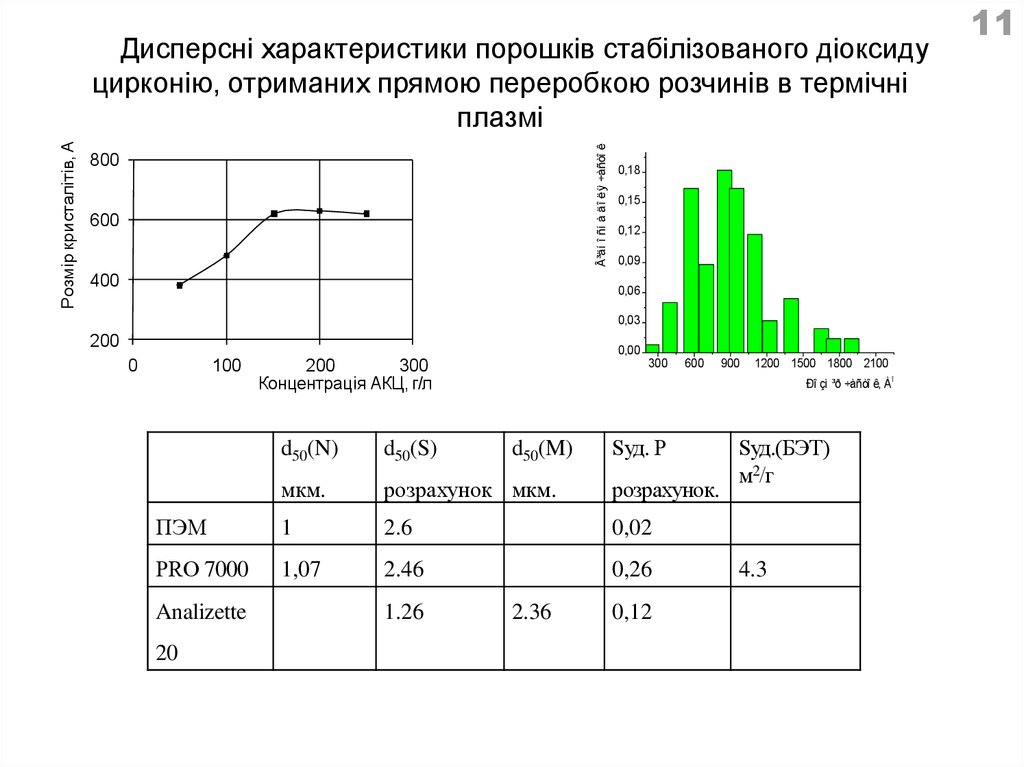
³äí î ñí à äî ëÿ ÷àñòî êРозмір кристалітів, А
Дисперсні характеристики порошків стабілізованого діоксиду
цирконію, отриманих прямою переробкою розчинів в термічні
плазмі
800
600
400
0,18
0,15
0,12
0,09
0,06
0,03
200
0,00
0
100
300
200
300
Концентрація АКЦ, г/л
600
î
мкм.
розрахунок мкм.
розрахунок.
ПЭМ
1
2.6
0,02
РRО 7000
1,07
2.46
0,26
20
d50(M)
Sуд. Р
d50(S)
1.26
1200 1500 1800 2100
Ðî çì ³ð ÷àñòî ê, À
d50(N)
Analizette
900
2.36
0,12
Sуд.(БЭТ)
м2/г
4.3
11
12. Кріохімічна технологія (Сублімаційна сушка)
13.
13Експериментальні дослідження прямої переробки водних розчинів
солей цирконію в нерівноважній плазмі
14.
Вірогідний механізм хімічних процесів утворення діоксиду цирконію вконтактній нерівноважній плазмі
-
- поглощение электрона, H2O (или катионами H3O+ в кислых растворах)
H2O + е → H2O–
(1)
+
H3O + е → H2O + Н·
2)
разрыв связи ОН (размещение электрона на σОН - орбитали молекулы H2O
способствует разрыву ОН– связи)
H2O– → ОН– + Н·
(3)
- цепная реакция радикального типа
H2O + Н· → H2 + ОН·
(4)
ОН· + H2O → H2O2 + Н·
(5)
.
Рекомбинация радикалов приводит к образованию молекул O2, H2, H2O2. В этой
связи процесс полимеризации гидроксоаквакомплексов Zr(+4) также необходимо
рассматривать как цепную реакцию радикального типа:
- генерация радикалов Н·
H3O+ + е → H2O + Н·
(6)
+
(в кислых средах концентрация H3O велика)
H2O + е → H2O– → ОН– + Н·
(7)
–
(т.к в кислых средах ОН сразу же исчезает, следовательно, можно записать
H2O + е → H2O– ; H2O– + H3O+ → 2H2O + Н·);
- образование радикалов гидроксокомплексов Zr(+4)
≡Zr– OH2 + Н· → ≡Zr– OH· + H2
(8)
≡Zr– OH· + Н· → ≡Zr– O· + H2
(9)
2(≡Zr)ОН + Н· → 2(≡Zr)О·
(10)
- полимеризация поликондесационного типа
≡Zr–О· + ≡Zr–OH· → ≡Zr–О–Zr≡ + OH·
(11)
≡Zr–О· + ≡Zr–O· → ≡Zr–О–О –Zr≡ → ≡Zr–О–Zr≡ + O·
(12)
14
15. Література
•С.П.Губин, Химия кластеров, М.: Наука, 1987, 262 с.•ЖВХО, т.32, н.1, 1987 - полностью посвящен кластерам и
кластерным материалам
•ЖВХО, т.36, н.3, 1991: Р.Хофман «Молекулы, ждущие своих
творцов» - с.261 и др. статьи.
•ЖВХО, т.36, н.6, 1991, в частности: С.П.Губин, Н.К.Еременко,
Кластерные серии: начальные этапы формирования твердой
фазы..., с.718-726., статьи по дисперсным материалам...
•И.Д.Морохов и др. Ультрадисперсные металлические среды,
М.Атомиздат, 1977, 263 с.
•М.А. Маргулис, Основы звукохимии, М.:Высшая школа, 1984, 272
с.
•Yu.D.Tretyakov, N.N.Oleynikov, O.A.Shlyakhtin, Cryochemical
Technology of advanced materials, Chapman & Hall, London,
1997, 319 p.
16. Технологічні стадії і фізико-хімічні процеси, що супроводжують одержання оксидів з гідроксидів (карбонатів, оксалатів)
Технологічні стадіїПриготуван Осадження Розділення Спеціальне
Сушіння,
ня розчинів гідроксидів продуктів оброблення термічне
осадження гідроксидів оброблення
Фізико-хімічні процеси методу сумісного осадження гідроксидів
Фізикохімічні
явища в
розчинах
гідратація,
Комплексо
утворення,
полімериз
ація
Р→Р
Осадження
:фізикохімічні
процеси
осадження
і сумісного
осадження
Р+Р→Т+Р
Фільтрація: Інформаці Дегідратац
виділення я відсутня ія:
продуктів
формуванн
осадження
я мікро-і
старіння
макро
гідроксиді
структури
в
кристалічн
Т+Р→Т+Р
ої фази
ZrO2
Т→Т+Г
Помел
Процеси
дезагрегац
іїі,
подрібнен
ня
Т→Т















 Физика
Физика Химия
Химия








