Похожие презентации:
Транскрипция ДНК. Регуляция активности генов на уровне транскрипции
1. Транскрипция ДНК Регуляция активности генов на уровне транскрипции
Министерство образования и науки Российской ФедерацииФедеральное бюджетное государственное образовательное учреждение
высшего образования «Оренбургский государственный университет»
Химико-биологический факультет
Кафедра биохимии и микробиологии
Транскрипция ДНК
Регуляция активности генов на
уровне транскрипции
Лекция №4
Лектор:
Давыдова Ольга Константиновна, к.б.н., доцент
2. План лекции:
Стадии транскрипции.
Структура и функция бактериальной РНК-полимеразы.
Сайты инициации транскрипции у бактерий.
Структура промоторов.
Механизмы узнавания промотора РНК-полимеразой.
Терминация транскрипции.
Механизмы антитерминации.
• Регуляция экспрессии генов на уровне транскрипции.
• Классическая схема оперона по Жакобу и Моно.
• Индукция и репрессия синтеза ферментов на примере лактозного
оперона.
• Явление аттенуации (на модели триптофанового оперона).
2
3. Транскрипция
© http://www.apickert.ch/Texte/Transkription.htm3
4.
Стадии транскрипцииНить ДНК, которая служит матрицей для синтеза РНК
при транскрипции называется смысловой или
матричной. Вторая нить ДНК называется
некодирующей (комплементарная ей РНК не кодирует
белки, она "бессмысленная").
В процессе транскрипции можно выделить три этапа.
Первый этап - инициация транскрипции – начало
синтеза нити РНК, образуется первая связь между
нуклеотидами.
Затем идет наращивание нити, ее удлинение –
элонгация, и, когда синтез завершен, происходит
терминация, освобождение синтезированной РНК.
РНК-полимераза при этом «слезает» с ДНК и готова к
новому циклу транскрипции.
© http://www.biochemistry.ru/pub/book3.htm
4
5.
РНК-полимеразаИстория изучения
РНК-полимераза была открыта независимо Сэмом Вайссом и Джерардом
Хурвицем в 1960.
Нобелевская премия по химии в 2006 году была присуждена Роджеру
Корнбергу за получение точных изображений молекул РНК-полимеразы в
различные моменты процесса транскрипции.
© https://s10.lite.msu.edu/res/msu/botonl/b_online/e21/21b.htm
5
6.
Транскрипция у прокариотУ бактерий один и тот же фермент
катализирует синтез трех типов
РНК: мРНК, рРНК и тРНК.
Молекулы РНК-полимеразы не
растворены в цитоплазме. Когда
РНК-полимераза не используется,
она связывается с неспецифичными
областями ДНК в ожидании
открытия активного промотора.
Нейлоновая модель фермента РНКполимеразы, застигнутой в тот
момент, когда она уже
присоединилась к промотору,
расплела двойную спираль ДНК и
собирается приступить к прочтению
генетической информации
© www.pingrysmartteam.com
6
7.
Структура РНК-полимеразыВ структуре РНК-полимеразы присутствует канавка
длиной 55 Å (5,5 нм) и шириной 25 Å (2,5 нм). Именно в
эту канавку помещается двойная спираль ДНК,
имеющая ширину 20 Å (2 нм). На длине канавки
укладывается 16 нуклеотидов.
Распределение зарядов на поверхности РНКполимеразы обеспечивает ее функции. Распределение
очень логично. Молекула нуклеиновой кислоты
заряжена отрицательно. Поэтому полость главного
канала, где должна удерживаться отрицательно
заряженная ДНК, выложена положительными зарядами.
Поверхность РНК-полимеразы выполнена
отрицательно заряженными аминокислотами, чтобы © http://dic.academic.ru/dic.nsf/ruwiki/157056
ДНК к ней не прилипала.
7
8.
Структура РНК-полимеразыБактериальная РНК-полимераза состоит
из нескольких белковых-субъединиц:
двух α-субъединиц (это маленькие
субъединицы), β- и β΄-субъединиц
(большие субъединицы) и ωсубъединицы. Вместе они образуют так
называемый минимальный фермент, или
кор-фермент.
К этому кор-ферменту может
присоединяться σ-субъединица. σсубъединица необходима для начала
синтеза РНК, для инициации
транскрипции.
После того, как инициация
осуществилась, σ-субъединица
© http://bio.fizteh.ru/student/files/biology/biolections/lection05.html
отсоединяется от комплекса, и
дальнейшую работу (элонгацию цепи)
ведет кор-фермент.
При присоединении к ДНК σ-субъединица
распознает участок, на котором должна
начинаться транскрипция. Он называется
промотор.
© http://mol-biol4masters.masters.grkraj.org/html/Gene_Expression_I2RNA_Polymerases.htm
8
9.
Структура РНК-полимеразыПромотор - это последовательность нуклеотидов, указывающих на начало
синтеза РНК. Без σ-субъединицы кор-фермент промотор распознать не
может. σ-субъединица вместе с кор-ферментом называется полным
ферментом, или холоферментом.
Связавшись с ДНК, а именно с промотором, который распознала σсубъединица, холофермент расплетает двунитевую спираль и начинает
синтез РНК.
Участок расплетенной ДНК – это точка инициации транскрипции, первый
нуклеотид, к которому должен комплементарно быть присоединен
рибонуклеотид.
Инициируется транскрипция, σ-субъединица уходит, а кор-фермент
продолжает элонгацию цепи РНК.
Затем происходит терминация, кор-фермент освобождается и становится
готов к новому циклу синтеза.
9
10.
Инициация транскрипции. Структура промоторовСочетание последовательностей "–10«(ТАТА- или Прибнов-бокс) и "–35" назвали
классическим промотором, т.к. она была описана первой.
Если есть ТАТА-бокс, но нет последовательности «-35», однако есть дополнительно
два нуклеотида, и этого достаточно, чтобы σ-субъединица распознала промотор, то
такая структура называется расширенным промотором.
© http://helicase.pbworks.com/w/page/17605620/Erin-Cartwright
10
11.
Промоторы, узнаваемые различными σ-факторамиσ
-35
-10
E.coli σ 70
TTGACA
TATAТT
E.coli σ 32
TCTC-CCCTTGAA
CCCCAT-TA
E.coli σ 54
(-24)CTGG-A
(-12)TTGCA
B. sub σ A
TTGACA
TATAAT
B. sub σ B
AGGTTTAA
GGGTAT
B. sub σ D
CTAAA
CCGATAT
B. sub σ E
ATATT
ATACA
B. sub σ K
AC
CATA---T
B. sub σ H
CAGGA
GAATT—T
11
12.
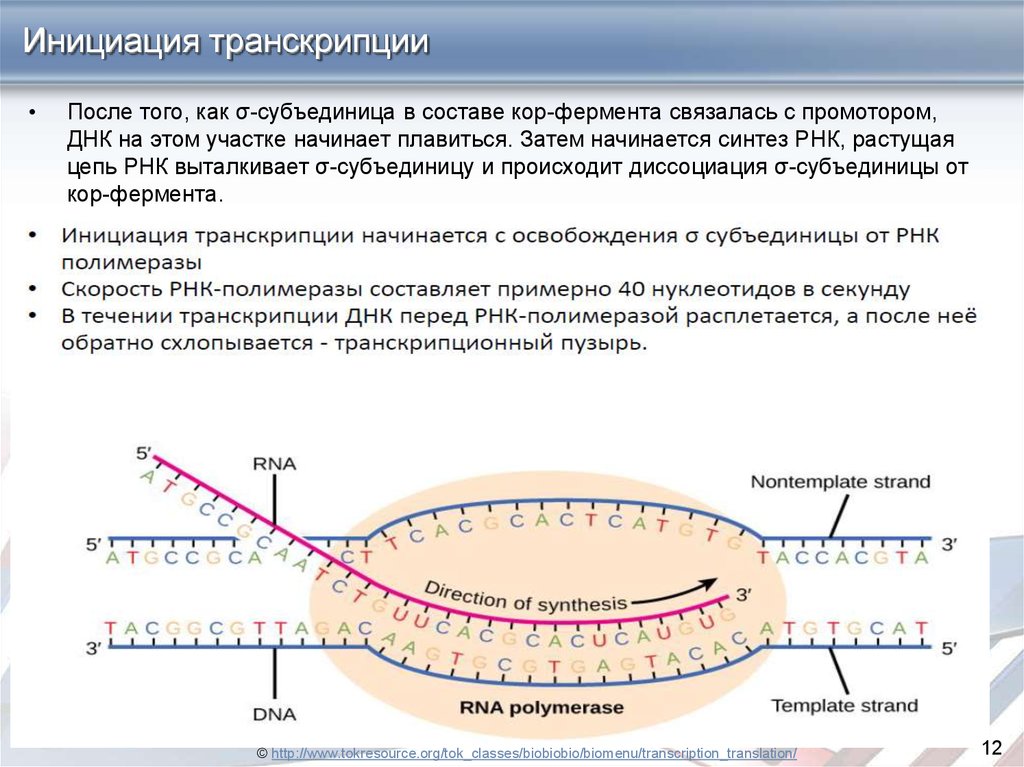
Инициация транскрипцииПосле того, как σ-субъединица в составе кор-фермента связалась с промотором,
ДНК на этом участке начинает плавиться. Затем начинается синтез РНК, растущая
цепь РНК выталкивает σ-субъединицу и происходит диссоциация σ-субъединицы от
кор-фермента.
© http://www.tokresource.org/tok_classes/biobiobio/biomenu/transcription_translation/
12
13.
Элонгация транскрипцииРНК наращивается на 3΄-конце.
Присоединением каждого нуклеотида
кор-фермент делает шаг по ДНК и
сдвигается на один нуклеотид.
После того, как синтезируется
фрагмент РНК более 12
нуклеотидов, σ-фактор необратимо
диссоциирует и транскрипция
вступает в стадию элонгации.
Комплекс кор-фермента с ДНК и РНК
называется элонгационным
комплексом. В нем находится ДНКРНК гибрид. То есть это участок, на
котором ДНК спарена с РНК, и 3΄конец РНК открыт для дальнейшего
роста. Размер этого гибрида – 9 пар
оснований. Расплетенный участок
ДНК занимает примерно 12 пар
оснований.
© http://bio.fizteh.ru/student/files/biology/biolections/lection05.html
13
14.
Элонгация транскрипцииПосле того, как σ-фактор диссоциирует
с элонгирующей РНК-полимеразой, с ней
начинают взаимодействовать несколько
белков – факторов элонгации.
Все дополнительные факторы не
являются необходимыми для
ферментативной активности самой РНКполимеразы.
Белок NusA, 56kD, способствует
паузам РНК-полимеразы на некоторых
участках ДНК, необходимых для
правильного сворачивания вторичной
структуры РНК.
NusG также фактор, ассоциированый с
элонгирующей РНК-полимеразой. В
отличии от NusA, он наоборот, подавляет
остановки РНК-полимеразы. Они играют
роль в регуляции терминации.
© http://player.myshared.ru/663083/
14
15.
Элонгация транскрипцииБелки GreA и GreB узнают так
называемые «арестованные» комплексы. Эти
комплексы образуются если РНК-полимераза
сдвигается против хода элонгации. При этом в
активном центре оказывается не 3’-конец
синтезируемой РНК, а РНК-ДНК дуплекс.
Такие комплексы стабильны и не могут ни
вернуться к элонгации ни диссоциировать
самостоятельно. Белки Gre узнают
«арестованные» комплексы и способствуют
гидролизу РНК-транскрипта РНК-полимеразой
в ее активном центре. После этого элонгация
может быть продолжена.
Другим препятствием для РНКполимеразы могут быть дефекты ДНК, такие,
как тиминовые димеры. РНК-полимераза,
остановившая транскрипцию в местах
повреждения ДНК, узнается белком Mfd,
который способствует диссоциации
полимеразного комплекса и присоединению
белков репарации uvrABC к ДНК.
© http://player.myshared.ru/663083/
15
16.
Терминация транскрипции© http://player.myshared.ru/663083/
16
17.
Регуляция транскрипцииДля регуляции транскрипции используются как стадии инициации, так и
элонгации/терминации.
Замена основного фактора инициации используется в случае, когда
необходимо существенно изменить спектр белков, синтезируемых в клетке.
Для более тонкой регуляции используются регуляторные ДНК связывающие
белки активаторы и ингибиторы. ДНК-связывающая способность этих белков
определяется связыванием лигандов или ковалентной модификацией.
На стадии элонгации и терминации регуляция может осуществляться с
помощью аттенюации, когда мРНК может иметь альтернативные вторичные
структуры, одна из которых способствует терминации. Относительная
стабилизация какой-либо из вторичных структур определяется либо
скоростью транскрипции, либо скоростью трансляции, либо связыванием
белка.
Антитерминация, или подавление активности некоторых терминаторов
может происходить с помощью регуляторных антитерминирующих белков.
17
18.
АттенюацияТранскрипция может регулироваться
также с помощью преждевременной
терминации, т.е. в зависимости от нужд
клетки должен осуществляться выбор
между элонгацией и терминацией.
Наиболее простой способ остановить
транскрипцию – связать белок-регулятор
на пути РНК-полимеразы. Два
механизма регулируемой терминации
это антитерминация и аттенюация.
Аттенюация – это регулируемая
терминация зависящая от
относительной стабилизации
альтернативных вторичных структур
транскрибируемой мРНК.
Как известно, ρ-независимый
терминатор представляет собой РНК
шпильку и последующий
олигоуридиловый участок.
Если будет стабилизирована
альтернативная вторичная структура,
где олигоуридиловый фрагмент удален
от ближайшей шпильки, терминация не
будет происходить.
© https://ru.wikipedia.org
18
19.
АнтитерминацияЛучше всего процесс антитерминации изучен для
бактериофага , у которого имеется два
механизма антитерминации, связанных с
регуляторными белками-антитерминаторами.
Белок N фага связывается с определенной
структурой на транскрибируемой РНК – nut (от N
utilization). На данной структуре при участии N
собирается РНК-белковый комплекс, включающий
белки S10, NusA, NusB и NusG,
взаимодействующий с РНК-полимеразой. Этот
комплекс препятствует терминации данного РНКполимеразного комплекса на -зависимых и
некоторых -независимых терминаторах.
По-другому устроен механизм антитерминации
при помощи белка Q фага . Это ДНКсвязывающий белок, место связывания которого
располагается с 5’-стороны от промотора
оперона, регулируемого этим белком. Сразу за
точкой начала транскрипции расположен сильный
-независимый терминатор, активность которого
подавляется белком Q.
© http://player.myshared.ru/663083/
19
20.
Регуляция активности геновАктивность генов определяется объемом генопродуктов (РНК и белков).
Степень активности генов называется их экспрессией.
Все гены клетки (и целостного организма) можно разделить на две группы:
регуляторные и структурные.
Регуляторные гены не транскрибируются, т.е. в обычных условиях им не
соответствует ни один из типов РНК.
Структурные гены способны транскрибироваться с образованием РНК
(матричной, рибосомальной, транспортной). В свою очередь, структурные
гены делятся на конститутивные и индуцибельные.
20
21.
Регуляция активности геновКонститутивные гены постоянно включены. К ним относятся гены,
обслуживающие матричные процессы (кодирующие тРНК, рРНК, ДНКполимеразы, РНК-полимеразы,рибосомальные белки), гены, кодирующие
обязательные структурные компоненты клетки (например, белки-гистоны),
гены, контролирующие постоянно протекающие обменные процессы
(например, гликолиз). Иначе говоря, это «гены домашнего хозяйства», без
которых клетки не могут существовать.
Индуцибельные гены функционируют на определенных этапах онтогенеза,
они могут включаться и выключаться, их активность может регулироваться по
принципу «больше или меньше». Это «гены роскоши». К
индуцибельным генам относятся как гены, контролирующие ход онтогенеза
(переключатели, или диспетчеры), так и гены, прямо определяющие структуру
и функции компонентов клетки и целостного организма.
Нужно отметить, что строгой разницы между перечисленными группами генов
не существует, поскольку один и тот же участок ДНК может выполнять разные
функции.
Существуют индуцибельные гены, в норме включенные, и гены, в норме
выключенные. Включение нормально выключенных индуцибельных генов
называется индукцией, выключение нормально включенных – репрессией.21
22.
Регуляция активности геновНа индукцию и репрессию могут влиять самые разнообразные факторы,
которые называются эффекторами.
Одни из них прямо закодированы в геноме организма (например, белки
теплового шока), другие образуются как промежуточные продукты обмена
веществ, третьи поступают в клетку извне в готовом виде из внешней среды
или из других клеток (тканей) организма, четвертые образуются в клетке под
влиянием физических факторов (экстремальных температур, ультрафиолета)
и т.д.
Особую группу эффекторов составляют белки теплового шока, которые
синтезируются в клетке при различных видах стресса (при повышении
температуры, при воздействии других неблагоприятных факторов). Эти белки
эволюционно консервативны, они обнаружены у самых различных
организмов; вероятно, они являются универсальными эффекторами.
22
23.
Регуляция активности геновИменно регуляцией активности генов объясняется тот факт, что, несмотря на
идентичность генотипов клеток многоклеточного организма, они
значительно различаются по строению и функции. Переключение синтеза
с одних белков на другие лежит в основе всякого развития, будь то
репродукция вирусов в зараженных клетках, рост и спорообразование у
бактерий, развитие эмбрионов или дифференцировка тканей. На каждом
этапе этих процессов синтезируются специфичные белки.
Регуляция экспрессии генов может осуществляться на нескольких уровнях:
– генном (связан с изменением количества или локализации генов,
контролирующих данный признак),
– транскрипционном (определяет, какие и сколько мРНК должны
синтезироваться в данный момент),
– трансляционном (обеспечивает отбор мРНК, транслирующихся на
рибосомах) и
– функциональном (связан с аллостерической регуляцией активности
ферментов).
– путем посттрансляционной модификации
полипептидов, посттранскрипционной модификации мРНК, и другими
путями.
23
24.
Теория оперонаВ 1961 Ф. Жакоб и Ж. Моно на основе экспериментальных работ по
синтезу индуцируемых ферментов у мутантов кишечной палочки
предложили модель генной регуляции: в ДНК существуют наборы
нескольких генов ("структурные гены"), объединенные в оперон и
подлежащие общей регуляции. Оперон транскибируется целиком, а
образующееся мРНК содержит информацию для синтеза нескольких
полипептидов (полигенная мРНК). Моногенной мРНК может быть только в
случае, если оперон содержит один ген.
Ф.Жакоб
© http://www.nobelprize.org/nobel_prizes/medicine/laureates/1965/
Ж.Моно
© http://persons-info.com/persons/MONO_ZHak_Liusen
24
25.
Схема оперонаОперон, группа функционально связанных между собой генов,
детерминирующих синтез белков-ферментов, относящихся к
последовательным этапам какого-либо биохимического процесса.
Регуляторная функция оперона осуществляется на стадии транскрипции.
В начале оперона обычно локализован промотор — инициирующий
транскрипцию участок ДНК, с которым специфически связывается фермент
РНК-полимераза, осуществляющая транскрипцию оперона.
За промотором расположен оператор — участок ДНК, с которым
взаимодействует регуляторный белок — репрессор.
Остальную часть оперона составляют структурные гены, содержащие
информацию о последовательности аминокислот в полипептидных цепях
белков.
25
26.
Схема оперонаРепрессоры синтезируются под контролем генов-регуляторов, необязательно
входящих в данный оперон. Взаимодействуя с оператором, репрессор влияет
на скорость транскрипции структурных генов. Репрессор, с одной стороны,
способен «узнавать» последовательность оснований ДНК оператора, с другой
— взаимодействовать с низкомолекулярными веществами — эффекторами,
являющимися чаще всего субстратами или продуктами действия ферментов,
определяемых данным опероном. Эффекторы резко меняют сродство
репрессора к оператору; некоторые его снижают, другие повышают.
Когда репрессор связан с оператором, он препятствует движению РНКполимеразы вдоль оперона, и синтез м-РНК тормозится, «выключается».
Отделение репрессора от оператора приводит к «включению» оперона. Т. о.,
оператор определяет активность оперона в целом. Описанная регуляция
называется негативной, или отрицательной.
Существует и позитивная, или положительная, регуляция, осуществляемая
белком-активатором, который, присоединяясь к начальной части оперона
(перед промотором), активирует транскрипцию оперона. Конец оперона —
последовательность нуклеотидов, с которыми связан специфический белок —
т.н. терминатор, прерывающий синтез РНК.
26
27.
Лактозный оперонВ лактозном опероне сгруппированы три гена, продукты которых необходимы
для танспортировки лактозы внутрь клетки и ее расщепления. Источником
углеводов "по умолчанию" для кишечной палочки является глюкоза.
Если глюкоза есть, то в этом случае ни на какие другие источники энергии
можно вообще не обращать внимания. А вот если глюкозы нет, то приходится
думать, чем бы её заменить или из чего добыть.
И если в окружающей среде есть молочный сахар, лактоза, то это неплохой
вариант: бактерия E. coli вполне способна расщепить его на два более простых
вещества – глюкозу и галактозу. Для того чтобы переваривать молочный
сахар, бактерия использует специальный фермент – β-галактозидазу.
27
28.
Лактозный оперонβ-галактозидаза вырабатывается только тогда, когда, во-первых, в
окружающей среде есть лактоза и во-вторых, отсутствует глюкоза, и, значит,
её нужно добывать из других веществ.
В ситуации когда молочного сахара нет вообще, не производится и нужный
для его переваривания фермент, β-галактозидаза. Такая экономия ресурсов
достигается благодаря тому, что с промотором гена β-галактозидазы связан
белок-репрессор, который физически не позволяет РНК-полимеразе
связаться с ДНК и начать транскрипцию.
© http://www.strf.ru/material.aspx?CatalogId=222&d_no=36947#.VcI4tfPtlBc
© http://www.strf.ru/material.aspx?CatalogId=222&d_no=36947#.VcI4tfPtlBc
28
29.
Лактозный оперонКогда в клетке появляется лактоза, она сама же и снимает запрет на
производство фермента, нужного для её расщепления. Молекула лактозы
связывается с белком-репрессором, в результате чего он меняет
конформацию и отсоединяется от ДНК.
Теперь нужный фермент производится, но в очень незначительном
количестве. Дело в том, что промоторы бывают разные: к некоторым РНКполимераза присоединяется охотно, а к некоторым – не очень.
Промотор гена β-галактозидазы слабый: он мало «привлекает» РНКполимеразу, и нужна дополнительная «приманка».
Приманка начинает работать в том случае, если в клетке очень мало
глюкозы. Значит, хочешь не хочешь, а использовать альтернативные
источники пищи необходимо.
29
30.
Лактозный оперонОтсутствие глюкозы – это настоящий голод, а в случае голода клетка
вырабатывает молекулы-алармоны (от англ. alarm – тревога), которые
служат сигналом для перестройки всей её жизнедеятельности. В роли
одного из таких посредников выступает циклический аденозинмонофосфат,
цАМФ. Молекула этого вещества взаимодействует с белком, активирующим
катаболизм, – CAP (catabolism activating protein), а образовавшийся
комплекс связывается с промотором гена β-галактозидазы. CAP
притягивает РНК-полимеразу к промотору и увеличивает вероятность того,
что ген β-галактозидазы будет прочитан.
Эти два события – блокировка репрессора и активация CAP – приводят к
активному производству β-галактозидазы. Клетка теперь может
использовать молочный сахар в качестве пищи, что позволяет ей выйти из
состояния голода и продолжить рост.
© http://www.strf.ru/material.aspx?CatalogId=222&d_no=36947#.VcI4tfPtlBc
30
31.
Лактозный оперонЕсли в питательной среде присутсвует и глюкоза, и лактоза, предпочтение
отдается первой, а лактозный метаболизм выключен. Входными данными для
лактозного триггера являются два сигнала (концентрации глюкозы и лактозы),
причем логика такова, что оперон включается только при одновременном
выполнении двух условий: лактоза должна присутствовать, глюкоза должна
отсутствовать. В остальных трех возможных вариантах оперон выключен:
Глюкоза есть, лактоза есть -> оперон выключен
Глюкоза есть, лактозы нет -> оперон выключен
Глюкозы нет, лактозы нет -> оперон выключен
Глюкозы нет, лактоза есть -> оперон ВКЛЮЧЕН
Обратная связь осуществляется здесь следующим образом.
а) Негативная регуляция. Наличие лактозы приводит к повышению
концентрации ее изомера - аллолактозы. Она связывается с репрессором,
изменяя его конфигурацию. Это приводит к тому, что он отсоединяется от ДНК
(в случае триптофанового репрессора будет наоборот - связывание
триптофана делало репрессор активным, а тут связывание аллолактозы с
репрессором делает его неактивным).
б) Позитивная регуляция. Активатором лактозного оперона является белок
CAP (Catabolite Activator Protein). Сигнальной молекулой для него является
cAMP (циклический аденозинмонофосфат). В свою очередь, концентрация
cAMP зависит от концентрации глюкозы: чем больше глюкозы, тем меньше
cAMP.
31
32.
Лактозный оперонИтак, глюкоза является
репрессором.
Лактоза является
индуктором.
Таким образом, лактозный
оперон находится под
двойным контролем
индуктора (лактозы) и
репрессора (глюкозы).
© http://galicarnax.livejournal.com/25939.html
32
33.
Триптофановый оперонВ триптофановый оперон кишечной палочки сгруппированы пять генов,
продукты которых участвуют в синтезе триптофана (одна из 20
аминокислот). Если же он присутствует в среде обитания и производить
его метаболически нет необходимости (например, бактерия находится в
кишечнике млекопитающего, которое только что съело белковую пищу),
то все пять генов молчат.
Как же гены узнают, когда им надо работать, а когда нет? Неужели они
"чувствуют" присутствие триптофана? Ответ - да, они его именно
чувствуют. Здесь вступают в игру обратные связи.
© http://galicarnax.livejournal.com/25939.html
33
34.
Триптофановый оперонВнутри промотора у триптофанового оперона имеется другая, меньшая
последовательность, которая называется оператором. Эту последовательность
узнает регуляторный белок - триптофановый репрессор. Если он присоединен к
оператору, то доступ к промотору для РНК-полимеразы закрыт, и гены будут
молчать.
Триптофановый репрессор регулируется обратной связью: для того, чтобы он
мог присоединиться к оператору на ДНК, он должен быть соединен с двумя
молекулами триптофана. Это его активное состояние. Если он не соединен с
молекулами триптофана, то имеет немного другую пространственную
конфигурацию, которая не позволяет ему присоединиться прочно к оператору это неактивное состояние репрессора.
© http://galicarnax.livejournal.com/25939.html
34
35.
Триптофановый оперонЕсли в клетке триптофана достаточно (поступает из внешней среды в готовом
виде), он связывается с репрессором, тот связывается с оператором, РНКполимеразе доступ закрывается, гены молчат, триптофан не производится.
Если триптофана мало или нет вообще, репрессор "выключен", с оператором
не связывается, доступ РНК-полимеразе открывается, гены экспрессируются,
триптофан производится. На рисунке показана только одна молекула
триптофана на репрессоре, в реальности присоединяются две.
Таким образом, триптофановый репрессор и оператор образуют простое
триггерное устройство, включающее и выключающее синтез триптофана в
зависимости от его наличия. Так как активное состояние репрессора выключает
гены, то такой режим называется негативной регуляцией
© http://galicarnax.livejournal.com/25939.html
35
36.
Триптофановый оперонТранскрипция триптофанового оперона
E. coli должна происходить только когда
концентрация триптофана в клетке мала.
В начале trp-оперона закодирован
короткий пептид, богатый остатками
триптофана. Поскольку трансляция
мРНК у кишечной палочки происходит
котранскрипционно, лидерный участок
мРНК начинает транслироваться сразу
после синтеза. Для лидерного участка
мРНК существуют две альтернативные
вторичные структуры, одна
способствующая преждевременной
терминации, другая нет. Если рибосома
быстро транслирует лидерный участок
мРНК, что характерно для высоких
концентраций триптофана, она
расплавляет элемент вторичной
структуры, препятствующий терминации
и, таким образом, стабилизирует
вторичную структуру терминатора.
© https://ru.wikipedia.org
36
37.
Триптофановый оперонНаконец, самый простой способ
стабилизировать одну из
альтернативных вторичных структур
РНК используется для регуляции
транскрипции trp-оперона B. subtilis.
В присутствии больших
концентраций триптофана
триптофан-связывающий белок
TRAP взаимодействует с
транскрибирующейся мРНК trpоперона и стабилизирует
конформацию, способствующую
преждевременной терминации.
© https://ru.wikipedia.org
37
38.
ЗаключениеТранскриипция — процесс синтеза РНК с использованием ДНК в качестве
матрицы, происходящий во всех живых клетках. Другими словами, это
перенос генетической информации с ДНК на РНК.
Транскрипция является первой стадией экспрессии генетического материала
в клетках всех организмов. Именно на уровне транскрипции действуют
основные механизмы генетической регуляции.
Процесс транскрипции ДНК в клетках всех организмов осуществляется ДНКзависимыми РНК-полимеразами. Это значит, что в качестве матрицы данные
ферменты используют молекулу ДНК, а синтезируют молекулу РНК из
рибонуклеозидтрифосфатов (рНТФ).
Транскрипция не связана с фазами клеточного цикла; она может ускоряться
и замедляться в зависимости от потребности клетки или организма в
определённом белке.
38





































 Биология
Биология








