Похожие презентации:
Обмен жиров в организме
1. ОБМЕН ЖИРОВ В ОРГАНИЗМЕ
ТАМБОВЦЕВА Р.В.Д.б.н., профессор
Москва, РГУФКСМиТ
2. ОБМЕН ЖИРОВ В ОРГАНИЗМЕ
Жиры поступают в организм человека с продуктами животного и растительногопроисхождения.
Взрослому человеку требуется от 70 до 145 г жира в сутки (преимущественно в виде
триглицеридов), в том числе 15 г ненасыщенных жирных кислот и 10 г фосфолипидов.
Суточная потребность в жире зависит от пола, климатических условий, двигательной
активности или трудовой деятельности.
Содержание жиров в организме взрослого человека в среднем составляет: у мужчин –
7-8 кг, у женщин – 5-6 кг или 10-15% от общей массы тела. При ожирении их содержание
может достигать 30% массы тела и более.
Жиры обеспечивают 25-30% потребности человека в энергии.
С животными жирами в организм поступают жирорастворимые витамины А, D, Е и К, а
с растительными маслами ненасыщенные жирные кислоты (витамин F), которые
являются предшественниками биологических активных веществ – простагландинов, а
также исходным материалом для синтеза фосфолипидов и других веществ.
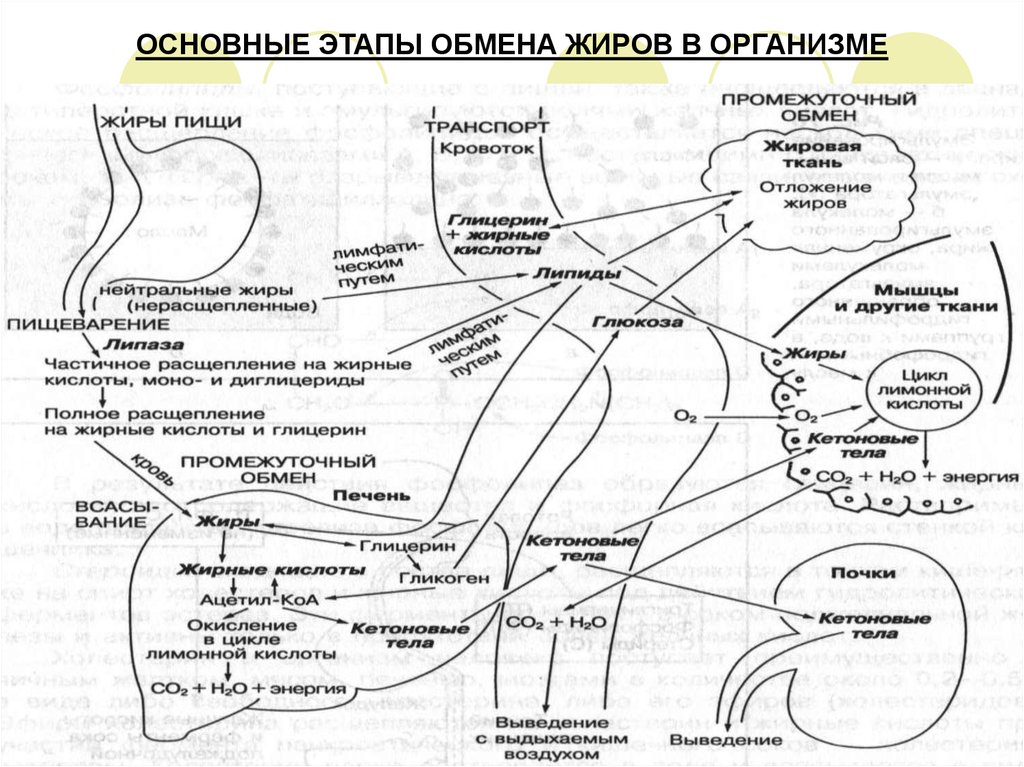
Поступившие в организм жиры пищи в ЖКТ подвергаются ферментативному
расщеплению до структурных мономеров – глицерина, жирных кислот и других
составных, которые всасываются в стенку кишечника.
Частичный синтез триглицеридов происходит уже в слизистой оболочке кишечника.
Далее большая часть липидов поступает в лимфатическую систему кишечника, затем
в ее грудной лимфатический проток, а из него в кровь.
Определенная часть триглицеридов поступает в жировое депо и печень.
При потребности организма в энергии происходит их гидролиз с последующим
окислением глицерина и жирных кислот
3. ОСНОВНЫЕ ЭТАПЫ ОБМЕНА ЖИРОВ В ОРГАНИЗМЕ
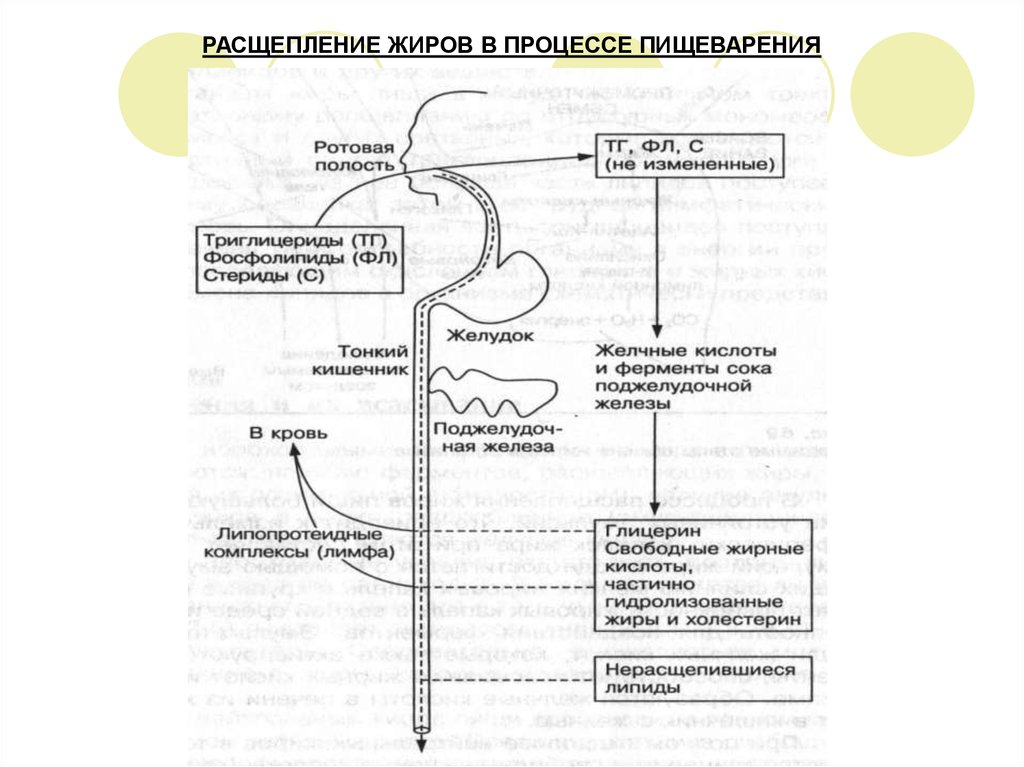
4. РАСЩЕПЛЕНИЕ ЖИРОВ В ПРОЦЕССЕ ПИЩЕВАРЕНИЯ И ИХ ВСАСЫВАНИЕ
Основные факторы, необходимые для расщепления жира в пищеварительном тракте:Ферменты, расщепляющие жиры
Условия для проявления оптимальной активности (рН)
Наличие эмульгаторов для перевода жира в мелко раздробленное (эмульгированное)
состояние – желчные кислоты.
В ротовой полости необходимые условия отсутствуют, поэтому химическое расщепление
жиров не происходит. В желудке имеется липаза с очень низкой активностью. Очень
кислая среда в желудке (рН = 1,5-2,5) подавляет активность липазы (рН = 7,8-8,1), а также
отсутствуют эмульгаторы. Следовательно, расщепляться могут только уже
эмульгированные жиры, которые содержатся в молоке и яичном желтке.
Основной гидролиз нейтральных жиров пищи происходит в тонком кишечнике под
воздействием активных липаз.
Среда в кишечнике слабощелочная – оптимальная среда для проявления активности
липазы, поступающая сюда с соком поджелудочной железы.
В процессе расщепления жиров пищи большую роль играет образование устойчивых
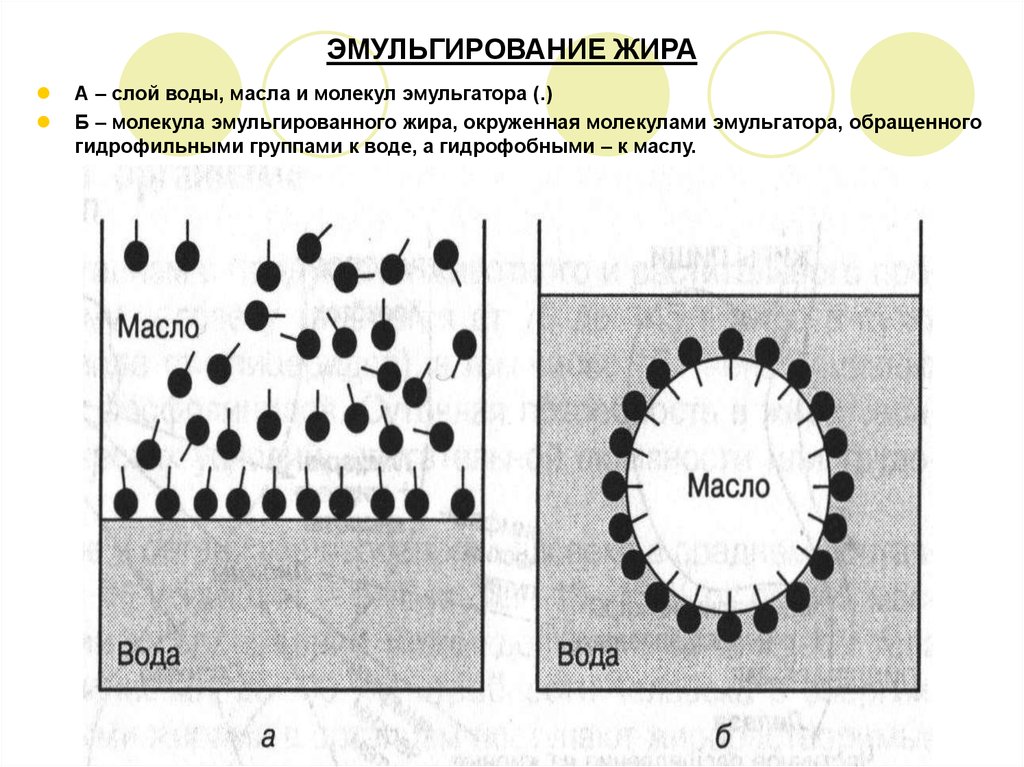
эмульсий, что приводит к измельчению жиров.
Диаметр сферических капелек жира составляет 1000 нм.
Устойчивость эмульсий жира к воде достигается с помощью эмульгаторов,
препятствующих слиянию мелких жировых капель в крупные.
Это увеличивает поверхность жировых капель в водной среде и создает большую
доступность для воздействия ферментов.
Эмульгаторами жиров являются соли желчных кислот, которые также активируют
гидролитические ферменты, способствуют всасыванию жирных кислот и их транспорту в
организме.
5. ЭМУЛЬГИРОВАНИЕ ЖИРА
А – слой воды, масла и молекул эмульгатора (.)Б – молекула эмульгированного жира, окруженная молекулами эмульгатора, обращенного
гидрофильными группами к воде, а гидрофобными – к маслу.
6. РАСЩЕПЛЕНИЕ ЖИРОВ В ПРОЦЕССЕ ПИЩЕВАРЕНИЯ
7. РАСЩЕПЛЕНИЕ ЖИРОВ В ПРОЦЕССЕ ПИЩЕВАРЕНИЯ
При полном гидролизе нейтральных жиров в тонком кишечнике образуются глицерин,свободные жирные кислоты и частично гидролизованные моно- и диглицериды.
ФОСФОЛИПИДЫ, поступающие с пищей, также расщепляются в двенадцатиперстной
кишке и эмульгируются солями желчных кислот.
Гидролитическое расщепление фосфолипидов осуществляется несколькими
специфическими фосфолипазами А, В, С и D, поступающими с панкреатическим соком.
Эти ферменты разрывают разные эфирные связи: рисунок
В результате действия фосфолипаз образуются глицерин, жирные кислоты,
азотсодержащие вещества и фосфорная кислота. Растворимые в воде продукты гидролиза
фосфолипидов легко всасываются стенкой кишечника.
СТЕРОИДЫ, входящие в состав пищи, расщепляются в тонком кишечнике на спирт
холестерол и жирные кислоты под действием гидролитических ферментов эстераз. Эти
ферменты поступают с соком поджелудочной железы и активны только в присутствии
солей желчных кислот.
Холестерин в организм человека поступает преимущественно с яичным желтком, мясом,
печенью, мозгами в количестве 0,2-0,5 г в виде свободного холестерина, либо его эфиров
(холестеридов).
Эфиры холестерина расщепляются на холестерин и жирные кислоты при участии
фермента панкреатического и кишечных соков – холестеринэстеразы.
Холестерин плохо растворяется в воде и всасывается в виде комплекса с желчными
кислотами.
8. РАСЩЕПЛЕНИЕ ЖИРОВ В ПРОЦЕССЕ ПИЩЕВАРЕНИЯ
В процессе пищеварения около 40% жиров распадается полностью до структурных компонентов,50% гидролизуются частично, а 10% остаются негидролизованными.
Продукты гидролиза жира по мере их образования всасываются клетками слизистой оболочки
кишечника («ворсинками»).
Глицерин, фосфорная кислота, аминоспирты, а также жирные кислоты с короткой цепью хорошо
растворяются в воде и переходят в кровь при всасывании без особых изменений.
Жирные кислоты с длинной углеродной цепью и частично гидролизованные триглицириды в воде
не растворяются и всасываются только в виде водорастворимых комплексов с желчными
кислотами, которые называются холеиновыми комплексами (холеинатами).
Холеинаты обеспечивают проникновение жирных кислот в клетки слизистой оболочки кишечника,
где эти комплексы распадаются на жирные и желчные кислоты.
Освободившиеся желчные кислоты возвращаются в систему воротной вены и попадают в печень,
где вновь включаются в состав желчи, а жирные кислоты используются для биосинтеза
индивидуальных жиров.
Первичный синтез специфических для данного организма жиров происходит уже в клетках
кишечного эпителия из глицерина и жирных кислот.
Затем жиры проникают в лимфатическую систему и транспортируются в виде комплексов с
белками (липопротеидов), которые различаются между собой по химическому составу, размеру
частиц и специфической функции.
В области грудного лимфатического протока они попадают в кровяное русло.
Через 1-2 часа после приема пищи увеличивается уровень липидов в крови (алиментарная
гиперлипемия). Наибольший пик гиперлипемии наблюдается через 4-6 часов после приема жирной
пищи.
Через 9 -10 часов после приема пищи уровень жиров в крови нормализуется. Для того, чтобы из
крови поступить в ткани организма, жиры распадаются на поверхности сосудов до жирных кислот
и глицерина.
В тканях жиры снова синтезируются и откладываются про запас в жировых депо либо окисляются
в ходе биоэнергетических процессов.
9. ВНУТРИКЛЕТОЧНЫЙ ОБМЕН ЖИРОВ
Промежуточный обмен липидов интенсивнопротекает в печени и жировой ткани, где
постоянно происходит синтез резервных и других
липидов, а также их распад.
Синтез резервных жиров, которые являются
триглициридами, приводит к накоплению их в
тканях (ДЕПОНИРОВАНИЕ).
Постоянно протекает процесс распада резервных
жиров до глицерина и жирных кислот, которые
затем утилизируются тканями – МОБИЛИЗАЦИЯ
ЖИРОВ.
Процесс распада нейтральных жиров в тканях
осуществляется с участием тканевых липаз –
ЛИПОЛИЗ.
10. ЛИПОЛИЗ
В 1948 – 1958 гг. А.Ленинджер и Ф.Линен и другие ученыеоткрыли сложный процесс распада и окисления нейтральных
жиров. Учеными было показано, что при увеличении
потребности организма в энергии (во время длительной
мышечной деятельности, голодании) активируются процесс
липолиза в клетках жировой ткани (адипоцитах).
Внутритканевые липазы расщепляют нейтральные жиры до
глицерина и жирных кислот, которые из жировых тканей
поступают в кровь и доставляются к тканям, где используются
в качестве энергетического или пластического материала.
Поскольку химическая природа жирных кислот и глицерина
различна, различны и пути их внутритканевого обмена.
Глицерин может участвовать в глюконеогенезе или включаться
в гликолитический путь расщепления с предварительным
образованием 3-фосфоглицеринового альдегида.
Жирные кислоты расщепляются преимущественно в печени,
где являются основными источниками энергии, либо участвуют
в синтезе холестерина и кетоновых тел.
11. СХЕМА ВНУТРИКЛЕТОЧНОГО ОБМЕНА ГЛИЦЕРИНА И ЖИРНЫХ КИСЛОТ
12. ОКИСЛЕНИЕ ГЛИЦЕРИНА
Глицерин используется всеми органами и тканями как эффективный энергетическийсубстрат.
Его окисление начинается с образованием а-глицерофосфата (или фосфоглицерина) с
помощью АТФ, а затем постепенно превращается в 3-фосфоглицериновую кислоту и
далее окисляется по пути окисления углеводов:
3-фосфоглицериновая кислота, являясь промежуточным продуктом гликолитической
фазы окисления углеводов, в анаэробных условиях окисляется до молочной кислоты, а в
аэробных условиях превращается в ацетил-КоА.
Ацетил-КоА вступает в цикл лимонной кислоты и окисляется до конечных продуктов
обмена – СО2 и Н2О.
При окислении одной молекулы глицерина образуется одна молекула АТФ в анаэробных
условиях и 19 молекул АТФ – в аэробных
Глицерин может использоваться также для новообразования глюкозы и восстановления
запасов гликогена.
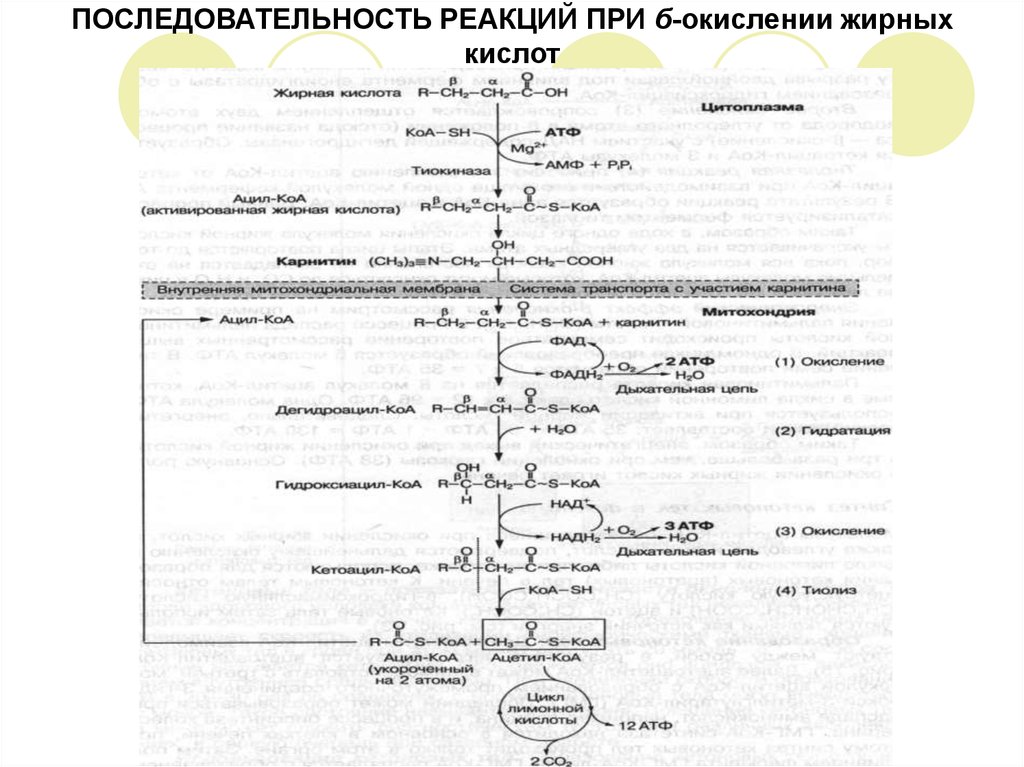
13. ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ
Окисление жирных кислот может происходить несколькими метаболическими путями, изкоторых для организма человека главным является – бета – окисление.
Сущность бета-окисления жирной кислоты – в ходе одного цикла химических превращений
происходит окисление второго от – СООН группы атома углерода, который находится в
бета-положении и отщепление молекулы ацетил-КоА.
Далее ацетил-КоА вступает в цикл лимонной кислоты, затем в системе дыхательных
ферментов окисляется до конечных продуктов обмена – СО2 и Н2О с освобождением
большого количества энергии.
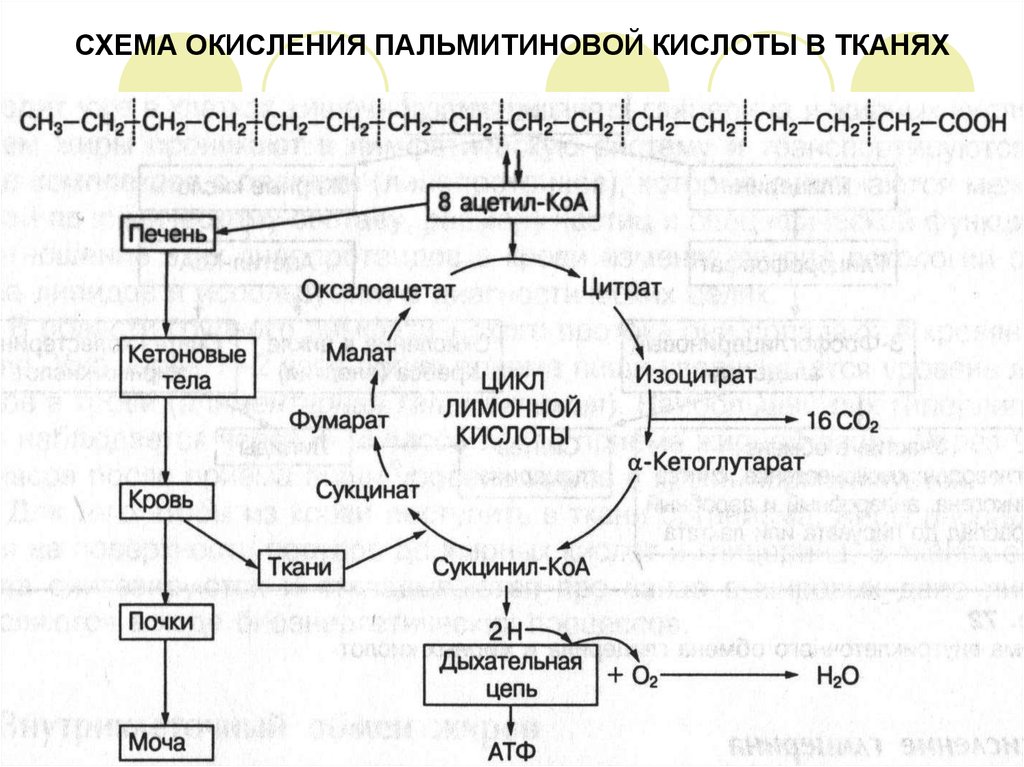
В результате полного распада, например, пальмитиновой кислоты образуется 8 молекул
ацетил-КоА, которые окисляются в лимонном цикле или поступают в печень, где из них
образуются кетоновые тела.
Полное окисление молекулы пальмитиновой кислоты:
С6Н32О2 + 23О2 16СО2 + 146 Н2О + 130 АТФ
Процесс б-окисления жирных кислот протекает в митохондриях.
Подготовительным этапом к окислению является предварительная активация молекулы
жирной кислоты, которая происходит в цитоплазме.
Активация жирной кислоты включает реакцию взаимодействия ее с коэнзимом-А и АТФ,
вследствие чего образуется активная форма жирной кислоты – ацетил-КоА. Реакцию
катализирует фермент тиокиназа.
Молекулы ацетил-КоА не способны проникать через мембрану митохондрий, поэтому их
транспорт внутрь митохондрий осуществляется в комплексе с карнитином.
В митохондриях комплекс ацетил-карнитин распадается и свободный ацетил-КоА
включается в процесс б-окисления, который протекает в 4 стадии.
14. СХЕМА ОКИСЛЕНИЯ ПАЛЬМИТИНОВОЙ КИСЛОТЫ В ТКАНЯХ
15. ЧЕТЫРЕ СТАДИИ
ПЕРВОЕ ОКИСЛЕНИЕ или ДЕГИДРИРОВАНИЕ (1) заключается в отщеплении водорода от аи б-атомов углерода в ацетил-КоА при участии фермента ацетил-КоА-дегидрогеназы,содержащий кофермент ФАД. При этом образуется ненасыщенное соединение:
дегидроацил-КоА и 2 молекулы АТФ.
ГИДРАТАЦИЯ (2) – это реакция присоединения молекулы Н2О по месту разрыва двойной
связи под влиянием фермента еноилгидратазы с образованием гидроксиацил-КоА.
ВТОРОЕ ОКИСЛЕНИЕ (3) сопровождается отщеплением двух атомов водорода от
углеродного атома в б-положении (отсюда название процесса – б-окисление) с участием
НАД-содержащей дегидрогеназы. Образуется кетоацил-КоА и 3 молекулы АТФ.
ТИОЛАЗНАЯ РЕАКЦИЯ (4) приводит к отщеплению ацетил-КоА от кето-ацил-КоА при
взаимодействии его с еще одной молекулой кофермента А. В результате реакции
образуется ацил-КоА и ацетил-КоА. Данный процесс катализируется ферментом тиолазой.
В ходе одного цикла окисления молекула жирной кислоты укорачивается на 2 углеродных
атома. Этапы цикла повторяются до тех пор, пока вся молекула жирной кислоты
постепенно не распадается на отдельные молекулы ацетил-КоА, которые могут
окисляться до СО2 и Н2О в цикле лимонной кислоты, либо использоваться в
биосинтетических процессах.
ЭНЕРГЕТИЧЕСКЙ ЭФФЕКТ б-окисления на примере окисления пальмитиновой кислоты
(С16Н32О2). В процессе распада пальмитиновой кислоты происходит семикратное
повторение рассмотренных выше реакций. В одном цикле преобразований образуется 5
молекул АТФ. В течение семи повторений образуется 5 х 7 = 35АТФ.
Пальмитиновая кислота распадается на 8 молекул ацетил-КоА, которые в цикле лимонной
кислоты дают: 8 х 12 = 96 АТФ. Одна молекула АТФ используется при активации жирной
кислоты. Следовательно, энергетический выход составляет: 35 АТФ + 96 АТФ – 1 АТФ = 130
АТФ.
Т.О. энергетический выход при окислении жирной кислоты в 3 раза больше, чем при
окислении глюкозы (38 АТФ).
Основную роль в окислении жирных кислот играет печень.
16. ПОСЛЕДОВАТЕЛЬНОСТЬ РЕАКЦИЙ ПРИ б-окислении жирных кислот
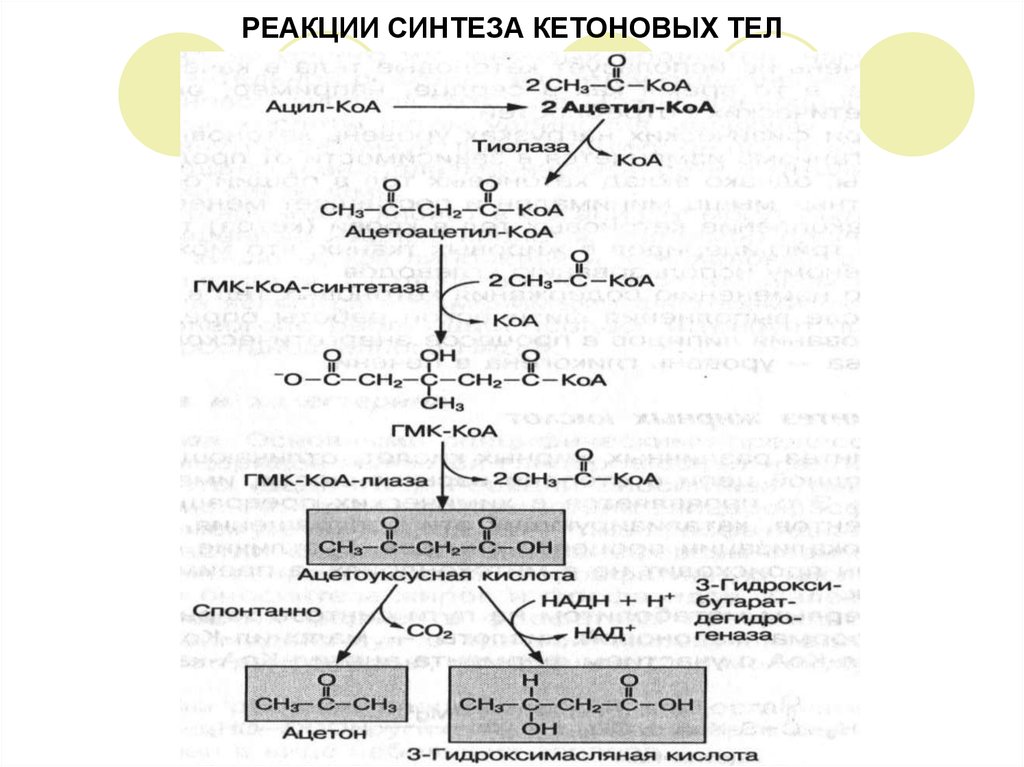
17. СИНТЕЗ КЕТОНОВЫХ ТЕЛ В ПЕЧЕНИ
Молекулы, образовавшиеся при окислении жирных кислот, а также углеводов иаминокислот, подвергаются дальнейшему окислению в цикле лимонной
кислоты либо, при их избытке, используются для образования кетоновых
(ацетоновых) тел в печени.
К кетоновым телам относят:
- ацетоуксусную кислоту (СН3СОСН2СООН)
- б-гидромасляную кислоту (СН3СНОНСН2СООН)
- ацетон (СН3СОСН3).
ОБРАЗОВАНИЕ КЕТОНОВЫХ ТЕЛ
Две молекулы ацетил-КоА взаимодействуют между собой, в результате
образуется ацетоацетил-КоА
Далее ацетоацетил-КоА может взаимодействовать с третьей молекулой ацетилКоА с образованием промежуточного соединения 3-гидрокси-3-метилглутарилКоА (ГМГ)
ГМГ может образовываться при распаде аминокислот, например, лейцина и в
процессе биосинтеза холестерина.
ГМГ-КоА-синтетаза находится в основном в клетках печени, поэтому синтез
кетоновых тел происходит только в печени.
Затем под влиянием фермента ГМГ-КоА-лиазы ГМГ-КоА распадается с
образованием первого кетонового тела – ацетоуксусной кислоты, которая
может превращаться в 3-гидроксимасляную кислоту или спонтанно
декарбоксилироваться, превращаясь в ацетон.
18. РЕАКЦИИ СИНТЕЗА КЕТОНОВЫХ ТЕЛ
19. КЕТОНОВЫЕ ТЕЛА – ПОКАЗАТЕЛЬ ИНТЕНСИВНОСТИ ОКИСЛЕНИЯ ЖИРОВ
В крови здорового человека концентрация кетоновых телневелика.
Увеличивается концентрация в случае, когда скорость
образования кетоновых тел превышает скорость их
утилизации периферическими тканями.
Уровень кетоновых тел в крови при этом может достигать
20 ммоль.л-1.
Такое состояние называется кетонемия.
Сопровождается оно ацидозом – закислением внутренней
среды организма.
При увеличении скорости образования их в 20-30 раз по
сравнению с нормой кетоновые тела могут выводиться с
мочой.
Такое состояние называется кетонурия.
Появление кетоновых тел в моче может служить
диагностическим тестом при различных заболеваниях и в
первую очередь – при сахарном диабете.
20. ИСПОЛЬЗОВАНИЕ КЕТОНОВЫХ ТЕЛ
Образование кетоновых тел в печени – один из многих путейперераспределения энергетических субстратов между
периферическими тканями.
Из печени они переходят в кровь, доставляются в скелетные мышцы,
сердце и другие ткани, где, окисляясь в цикле лимонной кислоты,
используются в качестве источника энергии.
Сама печень не использует кетоновые тела в качестве энергетического
субстрата, в то время как в сердце они обеспечивают до 30%
энергетических потребностей.
При физической нагрузке уровень кетоновых тел во внутренней среде
организма изменяется в зависимости от продолжительности
мышечной работы, однако вклад кетоновых тел в общий
окислительный метаболизм скелетных мышц минимален и составляет
менее 2%.
Накопление кетоновых тел в крови (кетоз) тормозит процесс
расщепления триглициридов в жировых тканях, что может приводить к
более интенсивному использованию углеводов.
По изменению содержания кетоновых тел в крови и моче у спортсмена
после выполнения физической работы определяют интенсивность
использования липидов в процессе энергетического обмена, а по
спектру их состава – уровень гликогена в печени.
21. БИОСИНТЕЗ ЖИРНЫХ КИСЛОТ
Биосинтез различных жирных кислот, отличающихся по длине и структуре углеродной цепии степени насыщенности, имеет существенные особенности.
Это проявляется в химических превращениях субстратов, наборе ферментов,
катализирующих эти превращения, а также во внутриклеточной локализации процесса
синтеза.
В отличие от окисления жирных кислот, биосинтез жирных кислот происходит не в
митохондриях, а преимущественно в цитоплазме клеток.
Первым метаболитом на пути синтеза жирных кислот является активная форма малоновой
кислоты – малонил-КоА, которая образуется из ацетил-КоА с участием фермента ацетилКоА-карбоксилазы:
Непременным участником биосинтеза жирных кислот является низкомолекулярный
ацилпереносящий белок (АПБ), с которым связан синтез жирных кислот.
В начале АПБ взаимодействует с ацетил-КоА и малонил-КоА с образованием ацетил-S-АПБ
и малонил-S-АПБ. Затем они реагируют между собой:
Образовавшийся D-б-оксибутирил-S-АПБ превращается в кротонил-S-АПБ + Н2О, который
при участии НАДФН2 превращается в бутирил-S-АПБ.
22. БИОСИНТЕЗ ЖИРНЫХ КИСЛОТ
Бутирил-S-АПБ, содержащий уже четырехуглеродную цепь,продолжает удлиняться до образования одного из конечных
продуктов, например, пальмитила-S-АПБ.
Заключительной реакцией является отщепление АПБ с
освобождением пальмитиновой кислоты, которая может
превращаться в другие насыщенные жирные кислоты путем
удлинения молекулы.
Однако этот процесс имеет иную внутриклеточную локализацию: он
происходит не в цитоплазме, а в митохондриях и
эндоплазматической сети и катализируется другими ферментными
системами.
Из пальмитиновой и стеариновой кислот в организме могут быть
синтезированы и мононенасыщенные жирные кислоты, например
олеиновая.
Такие полиненасыщенные кислоты, как линолевая и линоленовая, в
организме человека не синтезируются. Следовательно, их
источником может быть только пища, то есть они являются
незаменимыми факторами питания.
Синтез жирных кислот – энергопотребляющий процесс и требует
притока энергии в форме АТФ и восстановленного НАДФ.
23. БИОСИНТЕЗ ТРИГЛИЦЕРИДОВ И ХОЛЕСТЕРИНА
Основными специфическими предшественниками биосинтеза триглициридовявляются глицерофосфат и активированные КоА жирные кислоты (ацетил-КоА).
При взаимодействии глицерофосфата с ацил-КоА образуется промежуточный
продукт – лизофосфатидная кислота.
Лизофосфатидная кислота при участии фермента ацилтрансферазы
взаимодействует со второй ацил-КоА и превращается в фосфатидную кислоту –
промежуточный продукт в биосинтезе жиров и фосфатидов.
Далее фосфатидная кислота при участии фермента фосфатазы превращается в
диглицерид, который, взаимодействуя с третьей молекулой ацил-КоА при
участии фермента ацилтрансферазы, превращается в молекулу триглицерида.
Синтезированный таким образом специфический для организма жир
откладывается в жировых депо и других тканях, например в скелетных
мышцах, где он представлен в виде небольших запасов.
БИОСИНТЕЗ ХОЛЕСТЕРИНА
Холестерин в организме человека синтезируется практически во всех органов и
тканях.
Исходным веществом для его синтеза служит активная форма уксусной
кислоты – ацетил-КоА.
Синтез холестерина осуществляется в цитоплазме и в эндоплазматическом
ретикулуме и требует наличия энергии в виде молекулы АТФ и НАДФН.
Содержание холестерина в крови зависит от активности ряда ферментов и
регулируется гормонами – инсулином и глюкагоном.
24. РЕАКЦИИ СИНТЕЗА ТРИГЛИЦЕРИДОВ
25. РЕГУЛЯЦИЯ ОБМЕНА ЛИПИДОВ
Процессы регуляции обмена липидов как составной части общего обмена веществ в организме человекаосуществляется нервной и эндокринной системами.
Симпатическая нервная система тормозит синтез триглицеридов и усиливает распад (липолиз), а
парасимпатическая система активирует синтез и способствует отложению жира.
Процессы мобилизации и отложения жира контролируются эндокринной системой :
Адреналин и норадреналин активируют распад триглицеридов в жировой ткани и увеличивают
содержание свободных жирных кислот в крови.
Поэтому любое длительное возбуждение симпатического отдела нервной системы (длительная мышечная
деятельность, эмоциональное напряжение), приводящее к увеличению секреции адреналина и
норадреналина, сопровождается истощением жирового депо и, как следствие, заметным похудением.
Жиромобилизующим действием обладает соматотропный гормон, вырабатываемый передней долей
гипофиза, а также тиреотропный гормон гипофиза и тироксин – гормон щитовидной железы.
В связи с этим в периоды усиленного роста и при повышенной функции щитовидной железы
(гипертиреозе) наблюдается исхудание, а при недостаточной функции щитовидной железы и гипофиза
развивается ожирение.
Снижение выработки соматотропного гормона гипофиза и половых гормонов приводит к стимуляции
процесса синтеза жира и торможению липолиза, что приводит к ожирению.
Адренокортикотропный гормон гипофиза (АГТГ) и вырабатываемые под его влиянием глюкокортикоиды
(гормоны коры надпочечников), инсулин тормозят распад жира, т.к. способствуют отложению гликогена в
печени и несколько повышают уровень глюкозы в крови.
Процесс отложения жира и его мобилизация из жировых депо с последующим использованием в тканях
осуществляется по принципу саморегуляции. Основой его является уровень глюкозы в крови или
тканевой жидкости.
Повышение концентрации глюкозы в крови уменьшает распад триглицеридов и активирует их синтез. При
снижении концентрации глюкозы в крови синтез триглициридов тормозится, а расщепление их
усиливается, в кровь из жировой ткани поступают свободные жирные кислоты.
Взаимосвязь углеводного и липидного обмена в обеспечении энергетики организма: при избытке одного
из источников энергии (глюкозы) происходит депонирование триглицеридов жировой ткани. При
недостатке углеводов (гипогликемия) или недостаточном их использовании (сахарный диабет)
триглицериды расщепляются и поставляют в кровь энергетический материал – свободные жирные
кислоты.
26. НАРУШЕНИЕ ОБМЕНА ЛИПИДОВ
Нарушения обмена липидов обусловлены различными причинами:- недостаточное качественное и количественное поступление липидов
с пищей приводит к общему нарушению липидного обмена в
организме.
- гиповитаминоз жирорастворимых витаминов (А, D, Е, К).
- снижение потребления с пищей растительного масла – основного
источника ненасыщенных жирных кислот.
- ухудшение переваривания и всасывания жиров, когда в кишечник не
поступает желчь в достаточных количествах.
- выделение желчи может тормозиться при многих заболеваниях
печени (гепатите, циррозе) и желчного пузыря, при закупорке
выводных протоков желчными камнями.
- при недостаточной секреции липолитических ферментов.
- количество липазы значительно уменьшается в кишечнике при
опухолях поджелудочной железы и других заболеваниях.
- всасывание жиров ослабевает при воспалении слизистой оболочки
тонкой кишки, а также при усиленной перистальтике.
- пониженное усвоение жиров приводит к значительному выделению
их из организма.
27. ОЖИРЕНИЕ
Одной из распространенных форм нарушения тканевого обмена жировявляется ожирение.
При ожирении усиливаются процессы синтеза жирных кислот и триглицеридов,
что приводит к их накоплению и отложению в клетках.
Люди с избыточным массой тела живут в среднем на 7 лет меньше, чем люди с
нормальной массой тела.
Люди с избыточным весом в 3-4 раза чаще умирают от болезней ССС, сахарного
диабета.
Причины ожирения:
1. Энергетический дисбаланс, когда количество энергии, поступающей в
организм в виде пищи, значительно больше количества расходуемой энергии.
2. Нарушение липидного обмена, когда процессы синтеза жиров превышают их
распад.
3. Гормональные нарушения.
При ожирении рекомендуется диета с пониженной калорийностью: до 1750-1800
ккал.сут-1 вместо 2500-2700 ккал.сут.-1, рекомендуемых для здоровых людей.
Снижение калорийности достигается в основном за счет уменьшения
количества углеводов до 150 г.сут-1 при норме 450 г.сут-1.
Количество белков, витаминов и минеральных солей остается неизменным.
Одним из средств лечения ожирения в зависимости от состояния здоровья
человека являются физические упражнения, выполняемые под наблюдением
врача.
28. НАРУШЕНИЕ ОБМЕНА ХОЛЕСТЕРИНА
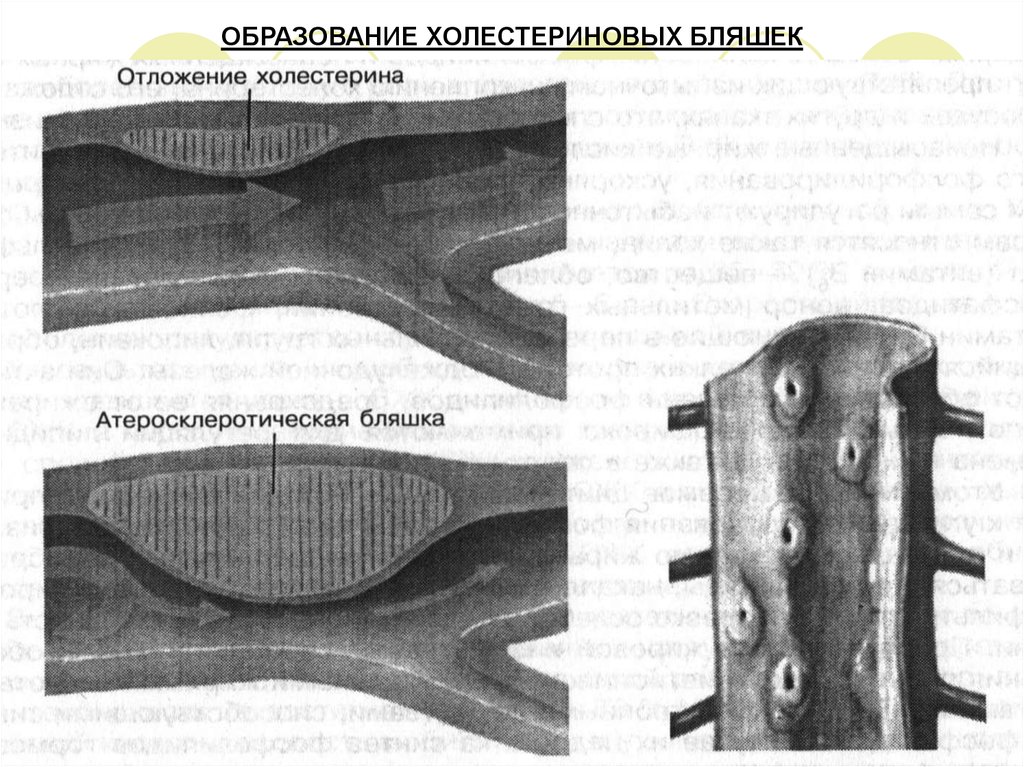
Нарушение обмена холестерина вызывает одно из распространенных заболеваний –атеросклероз, что связано с устойчивым повышением холестерина в крови.
При атеросклерозе в стенках сосудов откладываются липиды – в основном эфиры
холестерина, в меньшем количестве – сфингомиелины.
Отложение холестерина и других липидов, а также их солей в стенке сосудов приводит к ее
перерождению, снижению эластичности и прочности стенок кровеносных сосудов. Могут
образовываться также холестериновые бляшки, способные перекрывать просвет
капилляров.
Все это нарушает процессы кровообращения и обмена веществ между клетками и кровью.
Поэтому данное заболевание связано не только с патологией артерий, но и с нарушением
всего обмена веществ и нервного аппарата, регулирующего кровообращение и питание
стенок кровеносных сосудов.
При атеросклерозе уровень холестерина в крови повышается в 2-5 раз (до 5 г.л-1) по
сравнению с нормой (1,5-2,5 г.л-1). Повышается также уровень б-липопротеидов.
Причина данного явления обусловлена нарушением равновесия между количеством
распавшегося и синтезированного холестерина в организме.
С пищей в организм поступает около 0,2-0,5 г.сут-1 холестерина. Это количество не влияет
на уровень холестерина в организме, поэтому основную роль в возникновении
повышенного уровня холестерина играет эндогенный холестерин, содержание которого в
организме может достигать 0,8-1,5 г.сут-1.
Возникновению атеросклероза способствует избыточное потребление жиров и углеводов, а
также усиленный синтез холестерина из ацетил-КоА.
С возрастом содержание холестерина и его эфиров в крови повышается, что приводит к
атеросклеротическим изменениям кровеносных сосудов у людей пожилого возраста.
Атеросклероз вызывает такие заболевания как инсульт, инфаркт, атрофия конечностей.
Занятия физическими упражнениями активизируют липидный обмен, способствуют выведению
холестерина из организма, задерживают развитие возрастной гиперхолестеринемии и атеросклероза.
29. НАРУШЕНИЕ ОБМЕНА ХОЛЕСТЕРИНА
Жировая дистрофия печени характеризуется накоплением в ней триглицеридов (жиров) иприводит к дегенеративным изменениям клеток печени. В этом случае содержание жира в
печени может достигать 40-50% при норме 5%. Возникает ожирение печени (жировая
инфильтрация), нарушаются ее функции
В печени активно происходит синтез фосфолипидов из нейтральных жиров, фосфорной
кислоты и азотистого основания – холина.
Для образования холина необходимо поступление в организм с пищей достаточного
количества аминокислоты метионина, являющегося донором метильных групп.
При недостатке метильных групп нарушается синтез холина и последующее образование
фосфолипидов, в результате чего в печени накапливается жир.
Для синтеза фосфолипидов необходимы липотропные вещества, к которым относятся
ненасыщенные жирные кислоты, входящие в состав растительных масел.
Растительные масла содержат большое количество фосфолипидов и ненасыщенных
жирных кислот, препятствующих избыточному накоплению холестерина, его отложению в
сосудах и других тканях.
Ненасыщенные жирные кислоты, являясь разобщителями окислительного
фосфорилирования, ускоряют процессы окисления в митохондриях и тем самым
регулируют избыточное отложение жиров.
К липотропным факторам относятся также холин, метионин, инозит, серин,
пиридоксальфосфат (витамин В6) – вещество, облегчающее декарбоксилирование серинфосфатидов, донор метильных групп –метионин, фолиевая кислота и витамин В12,
участвующие в переносе метильных групп, липокаин, образующийся в эпителии мелких
протоков поджелудочной железы. Они активируют образование в печени фосфолипидов,
предохраняя ее от ожирения.
30. ОБРАЗОВАНИЕ ХОЛЕСТЕРИНОВЫХ БЛЯШЕК
31. НАРУШЕНИЕ ХОЛЕСТЕРИНА
УТОМЛЕНИЕ, вызываемое длительной мышечной деятельностью,приводит к угнетению образования фосфатидов в печени.
Мобилизуемые из депо и доставляемые кровью жиры, не успевая
расщепляться и преобразовываться в фосфолипиды, накапливаются в
клетках печени, а при жировой инфильтрации клеток резко ослабляется
функциональная деятельность печени.
Предупреждение жировой инфильтрации достигается путем обогащения
пищи холином, метионином, ненасыщенными жирными кислотами,
витамином В15 – то есть липотропными веществами, способствующими
синтезу фосфатидов.
При недостатке липотропных веществ синтез фосфолипидов тормозится,
а жирные кислоты используются для синтеза только триглицеридов,
избыток которых и приводит к инфильтрации ими клеток печени.
Для улучшения обмена липидов и предупреждения его нарушения
используются аэробные физические нагрузки, которые активируют
утилизацию жиров и предотвращают ожирение организма.
С продуктами питания могут вноситься вещества, улучшающие
биосинтетическую функцию печени, способствующие синтезу
фосфолипидов и препятствующие отложению жира.
32. ОБМЕН ЖИРОВ ПРИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
Использование жиров для энергообеспечения мышечной деятельности зависит от ееинтенсивности, длительности, уровня тренированности спортсмена, а также степени
вовлечения в процессы сокращения при физической работе различных типов мышечных
волокон. Устанавливается следующая закономерность:
1. Жиры используются в энергетике работающих мышц при длительных физических
нагрузках умеренной интенсивности; они подключаются к энергообмену после
существенного снижения уровня глюкозы в крови и запаса гликогена в мышцах.
2. С ростом тренированности на выносливость уменьшается скорость окисления
углеводов и увеличивается скорость окисления жиров.
Основными липидными энергетическими субстратами в метаболизме скелетных мышц
при физических нагрузках на выносливость являются триглицериды (ТГ) мышц, а также
триглицериды, свободные жирные кислоты (СЖК) и кетоновые тела.
Из немышечных жировых источников наиболее значительную роль в энергетике мышц
играют СЖК.
Поступление их в мышцы и другие ткани зависит от скорости мобилизации (липолиза)
жиров в жировых тканях, концентрации СЖК в плазме и скорости их транспорта в мышцы.
Физические нагрузки усиливают липолиз жиров в жировой ткани.
Уже после 30-минутной велоэргометрической нагрузки концентрация продуктов липолиза в
жировых клетках увеличивается на 35-50%, а после 4-часового бега на тредмиле – более
чем в 5-6 раз.
Скорость липолиза в жировых клетках регулируется гормончувствительной липазой.
В результате усиления мобилизации жиров в жировых клетках существенно повышается
уровень СЖК и глицерина в крови. Высокая концентрация СЖК, а также изменение
механизмов транспорта способствуют накоплению СЖК в скелетных мышцах и
активируют ферменты окисления.
33. ОБМЕН ЖИРОВ ПРИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
Проникновение СЖК в МВ скелетных мышц осуществляется путем активноготранспорта с участием переносчиков.
После поступления в мышечные клетки СЖК используется в аэроном окислении
для синтеза триглицеридов.
Вклад жиров в энергетику мышечной деятельности возрастает по мере
увеличения продолжительности мышечных нагрузок малой и умеренной
интенсивности.
Уже с начала выполнения такой работы и до тех пор, пока ее интенсивность не
достигает уровня 60-70% МПК и начала накопления молочной кислоты, скорость
мобилизации и утилизации СЖК повышается.
При высокой интенсивности физических нагрузок скорость использования СЖК
мышцами снижается, а скорость мобилизации ее продолжает оставаться
высокой, в результате чего и концентрация СЖК в плазме остается
повышенной.
Существенный вклад в энергетику мышечной деятельности вносят
внутримышечные ТГ. Они могут обеспечивать около 65% энергии,
образующейся за счет окисления липидов.
Скорость утилизации внутримышечных ТГ во время выполнения физических
упражнений также зависит от интенсивности и продолжительности работы, от
степени вовлечения в сократительную активность различных типов МВ.
Наиболее высокая утилизация внутримышечных ТК происходит в
быстросокращающихся окислительно-гликолитических МВ (тип IIА), средняя
утилизация – в медленносокращающихся окислительных и практически
отсутствует в быстросокращающихся гликолитических МВ (тип IIВ).
34.
35. ОБМЕН ЖИРОВ ПРИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
Внутримышечная утилизация ТГ зависит от уровня тренированности.Установлено, что после 12-недельной тренировки, направленной на развитие выносливости, под
действием 2-х- часовой велоэргометрической работы мощностью около 65 % МПК использование ТГ
увеличивается в 2 раза, в то время как у нетренированных людей такая физическая нагрузка вызывает
усиление использования ТГ мышц только на 20%.
Связано это с тем, что под влиянием тренировки активность ферментов, участвующих в активации,
транспорте и катаболизме жирных кислот, увеличивается. Отмечено двукратное повышение активности
АТФ-зависимой пальмитил-КоА-синтетазы, карнитин-пальмитил-трансферазы и пальмитил-КоАдегидрогеназы скелетных мышц.
При тренировке повышается способность мышц синтезировать триглицериды, что приводит к
повышению их внутримышечных запасов.
Адреналин повышает активность липазы и мобилизацию жиров.
Инсулин подавляет активность липазы и расщепления жиров.
При физических нагрузках концентрация инсулина в крови снижаетс, что приводит к повышению
мобилизации жира.
Несмотря на то, что основными факторами, регулирующими липолиз в жировой ткани, являются
гормональные воздействия, концентрация глюкозы также влияет на липолиз независимо от изменения
содержания в плазме гормонов.
Гипергликемия (10 ммоль.л-1) в одинаковой степени (на 32%) подавляет у здоровых людей скорость
образования как СЖК, так и глицерина. Независимо от гормональных изменений глюкоза регулирует
мобилизацию жиров путем угнетения липолиза.
Подключение жиров к энергообмену взаимосвязано с запасами углеводов в организме.
Жиры становятся основным энергетическим субстратом при истощении запасов гликогена и снижения
уровня глюкозы в крови. Это наблюдается на 30-40-й минуте выполнения физических упражнений
упражнений субмаксимальной аэробной мощности.
Для ускорения подключения жиров к энергообеспечению мышечной детельности используются вещества
– активаторы липолиза: кофеин (в недопинговых количествах),холин, фолиевая кислота, витамин
В12,карнитин, фентоламин, пропранолол. Они ускоряют мобилизацию жиров, улучшают утилизацию
кислорода тканями и сам процесс окисления жирных кислот.






























 Химия
Химия








