Похожие презентации:
Галогенпроизводные углеводородов
1.
Галогенпроизводные углеводородовСsp3-Hal
Сsp2-Hal
Галогеналканы
Сsp-Hal
СnH2n+1Х, где X - F, Cl, Br, I.
Номенклатура
CH3
CH C Br
CH3 C
1-бром-3-метил-1-бутин
OH
CH
CH3 C
C
H2C Cl
5-хлор-3-петин-2-ол
Br
CH3
CH
O
C
C
F
CH
C
C
3
CH CH
CH3
C C OH
CH2
CH3
2,3-диметил-1-фтор-1-гексен-4-ин
4-бром-3-гексиновая кислота
1
2.
Методы синтеза галогеналкановГалогенирование алканов (SR)
Хлорирование и бромирование метана.
h , 250-400 OC
CH4 + Cl2
CH3Cl + HCl
Присоединение галогеноводородов к алкенам (AdE)
CH3
CH3
эфир
C CH2 + HCl
Cl C CH3 (94%)
CH3
CH3
CH3 + HBr
1-метил-1-циклогексен
CH3COOH
CH3
R2O2 CH3
C CH2 + HCl
CH CH2 Cl
CH3
CH3
CH3
(91%)
Br
1-бром-1-метилциклогексан
2
3.
Гидрогалогенирование алкинов (HCl, HBr)HC CH +
HBr
HC CH2
Br
HBr
Br
HC CH3
Br
Правило Марковникова
Замещение гидроксильной группы спиртов на галоген
R OH
+ HCl
R OH
+ KBr + H2SO4
R Cl
OH + PCl5
R
3R
OH + PCl3
R OH
+
+
R Br + KHSO4+ H2O
Cl + HCl + POCl3
R
3R
SOCl2
H2O
Cl + P(OH)3
R Cl
+ SO2 + HCl
Иодирование. Фторирование. Реакция SN
R Cl
+ NaX
X=I,F
SN2
R X
+
NaCl
3
4.
Реакция карбонилсодержащих соединений с галогенидами фосфораO
C
R'
ALK
R'=H, Alk
O
C
R'
ALK
R'=H, Alk
+
PX5
t
O
X=Cl, Br
+
SF4
t
O
X
C
R'
ALK
X
+
POX3
F
C
R'
ALK
F
+
SOF2
Физические свойства. Строение молекулы.
С Х
Реакции нуклеофильного замещения - SN
Nu
Нуклеофил
X
R
Субстрат
R
Nu +
X
Продукт
Уходящая
группа
4
5.
Нуклеофил - частица, имеющая пару электронов, которую онаможет отдать для образования новой связи атому, несущему
целый или частичный положительный заряд.
Нуклеофилы-анионы
Нуклеофилы-нейтральные молекулы
Реакции элиминирования Е
' + +
C C
H
..
B
X
C C + X
BH +
5
6.
Нуклеофильное замещение R-Hal + Nu → R-Nu + HalНуклеофил NuПродукт реакции R-Nu
НО– или Н2О
Спирт ROH
R1O или R1OH
Простой эфир ROR1
R
1
С
O
O
Сложный эфир
R
1
С
OR
O
N C
Нитрил карбоновой кислоты R-C N
NO2
Нитросоединение R- NO2 и/или RONO
NH2–
Амин R-NH2
NH3
Соль первичного амина RNH3+X
R1NH2, R1R2NH
Соль вторичного или третичного
амина
+
RR1NH2 X , RR1R2NH+ X
R1R2R3N
Четвертичная аммониевая соль (ЧАС)
RR1R2R3N+ X
R1C C
Алкины R1C C-R
R1C
R1C-R (реакция Вюрца)
J
Иодиды R-J
SH , R1–S , S–S
Тиолы RSH, сульфиды R1SR,
дисульфиды RSSR
6
7.
Реакции нуклеофильного замещения в галогеналканах7
8.
89.
Бимолекулярное нуклеофильное замещение (SN2)HO + CH3 Br
этанол
водный раствор
Скорость реакции.
CH3OH + Br
v = k [R-Hal]·[Nu]
Концентрация нуклеофильного реагента, сила нуклеофила
Растворитель.
а) достаточно хорошая растворимость реагентов,
б) лучшая сольватация переходного состояния по сравнению с
исходными соединениями,
в) предотвращение побочных реакций.
Термин «бимолекулярное замещение» означает, что в стадии,
определяющей скорость реакции, участвуют две частицы.
9
10.
Механизм реакцииH
H
HO
Br
H
2
Br
1
HO
H
H
а
H
H
HO
H
H
б
Br
1 + 2
= -1
в
10
11.
Епот.H
б
HO
Br
H
H
а
HO + CH3 Br
в
CH3OH + Br
Координата реакции
Диаграмма изменения потенциальной энергии в реакции
бимолекулярного нуклеофильного замещения, SN2 - процесс
согласованный одностадийный:
а - энергия исходных веществ,
б - энергия переходного состояния, в - энергия продуктов реакции
11
12.
Нуклеофил – нейтральная молекула..NH + H C
H
+
H3N
+
3
3
Br
C
H
АК H
Eп
+
Nu
R
Br
+
H3N
CH3
Br
X
менее поля рный растворитель
м.п.
Еа
более поля рный растворитель
б.п.
Влияние полярности растворителя
Еа
Nu + R X
Координата реакции
на скорость SN2:
повышение полярности растворителя
стабилизирует АК в большей степени,
чем исходное соединение, энергия
активации уменьшается, скорость
реакции увеличивается.
12
13.
Нуклеофил - анионH
I
I + H3C Br
Eп
C
H
АК
Nu
R
Br
I
CH3 + Br
H
X
менее поля рный
м.п.
Еа
б.п.
Е а > Е м.п.
а
более поля рный
б.п.
Еа
Влияние полярности растворителя на
Nu + R X
Координата реакции
скорость SN2:
повышение полярности растворителя
стабилизирует исходную систему в
большей степени, чем АК, энергия
активации увеличивается, скорость
реакции уменьшается.
13
14.
Влияние растворителя на скорость реакции SN2Реагенты
Активированный
комплекс
Изменение заряда
при активации
Изменение скорости
реакции при увеличении
полярности
растволрителя
Nu + RZ
Nuδ+ …R…Zδ-
Разделение разноименных
увеличение
Nu- + RZ
Nuδ-…R…Zδ-
Распределение заряда
уменьшение
Nu + RZ+
Nuδ+…R…Zδ+
Распределение заряда
уменьшение
Nu- + RZ+
Nu…R…Z
Нейтрализация заряда
уменьшение
зарядов
14
15.
Апротонные биполярные растворители: растворители с высокойдиэлектрической проницаемостью, но не способные к образованию
водородных связей
CH3
CH3
O
N C
CH3
H
O
S
CH3
CH3
C
CH3
=25
Ацетон
=38
Диметилформамид
(ДМФА)
=45
Диметилсульфоксид
(ДМСО)
O
Сила нуклеофила.
HO
RO
R1
R2
>
> HO >
..NH
HS
H 2O ,
>R
O
..NH
2
>
>
H 2S ,
O
>H C
O
..NH
2
>
>
H 3N
Анионы более сильные
нуклеофилы, чем соответствующие
им нейтральные молекулы
O
C
3
H 2N
> HC >
..NHO
2
R C
O N O
Чем больше делокализован заря д,
тем слабее нуклеофил
O
15
16.
H3C > H2N > HO > FЗаря д я дра больше-нуклеофил слабее
В апротонных растворителях (ДМФА, ДМСО) реакционная способность нуклеофилов
с атомами, находящимися в одной группе, зависит от положения элемента в этой группе:
чем больше электроотрицательность атакующего атома, тем более реакционноспособен
нуклеофил.
J
<
Br
<
Cl ;
HS
<
HO
Однако в протонных растворителях этот ряд инвертируется: нуклеофильность аниона
тем выше, чем больше размер иона.
J
>
Br
>
Cl ;
HS
>
HO
Уходящие группы (нуклеофуги).
Сильные основания являются обычно «плохими» уходящими группами, слабые основания –
«хорошими» уходящими группами.
Наилучшими уходящими группами являются анионы - сопряженные основания сильных кислот, так
как они являются очень слабыми основаниями (отрицательный заряд распределен).
I
Br
Cl
F
увеличение основности
уменьшение способности отрыва аниона от субстрата
16
17.
OCH 3 O
OCH
3
O
O
O
Быстро
O
CH 3 C
S
CH 3 C
O CH
+
3
O
CH 3 C
Медленно
O CH
S
OCH
3
O
Очень хорошая
уходящая
группа
O
CH 3 Cl
O
+
Cl
3
Cтереохимия.
CH3
HO
C Br
H
H13C6
R-2-бромоктан
CH3
C
HO
H
CH3
Br
C6H13
HO C H
Br
C6H13
S-2-октанол
17
18.
Реакционная способность.H3C X > RCH2 X > R1R2CH X > R1R2R3C X
R1
H
C
Nu
X
C
Nu
X
H
R3
H
R2
Переходное состоя ние
легко достижимо
I > Br > Cl > F
Длина связи, нм
Переходное состоя ние
трудно достижимо или
недостижимо
Прочность связи, кДж/моль
F
0,1381
435
Cl
0,1767
293
Br
0,1940
238
I
0,2140
180
18
19.
1920.
Мономолекулярное нуклеофильное замещение (SN1)CH 3
CH 3
CH 3 COOH
CH 3 C
Br + H 2 O
OH + HBr
CH 3 C
CH
CH
3
3
Механизм реакции
Медленная стадия: образование карбокатиона.
H3C
CH3
+
C
Br
H3C
CH3
+
C
Br
CH3
CH3
R X
+
+ Ag
......
+
R X Ag
H3C C +
+
Br
CH3
+ < + , <
Переходное состоя ние
(АК)
Электрофильный катализ.
......
CH3
Третичный
карбокатион
+
R + AgX
20
21.
Быстрая стадия: атака нуклеофила.CH3
H3C C +
..OH
Быстро
2
CH3
+
CH3 C OH2
CH3
CH3
CH3
CH3
+
OH + H
CH3
+
(CH3)3C + Br
H2O
Еп
(2)
Еа
(1)
Еа
(CH3)3CBr
1 стадия
медленная
График изменения потенциальной
энергии в ходе мономолекулярного
нуклеофильного замещения.
SN1-двухстадийный процесс
+
(CH3)3COH2
2 стадия
быстрая
Координата реакции
21
22.
Скорость реакции. v= k[R-Hal]Концентрация нуклеофильного реагента.
Перегруппировка – признак механизма SN1.
CH3
C2H5OH, H2O
CH CH CH3
CH3
Br
CH3
CH3
CH CH CH3 + CH3 C CH2 CH3
CH3 OH
3-Метил-2-бутанол
OH
2-Метил-2-бутанол
Механизм перегруппировки.
H2O,C2 H5OH
H3C CH CH CH3
CH3 Br
..H
H3C C
+
CH CH3
CH3
вторичный
карбокатион
медленно
CH3
перегруппировка
1,2-сдвиг гидрид-иона Н
H
+
H3C C CH CH3
+
H2O H
H
+
H3C C CH CH3
+
CH3
+
H3C CH CH CH3 + Br
H2O
H3C C CH CH3
CH3
CH3
третичный
карбокатион
+
H HO H
H3C C CH CH3
CH3
22
23.
Растворитель.H
O
H
= 80
HC
H
O
C 2H 5
O
O
H
= 56
CH 3 C
= 25
H
O
O
= 6
ПС
' +
C
Еп
+
C X
'
X
менее поля рный
растворитель
м.п.
Еа
более поля рный
б.п. растворитель
Еа
м.п.
б.п.
Еа > Еа
ИС
Влияние полярности
растворителя на скорость реакции
мономолекулярного
нуклеофильного замещения
ПC более полярное ΄Ө> Ө
и ΄ > .
Более полярный растворитель
сильнее сольватирует ПС, чем ИС.
Координата реакции
23
24.
+O H
+
+
H
H
H+
O
Cl
+
H
O
+
H
+
+
H H
+
O
H
O
+
H
R
O
H H
+
+
+
H
+
H
O
+ O
R
+ O
H +
H
+
H
+
H
+
O H
+
+
H
H
+
+
H
O
Cl
O H
+
H
Стереохимия.
CH 3
CH 3
H
Br
C 2H 5
(S)-2-Бромбутан
Молекула хиральна
Br
+
H
C 2H 5
Карбокатион плоский
Ахирален
24
25.
Частичная рацемизацияH2O
CH3
Br
+
H
C2H5
CH3
HO
CH3
H
C2H5
(S)-2-Бутанол
H+
H
C2H5
OH
(R)-2-Бутанол
Эквимолекулярная смесь - рацемат
оптически недеятельна
25
26.
+R
+
R X
RX
С
ТИП
С + Nu
СИ + Nu
SN2
SN1
+
R + X
X
СИ
СРИП
обращение
конфигурации
С
- неионизированная молекула субстрата
ТИП - теcная ионная пара
СРИП - сольватно-разделенная ионная пара
СИ
- сольватированнные ионы
ТИП + Nu
SN1 + SN2
неполное обращение
конфигурации или
неполная рацемизация
СРИП + Nu
рацемизация
Реакционная способность.
R3
CH3
+ <
R1
+
CH2 < R1
CH
+
< R
1
R2
C
+
,
C
C
C
+
,
C
+
R2
Устойчивость карбокатионов увеличивается
R3
CH3
X < R1
CH2
X < R1
CH
R2
X < R1
C
X ,
C
C
C X ,
C
X
R2
Реакционная способность увеличивается
26
27.
Нуклеофильность и основностьНуклеофильность
Кинетически контролируемая реакция
электронной пары донора с электрофильным
атомом (С), с образованием новой
ковалентной связи C-Nu
Основность
Равновесная (термодинамически контролируемая)
реакция электронной пары донора с протоном,
с образованием новой связи H-X
27
28.
Сравнение реакций SN1 и SN2Скорость S N 1 -реакций возрастает
CH 3 X
R 1 CH 2 X
R 1 CH X
R2
R3
R1 C X
R2
Скорость S N 2 -реакций возрастает
Влияние условий реакции на соотношение двух механизмов.
Механизм
Растворитель
Сила
нуклеофила
Концентрация
нуклеофила
SN1
Протонный
Более слабый
Мéньшая
SN2
Апротонный
Более сильный
Бóльшая
28
29.
Амбидентные ионыАмбидентные нуклеофилы имееют не менее двух атомов, которые могут
отдавать пару электронов субстрату для образования ковалентной связи.
..O ..N ..O.
..
..
......O ..N ....O
нитрит-ион
....N ..C
..N ..C
цианид-ион
..O..
..
..
O
феноксид-ион
C
C
......S
..O..
..
..C
еноля т-ион
..
C N
..S
..
C
....
C N
тиоцианат-ион
..O..
На атомах с большей
электроотрицательностью сосредоточена
большая электронная плотность.
Атомы с меньшей
электроотрицательностью обладают
большей нуклеофильной силой,
т.е. способностью предоставлять
свою пару электронов для образования
новой ковалентной связи.
В соответствии с правилом Корнблюма
амбидентные ионы в реакциях
SN2-типа атакуют атомом с
наибольшей нуклеофильностью,
а в реакциях SN1 – атомом с
наибольшей электронной плотностью.
29
30.
C....
..
O R
O
C
C
..
..O
C
ДМФА
О-алкилирование
C
Виниловый эфир
R Х
..
C
C
Этанол
С-алкилирование
O
C
R
Карбонильное соединение
Влияние различных факторов на тип атаки амбидентных ионов.
Влияние растворителя.
....
..
O
CH2 CH CH2 Br
..
..
..
O
О-Алкилирование
ДМЭЭ H3C O CH2 CH2 O CH3
O CH2 CH CH2 + Br
100%
30
31.
......
CH2 CH CH2 Br
....
..
O
OCH2CH CH2
23 %
Продукт
О-алкилирования
O
фенол
OH
CH2=CH CH2
77 %
Продукт
С-алкилирования
Природа алкильного радикала.
R
+
CH2
Br
+
.....O ..N ....O
SN2
R
CH2
+
N
O
O
+ Br
Атака атомом
Нитроалкан
с более высокой
(основной продукт)
нуклеофильностью
R3
R1 C +
+
.....O ..N ....O
SN1
Атака атомом
с более высокой электронной плотностью
Br R2
R3
R1 C
O
N
O
R2
Эфир азотистой кислоты
(основной продукт)
31
32.
..C.
. ..
N
.. C
..
N
SN1
+
C
Изонитрил
C
N
C
C
C
N Нитрил
X
SN2
Участие соседних групп. Анхимерное содействие
Гидролиз горчичного газа протекает быстрее, чем гидролиз первичных алкилхлоридов
..
Cl CH2 CH2 S
CH2 Cl
CH2
горчичный газ (ОВ)
-Cl
Cl CH2 CH2 S
CH2
+
..
H 2O
Cl CH2 CH2 S CH2 CH2 OH
CH2
Гидролиз при низких концентрациях OH- или в воде в присутствии Ag+ (условия SN2)
H3C
Br
H
медленно
O
C
- Br
H3C H2C
H3C H2C
..
N
CH2
C
HO
H
O
(R)-2-бромпропаноат
CH3
CH2
CH Cl
H3C
O
быстро
O
H3C
HO
H
C
O
O
(R)-2-гидроксипропаноат
Перегруппировка
H3C H2C
- Cl
N,N-диэтил-2-хлор-1-бутанамин
H3C H2C
N
+
CH3
CH CH2
CH2
OH
H3C H2C
H3C H2C
..
CH3
N CH CH2
CH2 OH
2-диэтиламино-1-бутанол
32
33.
Реакции отщепления (элиминирование, Е)-Элиминирование
X
С
..
С
Z
карбен
+ X
+ Z
-Элиминирование
X
Z
С
С
С
С
+X + Z
γ-Элимириование – циклизация.
X
C
Z
C H2
C
CH2
C
C
+ X + Z
33
34.
-ЭлиминированиеC H2
C H
H
X
CH3
KOH (твердый)
CH2=CH-CH3 + H2O + KX
или КОН в безводном
C2H5OH, T
Бимолекулярное отщепление Е2
CH2
CH2
H
Br
KOH, C2H5OH, T
H2C
CH2 + KBr + H2O
34
35.
Механизм реакции Е2HO
HO
HO
H
H
C
H
H
C
HH
H
H
H
H
H
Br
H
H
H
H
Br
Br
а
H
б
в
Механизм реакции бимолекулярного элиминирования:
а – антикопланарное расположение связей С —Br и С —H, б – переходное
состояние, в – конечные продукты
Е2-одностадийный синхронный процесс
Наблюдается значительный изотопный эффект
35
36.
Антикопланарное расположениесвязей С —Br и С —H.
Атака гидроксид-аниона
Переходное состояние
36
37.
Эффективность оснований в реакции Е2 убывает в ряду:ӨNH
2
>
ӨOC H
2 5
> ӨOH > ӨOCOCH3
В галогеналкане R-X cкорость отщепления убывает в ряду: I ˉ > Br ˉ > Cl ˉ > F ˉ
Энергетическая диаграмма реакции Е2
OH
H
H
H
C
C
H
H
Br
б
Еп
в HO
а
H
H
HO
H
H
H
C
C
H
H
H
H
H
Br
Br
Координата реакции
37
38.
3839.
Е2- стереоспецифичная, региоспецифическая реакцияH
H3C
Hа
HC э
H3C
Cl
э
Hа
а
CH3
Hэ
H
а
ментилхлорид
более устойчивая
конформация
H3C H CH3
C
а
H
H
а
э
H
э
Cl
а
H
H3C
HC
H э -HCl
H3C
э а
CH3
CH3
3-изо-пропил-6-метилциклогексен
Реакция осуществляется
как анти-отщепление
аксиальных атомов Ha и Cla
39
40.
Скорость реакцииV(E2) = k΄ R-Br OНӨ
V (SN2)= k R-Br OНӨ
Правило Зайцева
Основным продуктом реакции отщепления от галогеналканов с
двумя не эквивалентными С -атомами является наиболее
устойчивый (наиболее алкилированный) алкен.
40
41.
СH 3CH 3
C
C
H
цис-2-Бутен
CH 2
CH
CH
H
Br
H
CH 3
KOH , C 2H 5OH , T
H
(массовая доля 11 %)
H
CH 3
C C
СH 3
H
транс -2-Бутен
(массовая доля 70 %)
CH 2
CH CH 2
1-Бутен
CH 3
(массовая доля 19 %)
Cl
(~100%)
+
E
цис-2-бутен : транс-2-бутен = 1: 6
HO
HO
H
H
CH3
H
H
H
CH3
CH3
H
СH3
Cl
ПС - более устойчивое
Cl
ПС - менее устойчивое
Две метильные группы
сближается в пространстве
41
42.
4243.
транс-2-бутенцис-2-бутен
43
44.
Реакции элимирования по ГофмануСостав продуктов Е2-реакции 2-замещенных пентанов (под
действием C2H5OӨK )
Массовая доля, %
R-G
CH3 CH CH2 CH2 CH3
CH2 CHCH2CH2CH3
CH3CH CHCH2CH3
31
69
48
52
98
2
Br
CH3 CH CH2 CH2 CH3
OSO2R
CH3 CH CH2 CH2 CH3
+ N(CH )
3 3
44
45.
Состав продуктов реакции трет-пентилбромида с алкоголятами калияROӨK (70-75О С)
Cl
R O K
H3C C CH
+
CH3
CH3
H3C C CH2 CH3
CH3
H2C C CH2 CH3
CH3
Основание
R-OӨ
Массовая доля,%
H3C C CH
CH3
C2H5 – OӨ
CH3 H2C C CH2 CH3
CH3
70,0
30,0
(CH3 )3C – OӨ
27,5
72,5
(C2H5 )3 С– OӨ
11,5
88,5
45
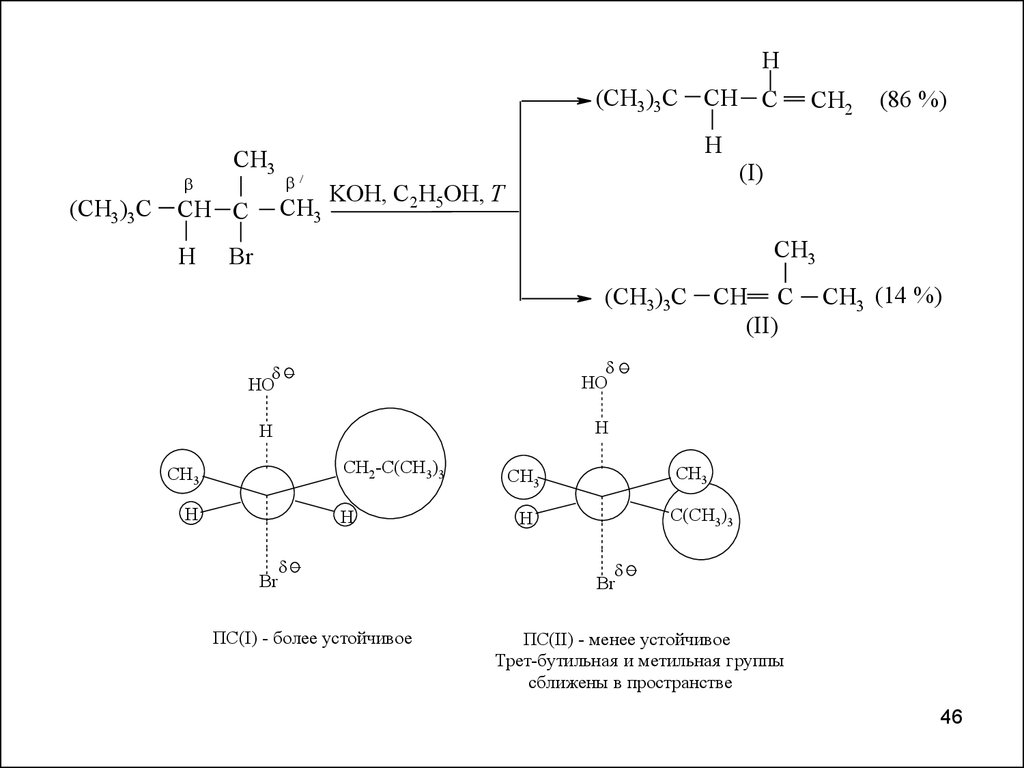
46.
H(CH3)3С
(CH3)3С
CH3
H
CH2
(86 %)
H
CH3
СH C
СH C
(I)
KOH, C2H5OH, T
CH3
Br
(CH3)3С
CH3 (14 %)
HO
HO
H
H
CH2-C(CH3)3
CH3
H
H
Br
СH C
(II)
ПС(I) - более устойчивое
CH3
CH3
C(CH3)3
H
Br
ПС(II) - менее устойчивое
Трет-бутильная и метильная группы
сближены в пространстве
46
47.
Реакционная способностьR CH 2
X
R3
< R 1 CH R 2 < R 1 C
Первичный
Этот ряд объясняется возрастающим числом
алкильных групп при двойной связи в
образующемся алкене.
R2
X
Третичный
X
Вторичный
Мономолекулярное отщепление Е1
Механизм.
CH 3
CH 3
C
Br
CH 3
[ CH 3
CH 3
C
Br
Медленно
]
Активированный комплекс
<
CH 3
C
+
Br
CH 3
CH 3
CH 3
,
<
Третичный
карбокатион
47
48.
БыстроCH
3
C
CH
CH
3
2
H
CH
OH
Реакционная способность
X
Первичный
C
CH
Уравнение скорости реакции.
R CH 2
3
2
+H
OH
3
v(E1) = k R-Br
R3
< R 1 CH R 2 < R 1 C
X
Вторичный
CH
R2
X
Третичный
I > Br > Cl > F
Длина связи, нм
Прочность связи, кДж/моль
F
0,1381
435
Cl
0,1767
293
Br
0,1940
238
I
0,2140
180
48
49.
Перегруппировки+
Ha
H OH2
H OH H+, быстро
медленно
+
H3C C C C H
H3C C C CH3
H3C C C CH3
H2 b
H3C H
H3C H
H3C H
вторичный карбокатион
1,2-H- сдвиг
-Hb
Ha
-Ha
H
H
H3C C HC CH2
c + d
-Hd
H2C C C CH3
H3C C CH CH3
CH3
H3C H
третичный карбокатион
CH3
-Hc
H2C C CH2 CH3
CH3
49
50.
Е1- нестереоспецифичная, нерегиоспецифическая реакцияМедленная стадия: отрыв протона от карбокатиона
возможен из двух положений
Преимущественно образуются наиболее алкилированные при двойной связи алкены.
H3C H CH3
C
Hэ
Hа
H
э
CH3
а
Hэ
H Cl а
э
ментилхлорид
CH3
H3C
CH
(32%)
CH3
3-изо-пропил-6-метилциклогексен
-HCl
H3C
CH3
CH
(68%)
CH3
1-изо-пропил-4-метилциклогексен
50
51.
Сравнение реакций нуклеофильного замещения и элиминированияX
С C
С C
H
H
E2
E1
SN 2
S 1
N
нуклеофил
Z основание
нуклеофил
Z основание
Сильное основание (ΘNH2, ΘOCH3) преобладает элиминирование (Е2).
Активный нуклеофил (IΘ, CH3C(O)OΘ) преобладает замещение (SN2).
Доля элиминирования возрастает
R3
R
CH 2
X , R1
CH
R2 ,
R1
X
C
R2
X
Доля замещения возрастает
51
52.
Повышение температуры – ускорение реакции отщепления.Более полярный растворитель ускоряет SN2.
HO ------H
E2
H
HO
спирт. р-р
щелочи
H
C ------ C ------ Cl
СH3
H
ПС(Е2)-заря д распределен
в большей степени
CH3-CH-CH2-Cl
H
SN2
водный р-р
щелочи
-----C
Cl
HO -----H
C2H5
ПС(SN2)-заря д распределен
в меньшей степени
52
53.
Замещение при С ускоряет реакцию элиминирования, т.к. образуется болееУстойчивый (более алкилированный) алкен.
CH3
C C Br
H
53





















































 Химия
Химия








