Похожие презентации:
Тепломассообмен. Теплообмен при кипении. (Лекция 12)
1.
Белорусский национальный технический университетКафедра ЮНЕСКО “Энергосбережение и
возобновляемые источники энергии”
ТЕПЛОМАССООБМЕН
Лекция 12.
Теплообмен при кипении.
2. ТМО Лекция 12
Кипение и конденсация,Плавление и затвердевание (замерзание),
Сублимация и десублимация – процессы фазового
перехода из одного агрегатного состояния (фазы) в
другое.
Правило фаз Гиббса:
=n–m+2
– число степеней свободы –
количество независимых параметров состояния (р, v, T)
необходимое для полного описания системы ,
n – число компонентов,
m – число фаз
Энергосбережение и возобновляемые источники энергии
Г.И.Пальчёнок
3.
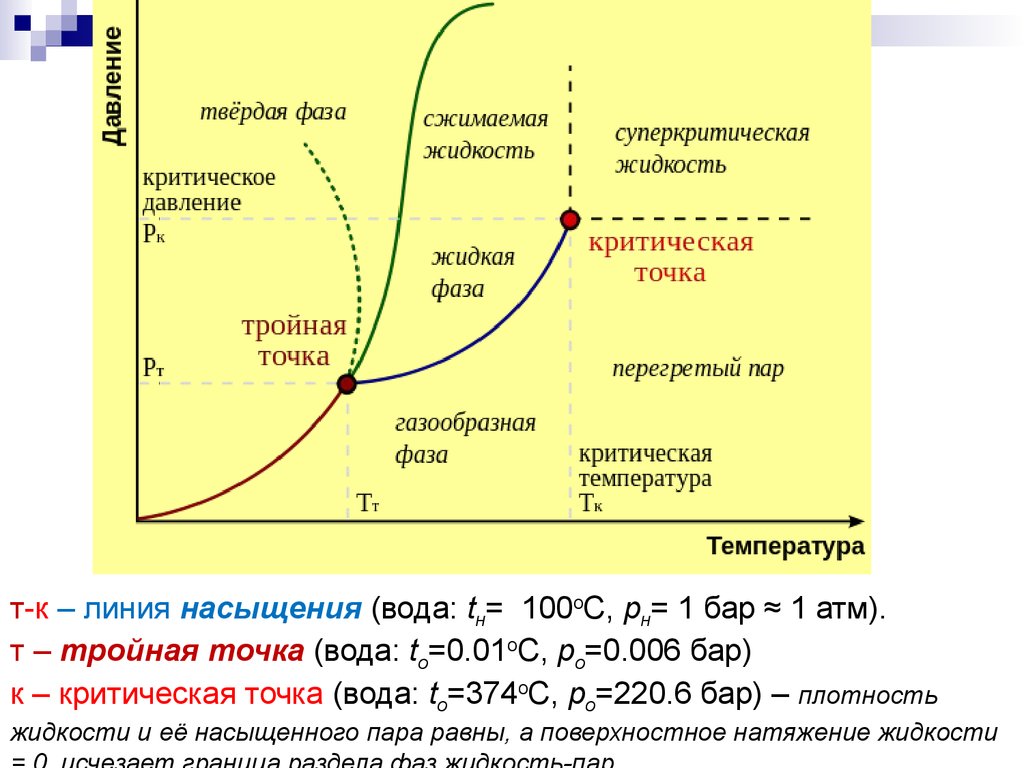
т-к – линия насыщения (вода: tн= 100oC, pн= 1 бар ≈ 1 атм).т – тройная точка (вода: to=0.01oC, po=0.006 бар)
к – критическая точка (вода: to=374oC, po=220.6 бар) – плотность
жидкости и её насыщенного пара равны, а поверхностное натяжение жидкости
4. ТП Лекция 13
Процессыкипения и конденсации
ТП
Лекция 13 воды в ТS диаграмме
5.
р,h – диаграмма хладагента R22 (Хлордифторметан, CHClF2)tкр= 96.00 °C, pкр= 49.774 бар, vкр= 0.00191 м3/кг
6. Тепломассообмен Лекция 13
СОСТОЯНИЕ НАСЫЩЕНИЯСостояние равновесия жидкой и газообразной фаз (m =
2 ) одного компонента, например, воды (n = 1), полностью
характеризуемое одним параметром состояния (одной
степенью свободы, = n – m + 2 = 1 ) рн или Тн (рs или
Тs). В р,Т –диаграмме представлено "линией
насыщения" (при любом рн – одна Тн)
Уравнение Клапейрона – Клаузиуса
устанавливает однозначную зависимость температуры от
r
давления на линии насыщения: æ dp ö
ç
÷ =
è dT ø s T (u ¢¢ - u ¢)
r = ( h¢¢ - h¢ ) – (скрытая) теплота фазового перехода
(кипения или конденсации), u ¢, h¢ ; u ¢¢, h¢¢ – удельные
объёмы и энтальпии воды и пара на линии насыщения,
м3/кг, Дж/кг соответственно;
7.
Лекция 14При ТП
кипении вещество переходит
из жидкой фазы
в газообразную при подводе к системе скрытой
теплоты парообразования, которая затрачивается
на преодоление сил межмолекулярного
взаимодействия и работу расширения ( u ¢¢ >>> u ¢ ) .
При конденсации пара (переходе в жидкое
состояние) при тех же условиях выделяется точно
такое же количество теплоты – скрытая теплота
конденсации, которую нужно отводить от системы.
Аналогично определяются фазовые переходы и
скрытые теплόты плавления/затвердевания
(твердое-жидкость) и сублимации/десублимации
(твердое – газ).
8. Тепломассообмен Лекция 3
ПРОЦЕСС КИПЕНИЯКипение – процесс образования пара (в виде
пузырьков или пленки) в жидкости или на
поверхности, перегретых сверх температуры
насыщения при данном давлении.
Величина необходимого перегрева ΔТ = (Т – Тs)
уменьшается при наличии центров парообразования
в жидкости (например, взвешенные частицы) и на
поверхности (царапины, неоднородности и т.п.).
Если вся жидкость оказывается значительно
перегретой (например, при резком сбросе давления,
т.е. снижении Тs), то паровые пузыри возникаютво
всем объеме жидкости и она вскипает в результате
объёмного кипения. (Этот механизм кипения мы
далее не рассматриваем).
9. Тепломассообмен Лекция 13
Два основных режима поверхностногоТепломассообмен
Лекция 13 кипения
1. Пузырьковое кипение – на начальной стадии кипения на
поверхности нагрева возникают отдельные паровые пузырьки,
интенсифицирующие свободноконвективный теплообмен :
– поверхность имеет прямой контакт с жидкостью, причем
пограничный слой турбулизируется и «утоньшается» паровыми
пузырями;
– отрывающиеся пузыри увлекают из погран. слоя в ядро потока
перегретую жидкость, что приводит к дополнительному молярному
переносу теплоты.
2. Пленочное кипение – при увеличении температурного
напора на поверхности образуется сплошной слой пара,
отделяющий ее от жидкости. Интенсивность теплоотдачи
резко снижается.
10.
qΔt
11. Тепломассообмен Лекция 13
Тепломассообмена) однородно–эмульсионный;
б, д) расслоённый;
в, г) снарядный
Лекция 13
12.
13.
ТПЛекция 14 в несмачиваемой
Схема
образования пузыря
впадине на стенке и его отрыва
14.
Минимальный(критический)
радиус
устойчивого пузыря
ТП
Лекция
14
Условия существования и роста пузырька:
1) сила давления пара не меньше силы
поверхностного натяжения жидкости;
2) перегрев жидкости: Δt = (tж – tн ) > 0, tж ≈ tс
2s
Dp = pп - pж =
Rк
(в момент отрыва температура пара tп,к= tж )
– з-н Лапласа, σ – поверхностн. натяжение, Н/м;
при меньшем Δр пузырек сконденсируется
æ dp ö r ж - r п
Dp » Dt ç
÷
dT
è
øs rж
r rж rп
r
æ dp ö
=
ç ÷ =
è dT ø s Ts (u ¢¢ - u ¢) Tsж( r -п r
( по Клапейрону-Клаузиусу )
)
}
r r п Dt
s
Dp = 2
»
Rк
Ts
r r п Dt 2s
2s Ts
Dp »
³
Þ Rminк = R »
Tsп c R кs
rr ( T -T
)
15.
ТПЛекция 14
Скорость роста пузыря
на поверхности
Подвод теплоты к пузырьку путем теплопроводности из
окружающего слоя перегретой жидкости и через поверхность под
пузырьком идет на испарение жидкости и работу расширения.
Скорость роста пузырька – функция критерия Якоба:
Ja º
c pжDt r
r rп
(
– соотношение между тепловым потоком, идущим
на перегрев жидкости, и объемной теплотой
испарения
R
= m Ja + m2 Ja 2 + 2n Ja
at
)
m = 0.1÷0.5 для углов смачивания Θ = 40÷90о;
n=6
16. ТМО Лекция 12
Диаметр и частота отрыва пузырей17. Тепломассообмен Лекция 13
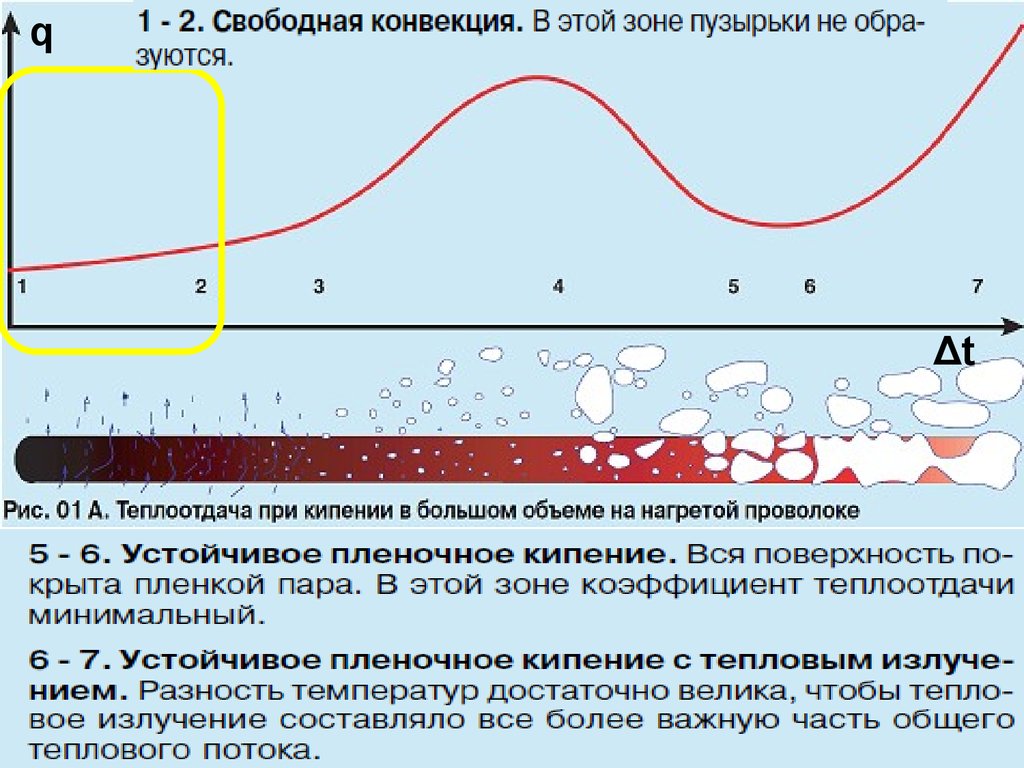
ТепломассообменКривая кипения при tc ,Лекция
Δt = 13
const
tc – заданная независимая величина, например, температура
конденсации греющего пара; q – плотность теплового потока,
отводимого от стенки к кипящей жидкости (зависимая величина).
С увеличением tc растёт Dt = tc – ts
и, следовательно, q = α Dt, которая
достигает максимума при развитом
пузырьковом кипении.
При переходе к плёночному режиму
снижается α, что приводит к
соответствующему снижению q.
После достижения минимума,
тепловой поток опять начинает
расти за счёт роста теплопроводности пара в плёнке и теплового
излучения.
Если уменьшать Dt в обратном порядке, процесс кипения будет
описываться точно той же кривой кипения.
18.
ТП Области кипенияЛекция14 при р = 1 бар
воды
Δt
0 – 5.5 оС
5.5 – 22 оС
22 – 111 оС
> 111 оС
Механизм кипения
Свободно-конвективный: пузырьки
малочислены, зарождаются только в
дефектных местах и неустойчивы
Пузырьковый
Переходный (частично пленочное)
Пленочный
Эффект Лейденфроста (1756): когда на раскаленную
поверхность попадает капля воды, она, не касаясь поверхности,
долго испаряется и распыляется на «паровой подушке» (пленочное
кипение).
19. Тепломассообмен Лекция 13
ТепломассообменКривая и кризисы кипенияЛекция
при 13
qс=const
qс – заданная независимая величина (тепловая нагрузка),
например, подводимая к стенке электронагревателем или
излучением от пламени горения топлива; tc ,Δt – зависимые
величины.
Прямой ход : при постепенном увеличении qс на поверхности
развивается пузрьковый режим кипения. Максимальная тепловая
нагрузка, которую можно отвести от поверхности стенки к кипящей
жидкости, qмакс = qкр1, называется первой критической плотностью
теплового потока.
20. ТП Лекция 14
При этойувеличение
qс приводит к
ТП нагрузке любое случайное
Лекция
14
повышению температуры стенки вследствие того, что подводимый к
ней тепловой поток превышает отводимый из-за того, что
начинается переход к пленочному режиму кипения, падают и
отвод теплоты от стенки. Это приводит к ещё большему росту
температуры стенки; процесс её разогрева приобретает
лавинообразный характер, в результате чего происходит "скачок" tc
и Δt , что может привести к разрушению стенки ("выгоранию
поверхности"). Это явление называется 1-м кризисом кипения.
Обратный ход: уменьшение qс
при плёночном кипении до qмин = qкр2
приводит к 2-му кризису кипения –
скачкообразному охлаждению стенки
вследствие того, что жидкость местами
"протекает" через нестабильную паровую
пленку к поверхности, из-за чего растет , и отвод теплоты от
стенки превышает подвод (qмин ); процесс имеет лавинообразный
характер, что приводит к разрушению пленки и "скачку "к
пузырьковому режиму кипения при более низкой температуре.
21. ТМО Лекция 12
Критическая плотность теплового потокаqкр1 = K × r r п 4 s g ( r ж - r п )
K = 0.13 ¸ 0.16
Жидкость
qкр1 , МВт/м2
Вода
Аммиак
R22
1.25
0.70
0.44
R12
0.36
Для воды
qкр1 = 0,248r 4 r П2 s ( r ж - r П )
Энергосбережение и возобновляемые источники энергии
Г.И.Пальчёнок
22. Тепломассообмен Лекция 13
Коэффициенттеплоотдачи при пузырьковом
кипении
Тепломассообмен
Лекция 13
2
q
1 13
3
Опыт: = сq
= , Dt = tc - ts .
Þ Dt = q
Dt
c
Д.А. Лабунцов:
2/3
1/ 3
2
é
ù
æ rп ö
æ l ö
2/3
= 0.075 ê1 + 10 ç
q
ú
÷
÷
ç
êë
è r ж - r п ø úû è ns Ts ø
23.
ЭмпирическиеформулыЛекция
для расчета
коэффициента
ТП
14
теплоотдачи при кипении воды
единицы СИ, кроме давления:
[p] = бар (= 105 Па)
0.18
3.4 p
=
q2 / 3
1 - 0.0045 p
α = 3.0 q 0.7p 0.15
α = 38.7 Δt 2.33p 0.5
24. Тепломассообмен Лекция 13
Сравнениекоэффициентов теплоотдачи
при
конвекции и фазовых переходах, Вт/(м2К)
25. Тепломассообмен Лекция 13
хладоновКоэфф-т
теплоотдачи при кипении
Г.Н. Данилова:
= Co F (p ) ( Rz / Rzo )
0.2
q 0.75
1/4 -1/8
-1/8
Coкр= 550
p
T
M
кр
0.4
æ
при 0.003 £ p £ 0.5 F (p ) = 0.14 + p ç1.6 +
1- p
è
ö
÷,
ø
p = psкр/ p
M – молекулярная масса; ркр [бар] и Ткр [К] – критические параметры,
Rz [мкм]– высота микронеровностей поверхности нагрева (3–5 мкм
для труб промышл. изготовления, Rzо = 1 мкм)
26.
Теоретические основы хладотехники.Тепломассообмен / С.Н.Богданов, Н.А. Бучко,
Э.И. Гуйко и др.; Под ред. Э.И. Гуйко.
– М.: Агропромиздат, 1986. – 320 с.
27. Тепломассообмен Лекция 13
Переходот своб. конвекции к кипению
в большом
объеме
Тепломассообмен
Лекция
13
а' – точка начала кипения
а – точка окончания кипения
28. Тепломассообмен Лекция 13
Расчеттеплообмена при развитом пузырьковом
кипении
Тепломассообмен
Лекция 13
Область IIр
(СИ)
= C × f ( p) × q
R 718
R 717
(R 729 – воздух)
n
29. Тепломассообмен Лекция 14
Безразмерное описание теплообменапри
Тепломассообмен
Лекция 14
пузырьковом кипении на основе модели Кружилина
(Д.А.Лабунцов)
1) задана тепловая нагрузка q, Вт/м2
13
Nu s = 0,0625Re0,5
Pr
s
s
13
Nu s = 0,125Re0,65
Pr
s
s
при Re s < 0,01
при Re s ³ 0,01
c pжr ssT
ls
ls ~ (dкр ·Ja) – характ. масштаб
Nu s =
; lм
=
,
;
s
2
длины для паровой фазы
l
( rП r )
ws ls
ls
q
Res =
= qAs ; ws =
,м/с;
As =
, м 2/Вт;
n
rrП
rnr П
n
l
Prs = ;
Bs =
, K -1
a
( r r Пn )
30. Тепломассообмен Лекция 12
2) задан температурный напор ∆t = tc - ts:1
2
s
( Bs Dt ) Prs0,952 при Bs Dt Pr ³ 1,6
2
1
Nu s = 3,91 ×10-3 ( Bs Dt ) Prs3 при Bs Dt Prs3 < 1,6
Nu s = 2,63 × 10
-3
1,86
Res=10-5÷10+4; Prs=0,86÷7,6; р=4500÷175*105 Па;
1
Bs Prc 3 = 0,05 ¸ 200
Энергосбережение и возобновляемые источники энергии
Г.И.Пальчёнок
31. Тепломассообмен Лекция 13
Теплоотдачапри кипении в условиях
вынужденной
Тепломассообмен
Лекция
13
конвекции
К-т теплоотдачи при кипении
определяется тепловой (qc)
нагрузкой и не зависит от
скорости, а при конвекции
является степенной функцией
скорости.
кип
< 0.5 Þ = конв
конв
кип
>2
Þ = кип
конв
кип
4 конв + кип
0.5 <
<2 Þ
=
конв
конв 5 конв - кип





























 Физика
Физика








