Похожие презентации:
Поверхностные явления. Адсорбция
1.
Кафедра химииТема лекции:
Поверхностные явления.
Адсорбция
2.
Поверхностные явленияА - молекула в
объеме
Б - молекула на
поверхности
В –молекула на
гребне
3.
Поверхностные явленияНа поверхностный слой молекул действует сила,
направленная вглубь объема. Она называется
поверхностным натяжением ( ).
Под действием этой силы поверхность раздела
Ж/Гстановится предельно гладкой и сокращается
до минимума. Поверхность жидкости эквипотенциальна в спокойном состоянии.
Любая поверхность имеет избыточную
свободную поверхностную энергию
(СПЭ)
4.
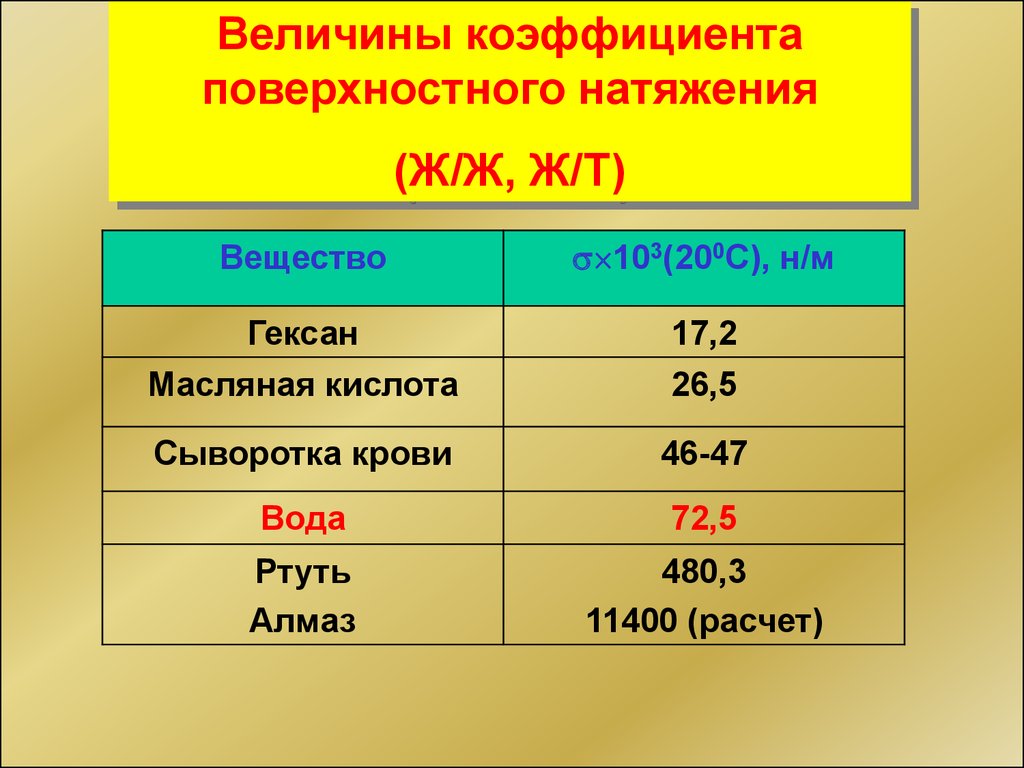
Величины коэффициентаповерхностного натяжения
(Ж/Ж, Ж/Т)
Вещество
103(200С), н/м
Гексан
Масляная кислота
17,2
26,5
Сыворотка крови
46-47
Вода
72,5
Ртуть
Алмаз
480,3
11400 (расчет)
5.
СПЭ в биологии и медицинеПолная альвеолярная поверхность легких
при вдохе равна 70—80 м2, что примерно
в 40 раз больше наружной поверхности
тела.
Суммарная поверхность эритроцитов,
контактирующих со всеми альвеолами в
течение 1 мин – 3750 м2.
В печени суммарная площадь внутренней
митохондриальной мембраны составляет 40м2
на 1 г белка.
Большая удельная поверхность органов и тканей
необходима для активного обмена веществ: он
происходит лишь в том случае, когда уменьшается СПЭ.
6.
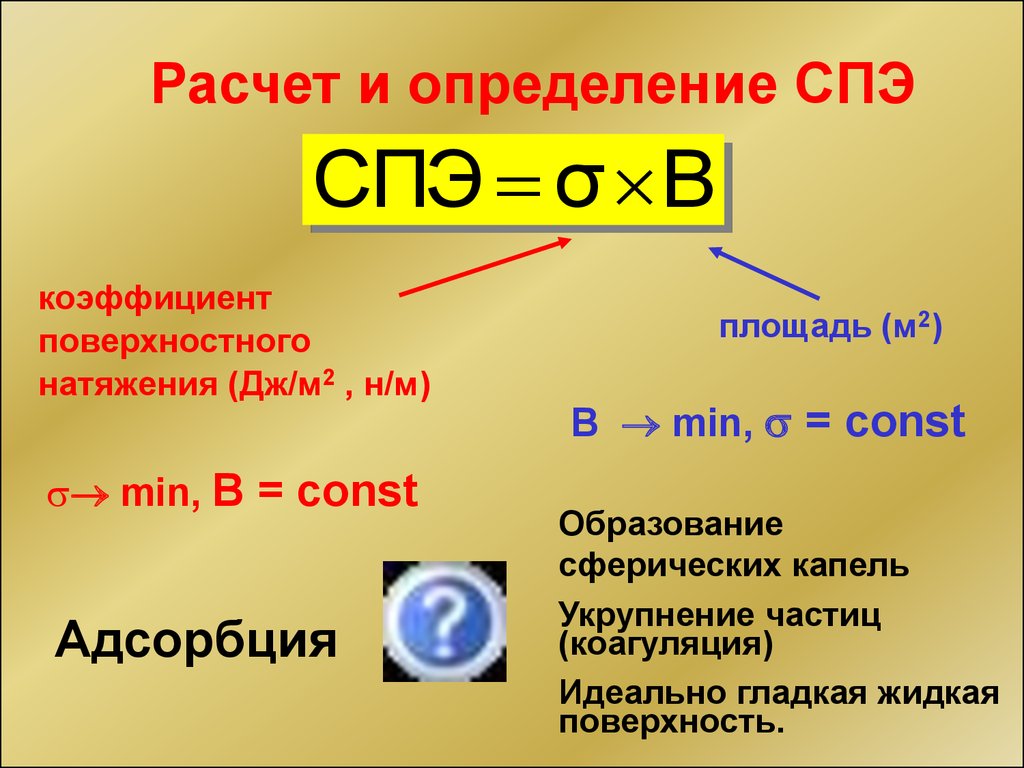
Расчет и определение СПЭСПЭ σ B
коэффициент
поверхностного
натяжения (Дж/м2 , н/м)
min, B = const
Адсорбция
площадь (м2)
B min, = const
Образование
сферических капель
Укрупнение частиц
(коагуляция)
Идеально гладкая жидкая
поверхность.
7.
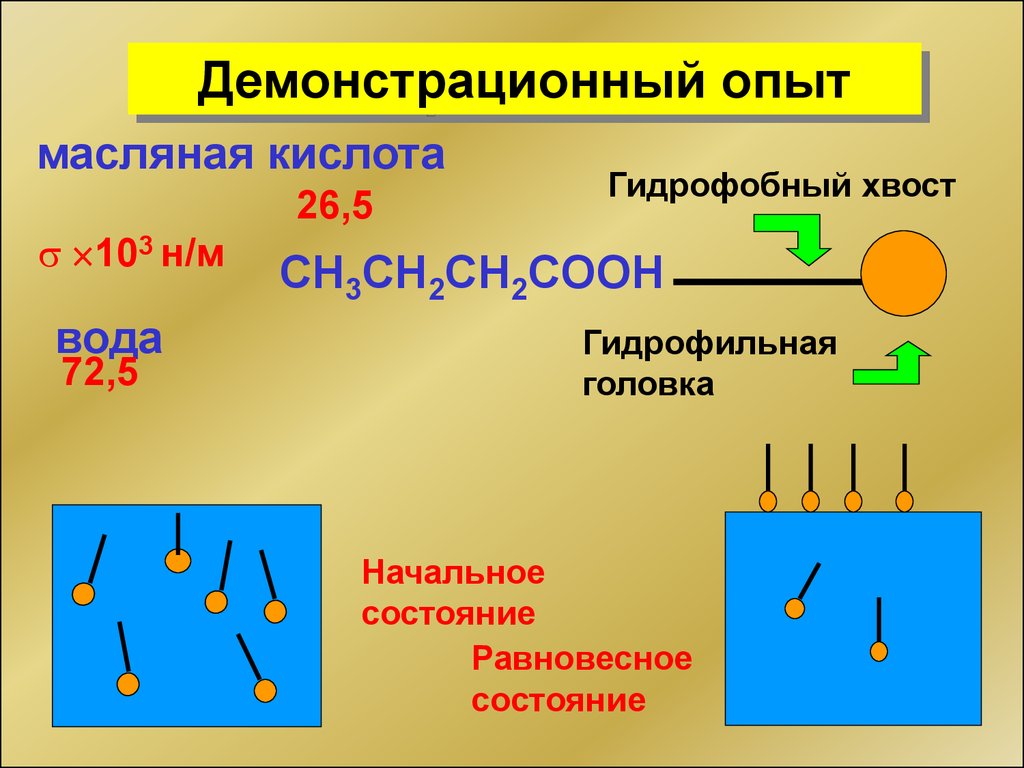
Демонстрационный опытмасляная кислота
26,5
103 н/м
вода
72,5
Гидрофобный хвост
СH3CH2CH2COOH
Гидрофильная
головка
Начальное
состояние
Равновесное
состояние
8.
Основные терминыАдсорбция – самопроизвольный процесс
накопления вещества на поверхности раздела
фаз.
Адсорбент – вещество, на котором происходит
адсорбция.
Вещество, молекулы которого могут
адсорбироваться, называется адсорбтивом, а
уже адсорбированные молекулы – адсорбатом.
Абсорбция – процесс поглощения одного
вещества всем объемом другого, а не только его
поверхностью.
Сорбция – любой процесс поглощения вещества (как адсорбция, так и абсорбция).
9.
АдсорбцияПроцесс самопроизвольный
G < 0 S < 0
H < 0
Процесс избирательный
Еактивации мала, Vадсорбции высокая
Первые исследования в области
адсорбции – Т.Е. Ловиц (1757-1804)
Предложил использовать уголь для очистки спирта
от сивушных масел и для дезодорации воздуха.
Поверхность раздела таблетки активированного
угля равна 125 м2
10.
Адсорбция в медицинской практикеФизиотерапевтические процедуры –
ванны, аппликации, обертывания
Энтеросорбция – удаление
ядовитых веществ и газов
из желудочно-кишечного тракта
Гемосорбция – удаление
ядовитых веществ из кровяного русла
Мази, эмульсии, присыпки
при лечении кожных заболеваний
11.
Pасчет адсорбции(С0 С р )V моль
(С0 С р )V моль
Г
Г
2
B
см
m
кг
Г (гамма) - адсорбция,
С0 – начальная концентрация адсорбтива,
моль/л;
Ср – равновесная концентрация адсорбтива ,
моль/л;
V – объем раствора, л или м3.
B – площадь адсорбента, см2 или м2
m – масса адсорбента, г или кг
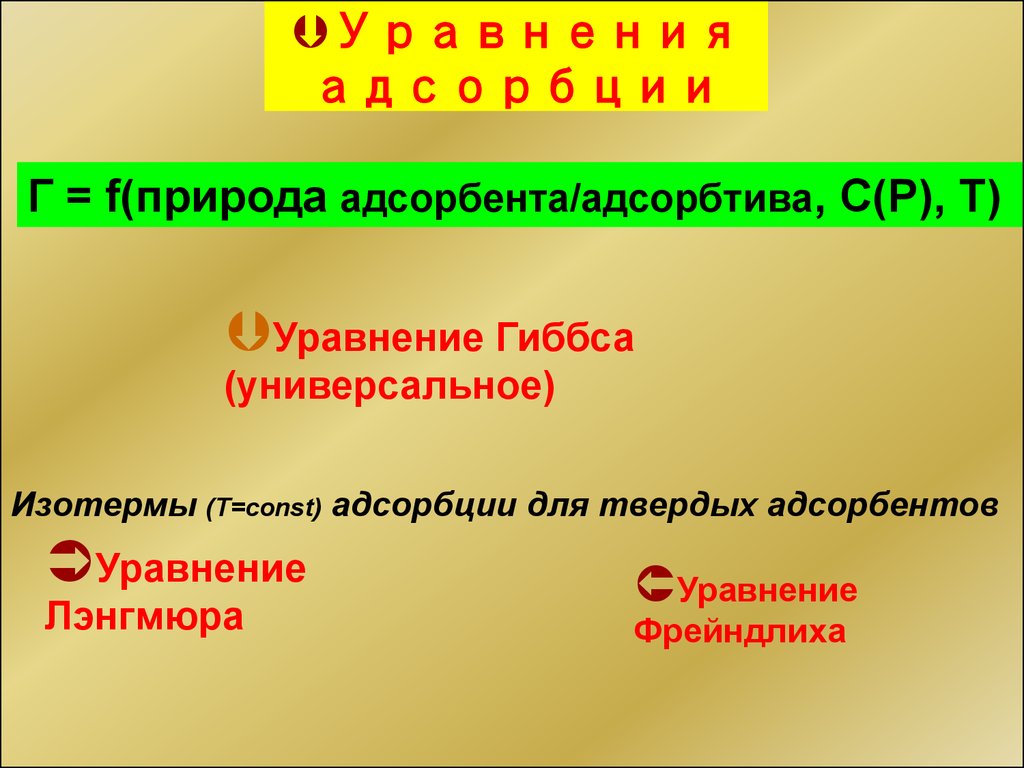
12. Уравнения адсорбции
Г = f(природа адсорбента/адсорбтива, С(Р), Т)Уравнение Гиббса
(универсальное)
Изотермы (T=const) адсорбции для твердых адсорбентов
Уравнение
Лэнгмюра
Уравнение
Фрейндлиха
13.
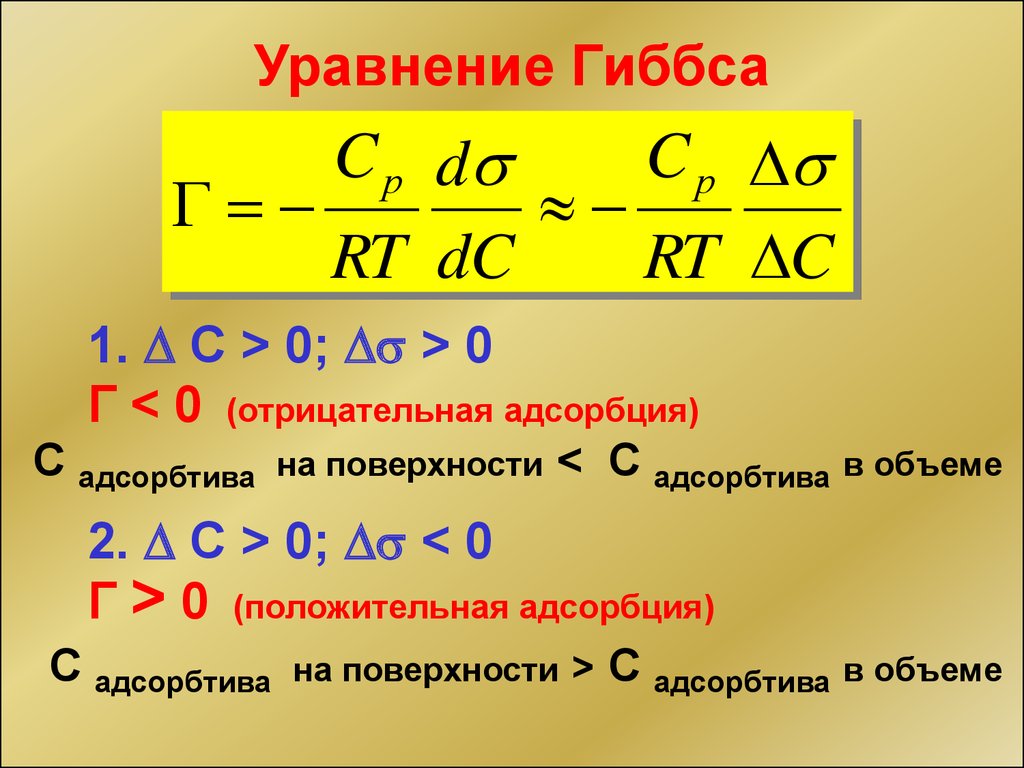
Уравнение ГиббсаC р d
C р
RT dC
RT C
1. С > 0; > 0
Г < 0 (отрицательная адсорбция)
С адсорбтива
на поверхности
< С адсорбтива в объеме
2. С > 0; < 0
Г > 0 (положительная адсорбция)
С адсорбтива
на поверхности >
С адсорбтива в объеме
14.
Вещества, вызывающие отрицательнуюадсорбцию, называются
поверхностно-инактивными веществами
(ПИАВ)
Для воды:
неорганические соединения:
кислоты, основания, соли.
Вещества, вызывающие положительную
адсорбцию, называются
поверхностно-активными веществами (ПАВ)
15. ПАВ
Полярныеорганические молекулы
С10 – С18
16.
ПАВАнионактивные ПАВ
Мыла
С17Н35СООNa С17Н35СОО- + Na+
Катионактивные ПАВ
Соли аммония и пиридиния
+
роккол
CH2
CH3
Cl
N R
CH3
Неионногенные мыла
C11H21-O-(CH2CH2O)8H
17.
Применение ПАВ в медицинеМоющие средства;
бактерицидные препараты
(катионактивные ПАВ);
эмульгаторы при стабилизации эмульсий
для внутривенного применения;
стабилизаторы лекарственных суспензий;
смачиватели для улучшения растекания
лекарственных форм;
дегазирующие средства.
18.
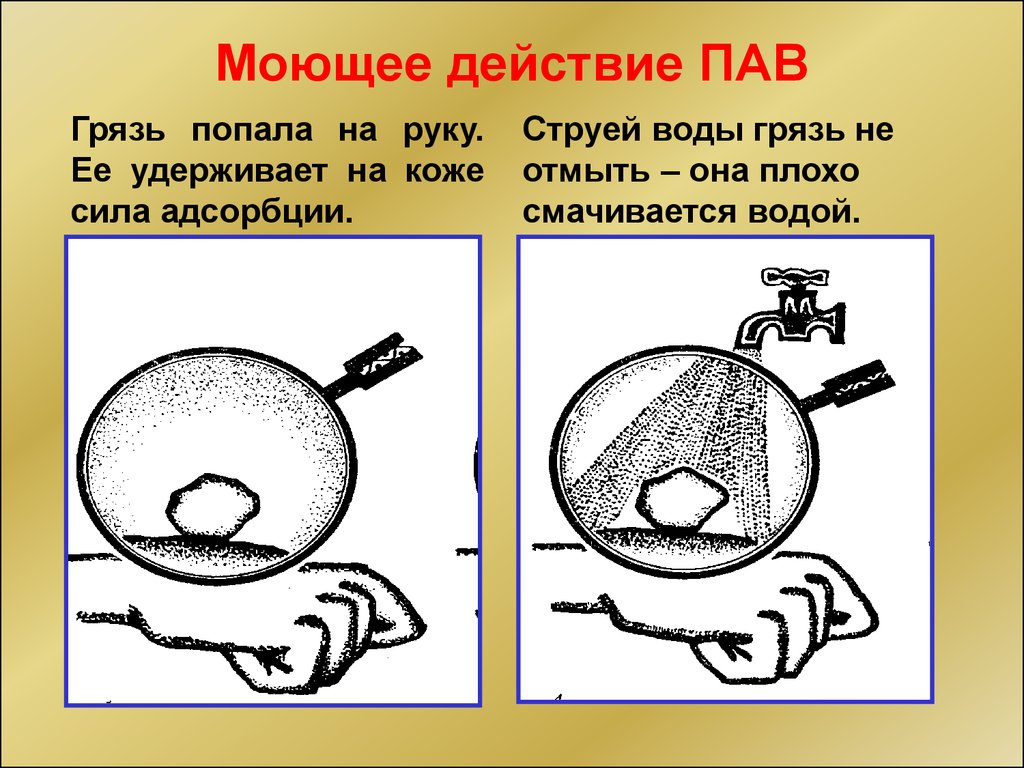
Моющее действие ПАВГрязь попала на руку.
Ее удерживает на коже
сила адсорбции.
Струей воды грязь не
отмыть – она плохо
смачивается водой.
19.
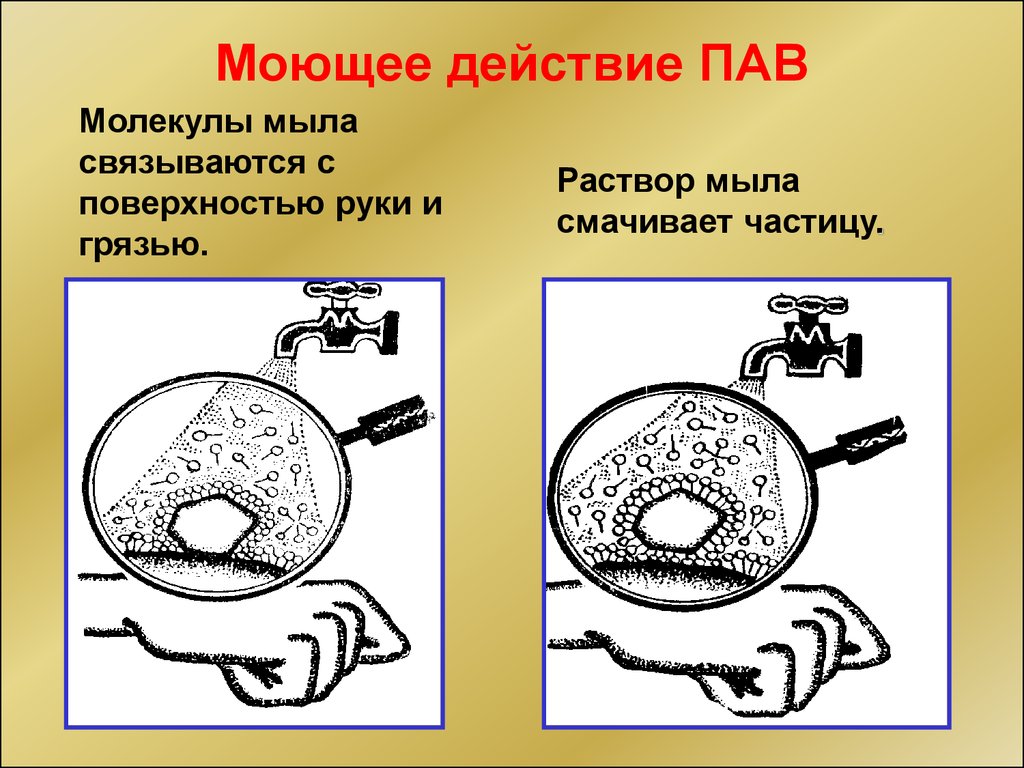
Моющее действие ПАВМолекулы мыла
связываются с
поверхностью руки и
грязью.
Раствор мыла
смачивает частицу.
20.
Моющее действие ПАВЧастица грязи отрывается
от кожи и уносится струей
воды, а мыло,
адсорбирующееся на
поверхности руки легко
смывается водой.
21.
Уравнение ЛэнгмюраНобелевская премия за работы по теории
поверхностных явлений (1932)
С
Г Г
К С
К дес
К
К адс
Г - предельная адсорбция
Г , К - константы для пары адсорбент-адсорбтив.
Кдес, Кадс - константы скорости процессов адсорбции
и десорбции
22.
Основные положения1. Адсорбция происходит лишь на
активных центрах поверхности.
Активные центры
адсорбент
адсорбат
2. Адсорбция
мономолекулярна
23.
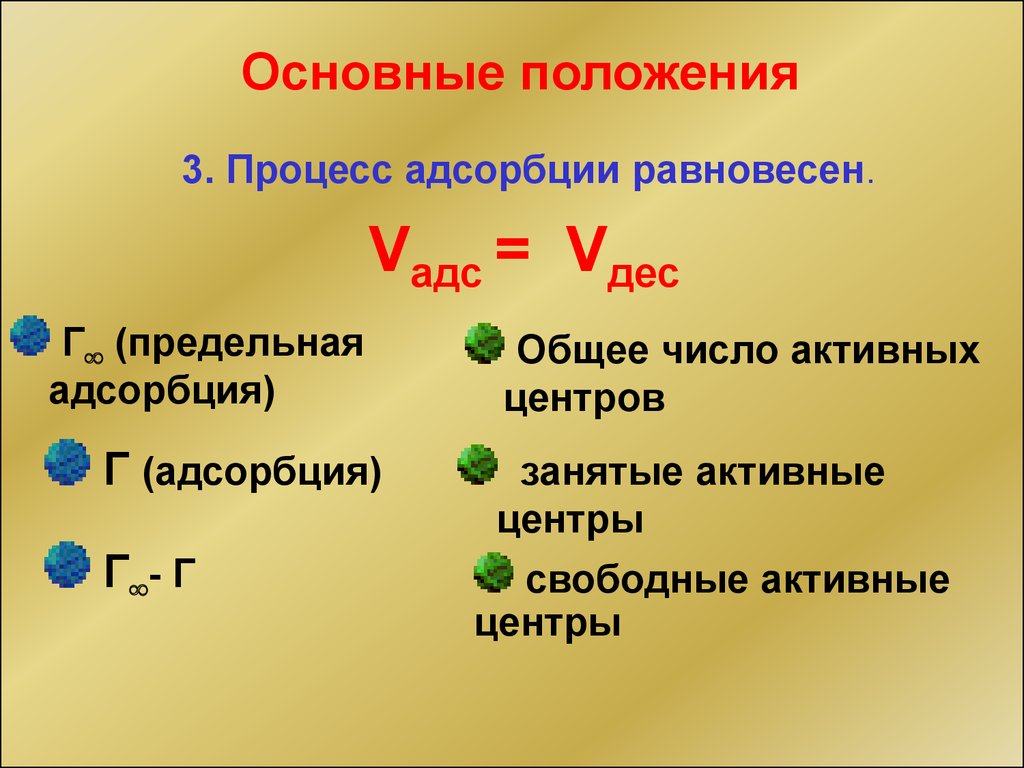
Основные положения3. Процесс адсорбции равновесен.
Vадс = Vдес
Г (предельная
адсорбция)
Г (адсорбция)
Г - Г
Общее число активных
центров
занятые активные
центры
свободные активные
центры
24. 1. Адсорбция происходит лишь на активных центрах поверхности.
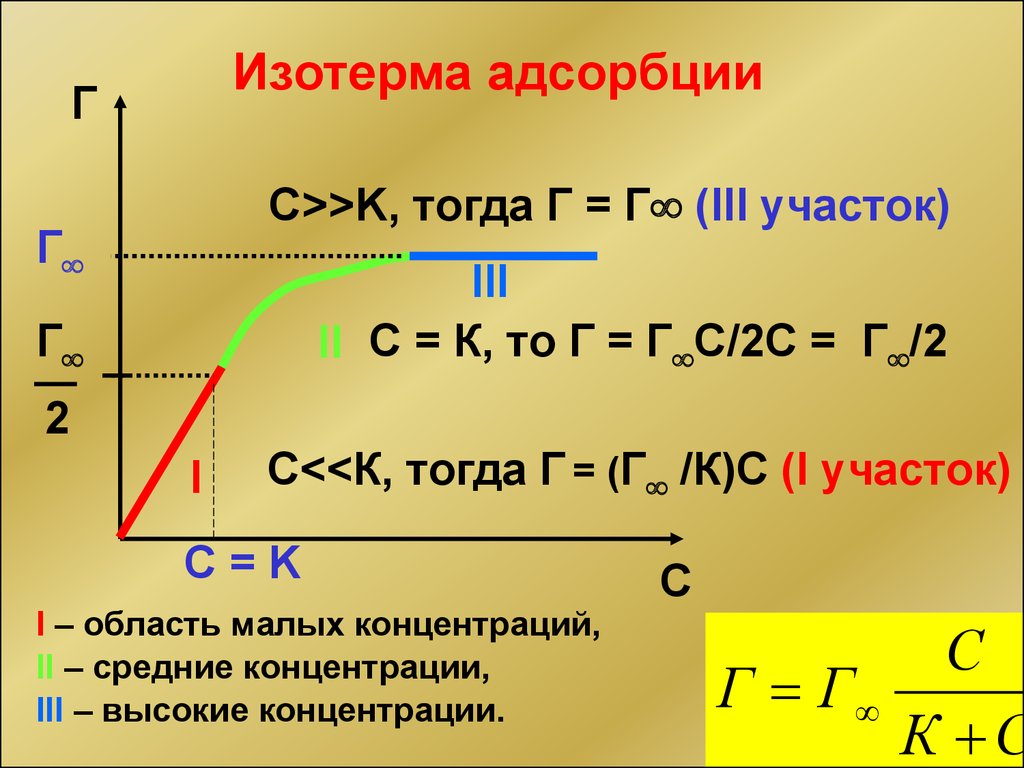
Изотерма адсорбцииГ
С>>K, тогда Г = Г (III участок)
Г
III
II С = К, то Г = Г С/2C = Г /2
Г
2
I
С<<К, тогда Г = (Г /К)С (I участок)
C=K
I – область малых концентраций,
II – средние концентрации,
III – высокие концентрации.
С
С
Г Г
К С
25. 3. Процесс адсорбции равновесен.
Расчет площади полярной «головки»молекулы ПАВ
1
S
NaГ
S
Для RCOOH S = 21 10-16 cм2
26. Вывод уравнения Ленгмюра
Уравнение ФрейндлихаГ(x/m) =
n
aC
Описывает процесс адсорбции на твердой поверхности
a, n – постоянные величины для данной пары
адсорбент-адсорбтив
x
lg lg a n lg c
m
y =
a
+
bx
27.
Определение констант “a” и “n”lgx/m
C
n = tg = OC/AO
3
2
1
A
lgcр
1
2
3
O
lga
28.
Константы “a” и “n”(адсорбент - активированный уголь)
Адсорбтив
a
n
Уксусная
кислота
2,99
0,52
Ацетон
5,12
0,52
Бром
23,12
0,34
29.
Обменная адсорбцияЯвление замещения на адсорбенте одного
вещества другим, находящимся во внешней
среде.
Ионообменная адсорбция
Некоторые адсорбенты (иониты) обладают
химическими группами, способными в
результате диссоциации замещать свои
ионы на одноименно заряженные ионы,
содержащиеся в растворе.
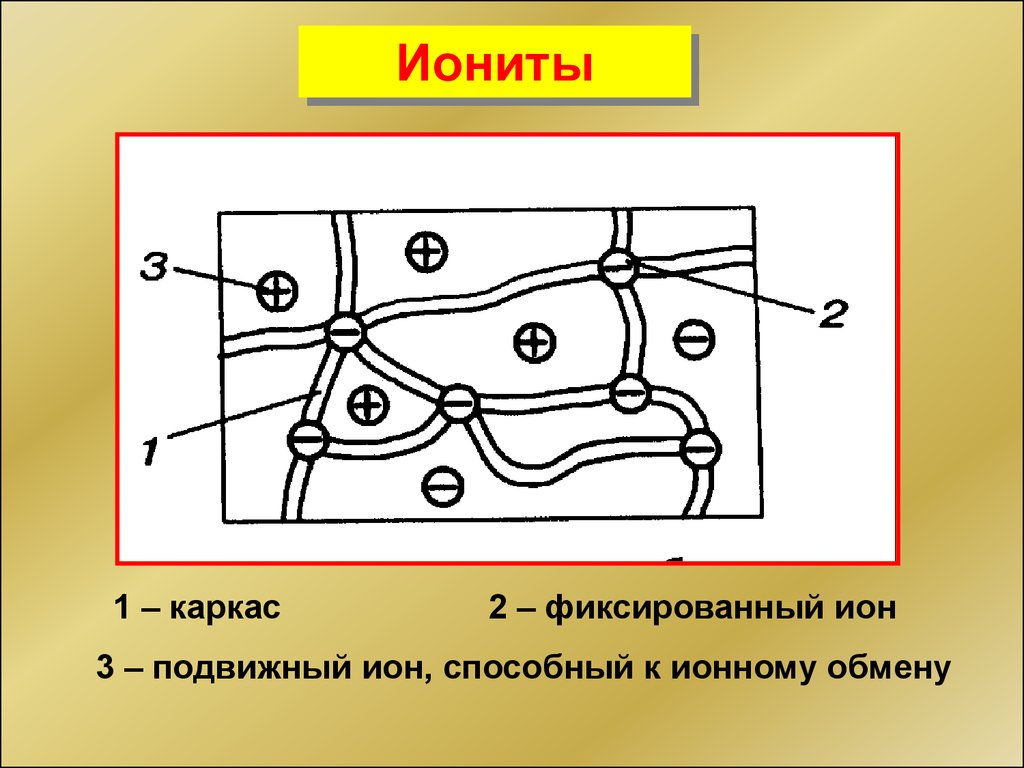
30.
Иониты1 – каркас
2 – фиксированный ион
3 – подвижный ион, способный к ионному обмену
31.
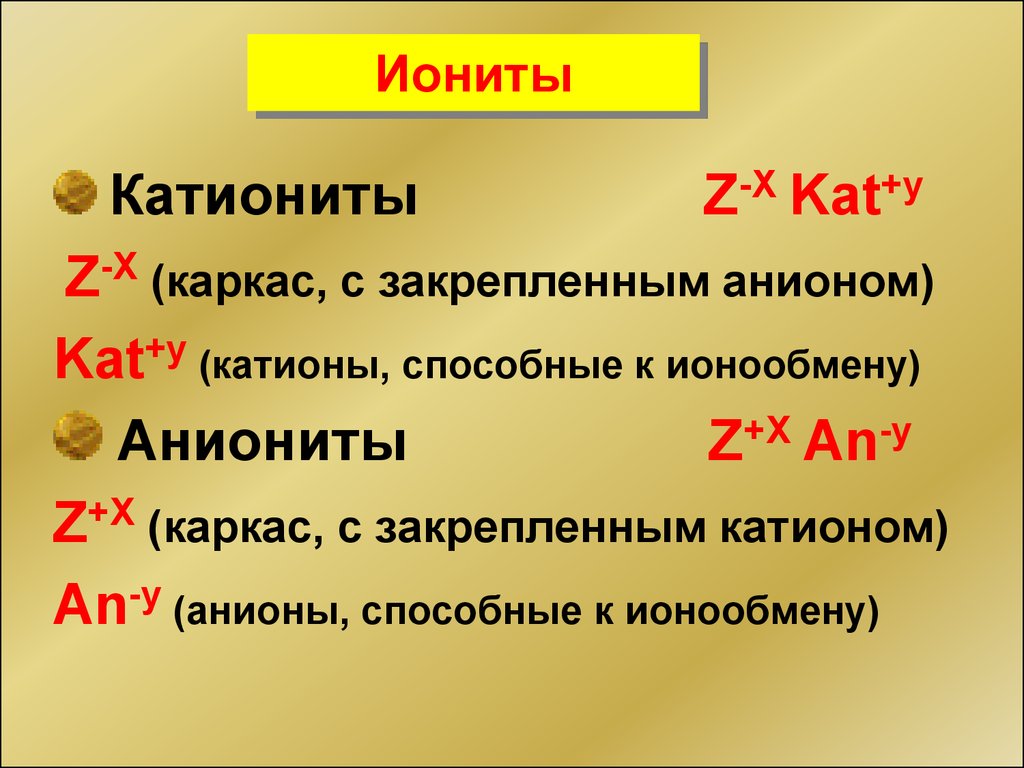
ИонитыКатиониты
Z-X Kat+y
Z-X (каркас, с закрепленным анионом)
Kat+y (катионы, способные к ионообмену)
Аниониты
Z+X An-y
Z+X (каркас, с закрепленным катионом)
An-y (анионы, способные к ионообмену)
32.
ИонитыПриродные:
Алюмосиликаты (цеолиты, гидрослюда и др.)
Древесина, торф, целлюлоза,
сульфированные угли
Синтетические:
Алюмосиликаты (пермутиты)
Органические ионообменные смолы
ZSO3H, ZCOOH, ZPO(OH)2 (катиониты)
ZNH2, ZN(CH3)2, Z=NH (аниониты)
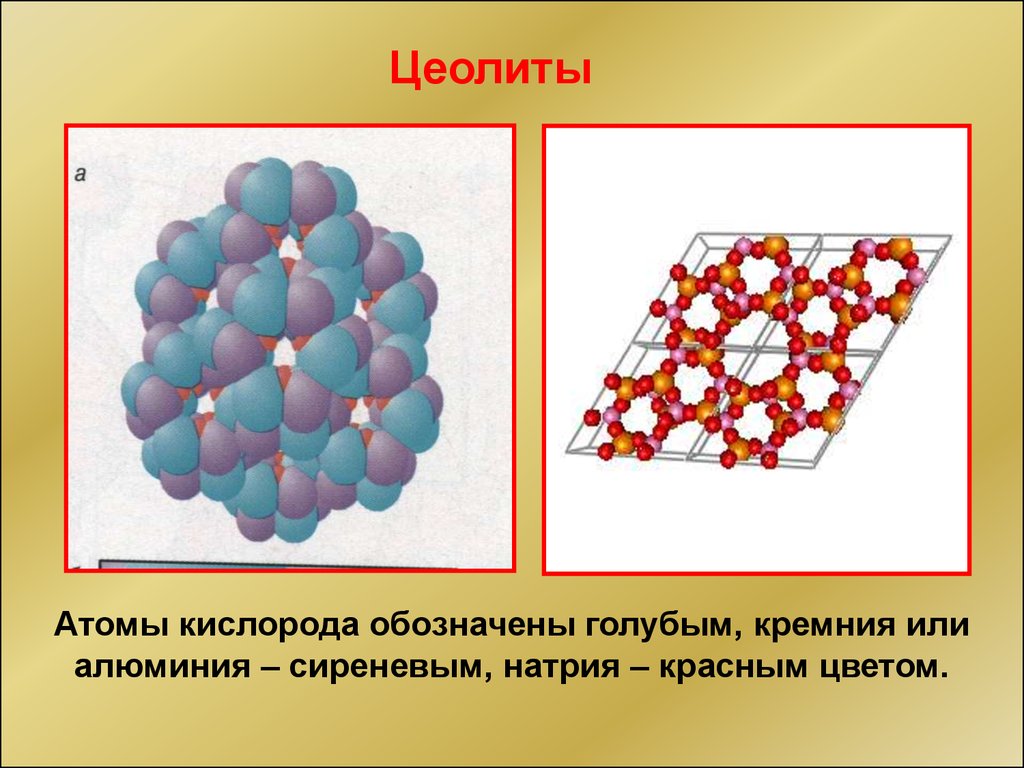
33.
ЦеолитыАтомы кислорода обозначены голубым, кремния или
алюминия – сиреневым, натрия – красным цветом.
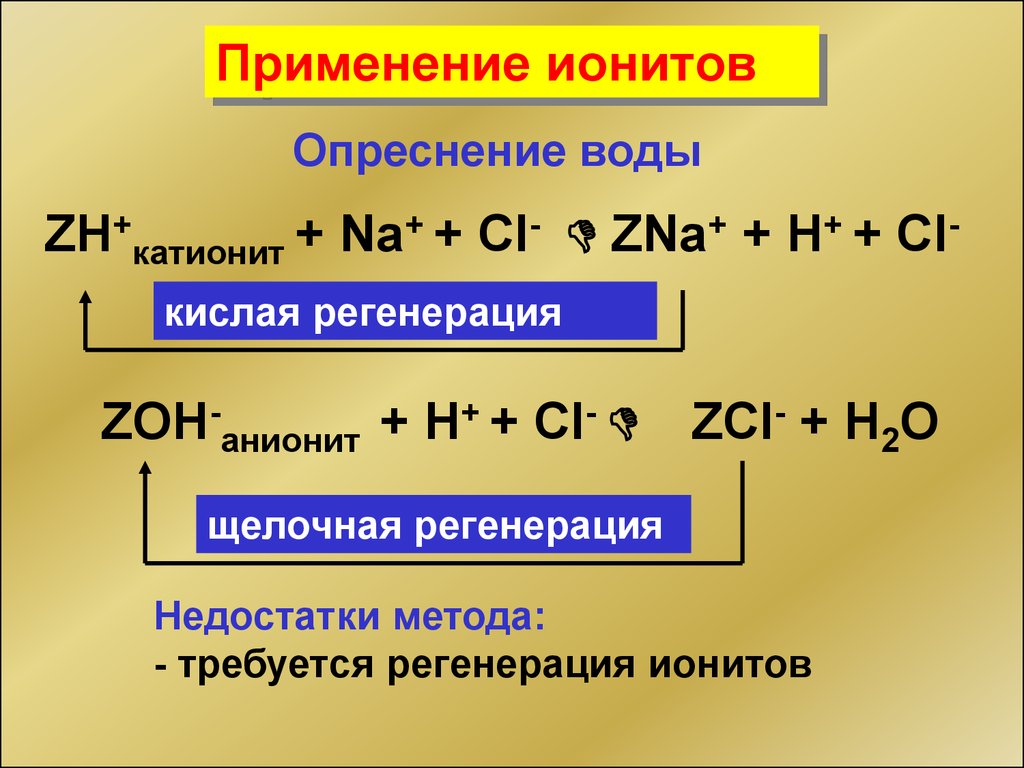
34.
Применение ионитовОпреснение воды
ZH+катионит + Na+ + Cl- D ZNa+ + H+ + Clкислая регенерация
ZOH-анионит + H+ + Cl- D ZCl- + H2O
щелочная регенерация
Недостатки метода:
- требуется регенерация ионитов




















 Химия
Химия








