Похожие презентации:
Химическая связь
1.
Химическаясвязь
Подготовила: учитель химии и биологии
МКОУ основной общеобразовательной школы
№ 27, д. Прилесье Узловского района
Гришина Елена Андреевна.
2.
Цель урокаСформировать понятие о химической
связи и научиться определять ее тип в
различных соединениях по химической
формуле вещества.
3.
ЗадачиОбразовательные:
• сформировать представление учащихся о единой природе
химической связи;
• познакомить учащихся с различными типами химических связей;
• научить школьников определять типы химических связей в различных
соединениях.
Развивающие:
• формировать умение определять тип химической связи в соединении;
• развивать устную речь учащихся, умение применять знания в новой
ситуации;
• развитие творческого химического мышления.
Воспитательные:
• развивать познавательный интерес учащихся;
• способствовать росту инициативы и самостоятельности;
• формирование культуры общения, чувства уважения друг к другу.
4.
• Химическая связь – этовзаимодействие атомных частиц,
сопровождающееся перестройкой
электронных оболочек (орбиталей).
• Химическая связь – это связь между
химическими частицами (атомными
частицами, молекулами, ионами),
объединяющая их в более сложные
структуры (молекулы, ионы).
5.
• Энергия химической связи –количество теплоты, поглощаемое при
разрыве ковалентной связи или
выделяемое при ее образовании
(единица – кДж/моль).
• Длина химической связи – расстояние
между ядрами связываемых атомных
частиц одного химического элемента
или разных элементов (единицы –
нанометр (нм), пикометр (пм)).
6.
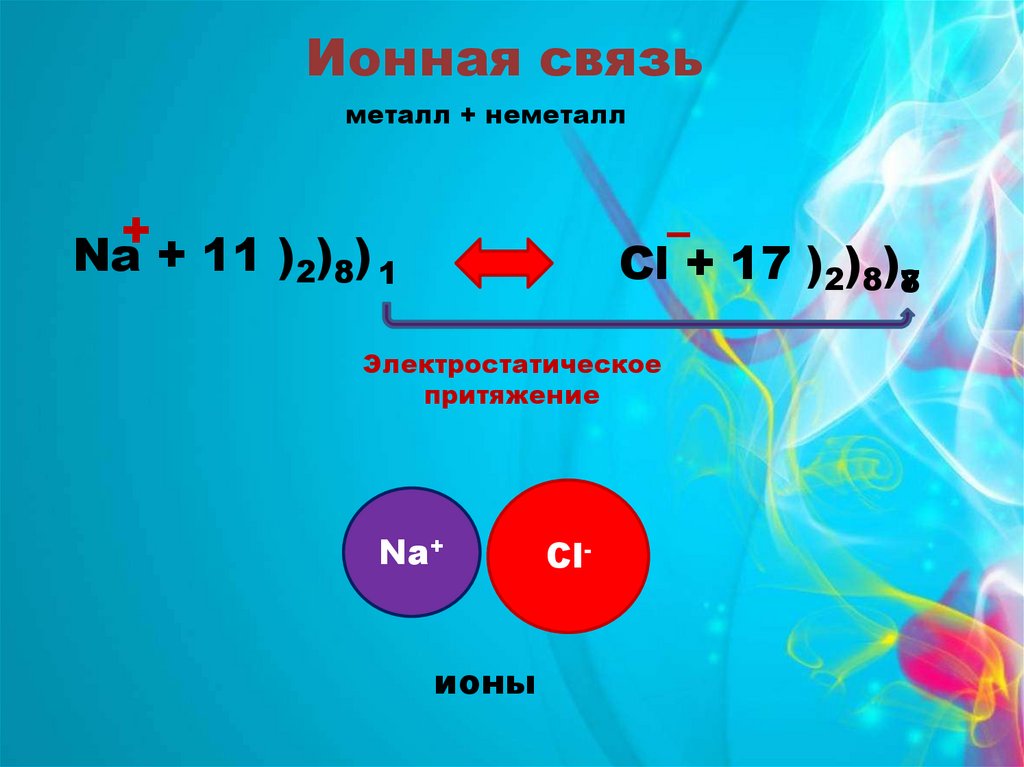
Ионная связьметалл + неметалл
+
Na + 11 )2)8) 1
–
Cl + 17 )2)8)78
Электростатическое
притяжение
Na+
ионы
Cl-
7.
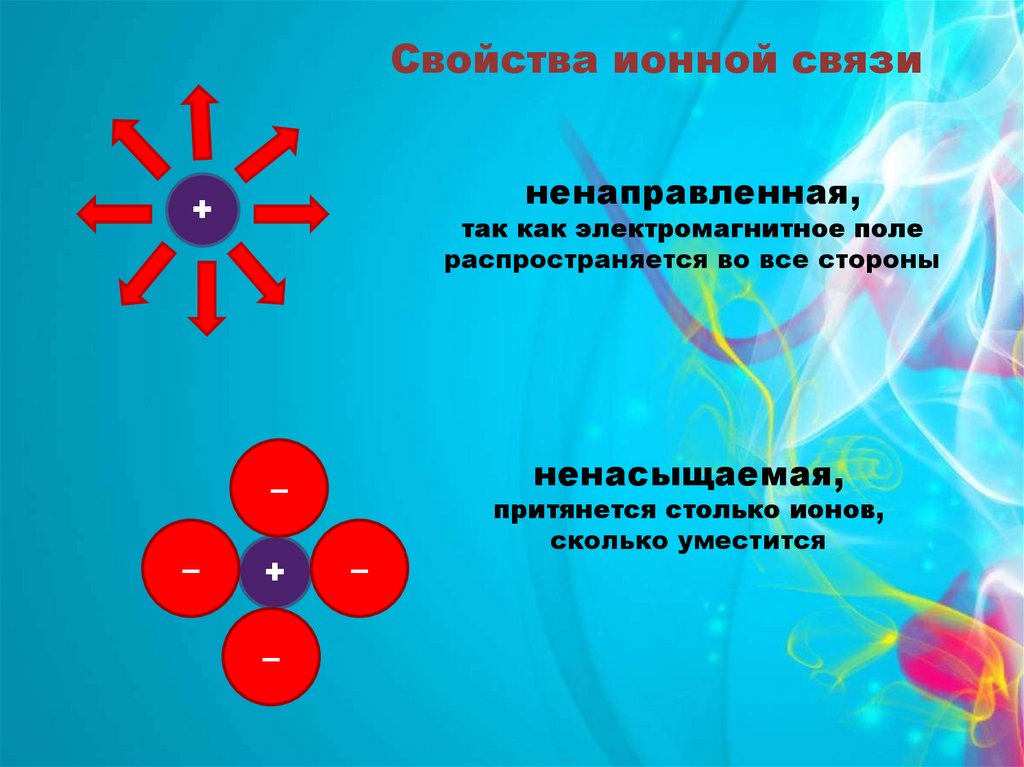
Свойства ионной связиненаправленная,
+
так как электромагнитное поле
распространяется во все стороны
ненасыщаемая,
–
–
+
–
–
притянется столько ионов,
сколько уместится
8.
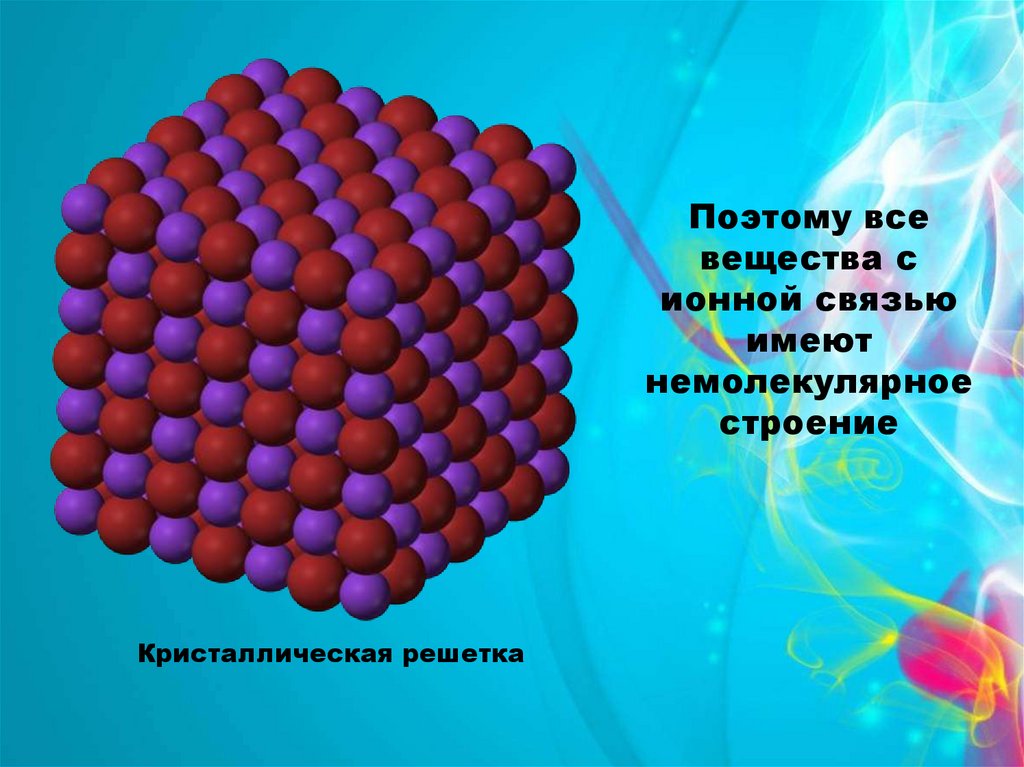
Поэтому всевещества с
ионной связью
имеют
немолекулярное
строение
Кристаллическая решетка
9.
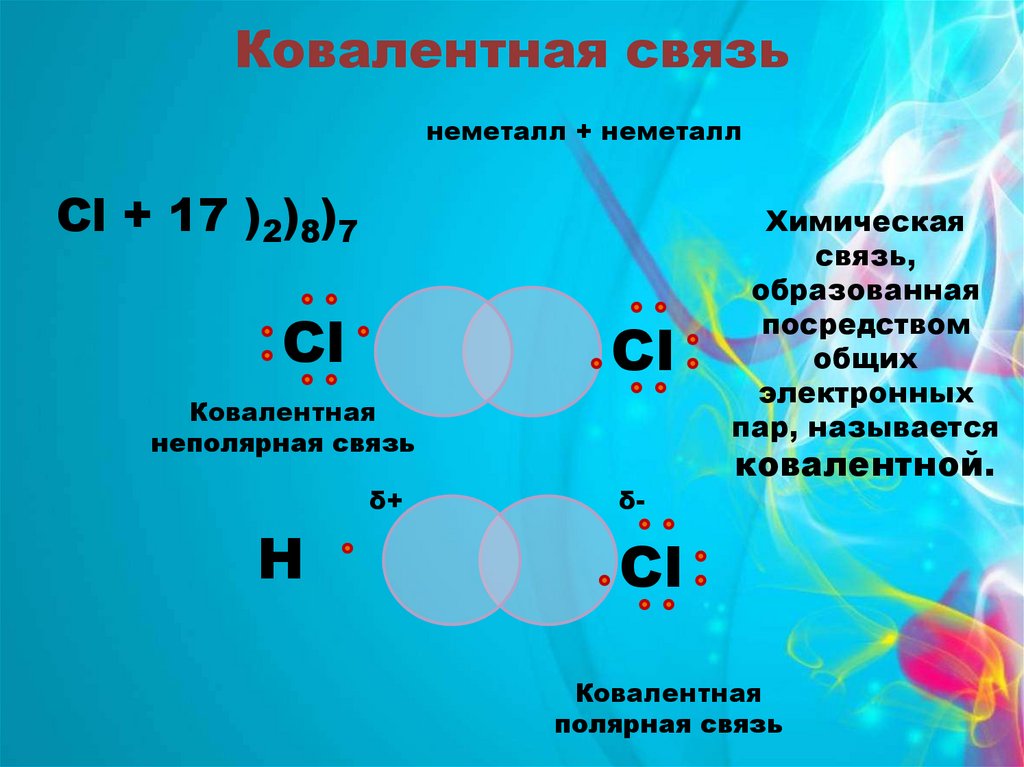
Ковалентная связьнеметалл + неметалл
Cl + 17 )2)8)7
Сl
Сl
Ковалентная
неполярная связь
δ+
Н
δ-
Химическая
связь,
образованная
посредством
общих
электронных
пар, называется
ковалентной.
Сl
Ковалентная
полярная связь
10.
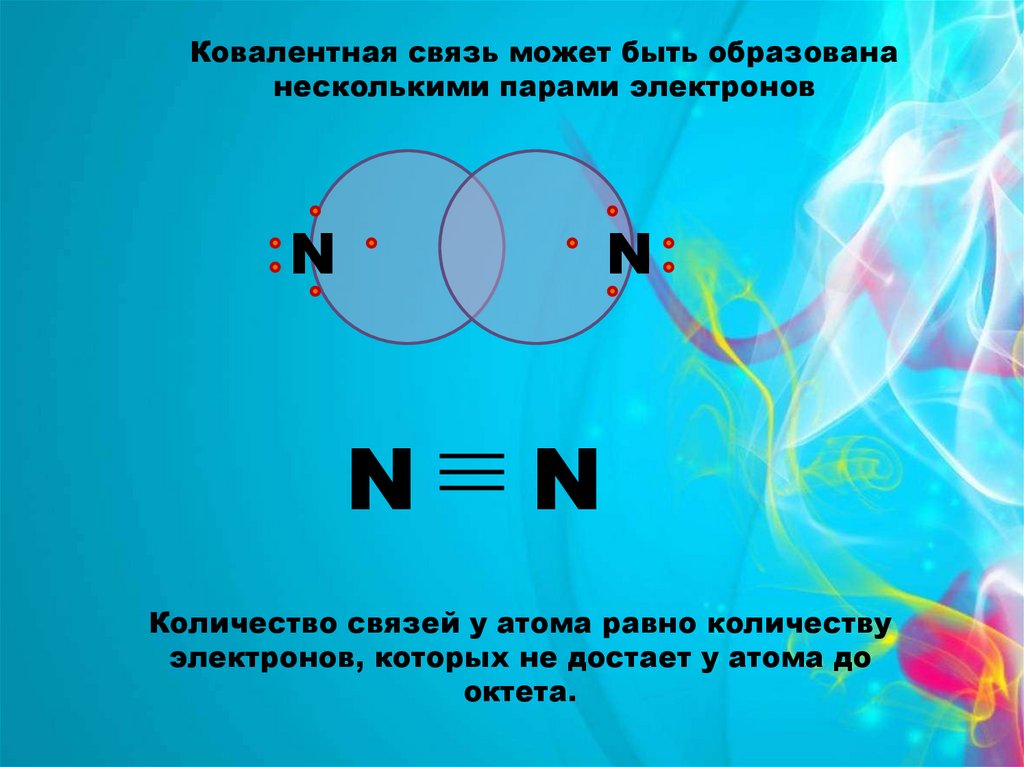
Ковалентная связь может быть образовананесколькими парами электронов
N
N
N
N
Количество связей у атома равно количеству
электронов, которых не достает у атома до
октета.
11.
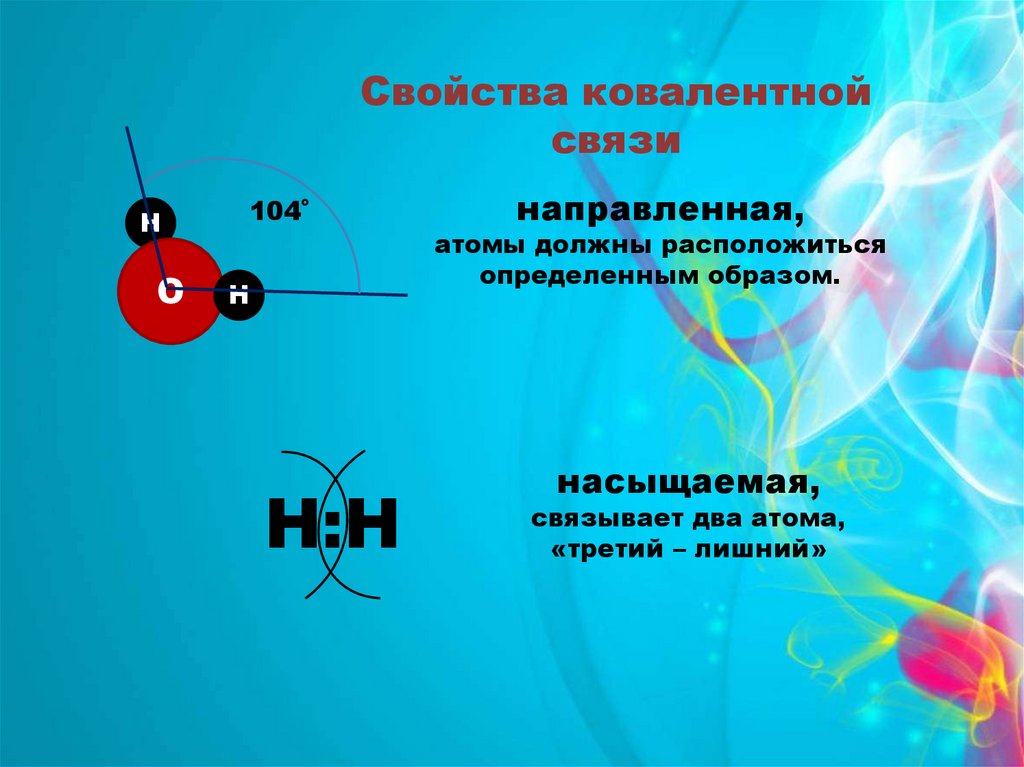
Свойства ковалентнойсвязи
Н
О
104˚
Н
Н:Н
направленная,
атомы должны расположиться
определенным образом.
насыщаемая,
связывает два атома,
«третий – лишний»
12.
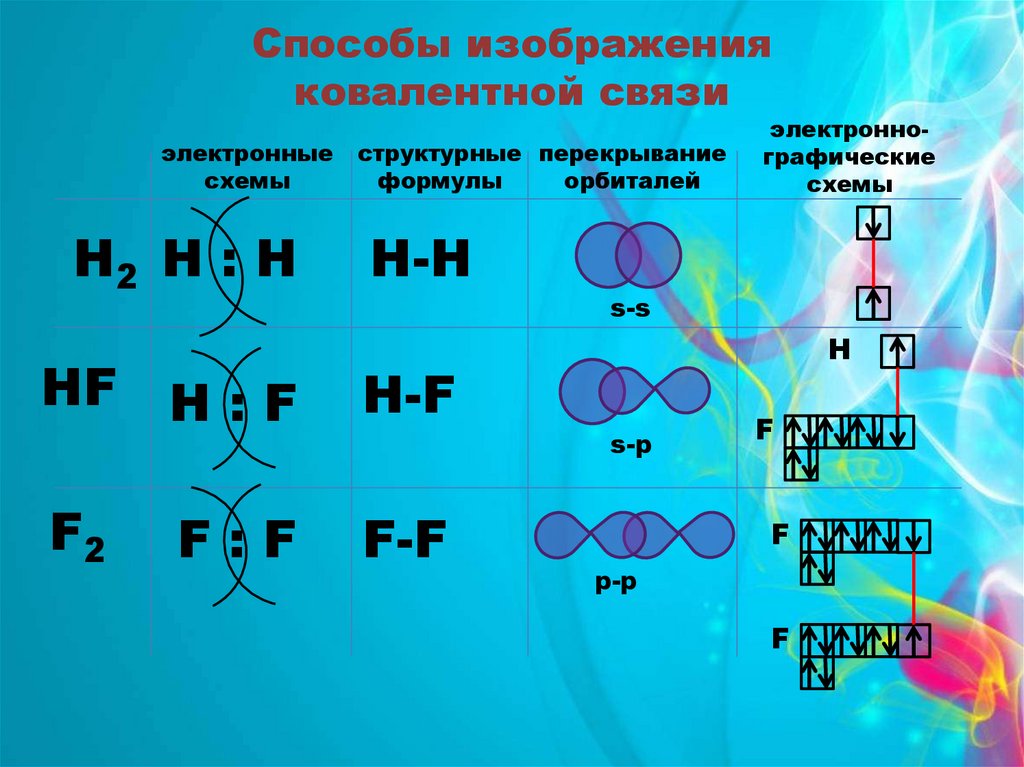
Способы изображенияковалентной связи
электронные
схемы
Н2 Н : Н
структурные перекрывание
формулы
орбиталей
Н-H
s-s
НF Н : F
Н-F
F2
F-F
F:F
электроннографические
схемы
H
s-p
F
F
p-p
F
13.
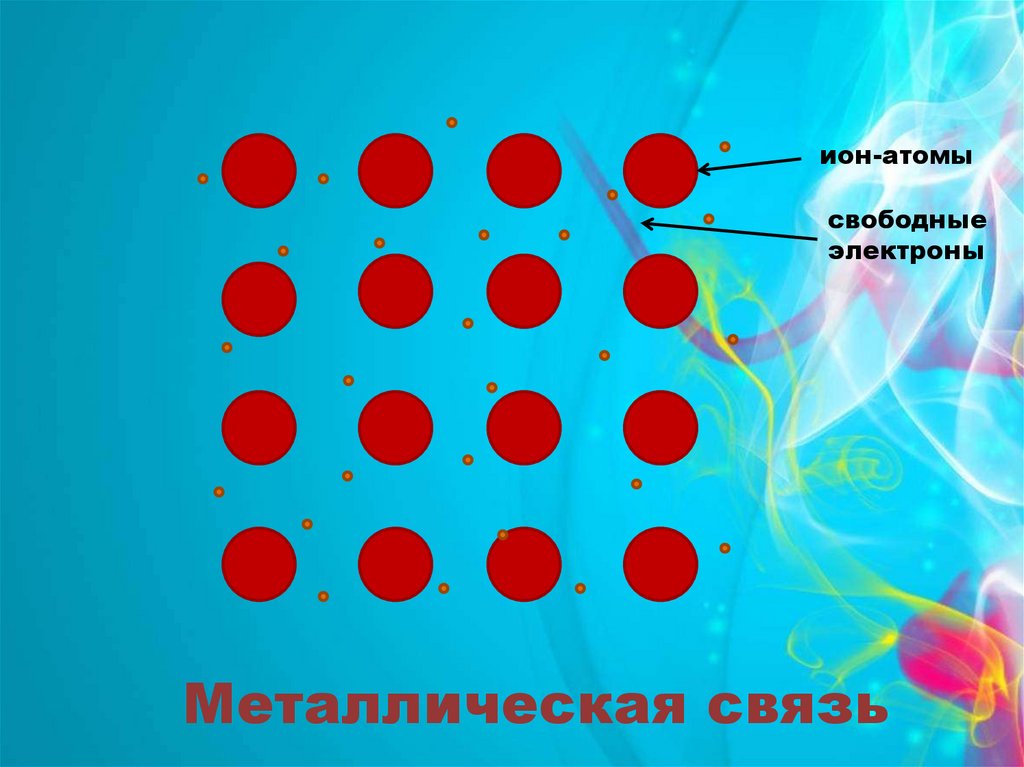
++
+
+
ион-атомы
свободные
электроны
+
+
+
+
+
+
+
+
+
+
+
+
Металлическая связь
14.
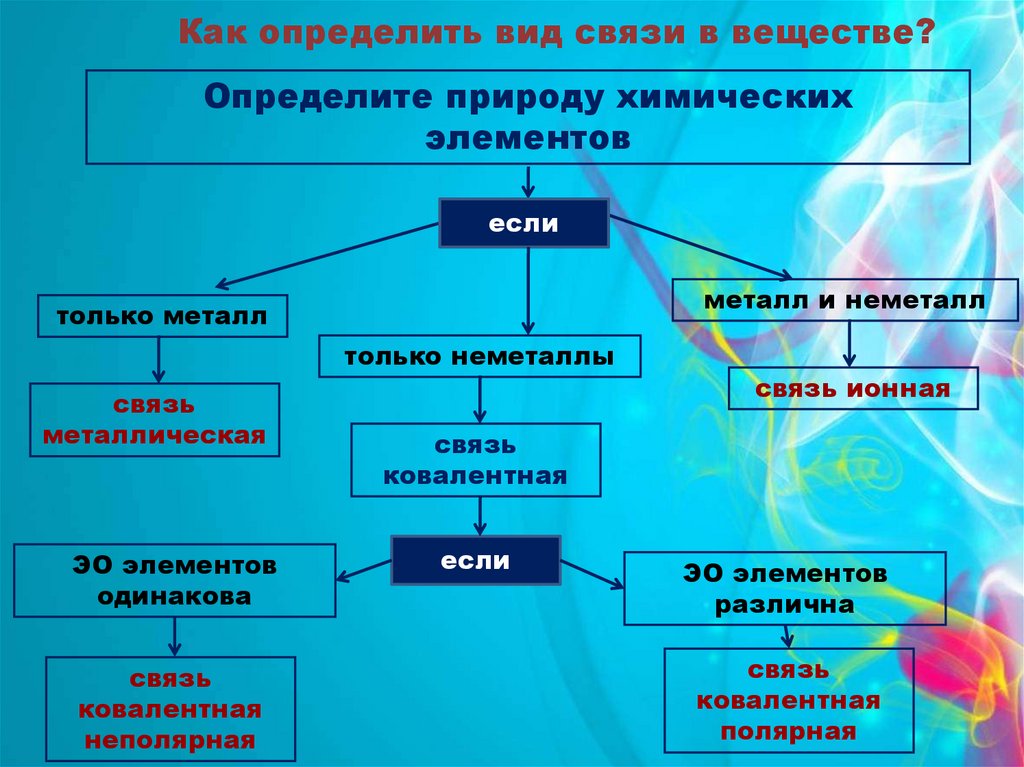
Как определить вид связи в веществе?Определите природу химических
элементов
если
металл и неметалл
только металл
только неметаллы
связь
металлическая
ЭО элементов
одинакова
связь
ковалентная
неполярная
связь ионная
связь
ковалентная
если
ЭО элементов
различна
связь
ковалентная
полярная
15.
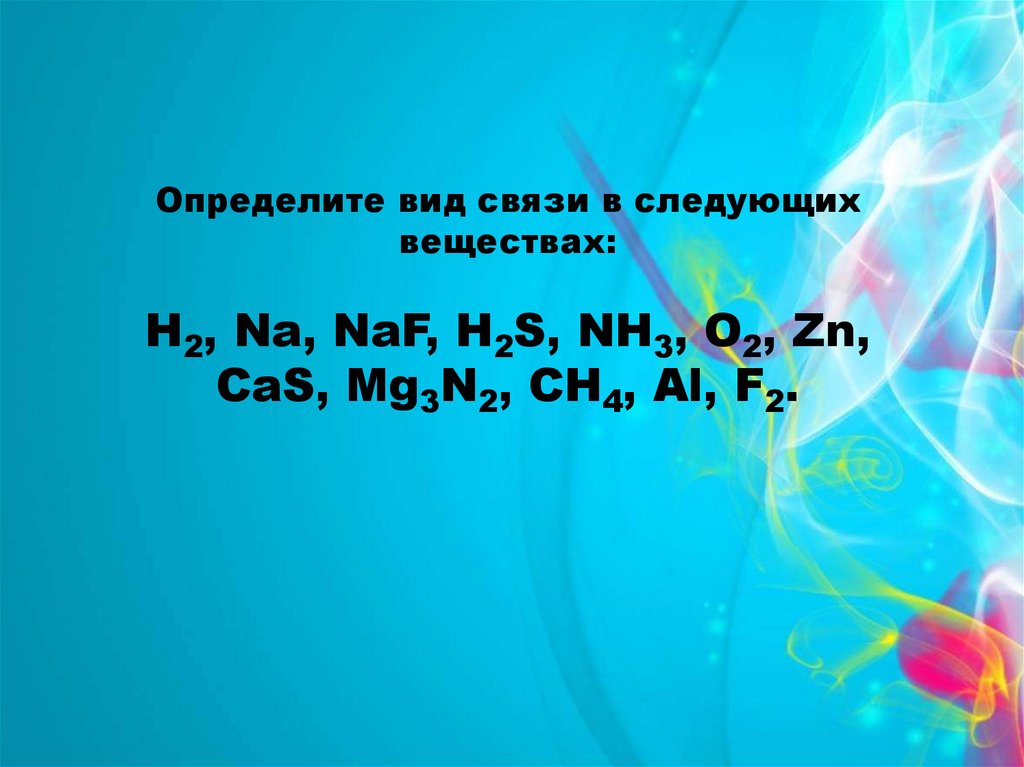
Определите вид связи в следующихвеществах:
Н2, Na, NaF, H2S, NH3, O2, Zn,
CaS, Mg3N2, CH4, Al, F2.
16.
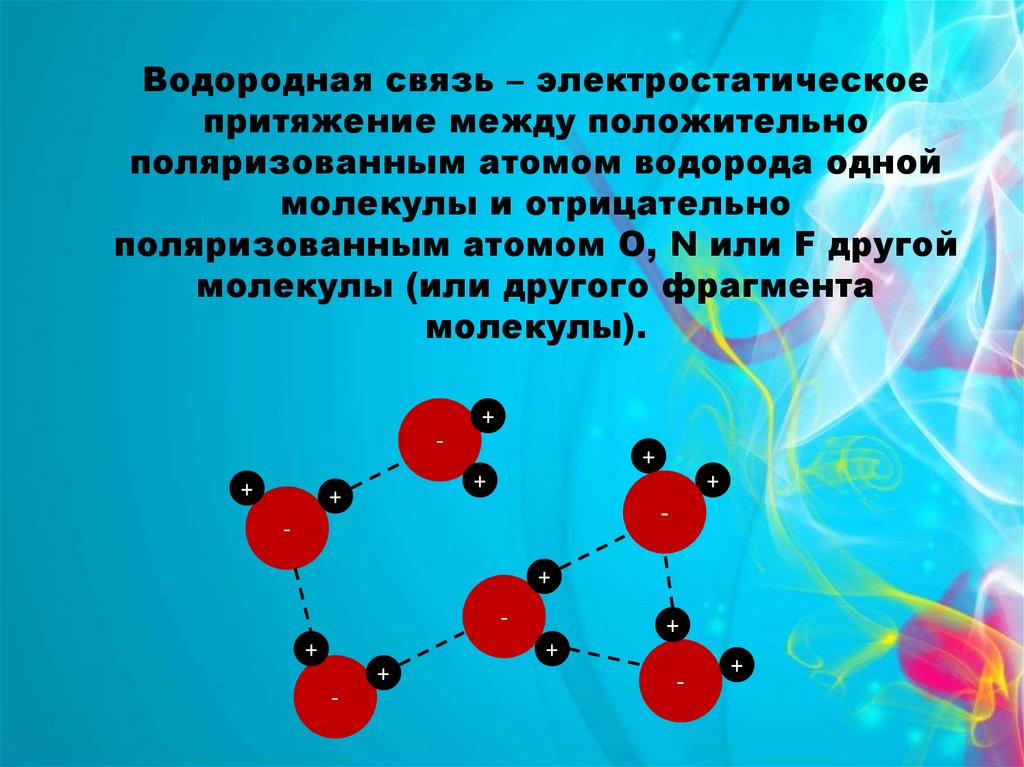
Водородная связь – электростатическоепритяжение между положительно
поляризованным атомом водорода одной
молекулы и отрицательно
поляризованным атомом О, N или F другой
молекулы (или другого фрагмента
молекулы).
+
+
+
+
+
+
-
+
+
-
+
+
+
-
+





 Химия
Химия








