Похожие презентации:
Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции
Окислительновосстановительныереакции
Учитель: Крутто Любовь Семеновна
ЛИКТ 590
2. Цели и задачи урока:
Дать определение данному типуреакций
Показать алгоритм записи о-в реакции
Дать понятия процессов окисления и
восстановления
Дать классификацию о-в реакциям
Закрепить изученный материал
3. Содержание
Роль ОВР в современном миреОсновные понятия
Расчет степени окисления
Творческое задание
Домашнее задание
Сочиняют дети
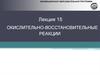
4. Роль ОВР в современном мире
ОВРВ природе
Дыхание, усвоение
CO2, фотосинтез
Обмен веществ
в живых организмах
Коррозия
Брожение и гниение
В жизнедеятельности
человека
Сгорание топлива
Электролиз и
выплавка металлов
Гальванические и
топливные элементы
Получение кислот,
щелочей
5. Основные понятия
окислительно-восстановительнаяреакция
степень окисления
окислитель
восстановитель
процесс окисления-восстановления
6. Расчет степени окисления Следует запомнить:
1.2.
Степени окисления атомов в простых веществах
равны нулю:
Na0; H20
Алгебраическая сумма степеней окисления всех
атомов, входящих в состав молекулы, всегда равна
нулю
3.
Постоянную степень окисления
в сложных
веществах имеют атомы:
-щелочных металлов (+1)
K+1CI, Li+1NO3
-щелочноземельных металлов (+2) Ca+2CO3
-водорода (+1)
H2+1SO4
-кислорода (-2)
H2O-2
7. Расчет степени окисления
1. Для веществ из двух элементов:-поставить постоянную степень окисления
CO-2
-рассчитать степень окисления другого элемента:
сумма степеней окисления должна быть равна 0,
поэтому степень окисления атома C также будет равна 2,
но иметь противоположный знак, т.е. +
-поставить вторую степень окисления
C+2O-2
-выполнить упражнения:
определить степени окисления элементов в следующих
веществах
NaCI; CaBr2; MgO; H2S
8. Расчет степени окисления
2.Для веществ из трех и более элементов:-поставить постоянные степени окисления
H+1MnO4-2
-рассчитать степень окисления марганца
сумма положительных степеней окисления равна 1
сумма отрицательных степеней окисления равна 8
так как эти суммы должны быть равны, то на атом марганца
приходится 7 положительных СО
-поставить рассчитанную степень окисления
H+1Mn+7O4-2
-выполнить упражнения:
определить степени окисления элементов в следующих
веществах
H2MnO4, H2SO4, HNO3, KCIO3
9. Творческое задание: ОВР в технике и жизни
Задание для двух команд:Внимательно изучить представленную на слайде информацию,
показывающую процессы и предметы, в которых или с помощью
которых могут протекать окислительно-восстановительные
реакции в природе или в технике.
Используя текстовый вариант схемы и форму для заполнения,
следует:
-отнести каждый пронумерованный фрагмент рисунка к
определенному типу ОВР (фотосинтез, сгорание топлива…)
-охарактеризовать этот тип (приносит пользу, приносит вред, или
то и другое)
-написать известные ОВ-реакции
-сделать вывод о преобладающем типе ОВР
-сделать выводы о преобладании пользы или вреда от ОВР.
10. Творческое задание
14
2
8
43
6
3
Творческое
задание
10
9
11
7
5
15
14
16
22
12
17
NH3 13
19
18
21
24
20
26
25
29
27
28
30
23
34
31
36
32
37
38
11. Домашнее задание
1. §57,59,61 – учебника 8 класса№10.40-10.42 , Хомченко И.Г.
«Сборник задач и упражнений по химии»
2. Тренировочные задания размещены по адресу:
http://wiki.likt590.ru/doku.php/likt:ximija:krutto_l.s
Выполнить задания по разделу ОВР, прислать
ответы по адресу: [email protected]
12. Сочиняют дети….
Окислитель, как отъявленныйзлодей,
Как пират, бандит, агрессор,
Бармалей,
Отнимает электроны - и OK!
Потерпев урон, восстановитель
Восклицает: "Вот я! Помогите!
Электроны мне мои верните!"
Но никто ему не помогает
И тем более ущерб не возмещает.
13. Окислительно-восстановительные реакции
Окислительновосстановительные реакцииРеакции, протекающие с изменением
степени окисления, называются
окислительно-восстановительными
реакциями.
0
+2
0
+2
Cu + Hg(NO3)2 = Hg + Cu(NO3)2
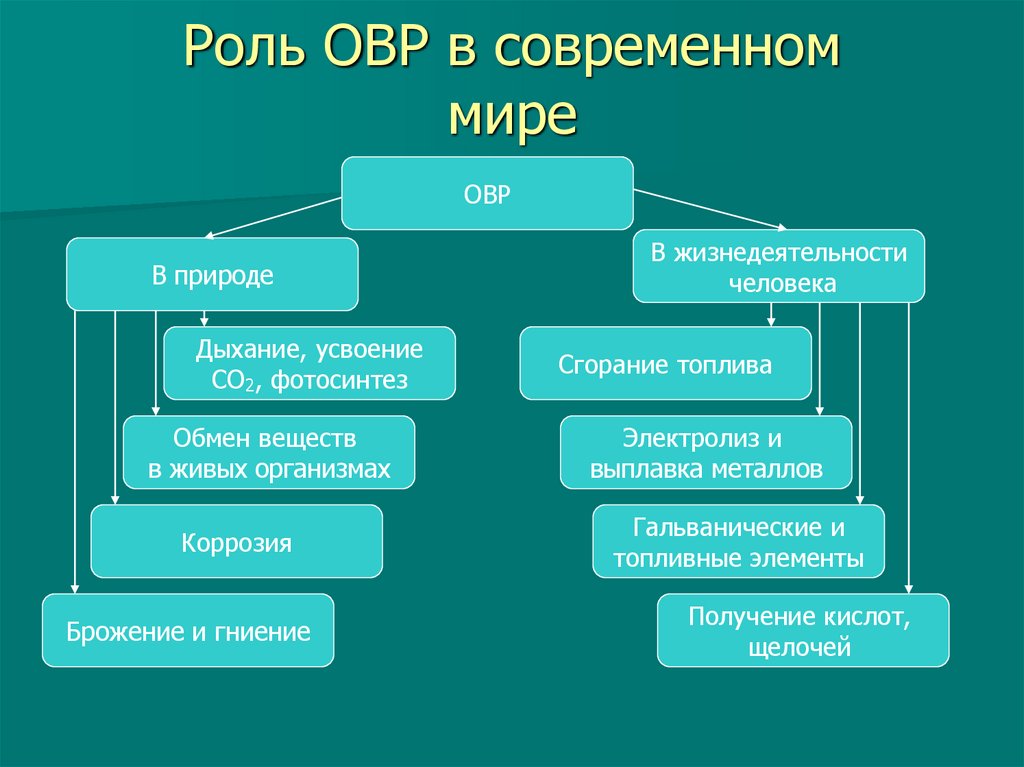
14. Степень окисления (СО)
Степень окисления – это условный зарядатома в соединении, вычисленный исходя
из предположения, что соединение состоит
только из ионов.
15. Окислитель
-Частица (атом, ион), которая в ходеокислительно-восстановительного
процесса принимает электроны
называется окислителем
-Простые вещества - неметаллы
обладают большими
окислительными свойствами,
чем металлы
-Типичные окислители
16. Типичные окислители
К ним относятся многиесложные
и
KClO3,
H2SO4 (конц.),
HNO3,
KMnO4,
MnO2,
K2Cr2O7,
PbO2 и др.
простые вещества
F2,
Cl2,
O2,
17. Восстановитель
Частица (атом, ион), которая в ходеокислительно-восстановительного
процесса отдает электроны, называется
восстановителем
Типичные восстановители
18. Типичные восстановители
К ним также относятсяпростые
и
сложные вещества
H2,
KI,
C (графит),
HCl (конц.),
Zn,
H2S,
Al,
CO и др.
Ca,
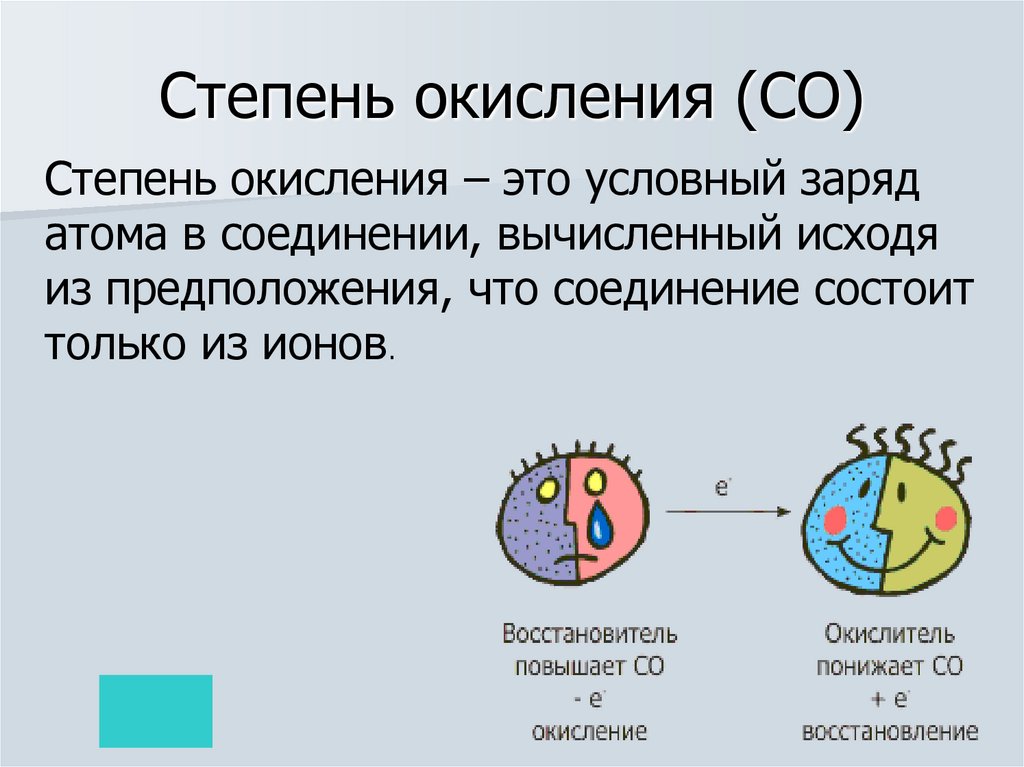
19. Окисление-восстановление
Окислением называется процессотдачи атомом, молекулой или
ионом электронов. Степень
окисления при этом повышается
окисление
Восстановлением называется
процесс присоединения электронов
атомом, молекулой или ионом.
Степень окисления при этом
понижается.
восстановление
20. Окисление-процесс отдачи электронов
0+2
Cu – 2 e- = Cu
При окислении степень окисления
элемента повышается,а элемент является
восстановителем
21.
Восстановление –процессприсоединения электронов
+2
0
Hg + 2 e- = Hg
При восстановлении степень окисления
элемента понижается, а элемент является
окислителем.


















 Химия
Химия