Похожие презентации:
Углеводы: простые и сложные. Строение, свойства и биологическая роль
1. Ставропольский государственный медицинский университет кафедра общей и биологической химии
ЛекцияУглеводы: простые и сложные.
Строение , свойства и биологическая роль
2. План лекции
• Углеводы. Классификация. Биологическая роль.• Моносахариды. Стереоизомерия. Циклооксотаутомерия моносахаридов.
• Химические свойства моносахаридов.
Биологическая роль.
• Сложные углеводы олигосахариды
(дисахариды).Строение, биологическая роль.
• Сложные углеводы: гомо-и гетерополисахариды
3.
Общая характеристика углеводовУглеводы – природные соединения, имеющие в подавляющем
большинстве состав Cх(H2O)у.
Это альдегиды или кетоны многоатомных спиртов или продукты
их поликонденсации.
● входят в состав клеток и тканей всех растительных и
животных организмов;
● по массе составляют основную часть органического
вещества на Земле (80% сухого вещества растений).
4.
Основные функции углеводов● источник энергии в метаболических процессах (в растениях
– крахмал, в животных организмах – гликоген)
! При сгорании 1 моль глюкозы выделяется
3060 Дж энергии
Суточная потребность в углеводах для человека достигает 50% от всей
суточной калорийности рациона и приблизительно составляет
300—500 г для здорового мужчины и
250—450 г — для женщины.
5.
Основные функции углеводов● структурные компоненты клеточных стенок
растений (целлюлоза), бактерий (мурамин),
грибов (хитин);
● составные элементы жизненно важных веществ
(нуклеиновые кислоты, коферменты, витамины);
● выполняют защитную функцию (поддержание
иммунитета организма, н-р, тиреотропный
гормон-гликопротеин)
6. Основные функции углеводов
● моно- и полисахариды- основалекарственных препаратов
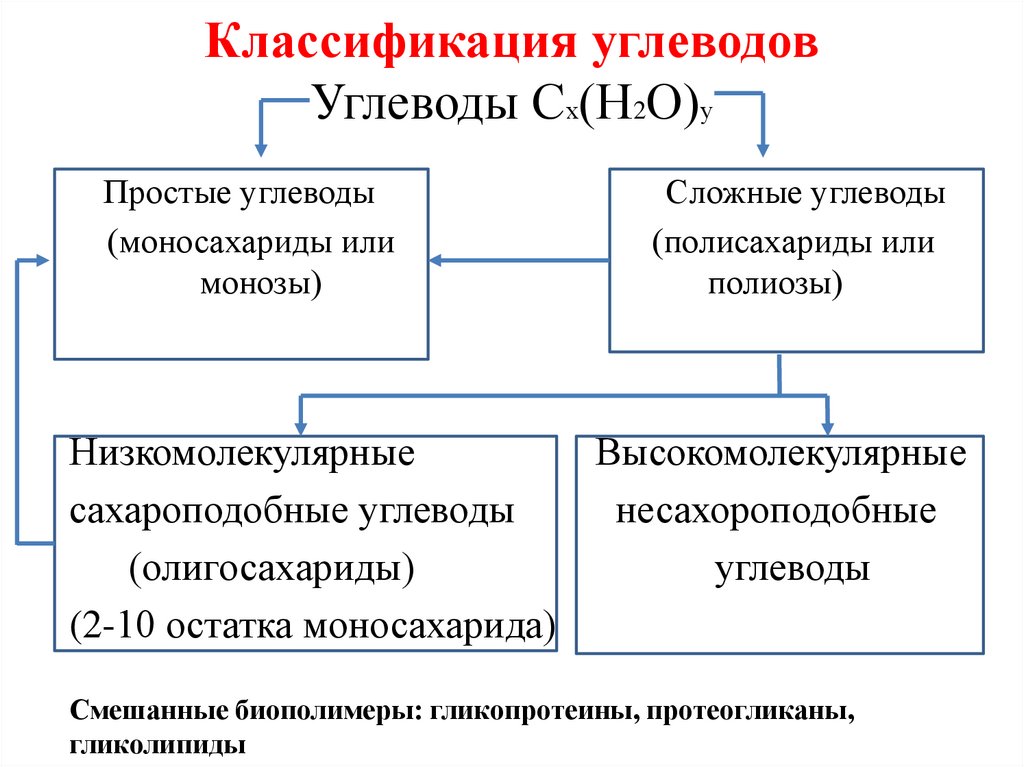
7. Классификация углеводов Углеводы Сх(Н2О)у
Простые углеводы(моносахариды или
монозы)
Сложные углеводы
(полисахариды или
полиозы)
Низкомолекулярные
Высокомолекулярные
сахароподобные углеводы
несахороподобные
(олигосахариды)
углеводы
(2-10 остатка моносахарида)
Смешанные биополимеры: гликопротеины, протеогликаны,
гликолипиды
8.
Моносахариды (монозы) CnH2nOn ,где n > 3
– это полигидроксикарбонильные соединения, в которых
каждый атом углерода (кроме >С=O - карбонильного)
связан с группой ОН.
Моносахариды – это альдегиды и кетоны многоатомных
спиртов.
9.
Классификация моносахаридов–открытые формы:
● По числу атомов углерода в цепи (триозы С3, тетрозы
С4, пентозы С5, гексозы С6).
● На основании природы функциональной группы (альдозы
, кетозы).
● С учётом обоих классификационных признаков
(альдогексозы, кетогексозы, альдопентозы, кетопентозы
и т.д.).
10.
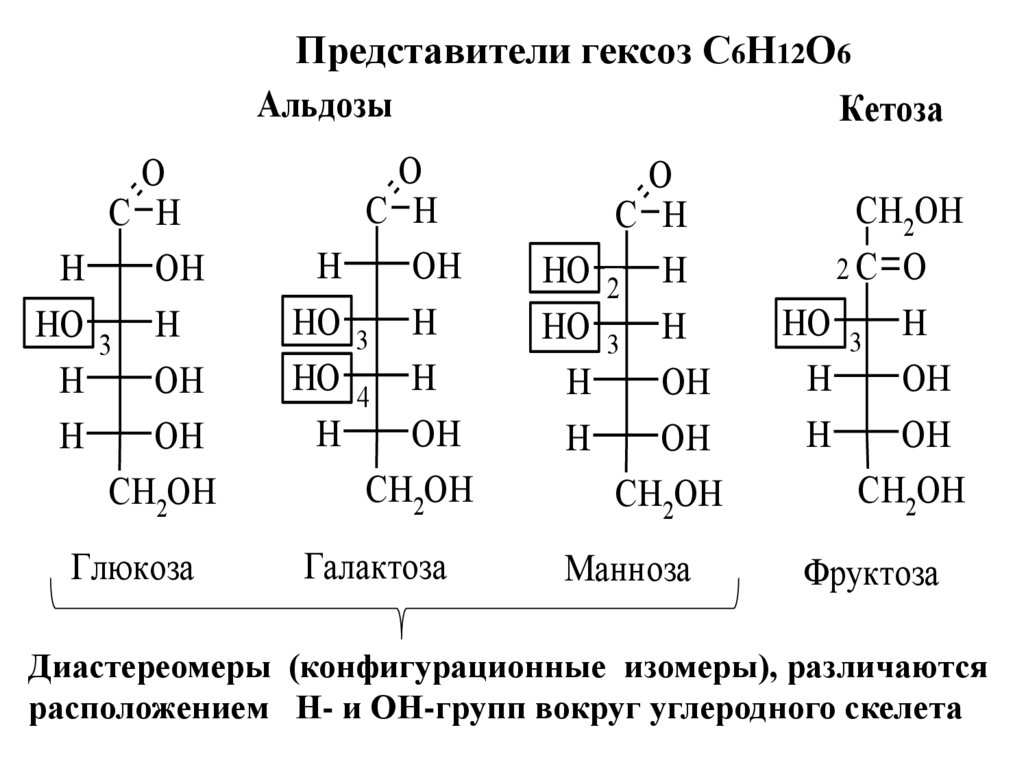
Представители гексоз С6Н12О6Альдозы
Кетоза
H
HO
H
H
O
C H
OH
H
3
OH
OH
CH2OH
Глюкоза
H
HO
HO
H
O
C H
OH
H
3
H
4
OH
CH2OH
Галактоза
HO
HO
H
H
O
C H
H
2
H
3
OH
OH
CH2OH
Манноза
CH2OH
2C O
HO 3 H
H
OH
H
OH
CH2OH
Фруктоза
Диастереомеры (конфигурационные изомеры), различаются
расположением Н- и ОН-групп вокруг углеродного скелета
11.
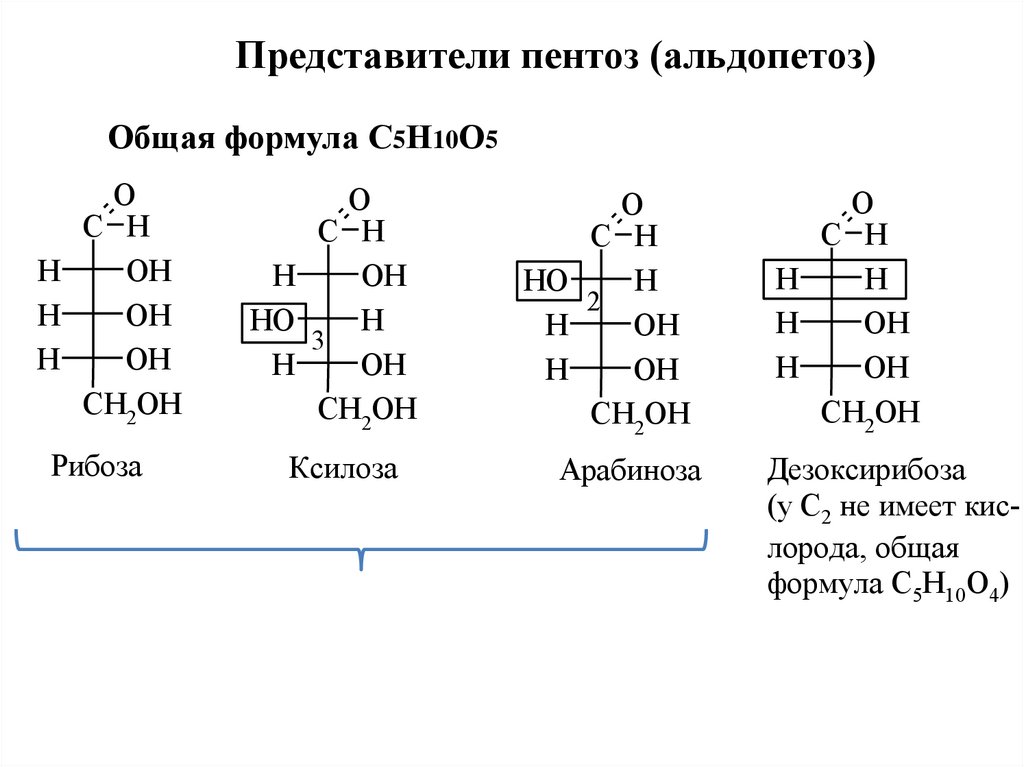
Представители пентоз (альдопетоз)Общая формула С5Н10О5
O
C H
H
OH
H
OH
H
OH
CH2OH
Рибоза
O
C H
H
OH
HO
H
3
H
OH
CH2OH
Ксилоза
O
C H
HO
H
2
H
OH
H
OH
CH2OH
Арабиноза
O
C H
H
H
H
OH
H
OH
CH2OH
Дезоксирибоза
(у С2 не имеет кислорода, общая
формула С5Н10О4)
12.
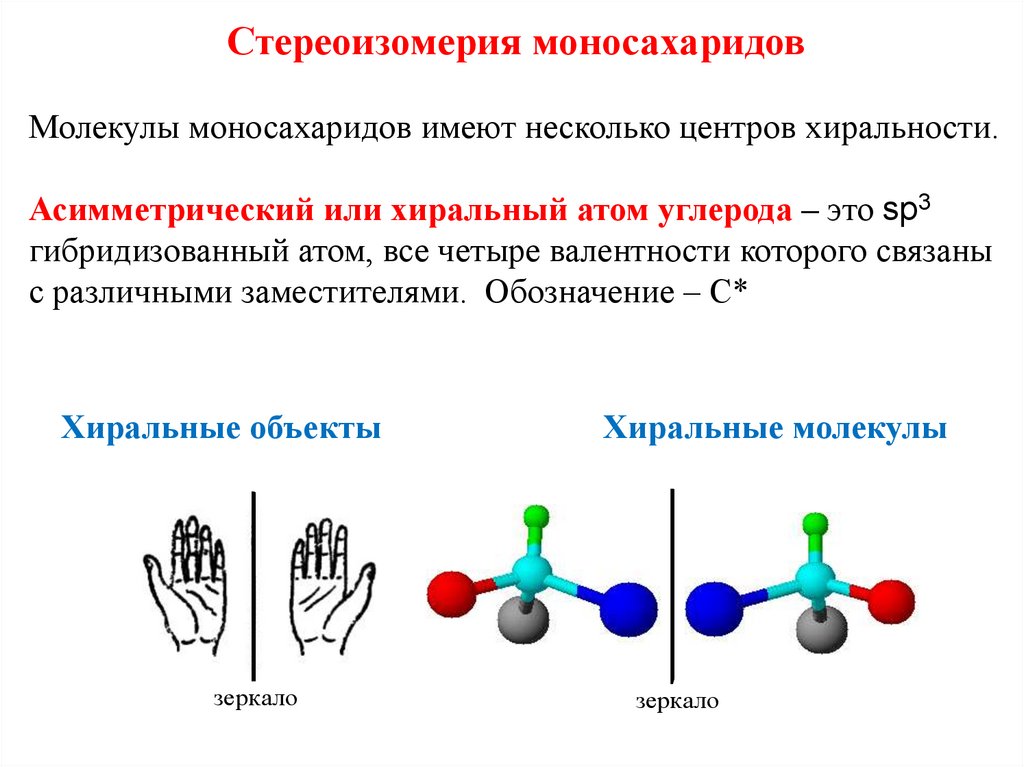
Стереоизомерия моносахаридовМолекулы моносахаридов имеют несколько центров хиральности.
Асимметрический или хиральный атом углерода – это sp3
гибридизованный атом, все четыре валентности которого связаны
с различными заместителями. Обозначение – С*
Хиральные объекты
зеркало
Хиральные молекулы
зеркало
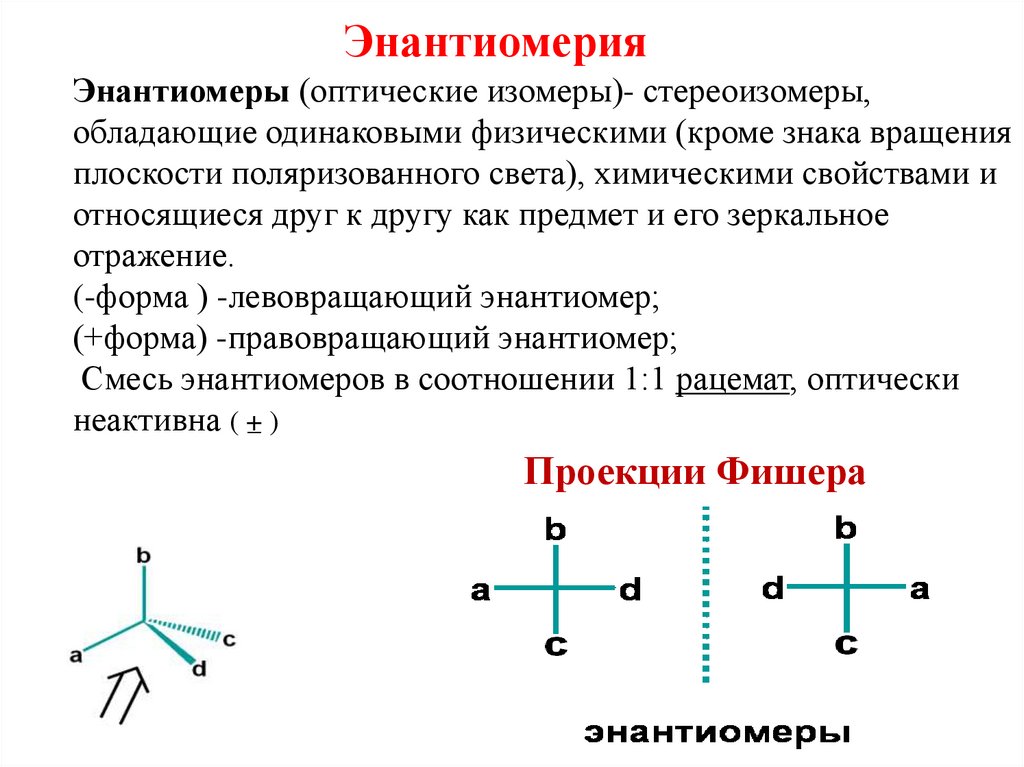
13. Энантиомерия Энантиомеры (оптические изомеры)- стереоизомеры, обладающие одинаковыми физическими (кроме знака вращения
плоскости поляризованного света), химическими свойствами иотносящиеся друг к другу как предмет и его зеркальное
отражение.
(-форма ) -левовращающий энантиомер;
(+форма) -правовращающий энантиомер;
Смесь энантиомеров в соотношении 1:1 рацемат, оптически
неактивна ( +– )
Проекции Фишера
14.
Абсолютная и относительная конфигурацияАбсолютная конфигурация — это истинное расположение в
пространстве заместителей при каждом асимметрическом
атоме молекулы. Определяется метод рентгеноструктурного
анализа с последующей расшифровкой спектров
(Бийо, 1951)
Относительная конфигурация — это взаимное расположение
заместителей при разных асимметрических атомах по
отношению друг к другу. Используют при написании формул
(сравнение со стандартом)
15.
Кофигурационный стандарт глицериновый альдегид(Розанов М.А.,1906 г)
Формулы Фишера
O
H
C
H
O
H
Хиральный
центр
OH
CH2-OH
C
HO
H
CH2-OH
Функциональная – ОН группа
Функциональная– ОН группа
хирального центра
находится справа–D –форма
хирального центра
находится слева –L- форма
D ( + ) - глицериновый альдегид
α = + 8,7
L ( - )- глицериновый альдегид
α = - 8,7
Знак вращения определяется экспериментально и не имеет прямой связи
с конфигурацией : в D ряду есть как ( + ), так и ( - ) вращающие вещества.15
16.
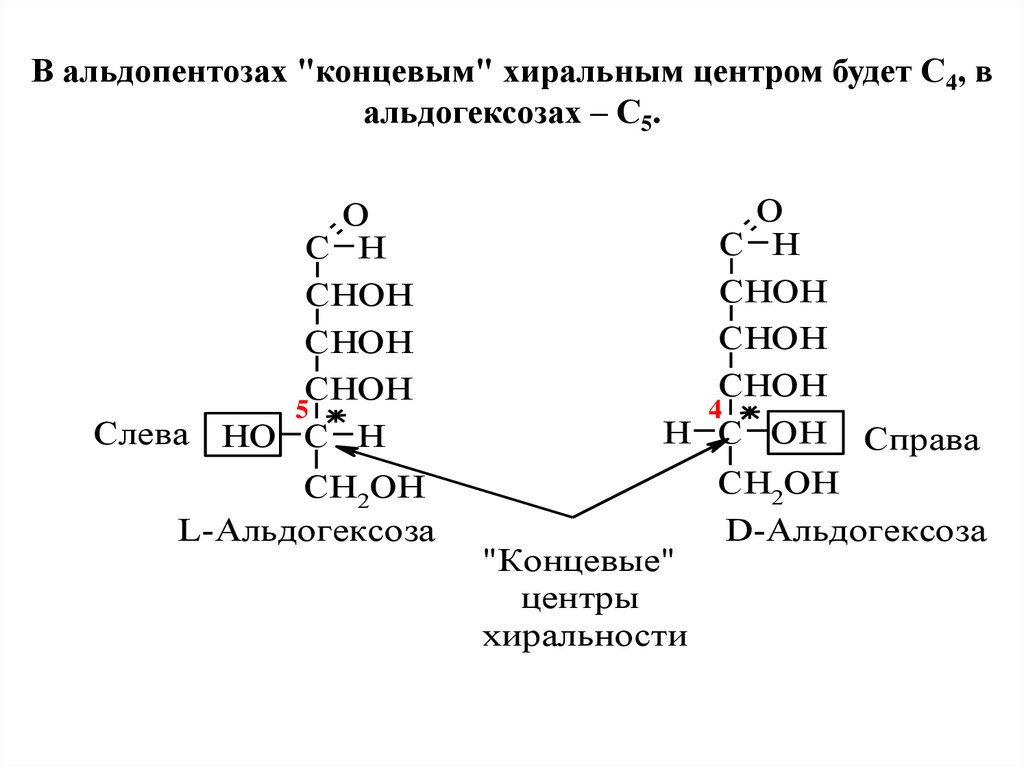
В альдопентозах "концевым" хиральным центром будет С4, вальдогексозах – С5.
Слева
O
C H
CHOH
CHOH
CHOH
5
HO C H
CH2OH
L-Альдогексоза
O
C H
CHOH
CHOH
CHOH
4
H C OH
"Концевые"
центры
хиральности
Справа
CH2OH
D-Альдогексоза
17.
Стереоселективные реакцииреакции, в результате которых образуетсяисключительно (или с небольшим преобладанием)
только один из возможных стереоизомеров
(энантиомеров)
Подавляющее большинство природных
моносахаридов принадлежит к D-ряду. Живые
организмы не "узнают" и не умеют использовать Lглюкозу.
18.
Диастереомерия углеводовФормула Фишера: N =2n , где
где N-число стереоизомеров, n-число центров хиральности
Альдогексоза СН2ОН(*СНОН)4СНО n=4,
N= 24 , 16 стереоизомеров т.е. 8 пар энантиомеров
Кетогексоза n=3, N= 23 8 стереоизомеров, 4пары энантиомеров
Диастереоизомеры- пространственные изомеры с
несколькими хиральными центрами, часть которых имеет
одинаковую конфигурацию. Имеют разные физические,
химические свойства и физиологическое действие.
19.
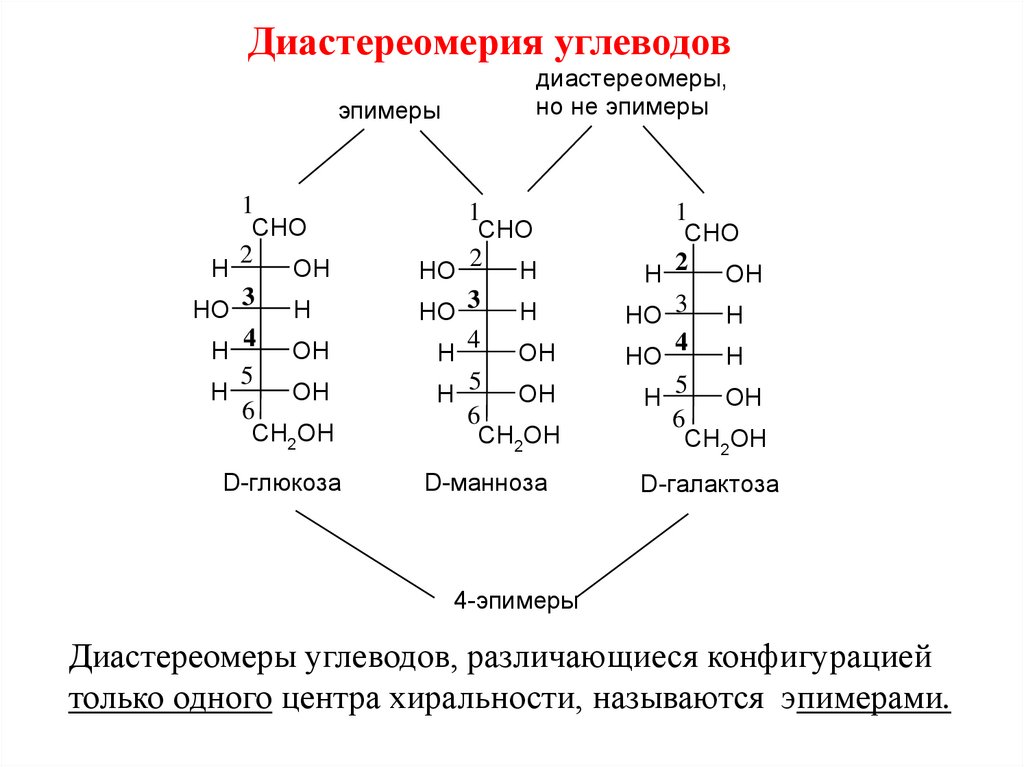
Диастереомерия углеводовэпимеры
1
CHO
2
H
OH
3 H
HO
4
H
OH
5
H
OH
6
CH2OH
D-глюкоза
диастереомеры,
но не эпимеры
1
CHO
2
HO
H
HO 3
H
4
H
OH
5
H
OH
6
CH2OH
D-манноза
1
CHO
H 2 OH
HO 3
H
HO
H
4
H
5 OH
6
CH2OH
D-галактоза
4-эпимеры
Диастереомеры углеводов, различающиеся конфигурацией
только одного центра хиральности, называются эпимерами.
20.
Цикло-оксо (цикло-цепная) таутомерия ианомерныеформы глюкозы
Моносахариды могут существовать в циклической форме.
Впервые предположение о циклическом строении глюкозы А.А.
Колли (1870 г.), а затем развито немецким ученым Б. Толленсом
(1883 г.).
А.А. Колли (1840- 1916г.г.
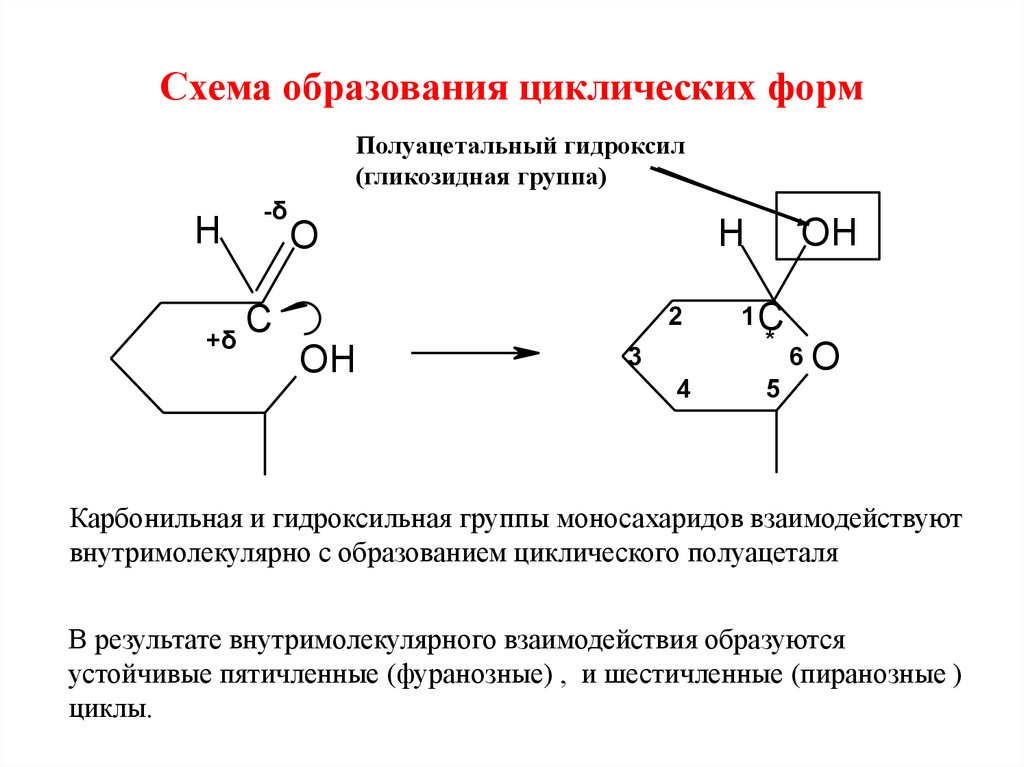
21.
Схема образования циклических формПолуацетальный гидроксил
(гликозидная группа)
H
-δ
C
+δ
2
OH
OH
H
O
3
4
1C
*
6O
5
Карбонильная и гидроксильная группы моносахаридов взаимодействуют
внутримолекулярно с образованием циклического полуацеталя
В результате внутримолекулярного взаимодействия образуются
устойчивые пятичленные (фуранозные) , и шестичленные (пиранозные )
циклы.
21
22. Аномерный атом углерода. α-,β-аномеры
В случае образования циклического полуацеталявозникает дополнительный центр хиральности у С1аномерный атомом углерода.
Два образующихся σ-диастереомера называются
α-,β-аномеры
23.
Формулы ФишераГликозидная ОН-группа
справа
H
H
HO
H
H
OH
1C
OH
H O
OH
5
CH2OH
-D-глюкопираноза
(циклическая )
слева
H
O
HO
1C
H
HO
H
H
OH
H
OH
5
OH
CH2OH
D-глюкоза
(открытая форма)
H
1C
H
HO
H
H
OH
H O
OH
CH2OH
-D-глюкопираноза
(циклическая )
24.
Формулы ФишераГликозидная ОН-группа
H
H
HO
H
H
OH
1C
OH
H O
4
OH
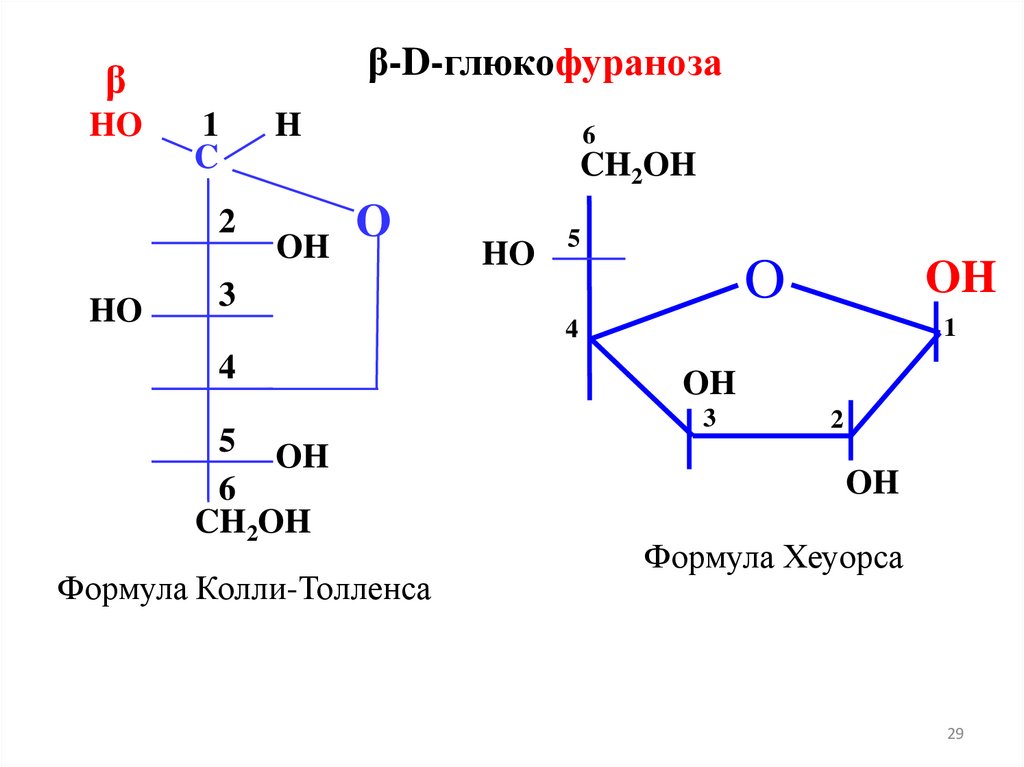
CH2OH
-D-глюкофураноза
(циклическая )
H
H
HO
H
H
O
HO
1C
OH
H
OH
4
OH
CH2OH
D-глюкоза
(открытая форма)
H
1C
H
HO
H
H
OH
H O
4
OH
CH2OH
-D-глюкофураноза
(циклическая )
25.
Циклические перспективныеФормулы Хеуорса
5
O
4
O
O
пиран
фуран
O
1
3
4
2
Пиранозный цикл
1
3
2
Фуранозный цикл
Полуацетальный гидроксил
Полуацетальный гидроксил
под плоскостью цикла
над плоскостью цикла
26.
Правила изображения формул Хеуорса• атом кислорода располагается в дальнем правом углу
(пиразнозн) и вверху по центру (фуран);
• заместители, находящиеся в формулах Фишера или
Колли-Толенса), слева располагаются над плоскостью
оксидного цикла, а находящиеся справа – под
плоскостью;
• СН2ОН-для D-ряда располагается над плоскостью
27.
α-D-глюкофуранозаH
1
C
2
HO
OH
OH
α
6
CH2OH
O
3
4
5
OH
6
CH2OH
Формула Колли-Толленса
HO
5
O
4
1
OH
OH
3
2
OH
Формула Хеуорса
27
28.
HHO
OH
α
2 OH
O
1
C
α-D-глюкопираноза
6
CH2OH
3
4 OH
5
6
CH2OH
Формула Колли-Толленса
5
4
HO
O
1
OH
3
2
OH
OH
Формула Хеуорса
28
29.
β-D-глюкофуранозаβ
HO
1
C
2
HO
H
6
CH2OH
OH
O
HO
5
O
3
OH
1
4
4
5 OH
6
CH2OH
Формула Колли-Толленса
OH
3
2
OH
Формула Хеуорса
29
30.
ГалактозаАНОМЕРЫ
С
α,D(+)галактопираноза
он
О
Н
Н
С
HO
C
H
НО
C
Н
H
C
OH
ОН
С Н ОН
2
β,D(+)-галактопираноза
31.
МутаротацияМутаротация – изменение удельного вращения растворов УВ
во времени. При растворении моносахарид из одной
циклической формы может перейти в другую, но только через
открытую.
β- глюкопираноза
α = + 19°
D – глюкоза
равнов. α = 52.5°
смесь таутомеров
α- глюкопираноза
α = + 112°
31
32.
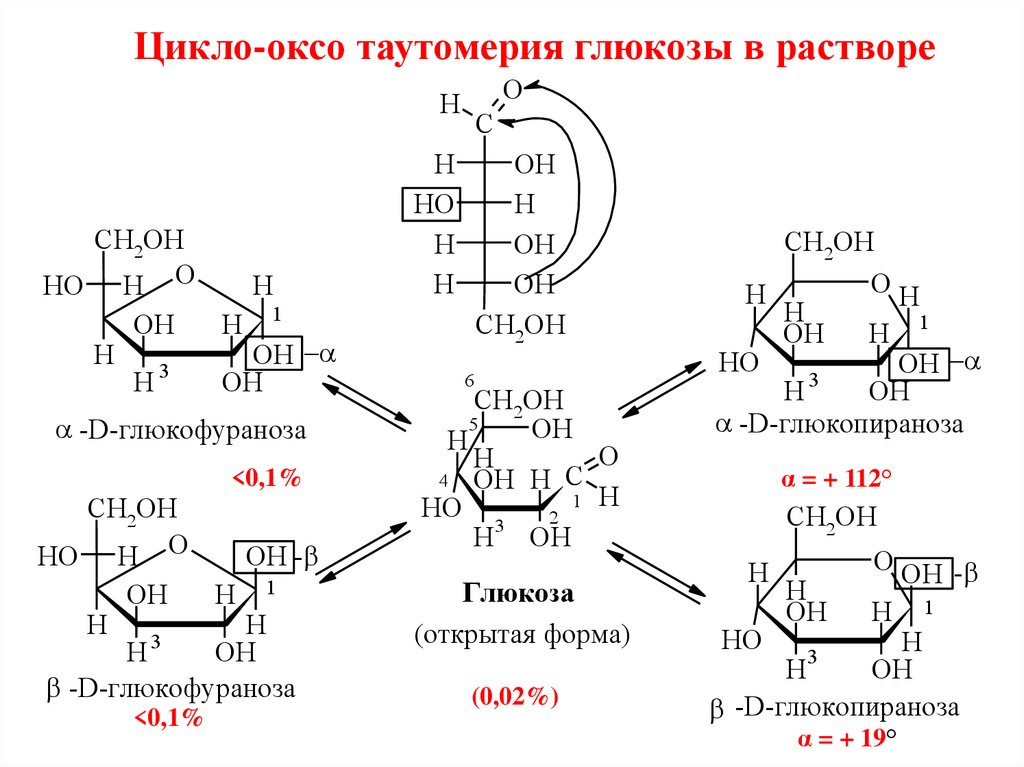
Цикло-оксо-таутомерия моносахаридовЦикло-оксо-таутомерия (кольчато-цепная таутомерия)явление существования циклических (окси-) и
нециклических (оксо-) форм моносахаридов, способных
свободно переходить друг в друга
Таутомеры - изомеры, взаимно переходящие друг в друга и
находящиеся в состоянии динамического равновесия.
33.
Цикло-оксо таутомерия глюкозы в раствореO
H
CH2OH
HO H O
H
OH
H 1
H
OH
3
H
OH
-D-глюкофураноза
<0,1%
CH2OH
HO H O
OH -
OH
H 1
H
H
3
H
OH
-D-глюкофураноза
<0,1%
C
H
HO
H
H
OH
H
OH
OH
CH2OH
6
CH2OH
5
OH
H
O
H
4 OH H С
1 H
HO
2
3
H OH
Глюкоза
(открытая форма)
(0,02%)
CH2OH
OH
H
H
OH
H 1
HO
OH
3
H
OH
-D-глюкопираноза
α = + 112°
CH2OH
O OH -
H
OH
H 1
HO
H
3
H
OH
-D-глюкопираноза
H
α = + 19°
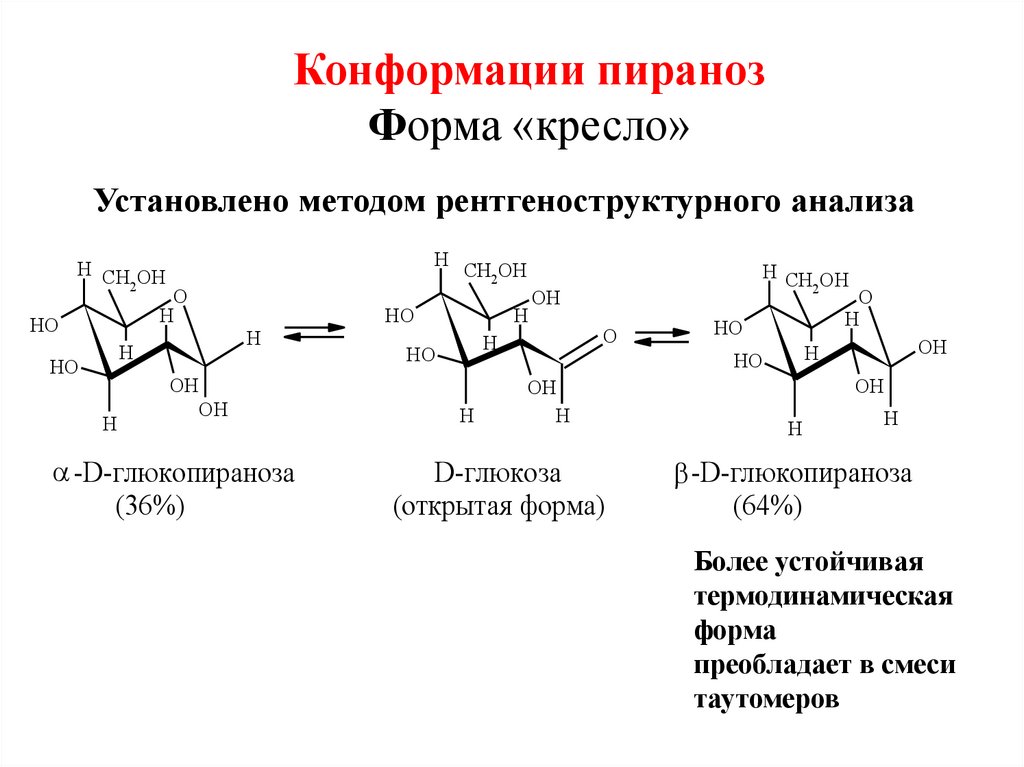
34. Конформации пираноз Форма «кресло»
Установлено методом рентгеноструктурного анализаH
H CH OH
2
O
H
HO
H
HO
H
H
OH
OH
-D-глюкопираноза
(36%)
CH2 OH
HO
H
OH
H
HO
H
H CH OH
2
O
O
H
HO
OH
H
D-глюкоза
(открытая форма)
OH
H
HO
OH
H
H
-D-глюкопираноза
(64%)
Более устойчивая
термодинамическая
форма
преобладает в смеси
таутомеров
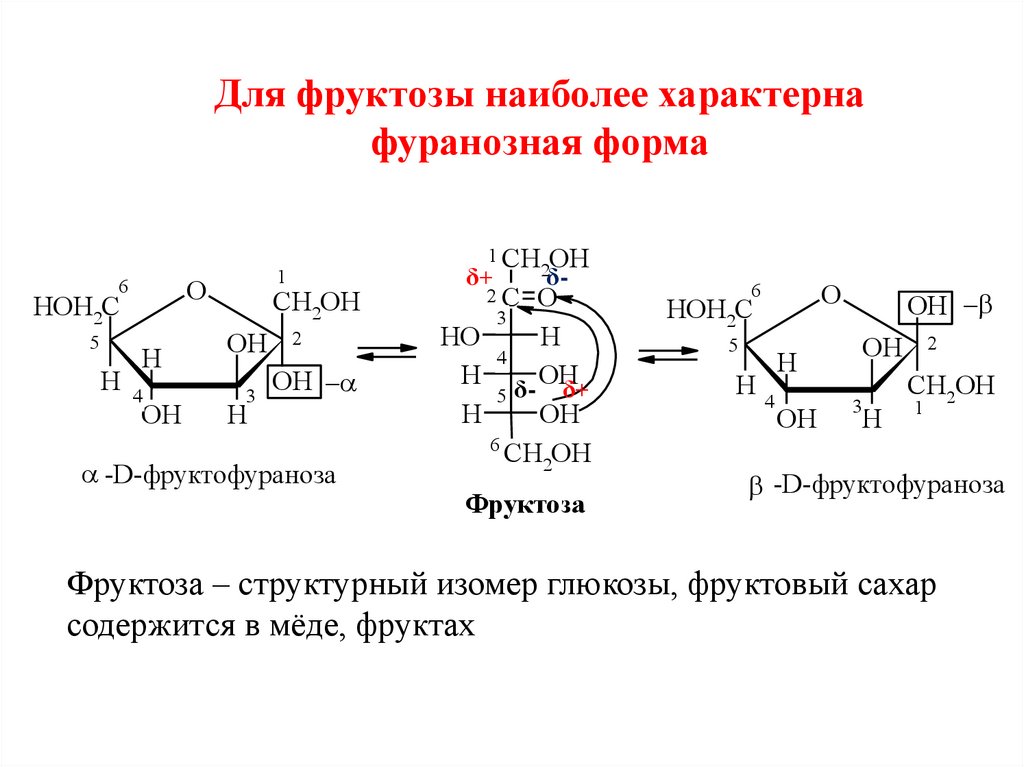
35.
Для фруктозы наиболее характернафуранозная форма
O
6
HOH2C
5
H
H
4
OH
1 CH
1
CH2OH
OH
3
2
OH
H
-D-фруктофураноза
δ+
2C
3
OH
2δ-
O
HO
H
4
H δ- OH
δ+
5
H
OH
6
CH2OH
Фруктоза
O
6
HOH2C
5
H
H
4
OH
OH
2
OH
3
H
CH2OH
1
-D-фруктофураноза
Фруктоза – структурный изомер глюкозы, фруктовый сахар
содержится в мёде, фруктах
36.
Аномерные формы пентоз и цикло-оксо(цикло-цепная) таутомерия
Рибоза (С5Н10О5)
5
O
HOH2C
4
H
H
3
OH
H
1
H
2
OH
OH
-D-рибофураноза
δδ+ O
1C
H
2
H
OH
3
H
OH
4 δδ+
H
OH
5
CH2OH
Рибоза
(открытая форма)
5
O
HOH2C
4
H
H
3
OH
OH
1
H
2
H
OH
-D-рибофураноза
Входит в состав коферментов, РНК, мононуклеотидов, АТФ
Обычно находится в β-форме
37.
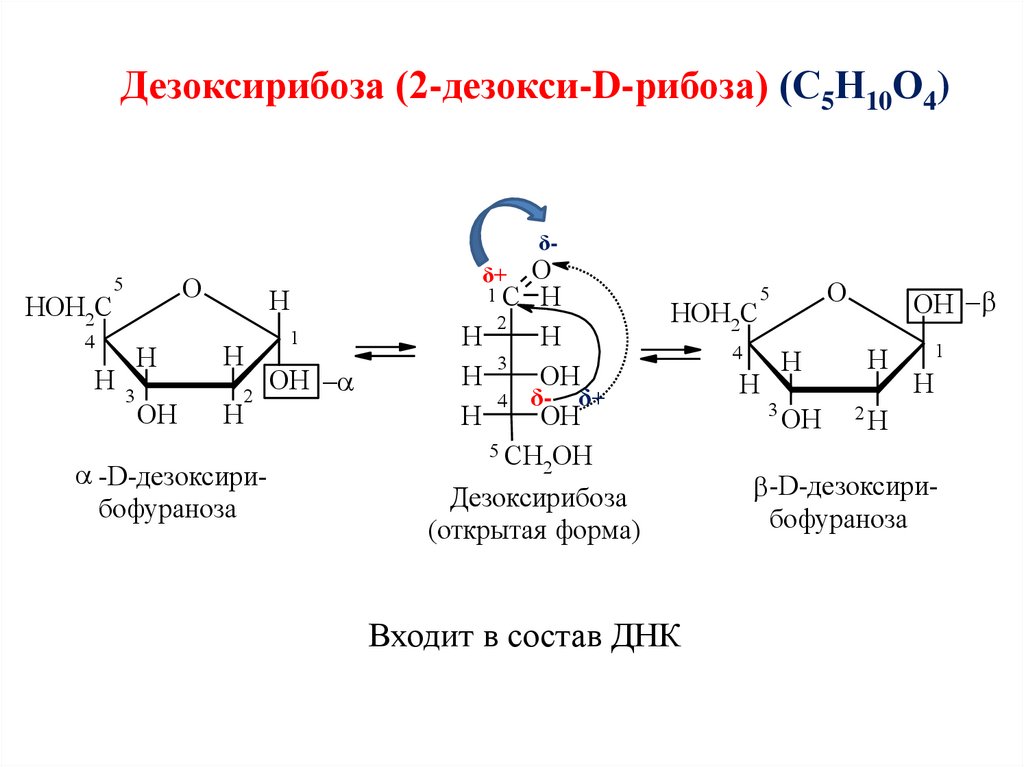
Дезоксирибоза (2-дезокси-D-рибоза) (С5Н10О4)δ-
HOH2C
O
5
4
H
H
3
OH
H
H
2
H
-D-дезоксирибофураноза
O
1C H
2
H
H
3
H
OH
4 δ- δ+
H
OH
5 CH OH
2
Дезоксирибоза
(открытая форма)
δ+
1
OH
HOH2C
Входит в состав ДНК
4
H
O
5
OH
H
H
3
OH
2
1
H
H
-D-дезоксирибофураноза
38.
Химические свойства моносахаридовОбщие :
( > C = O , - OH )
а) на > C = O
б) на ОН- спиртовый
в) на полуацетальный ОН (гликозидную группу)
г) ОВР
Специфические (различают пентозы и гексозы):
а) брожение
б) действие конц. к-т
в) реакция Селиванова
38
39.
1. Образование гликозидов – реакции с участиемполуацетального гидроксила ОНгликозиды – ацетали
гликозильный
остаток
CH2OH
CH2OH
O
O
OH
OH
+
..
CH3OH
HCl сух.
OCH3
OH
+
Н2О
OH
OH
OH
D - глюкопираноза
Полуацетальный
гидроксил
OH
агликон
(не УГЛЕВОД)
О-метил – D - глюкопиранозид
более устойчив β аномер
39
40.
Классификация гликозидовГликозиды
S-гликозиды
С-гликозиды
О-гликозиды
N-гликозиды
O
H
CH2OH
H
N
O
H
OH
OCH3
H
HO
H
H
OH
O-метил- -D-глюкопиранозид
O
HO
CH2
H
H
N
O
H
H
OH
OH
уридин
40
41.
О - гликозиды:Витамины К, Р некоторые лекарственные препараты
(стрептомицин), антибиотики, сердечные гликозиды.
извлекаемые из ландыша наперстянки.
41
42.
2.ОН- спиртовой и ОН- полуацетальный –
образование простых эфиров – алкилирование.
Алкилирующий агент R-Cl
CH2OH
CH2O-СН3
H2C O CH3
H3C O
O OH
H3C O
HO
O OH
O O CH
+
+ 5CH3I (KOH)
H
3 H O; H
H
H
2
H
OH
O CH3 H
O CH3 H
-CH3OH H
H
H
H
H
H
H
OH
H
O CH3
H
O CH3
-D-галактопираноза
Метил-1,2,3,4,6-пента-О-метил--D-галактопиранозид
2,3,4,6-тетра-О-метилD-галактопираноза
43.
3. АминосахараCH2OH
O
H
1
H
OH
OH
H
HO
H
NH2
D-глюкозамин
(2-амино-2-дезокси-D-глюкопираноза)
CH2OH
O
HO
H
OH
OH
H
H
H
NH2
D-галактозамин
(2-амино-2-дезокси-D-галактопираноза)
структурные компоненты гетерополисахаридов
44.
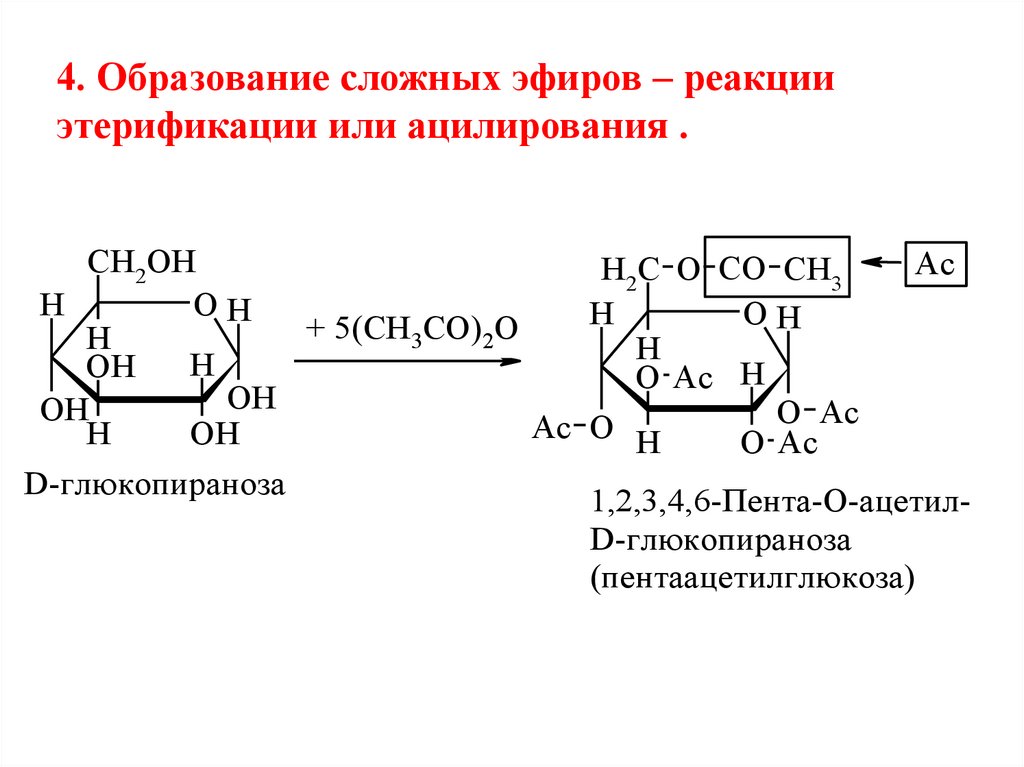
4. Образование сложных эфиров – реакцииэтерификации или ацилирования .
CH2OH
Ac
H2C O CO CH3
H
OH
H
OH
+
5(CH
CO)
O
3
2
H
H
H
OH
O Ac H
OH
OH
O Ac
Ac
O
H
OH
H
O Ac
D-глюкопираноза
1,2,3,4,6-Пента-О-ацетилD-глюкопираноза
(пентаацетилглюкоза)
45.
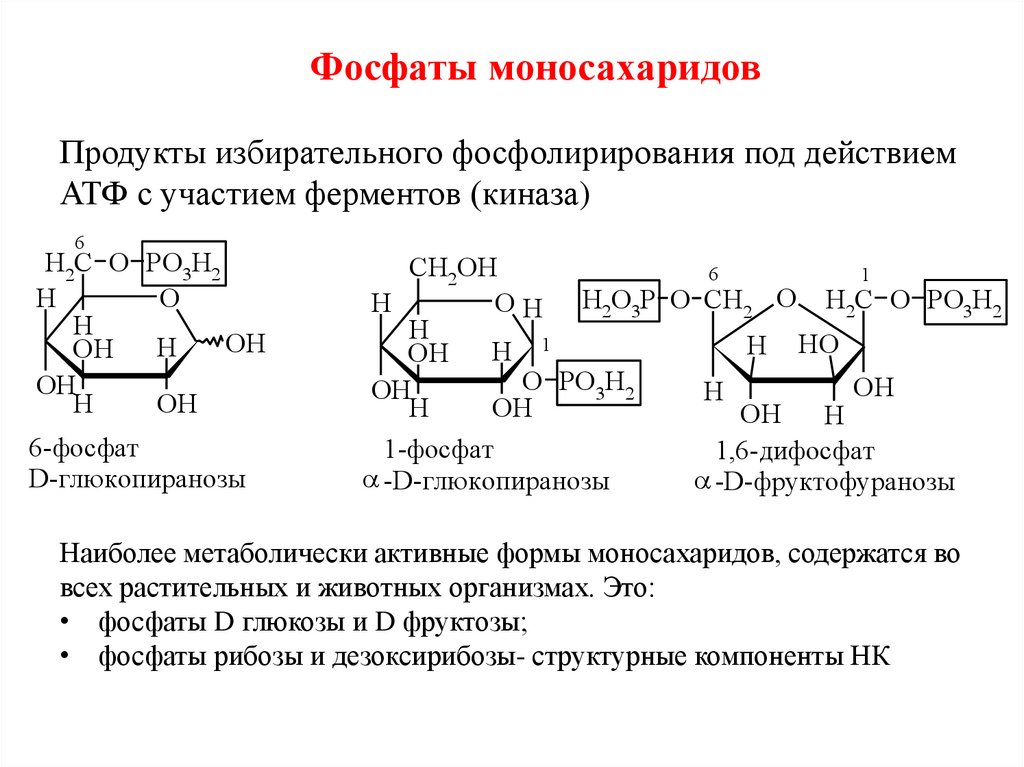
Фосфаты моносахаридовПродукты избирательного фосфолирирования под действием
АТФ с участием ферментов (киназа)
6
H2C O PO3H2
H
O
H
OH
H
OH
OH
H
OH
6-фосфат
D-глюкопиранозы
CH2OH
6
1
H
O H H2O3P O CH2 O H2C O PO3H2
H
H HO
H 1
OH
O PO3H2
OH
OH
H
H
OH
OH
H
1-фосфат
1,6-дифосфат
-D-глюкопиранозы
-D-фруктофуранозы
Наиболее метаболически активные формы моносахаридов, содержатся во
всех растительных и животных организмах. Это:
• фосфаты D глюкозы и D фруктозы;
• фосфаты рибозы и дезоксирибозы- структурные компоненты НК
46.
Витамин С существует в двух формах:O C
C OH
O
C OH
H C
HO C H
CH3
-2H
+2H
L-Аскорбиновая
кислота
(восстановленная форма)
рКа=4,2
O C
C O
O
C O
H C
HO C H
CH3
Дегидроаскорбиновая
кислота
(окисленная форма)
47.
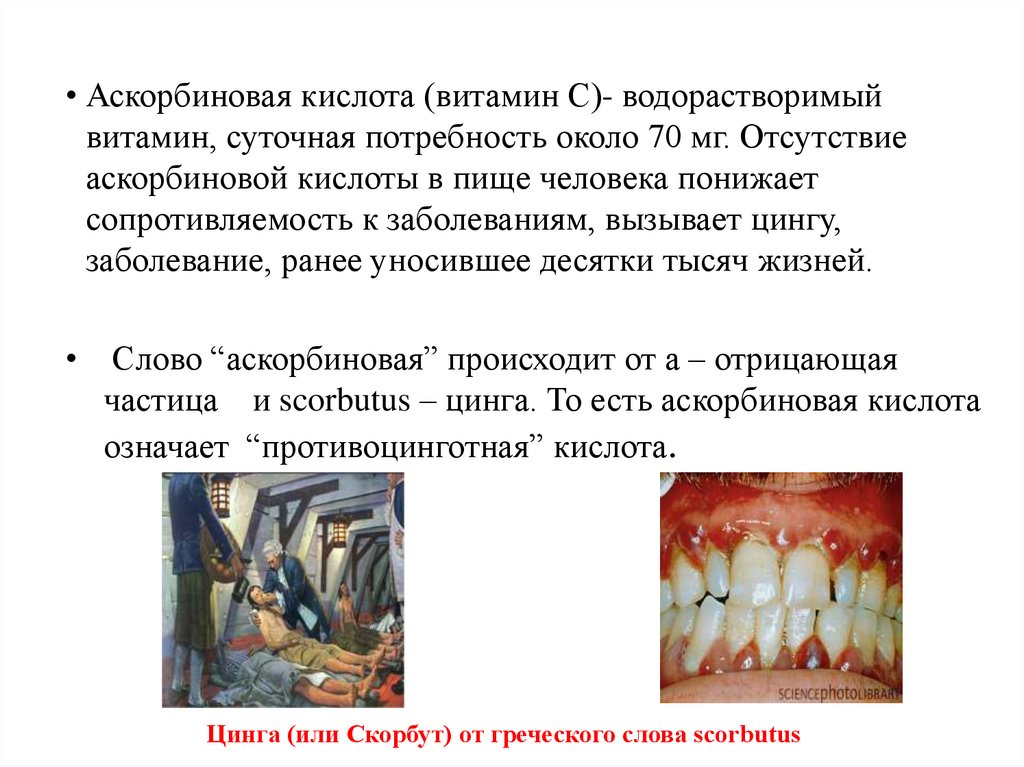
• Аскорбиновая кислота (витамин С)- водорастворимыйвитамин, суточная потребность около 70 мг. Отсутствие
аскорбиновой кислоты в пище человека понижает
сопротивляемость к заболеваниям, вызывает цингу,
заболевание, ранее уносившее десятки тысяч жизней.
Слово “аскорбиновая” происходит от а – отрицающая
частица и scorbutus – цинга. То есть аскорбиновая кислота
означает “противоцинготная” кислота.
Цинга (или Скорбут) от греческого слова scorbutus
48.
5. Окислительно-восстановительныереакции.
а) восстановление в спирты – альдиты (полиолы)
H
HO
H
H
O
C H
OH
H
OH
OH
CH2OH
Н2; Pd
Глюкоза
Ксилоза
ксилит
Глюкоза, фруруктоза
сорбит, глюцит
Галактоза
дульцит
Манноза
маннит
H
HO
H
H
CH2OH
OH
H
OH
OH
CH2OH
Сорбит
(глюцит)
сахарозаменители для
больных сахарным
диабетом
49.
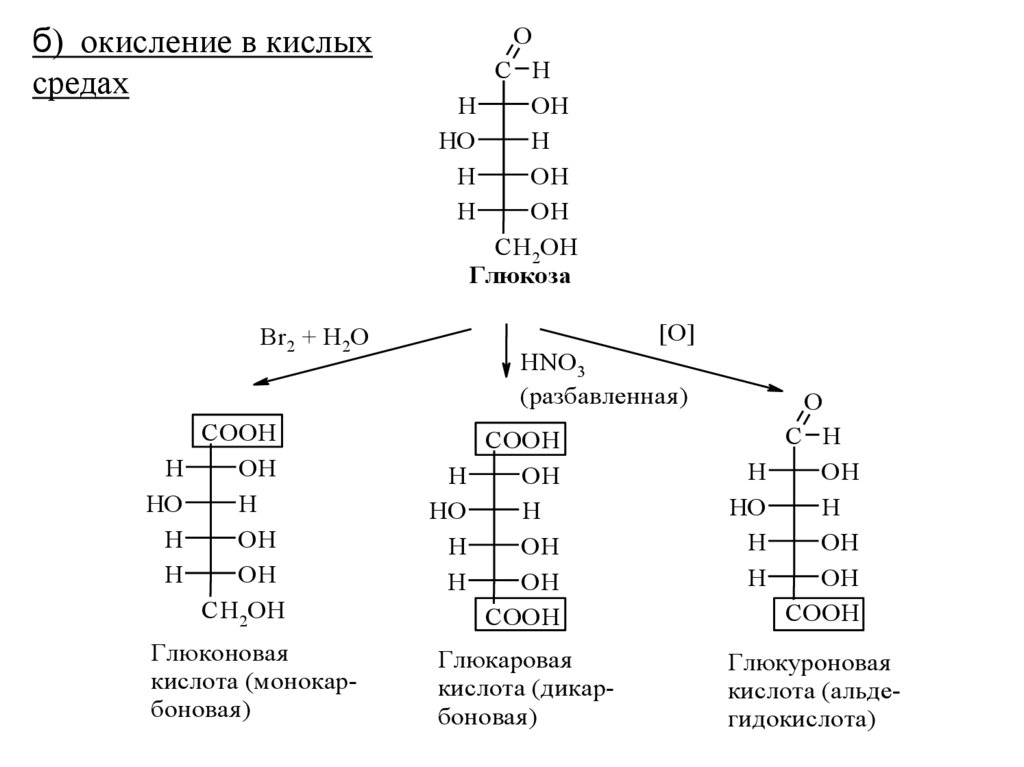
б) окисление в кислыхсредах
O
C H
H
OH
HO
H
H
OH
H
OH
CH2OH
Глюкоза
[O]
Br2 + H2O
H
HO
H
H
COOH
OH
H
OH
OH
CH2OH
Глюконовая
кислота (монокарбоновая )
HNO3
(разбавленная )
H
HO
H
H
COOH
OH
H
OH
OH
COOH
Глюкаровая
кислота (дикарбоновая )
H
HO
H
H
O
C H
OH
H
OH
OH
COOH
Глюкуроновая
кислота (альдегидокислота)
50.
• Гликуроновые (уроновые) кислоты образуются приокислении первичной спиртовой группы, не затрагивая
альдегидную группу:
H
OH
CHO
CHO
CHO
H
OH
HO
H
H
H
HO
H
HO
H
OH
HO
H
H
OH
H
OH
H
OH
H
OH
HO
COOH
COOH
глюкуроновая
галактуроновая
кислота
кислота
11.12.2021
COOH
маннуроновая
кислота
50
51.
HOOCCOOH
OH
COOH
H
O
O
H
OH
H
H
OH
OH
салициловая кислота
глюкуронид салициловой кислоты
Уроновые кислоты выводят из организма ксенобиотики (от
греч. eno — чужой и bio — жизнь) и токсичные вещества
51
52.
Качественные реакции на моносахариды:а) качественная реакция на
>C=O
в щелочной
среде, используется для обнаружения глюкозы в
биологической жидкости
-реакция «серебряного зеркала»
Альдоза
+
Ag(NH3)2
OH
2 Ag
продукты
+ окисления
реактив Толленса
52
53.
-реакция Троммера («медного зеркала»)компоненты реактива Троммера: CuSO4 и NaOH:
CuSO4
O
R C
H
Альдоза
+
Cu(OH)2
2NaOH
+ Na2SO4 (свежеприготовленный)
O
+
2Cu(OH)2
Голубой
осадок
to
Cu2O
+
Кирпичнокрасный осадок
R C
+ H2O
OH
Продукты
окисления
54.
Недостаток реакции Троммера:.Cu(OH)2
избыток
to
CuO + H2O
черный
цвет
затушевывает
кирпично-красное окрашивание
55.
Реакция Фелинга - (аналогична реакции Троммера):вводится дополнительный компонент – сегнетовая соль, которая
препятствует образованию черного осадка и не мешает
открытию глюкозы
СOOK
CHOH
CHOH
COONa
Сегнетовая
соль
+
HO
HO
(или K, Na – тартрат)
Cu
СOOK
CHO
Cu + 2H2O
CHO
COONa
Реактив Фелинга
синего цвета
не разлагается при
нагревании.
56.
Реакция Гайнеса – аналогична реакции Фелинга, только вотличие от неё вместо сегнетовой соли введен глицерин, роль
которого также связать избыток гидроксида меди.
CH2OH
CHOH
CH2OH
Глицерин
+
HO
HO
Cu
CH2 O
Cu
CH O
CH2OH
+
2H2O
Реактив Гайнеса
синего цвета
57.
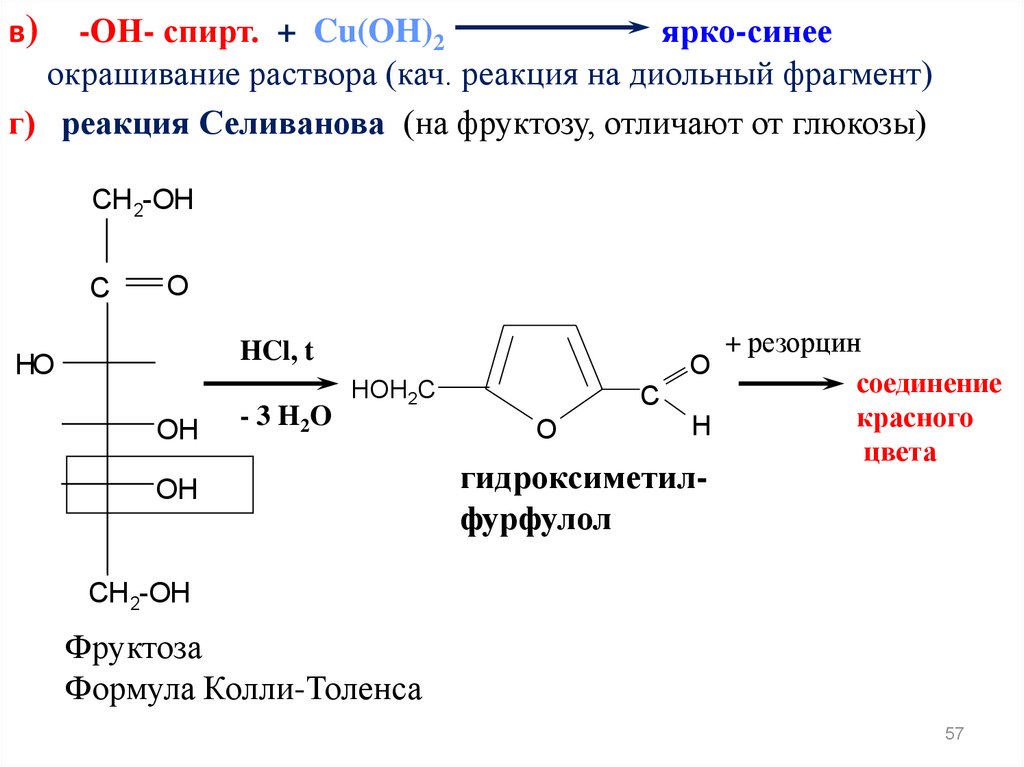
-ОН- спирт. + Cu(OH)2ярко-синее
окрашивание раствора (кач. реакция на диольный фрагмент)
г) реакция Селиванова (на фруктозу, отличают от глюкозы)
в)
CH 2-OH
C
O
HCl, t
HO
OH
- 3 H2O
HOH2C
OH
C
O
+ резорцин
O
соединение
красного
H
цвета
гидроксиметилфурфулол
CH 2-OH
Фруктоза
Формула Колли-Толенса
57
58. Содержание сахара в биологических жидкостях
Содержание сахара в крови:3,55-5,55 ммоль/л
Гипергликемия > 5,55 ммоль/л
Гипогликемия < 3,55 ммоль/л
Глюкозурия - появление
сахара в моче
59. Сложные углеводы (подвергающиеся гидролизу) (полисахариды)
олигосахаридыот 2 до 10
моносахаридов
гомополисахариды
состоят из одинаковых моносахаридов
крахмал, гликоген,
целлюлоза
гетерополисахариды
состоят из разных моносахаридов
хондроитинсульфат, гиалуроновая кислота, гепарин
60.
Дисахариды (биозы) – это олигосахариды с общейформулой С12Н22О11, состоящие из двух
моносахаридов одинаковой или разной природы,
связанные между собой О-гликозидной связью
В природе наиболее распространены дисахариды:
Мальтоза
C12H22O11
+
Целлобиоза
Лактоза
Сахароза
+
+
H2O
+
H2O
H2O
H2O
H+
H+
H+
H+
-D-глюкоза
+
-D-глюкоза
-D-глюкоза
+
-D-глюкоза
-D-глюкоза
+
-D-галактоза
-D-глюкоза
+
-D-фруктоза
61. Дисахариды (биозы)
Восстанавливающие• соединяются за счет
полуацетальной (гликозидной)
группы -ОН С-1 и С-4
спиртового гидроксила другого
моносахарида
• обрауют таутомерные формы за
счет свободного
полуацетального гидроксила
• проявляют восстанавливающие
свойства
• свежеприготовленные растворы
мутаротируют
Мальтоза
Лактоза
Целлобиоза
Невосстанавливающие
• образуют связь между
моносахаридами за счет
полуацетальных (гликозидных)
гидроксилов
• не образуют таутомерных форм
• не проявляют
восстанавливающих свойств
• не мутаротируют
Сахароза
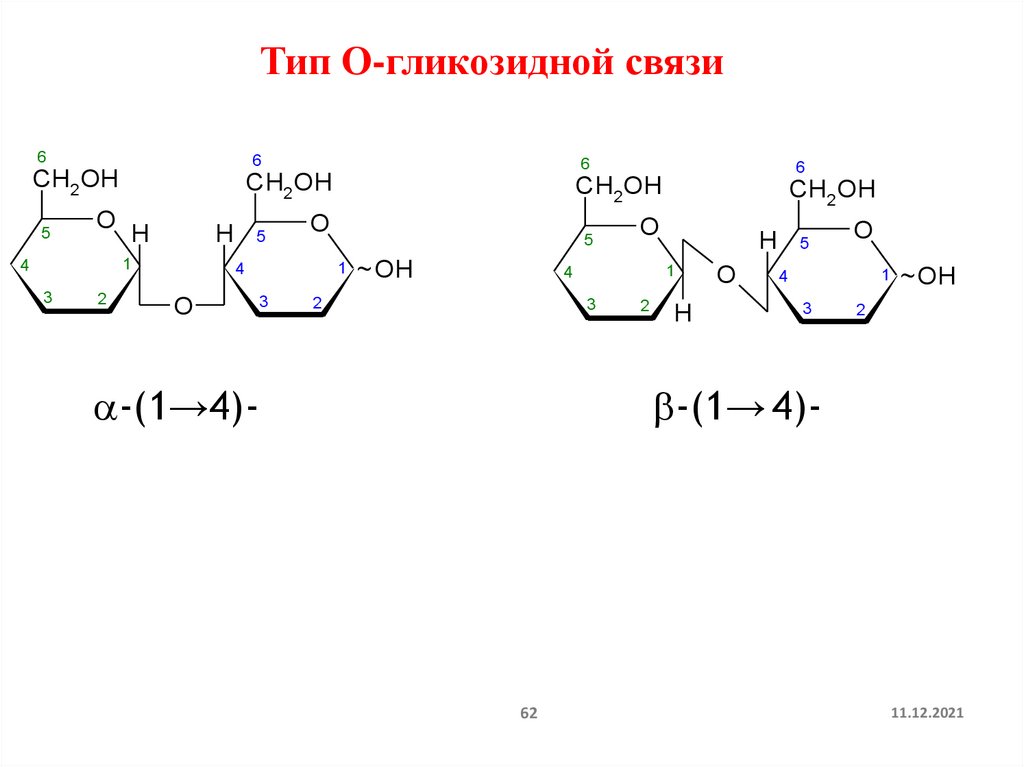
62.
Тип О-гликозидной связи6
6
CH2OH
5
O
CH2OH
H
H
1
4
3
2
6
5
O
CH2OH
O
5
1
4
3
6
~OH
O
3
-(1→4)-
H
1
4
2
CH2OH
2
H
O
5
O
1
4
3
~OH
2
-(1→ 4)-
62
11.12.2021
63.
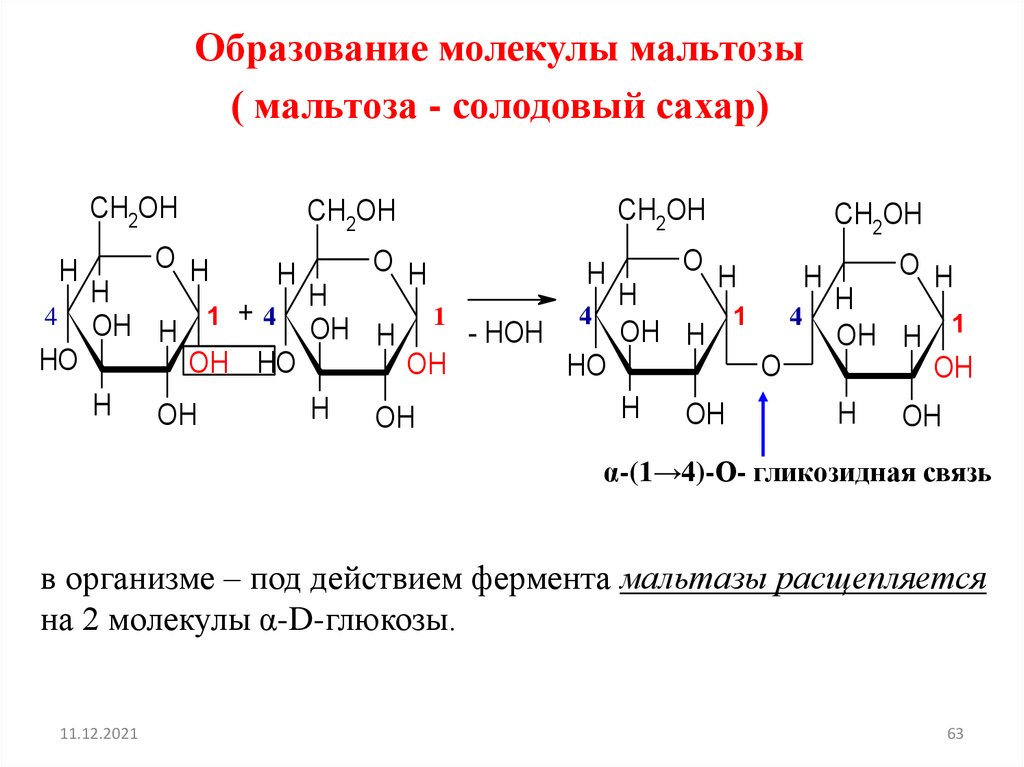
Образование молекулы мальтозы( мальтоза - солодовый сахар)
CH2OH
H
O H
CH2OH
CH2OH
H
O H
H
O
CH2OH
H
H
H
H
+
4 OH
4
1
OH H 1 - HOH 4 OH H 1 4
H
HO
OH HO
OH
HO
O
H OH
H OH
H OH
H
O H
H
OH H 1
OH
H
OH
α-(1→4)-О- гликозидная связь
в организме – под действием фермента мальтазы расщепляется
на 2 молекулы α-D-глюкозы.
11.12.2021
63
64.
ЦиклоформаCH2OH
CH2OH
OH
H
OH
H
H
H
4
4
1
H
H 1
OH
OH
OH
HO
O
H
OH
H
OH
-D-глюкоза
-D-глюкоза
место раскрытия
цикла
Свободный
полуацетальный
(гликозидный)
гидроксил
-(1 4)-О-гликозидная свя зь
оксоформа
CH2OH
CH2OH
OH
H
OH
HH
O
H
H
HC
OH
OH
H
HO
O
H
OH
H
OH
-Мальтоза (солодовый сахар)
(цикло-оксо таутомерные формы)
Может быть и -мальтоза
цикло-оксо таутомерия
альдегидная
(восстанавливающая )
группа. При окислении
образуется мальтобионовая кислота
65.
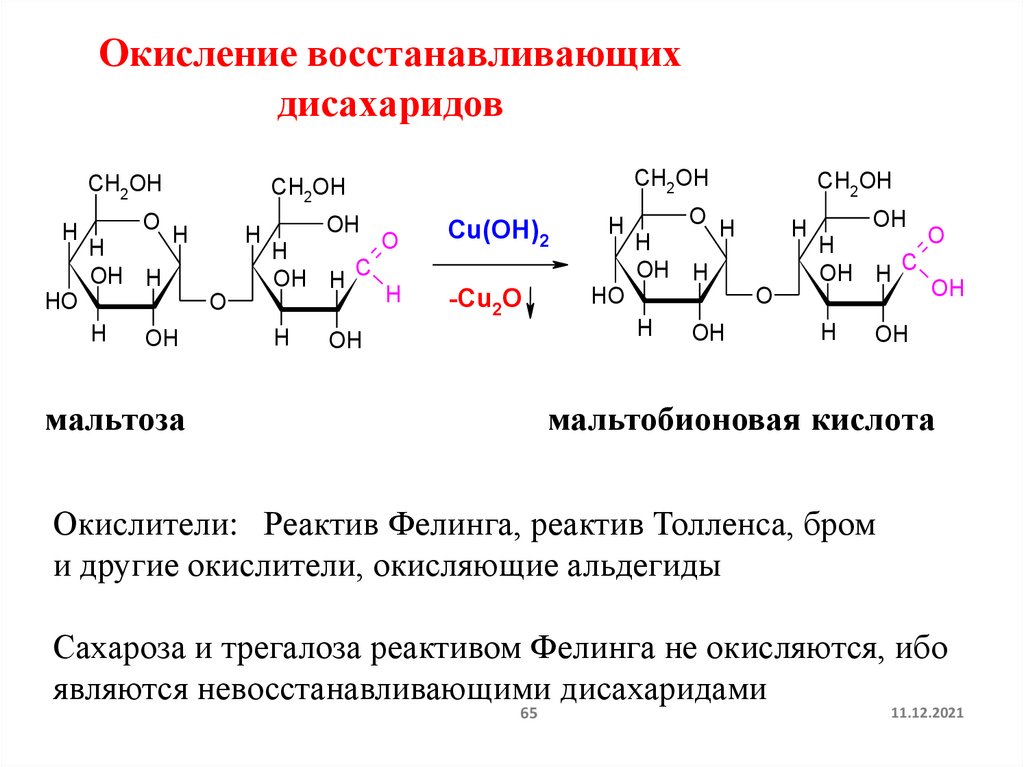
Окисление восстанавливающихдисахаридов
CH2OH
H
O
H
OH H
H
HO
H
OH
H
OH H C
O
H
CH2OH
CH2OH
OH
H
O
Cu(OH)2
H
-Cu2O
H
O
H
OH H
мальтоза
H
HO
H
O
H
OH
CH2OH
OH
OH
O
H
OH H C
OH
H
OH
мальтобионовая кислота
Окислители: Реактив Фелинга, реактив Толленса, бром
и другие окислители, окисляющие альдегиды
Сахароза и трегалоза реактивом Фелинга не окисляются, ибо
являются невосстанавливающими дисахаридами
65
11.12.2021
66.
Целлобиоза образуется при неполном гидролизеполисахарида целлюлозы, состоит из двух остатков β-Dглюкоз, связанных β-(1 4)-O-гликозидной связью:
67.
Лактоза(молочный сахар) содержится в молоке (4-5%)
Циклоформа
CH2OH
CH2OH
O
O H
HO
H
H
H
4
4
1
H 1 O
H
OH
OH
H
OH
H
3
H3
OH
H
OH
-D-галактоза
-D-глюкоза
-(1
оксоформа
место раскрытия
цикла
Свободный полуацетальный
гидроксил
4)-О-гликозидная свя зь
CH2OH
CH2OH
O
OH
HO
H
O
H
H
4
H 1O
HC
OH
OH
1 H
H
H
H
OH
H
OH
-Лактоза (цикло-оксо таутомерные формы). Может быть и -лактоза
альдегидная
(восстанавливающая)
группа. При окислении
образуется лактобионовая
кислота
В организме расщепляется под действием фермента лактазы
на составляющие моносахариды.
68.
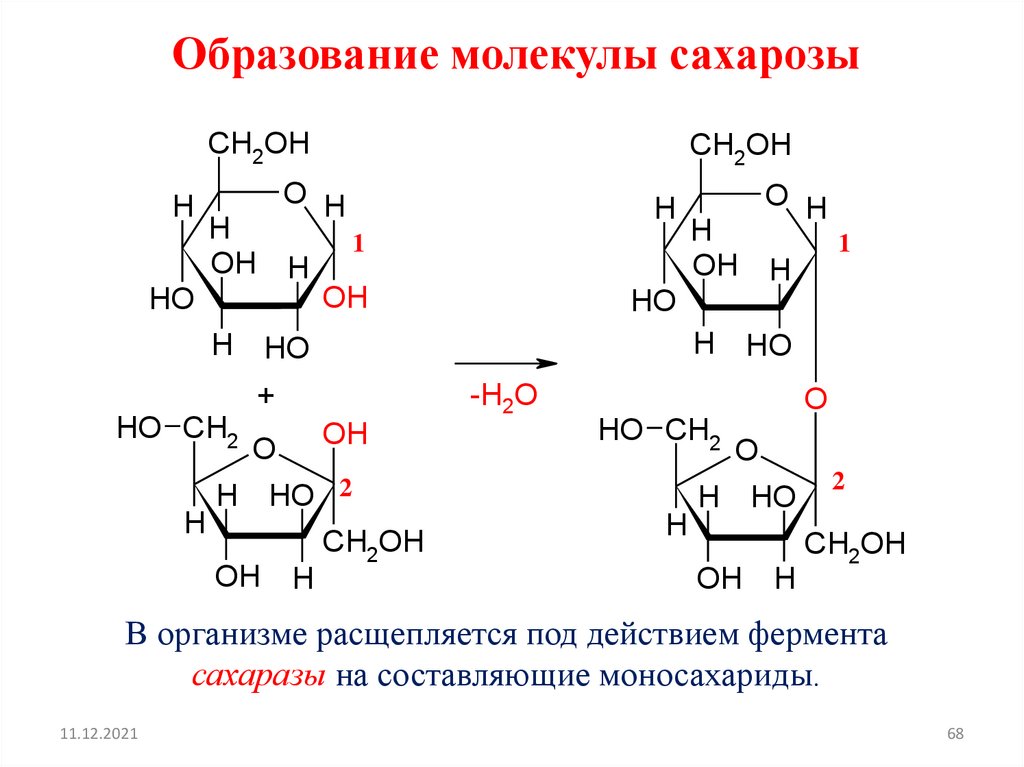
Образование молекулы сахарозыCH2OH
H
CH2OH
O H
H
OH H
H
1
OH
HO
-H2O
H
OH
O
OH
O
HO CH2
HO 2
CH2OH
H
1
H HO
+
H
H
OH H
HO
H HO
HO CH2
O H
H
O
H
OH
HO
H
2
CH2OH
В организме расщепляется под действием фермента
сахаразы на составляющие моносахариды.
11.12.2021
68
69.
Сахароза (тростниковый сахар)Содержится в сахарном тростнике, сахарной свекле (28% от
массы сухого вещества) соках растений, плодах
CH2OH
H
OH
H
4
H 1
OH
OH
H
OH
-D-глюкопираноза
-конфигурация
O
(1
2)-О-гликозидная свя зь
O
HOH2C
H
H
HO
2
CH2OH
OH
H 1
-D-фруктофураноза
-конфигурация
70. Инверсия сахарозы-
Инверсия сахарозыизменение угла вращения сахарозы после её гидролиза с D (+)66,5° до D (-) 40°, за счет сильного преобладания левого
вращения фруктозы (D (-) 92°) по сравнению с глюкозой (D (+)
52,2°).
Инвертный сахар-смесь равных количеств глюкозы и
фруктозы (природный мед).
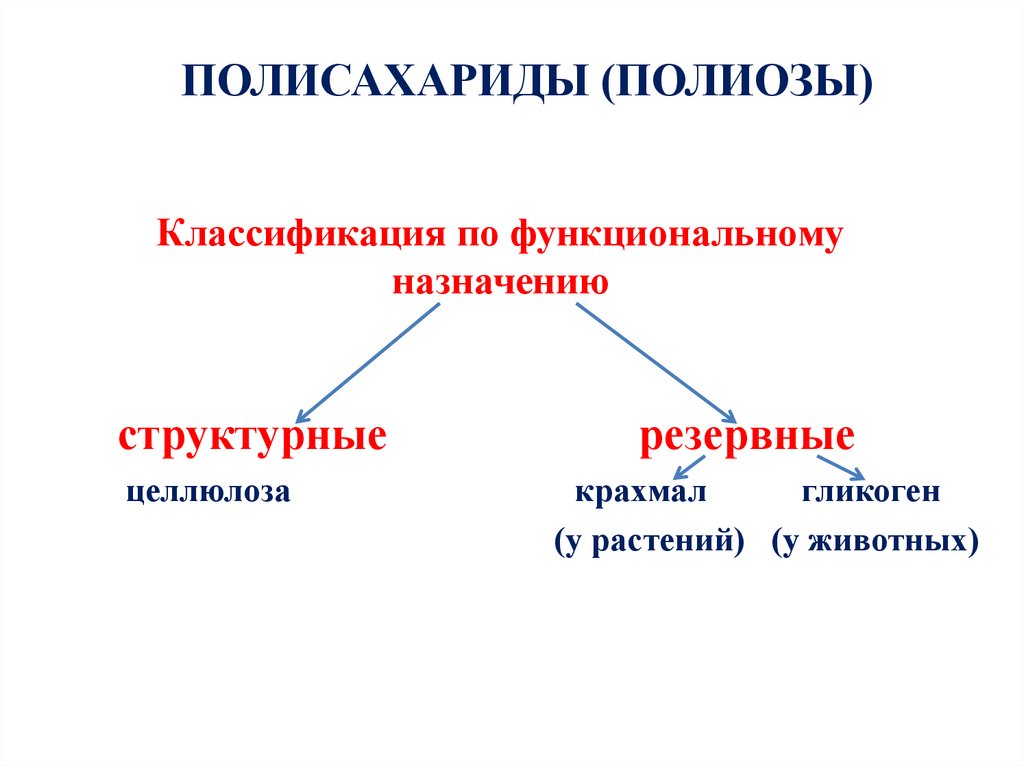
71. Классификация по функциональному назначению
ПОЛИСАХАРИДЫ (ПОЛИОЗЫ)Классификация по функциональному
назначению
структурные
целлюлоза
резервные
крахмал
гликоген
(у растений) (у животных)
72.
Полисахариды легко гидролизуются в кислой среде,устойчивы в щелочных.
+ Н2О
(С6Н10О5)n
полисахарид
гидролиз
(С6Н10О5)x
олигосахариды
+ Н2О
гидролиз
С12Н22О11
+ Н2О
гидролиз
дисахариды
n С6Н12О6
моносахариды
In vivo гидролизуются ферментами: крахмал - амилазами,
целлюлоза – целлюлазами, гемицеллюлозы –
гемицеллюлазами.
73. Гомополисахариды (гликаны)
первичная структура полисахаридов – этопоследовательность мономерных остатков
вторичная структура –макромолекула, свёрнутая в
спираль (амилоза).
74. Крахмал (С6Н10О5)n : биополимер, Mr-106-107
Состоит из моносахаридных звеньев α-Dглюкопиранозы. Продукт фотосинтеза в растениях,накапливается в клубнях, семенах, корнях.
Включает 2 фракции: 1) амилоза;
2) амилопектин
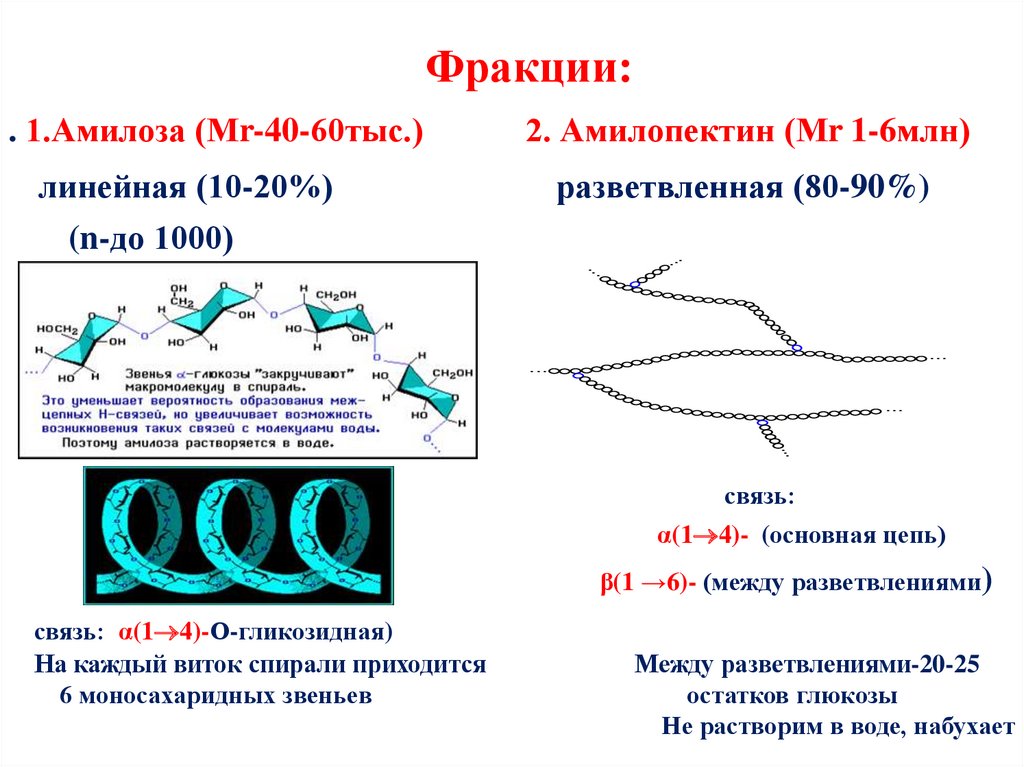
75. Фракции:
. 1.Амилоза (Мr-40-60тыс.)2. Амилопектин (Мr 1-6млн)
линейная (10-20%)
(n-до 1000)
разветвленная (80-90%)
...
...
...
...
...
...
связь:
α(1 4)- (основная цепь)
β(1 →6)- (между разветвлениями)
связь: α(1 4)-О-гликозидная)
На каждый виток спирали приходится
6 моносахаридных звеньев
Между разветвлениями-20-25
остатков глюкозы
Не растворим в воде, набухает
76.
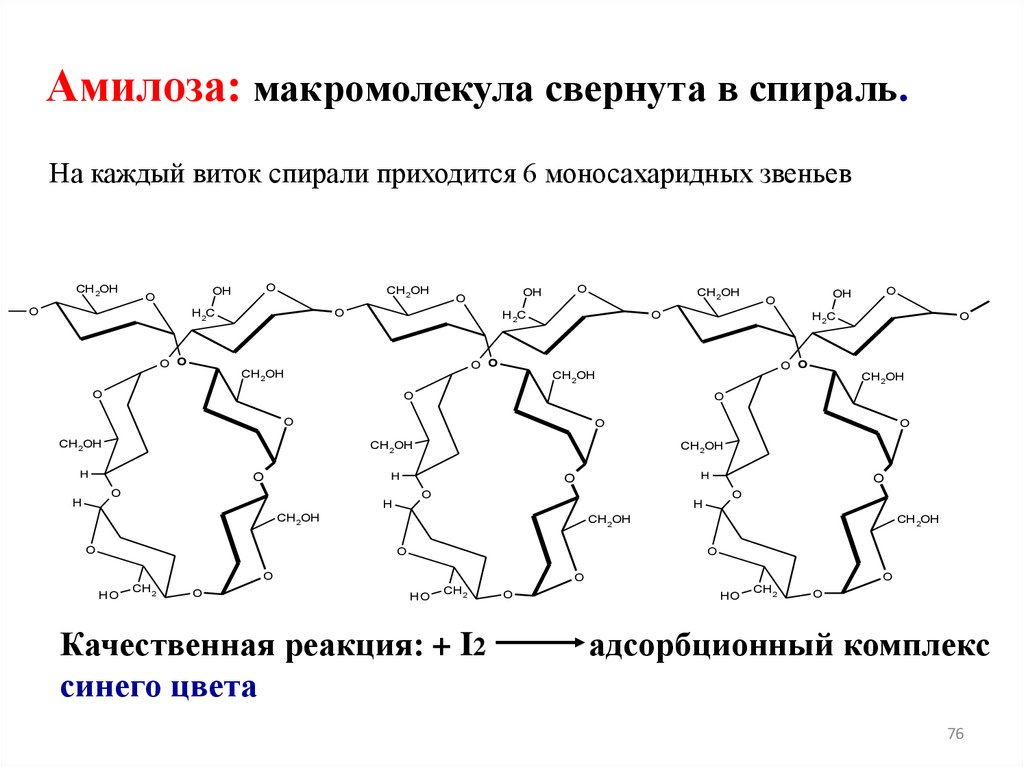
Амилоза: макромолекула свернута в спираль.На каждый виток спирали приходится 6 моносахаридных звеньев
CH 2OH
O
OH
O
O
CH 2OH
H 2C
O
OH
O
O
H 2C
O O
O
H 2C
CH 2OH
O
O
O
CH 2OH
O
CH 2OH
H
O
O
O
HO
CH 2OH
CH 2OH
O
O
O
O
H
CH 2OH
CH 2
H
O
O
H
O
CH 2OH
H
O
O
O
O O
CH 2OH
O
O
OH
O
O O
CH 2OH
H
CH 2OH
O
O
HO
CH 2
Качественная реакция: + I2
синего цвета
O
HO
CH 2
O
адсорбционный комплекс
76
77.
Фрагмент молекулы крахмала-фракции амилозыCH2OH
H
OH
H
4
H 1
OH
HO
O
H
OH
CH2OH
H
OH
H
4
H 1
OH
CH2OH
H
OH
H
4
H 1
OH
H
OH
O
H
OH
CH2OH
H
OH
H
4
H 1
OH
O
Фрагмент молекулы крахмала фракции амилозы
( -(1 4)-О-гликозидная свя зь)
H
OH
O ...
78.
Биозный фрагмент молекулы амилозыCH2OH
H
4
O
H
OH H
CH2OH
H
H
1
4
O H
H
OH H
O
H
OH
1
n = 200-1000
O
H
OH
М = 40000-160000
n
α-(1→4)-О- гликозидная связь
78
79.
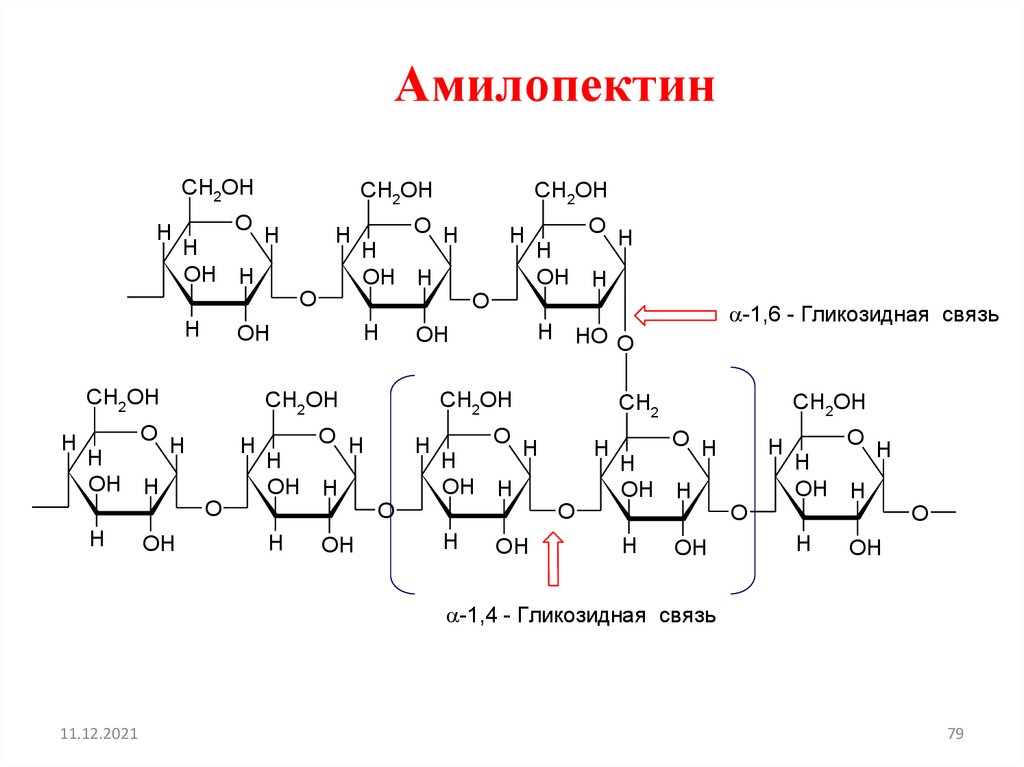
АмилопектинCH2OH
H
O
H
OH H
CH2OH
H
H
CH2OH
O H
H
OH H
O
H
H
O
H
OH H
H
H
OH
CH2OH
O H
H
H
OH H
O
H
H
OH
-1,6 - Гликозидная связь
O
H
OH H
CH2OH
CH2
H
O
H
H
OH H
H HO
O
OH
CH2OH
H
O
O
OH
CH2OH
H
H
O H
H
OH H
O
H
OH
H
O
H
OH H
H
O
H
OH
O
H
OH
-1,4 - Гликозидная связь
11.12.2021
79
80.
В пищеварительном тракте гидролизуется ферментамислюны и сока поджелудочной железы α- амилазой и α(1→ 6)-глюкозидазой поэтапно до глюкозы и мальтозы
(от «amilum» – крахмал):
(C6H10O5)n
крахмал
H2O (H+)
растворимый
крахмал
(C6H10O5)m
xC12H22O11 + yC6H12O6
декстрины
мальтоза
глюкоза
81. Гликоген (животный крахмал)
Содержится в печени, мышцах, мозге.Структурный и функциональный аналог
амилопектина.
Основное отличие :
1) большая разветвленность цепей (через 6-12
звеньев);
2) большая Mr-100 мл.
Функции: 1) энергетическая (сильное
разветвление);
2) резервный углевод (большая Мr).
82. Пути расщепления в организме
• амилолитический (под действием амилазы)• фосфоролитический (под действием Н3РО4) до
мальтозы и глюкозы
83.
Гетерополисахариды соединительнойткани (мукополисахариды)
Составляющие компоненты: (уроновые кислоты
аминосахариды ацетиламинопроизводные
моносахаридов и др.)
Связи: О-гликозидные
Функции соединительной ткани: опорная , трофическая
(питательная),защитная
К соединительной ткани относят: подкожную клетчатку,
сухожилия, связки, кости, хрящи, стенки крупных
кровеносных сосудов, роговицу, кровь, лимфу.
Наиболее изучены хондроитинсульфаты, гиалуроновая
кислота, гепарин.
83
84.
Гиалуроновая кислота (Mr = 2-7•106 )(стекловидное тело глаза, хрящи, пуповина, суставная
жидкость).
Биозный фрагмент: остатки D-глюкуроновой кислоты +
N-ацетил-D-глюкозамина,
Связи: в биозном фрагменте β-(1→3)-,
между дисахаридами β-(1→4)-О-гликозидная связь.
COOH
H
CH2OH
O
H
H
OH H
O
H
H
O
H
H
O
H
HO
-1,3
NH
C O
CH3
Биозный фрагмент
CH2OH
O
H
H
OH H
H
H
OH
COOH
-1,4
O
H
H
-1,4
O
H
O
H
HO
H
H
OH
-1,3
NH
C O
CH3
Выполняет барьерную функцию.
84
85. Хондроитинсульфаты (Мr-10 тыс.-до 60 тыс.) (кожа, хрящи, сухожилия)
86. Состав: дисахаридные остатки + N-ацетилированный хондрозин Связь: β(1→4)-О- гликозидная связь.
Хондрозин:β Д-глюкуроновая кислота
+
Д-галактозамин
Связи в биозном фрагменте : β(1→3), β(1→4),
β(1→6)-О- гликозидная связь.
β(1→3)- характерна для полисахаридов животного и
растительного происхождения.
87.
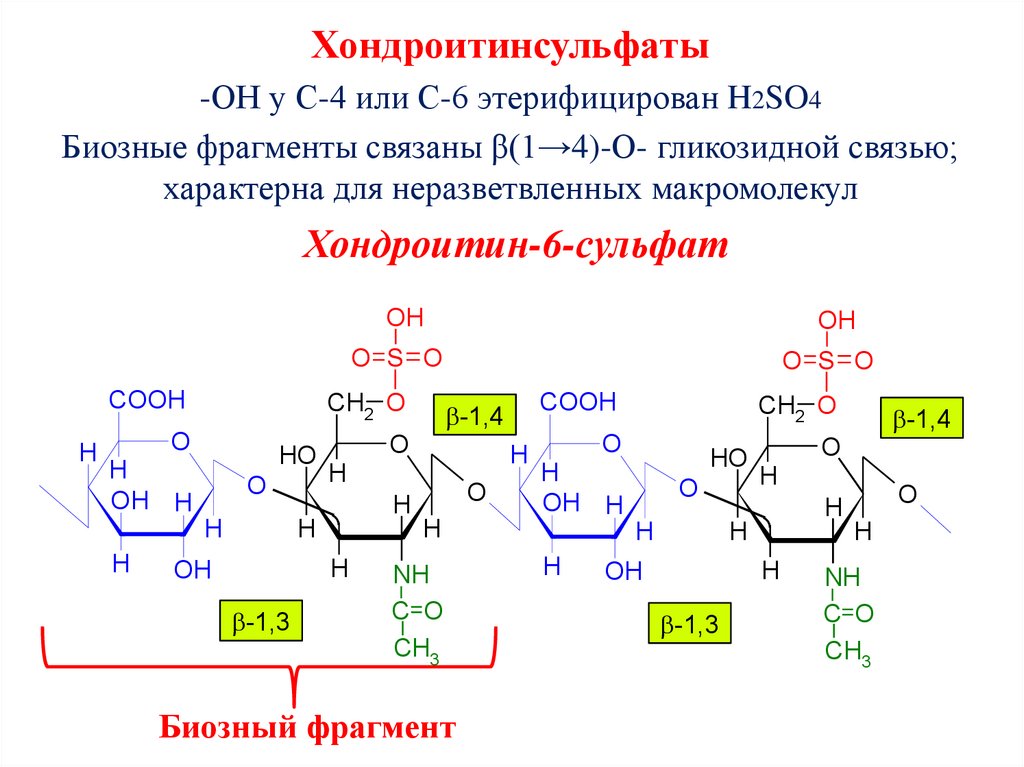
Хондроитинсульфаты-ОН у С-4 или С-6 этерифицирован H2SO4
Биозные фрагменты связаны β(1→4)-О- гликозидной связью;
характерна для неразветвленных макромолекул
Хондроитин-6-сульфат
OH
OH
O S O
COOH
H
CH2 O
O
HO
H
OH H
O
H
-1,3
H
H
O
H
NH
C O
CH3
Биозный фрагмент
CH2 O
O
HO
H
OH H
H
H
OH
COOH
-1,4
O
H
H
O S O
O
H
O
H
H
H
OH
-1,3
O
H
H
H
-1,4
NH
C O
CH3
88. Гепарин (лат. hepar – печень) Мr = 16-20 тыс.
биозный фрагмент содержит:1) Д- глюкозамин или сульфированный (или
ацетилированный) D-глюкозамин ;
2) D-глюкуроновую и L-идуроновую кислоты (преобладает) .
О- гликозидные связи:
-в биозном фрагменте α-(1→4);
-между фрагментами α-(1→4), если L-идуроновая и β(1→4), если D-глюкуроновая кислота.
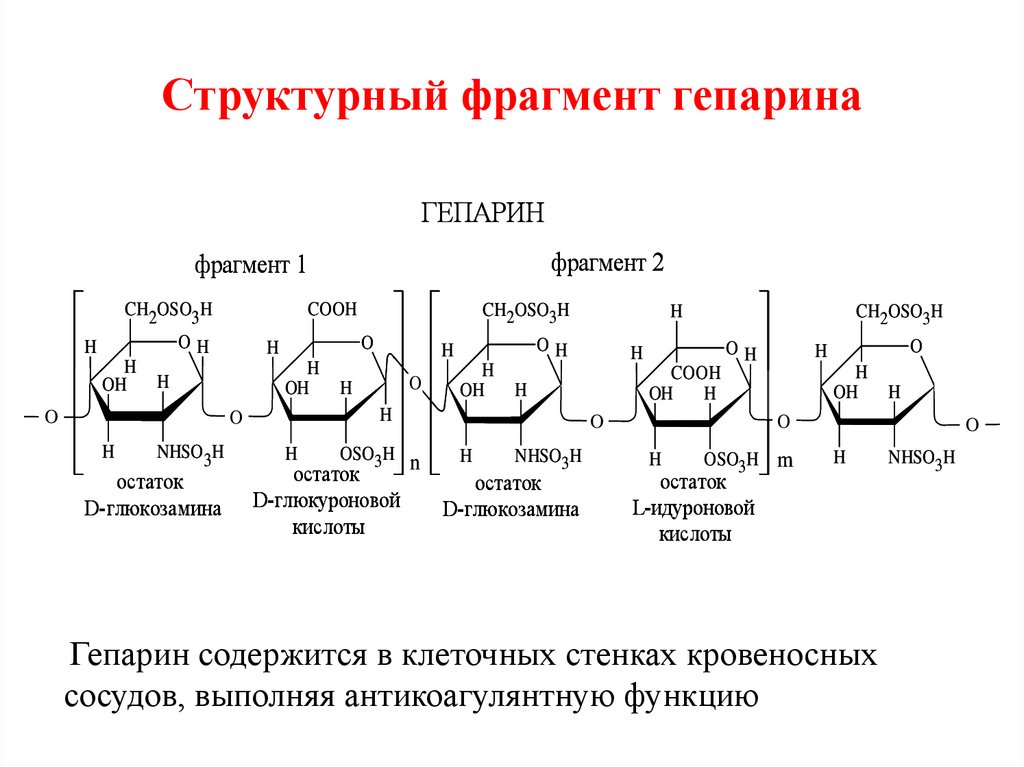
89. Структурный фрагмент гепарина
ГЕПАРИНфрагмент 2
фрагмент 1
CH2OSO3H
OH
H
H
H
OH
O
COOH
O
H
H
OH
NHSO3H
остаток
D-глюкозамина
O
H
H
OSO3H
остаток
D-глюкуроновой
кислоты
H
OH
H
H
OH
CH2OSO3H
OH
H
H
NHSO3H
остаток
D-глюкозамина
H
OH
H
O
O
n
O
H
COOH
OH
H
H
H
O
H
CH2OSO3H
H
OSO3H m
O
H
остаток
L-идуроновой
кислоты
Гепарин содержится в клеточных стенках кровеносных
сосудов, выполняя антикоагулянтную функцию
NHSO3H
90. Биологическая роль углеводсодержащих мешанных биополимеров
Составляют основу клеток и жидкостей животныхорганизмов:
пептидогликаны и протеогликаны- преобладает углеводная
часть;
гликопротеины- преобладает полипептидная часть;
гликолипиды- преобладает липидная часть
Хондроитинсульфаты и гиалуроновая кислота содержатся в
связанном виде с полипептидными цепями в протеогликанах.






























































 Химия
Химия