Похожие презентации:
Алканы – строение, химические свойства
1. Алканы – строение, химические свойства. Типы реакций в органических соединениях. Гибридизация.
Голышев А.А.2.
АлканыАлканы (парафины) - нециклические углеводороды, в молекулах
которых все связи одинарные.
Простейшие представители:
Общая формула
CH4 Метан
C2H6 Этан
CnH2n+2, n ≥ 1
Гомологи (др.-греч. ὅμοιος «подобный, похожий» + λογος «слово,
закон») — ряд химических соединений схожих свойств,
отличающихся друг от друга по составу на определённое число
повторяющихся структурных единиц — так называемую
гомологическую разность – CH2
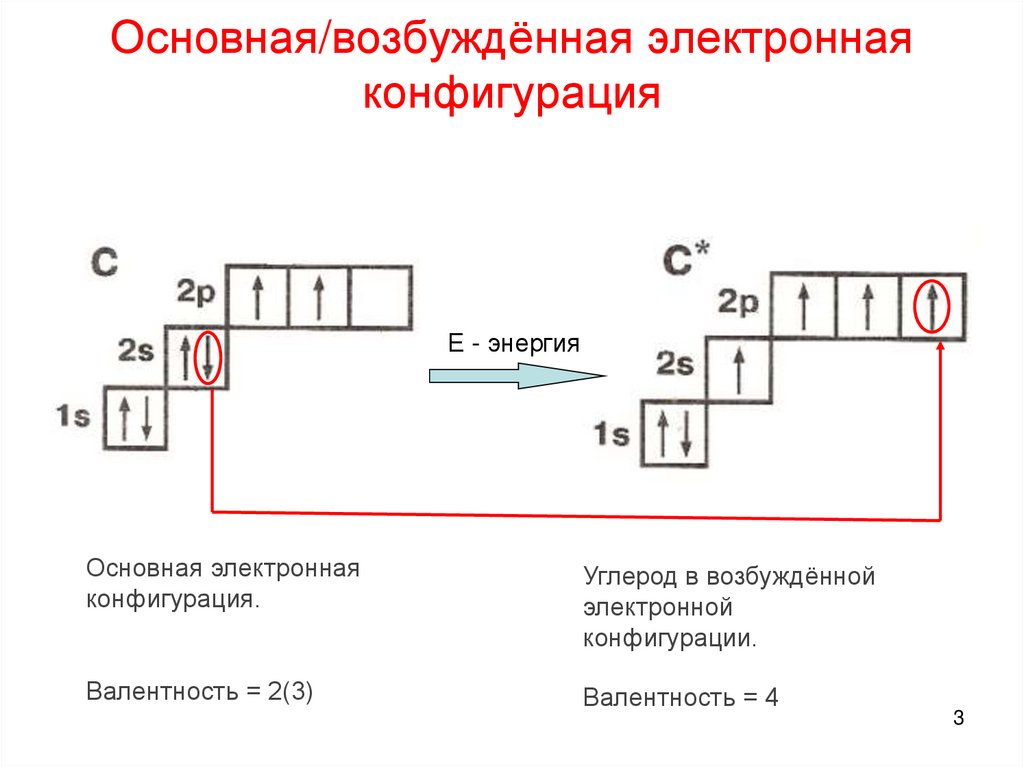
3. Основная/возбуждённая электронная конфигурация
Е - энергияОсновная электронная
конфигурация.
Углерод в возбуждённой
электронной
конфигурации.
Валентность = 2(3)
Валентность = 4
3
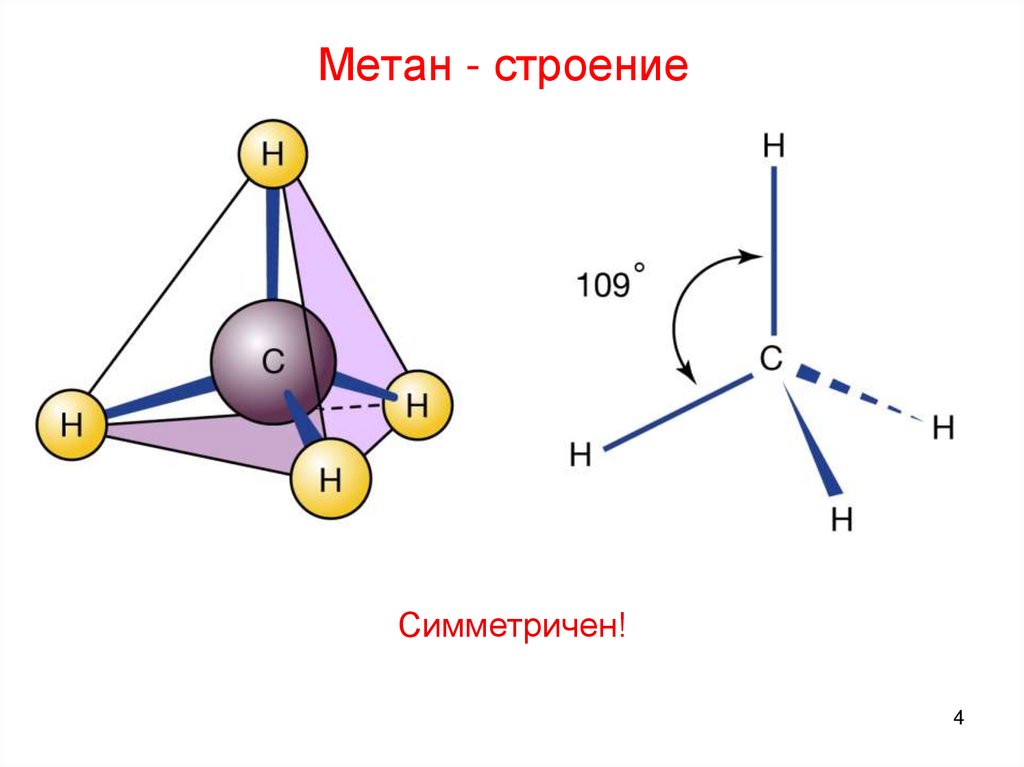
4. Метан - строение
Симметричен!4
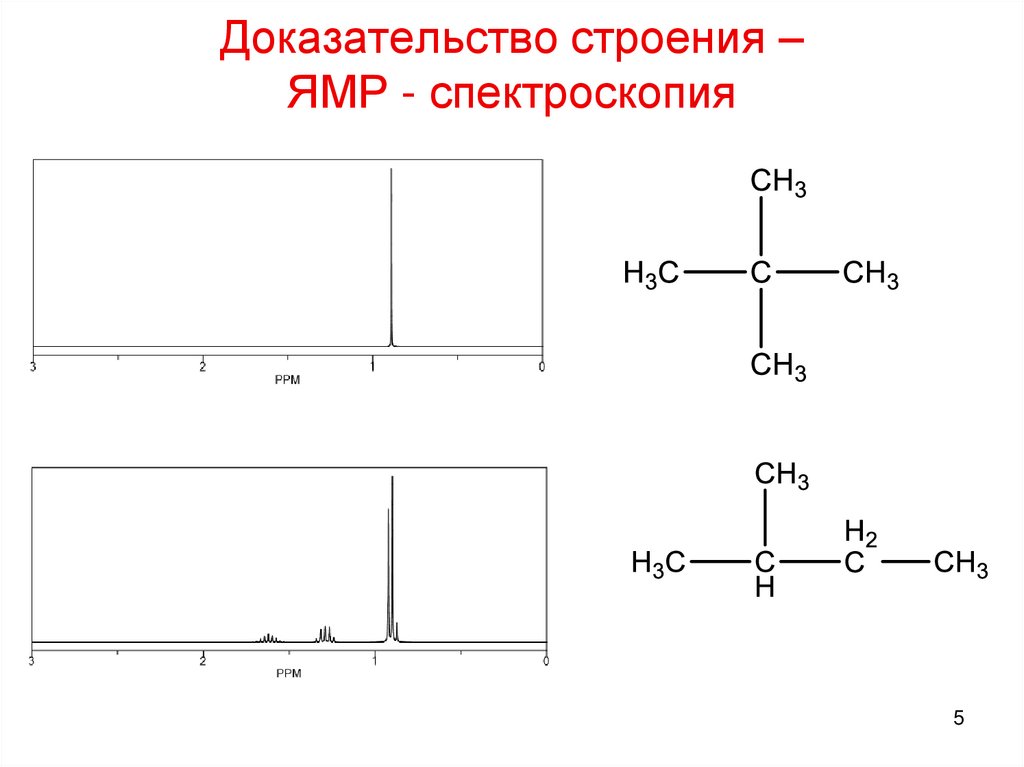
5. Доказательство строения – ЯМР - спектроскопия
56. Доказательство строения – ЯМР - спектроскопия
CH4 Метан6
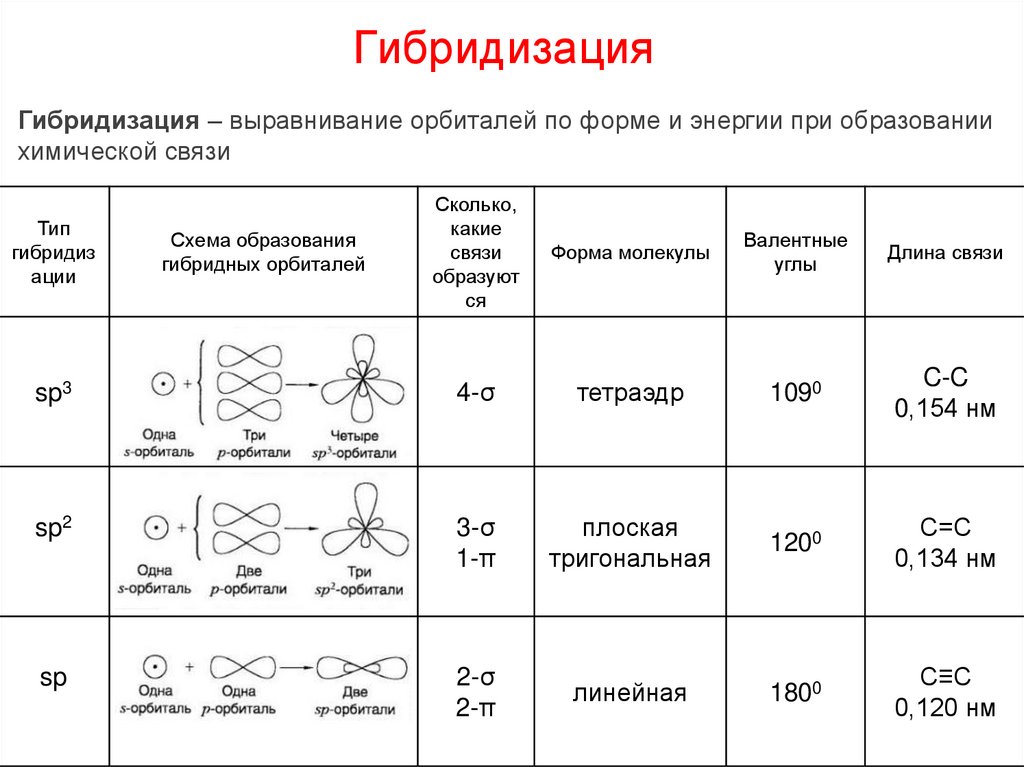
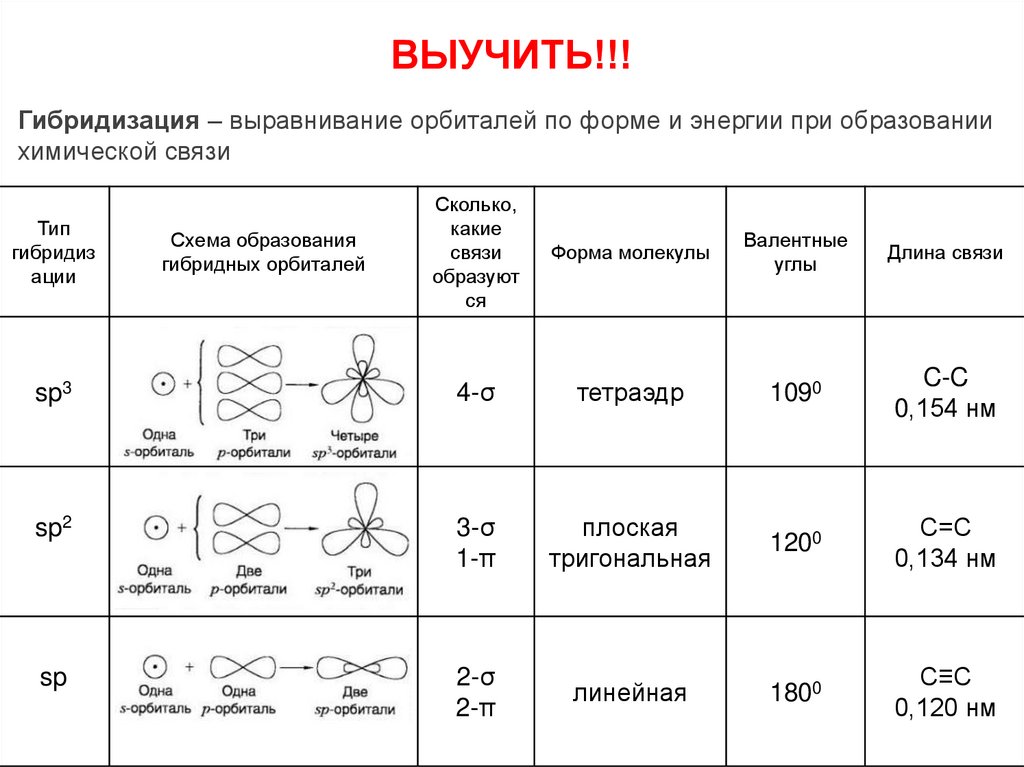
7. Гибридизация
Гибридизация – выравнивание орбиталей по форме и энергии при образованиихимической связи
Сколько,
какие
связи
образуют
ся
Форма молекулы
Валентные
углы
Длина связи
sp3
4-σ
тетраэдр
1090
C-C
0,154 нм
sp2
3-σ
1-π
плоская
тригональная
1200
С=С
0,134 нм
sp
2-σ
2-π
линейная
1800
С≡С
0,120 нм
Тип
гибридиз
ации
Схема образования
гибридных орбиталей
8. ВЫУЧИТЬ!!!
Гибридизация – выравнивание орбиталей по форме и энергии при образованиихимической связи
Сколько,
какие
связи
образуют
ся
Форма молекулы
Валентные
углы
Длина связи
sp3
4-σ
тетраэдр
1090
C-C
0,154 нм
sp2
3-σ
1-π
плоская
тригональная
1200
С=С
0,134 нм
sp
2-σ
2-π
линейная
1800
С≡С
0,120 нм
Тип
гибридиз
ации
Схема образования
гибридных орбиталей
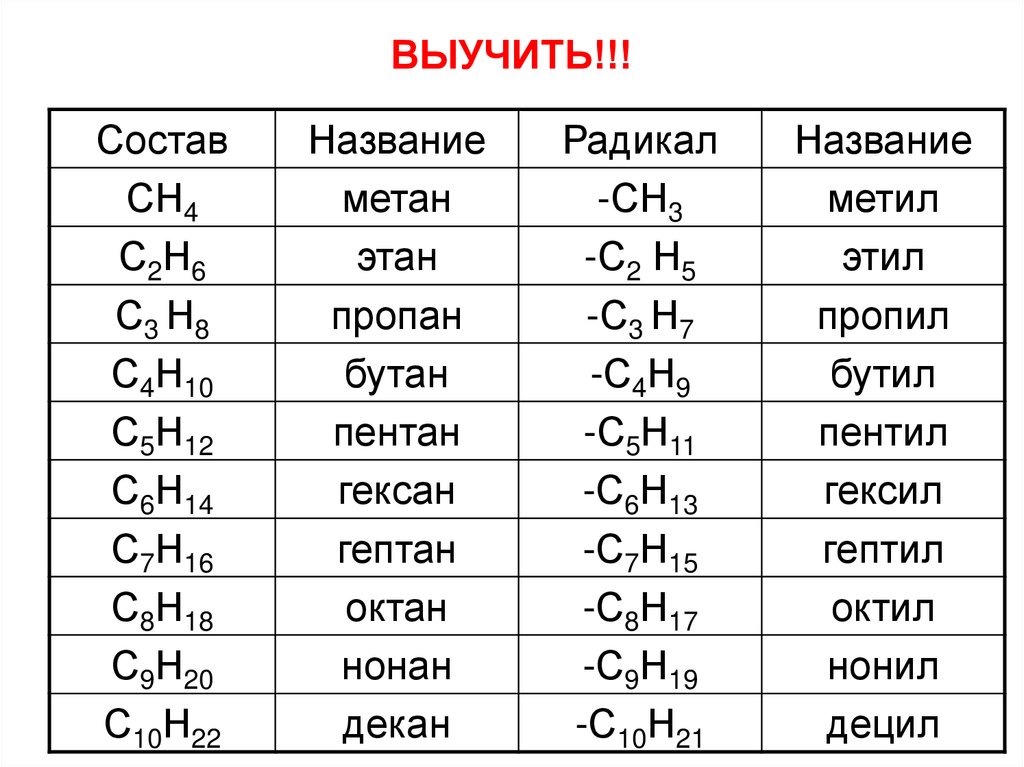
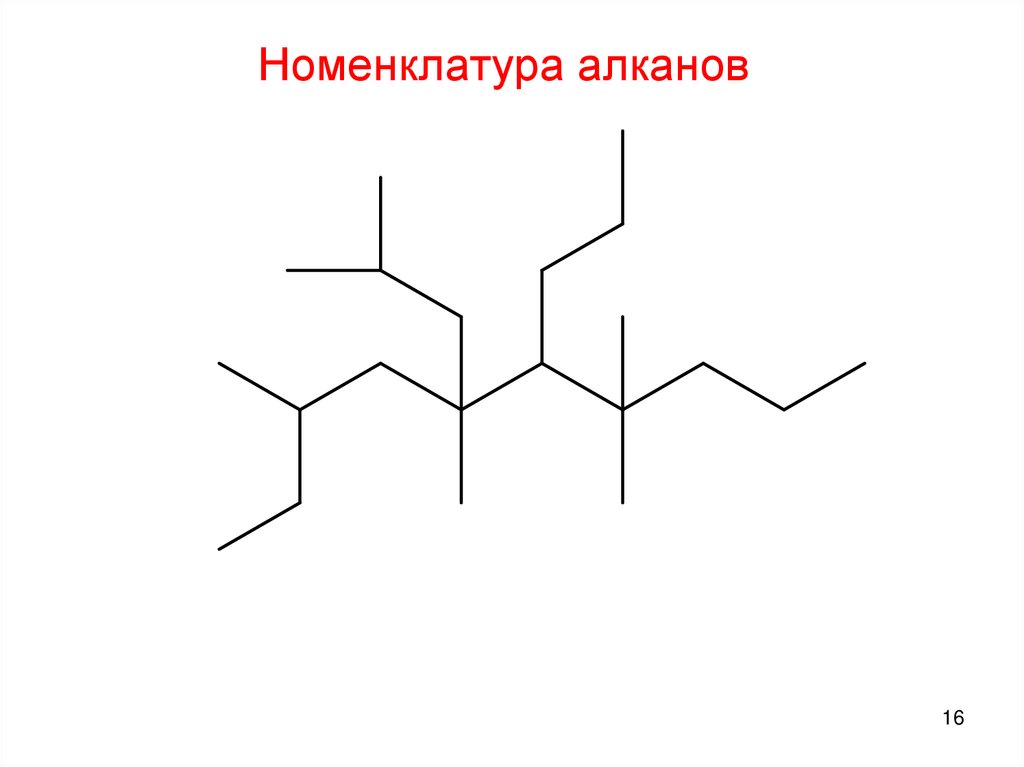
9. Номенклатура алканов
1. Выбрать в структурной цепи наиболее длинную цепь атомовСостав
Название
Радикал
Название
СН4
метан
-СН3
метил
С 2Н 6
этан
-С2Н5
этил
С3 Н8
пропан
-С3 Н7
пропил
С4Н10
бутан
-С4Н9
бутил
С5Н12
пентан
-С5Н11
пентил
С6Н14
гексан
-С6Н13
гексил
С7Н16
гептан
-С7Н15
гептил
С8Н18
октан
-С8Н17
октил
С9Н20
нонан
-С9Н19
нонил
С10Н22
декан
-С10Н21
децил
10. ВЫУЧИТЬ!!!
СоставСН4
С2Н6
С3 Н8
С4Н10
С5Н12
С6Н14
С7Н16
С8Н18
С9Н20
С10Н22
Название
метан
этан
пропан
бутан
пентан
гексан
гептан
октан
нонан
декан
Радикал
-СН3
-С2 Н5
-С3 Н7
-С4Н9
-С5Н11
-С6Н13
-С7Н15
-С8Н17
-С9Н19
-С10Н21
Название
метил
этил
пропил
бутил
пентил
гексил
гептил
октил
нонил
децил
11. ВЫУЧИТЬ!!!
12.
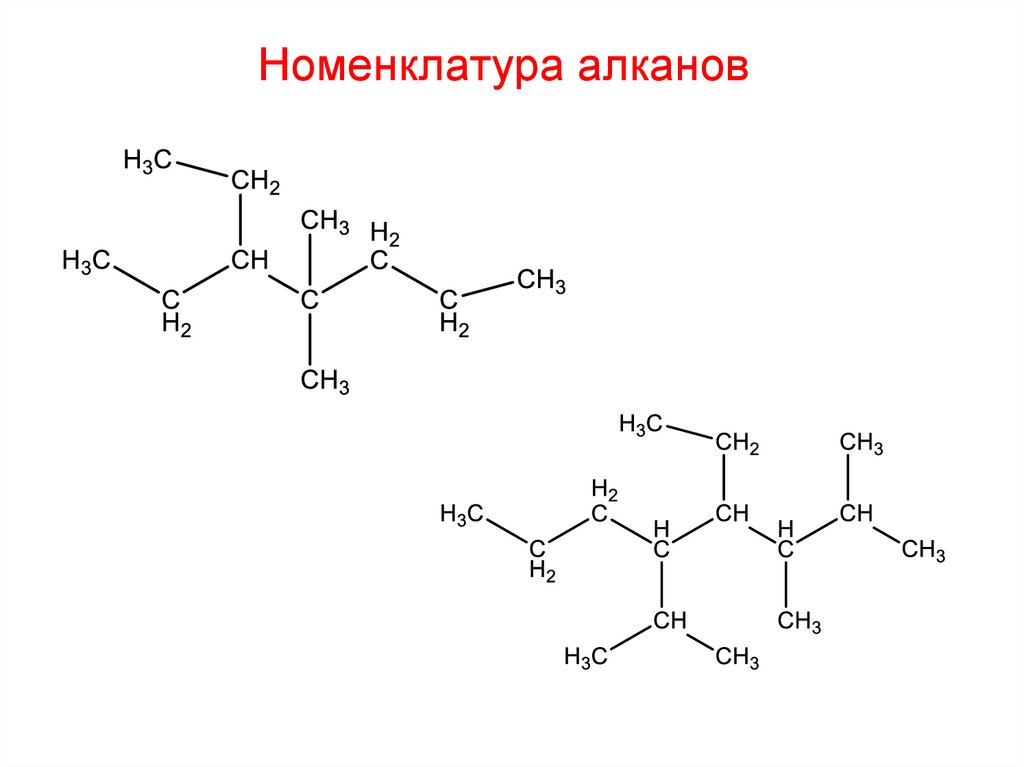
Номенклатура алканов1. Выбрать наиболее длинную углеродную цепь
2. Пронумеровать атомы углерода в выбранной цепи с того конца, к
которому ближе находится заместитель.
1
2
4
3
6
7
5
гептан
12
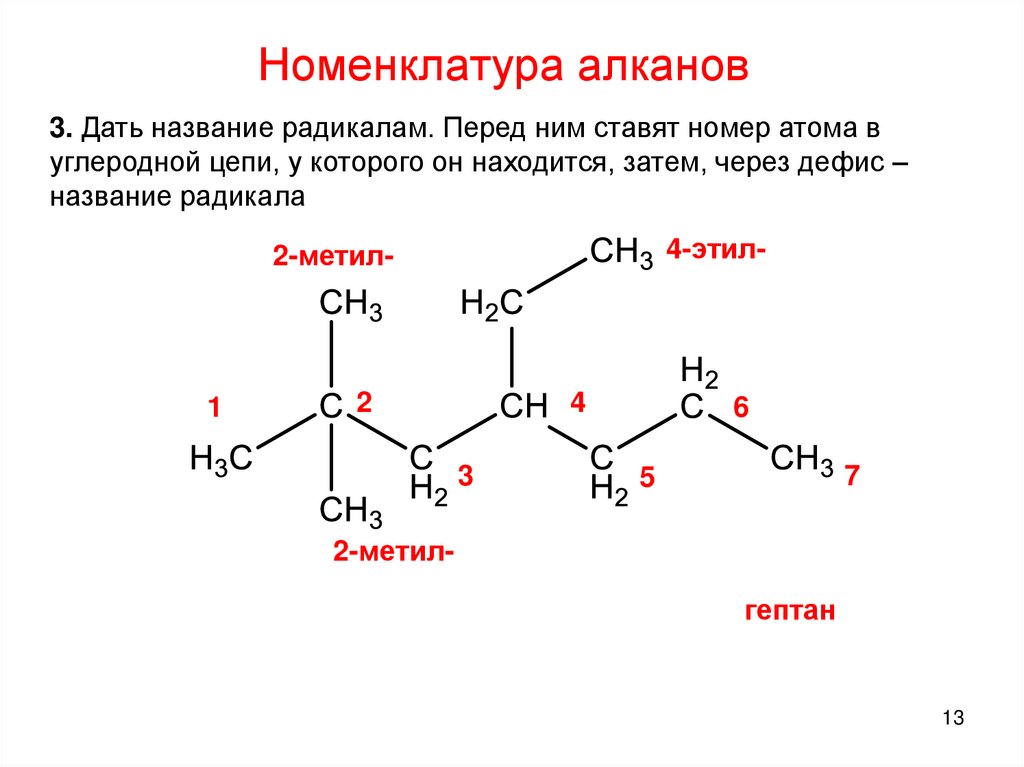
13.
Номенклатура алканов3. Дать название радикалам. Перед ним ставят номер атома в
углеродной цепи, у которого он находится, затем, через дефис –
название радикала
4-этил-
2-метил-
1
2
4
3
6
7
5
2-метилгептан
13
14.
Номенклатура алканов4. Перечисляют радикалы в алфавитном порядке.
Если в формуле встречаются одинаковые радикалы, то сначала
через запятые перечисляют цифрами местоположения
разветвлений, затем их количество и названия. Количество
одинаковых радикалов обозначается греческими числительными
«ди» (два)
4-этил«три» (три)
2-метил«тетра» (4)
«пента» (5)
1
2
4
3
6
5
7
2-метил-
2,2 - диметил – 4 - этилгептан
14
15.
Номенклатура алканов16.
Номенклатура алканов16
17.
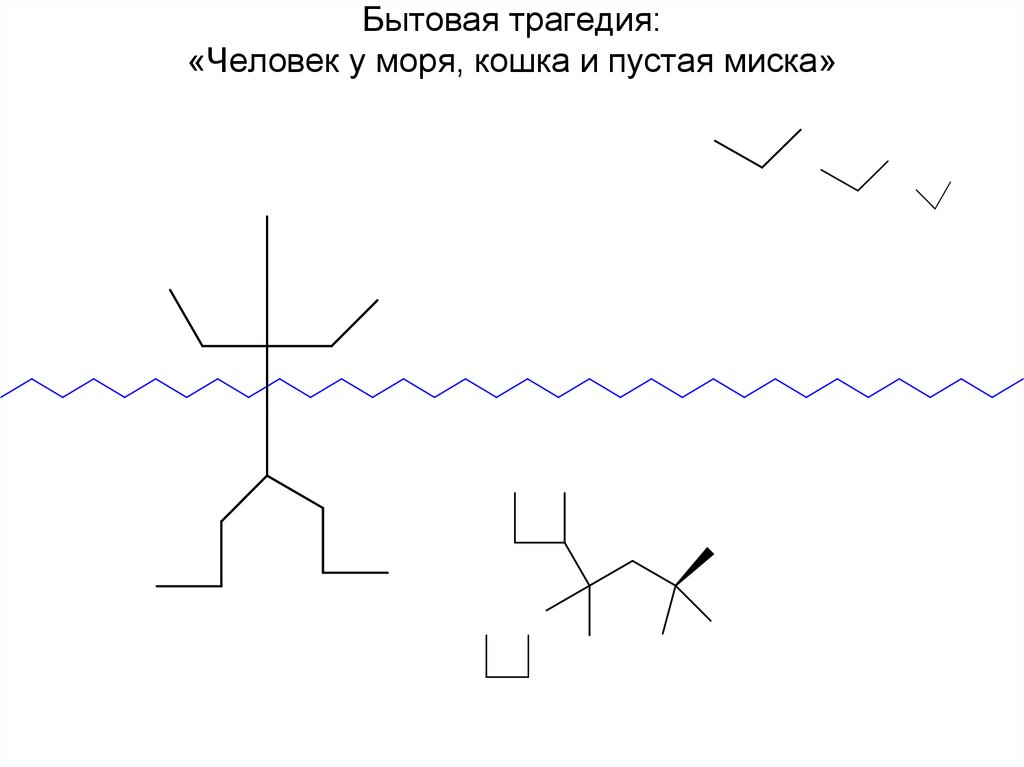
Бытовая трагедия:«Человек у моря, кошка и пустая миска»
18. Механизмы разрыва ковалентной связи
ГомолитическийX
Гетеролитический
:Y
X
:Y
(h )
.
.
X+ +
X + Y
Свободные радикалы
:Y
Ионы
X+ - электрофил
SR
AdR
S – англ. substitution –
замещение
A – англ. addition –
присоединение
Y- - нуклеофил
S
SE SN
Ad
AdE AdN
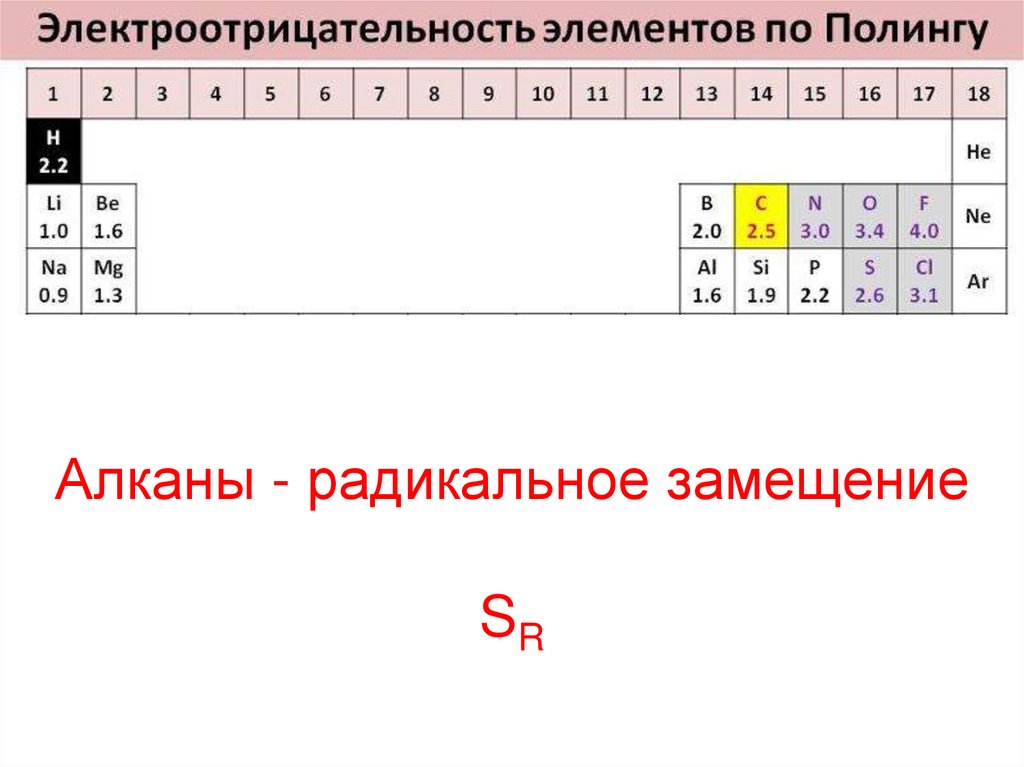
19. Алканы - радикальное замещение SR
1920.
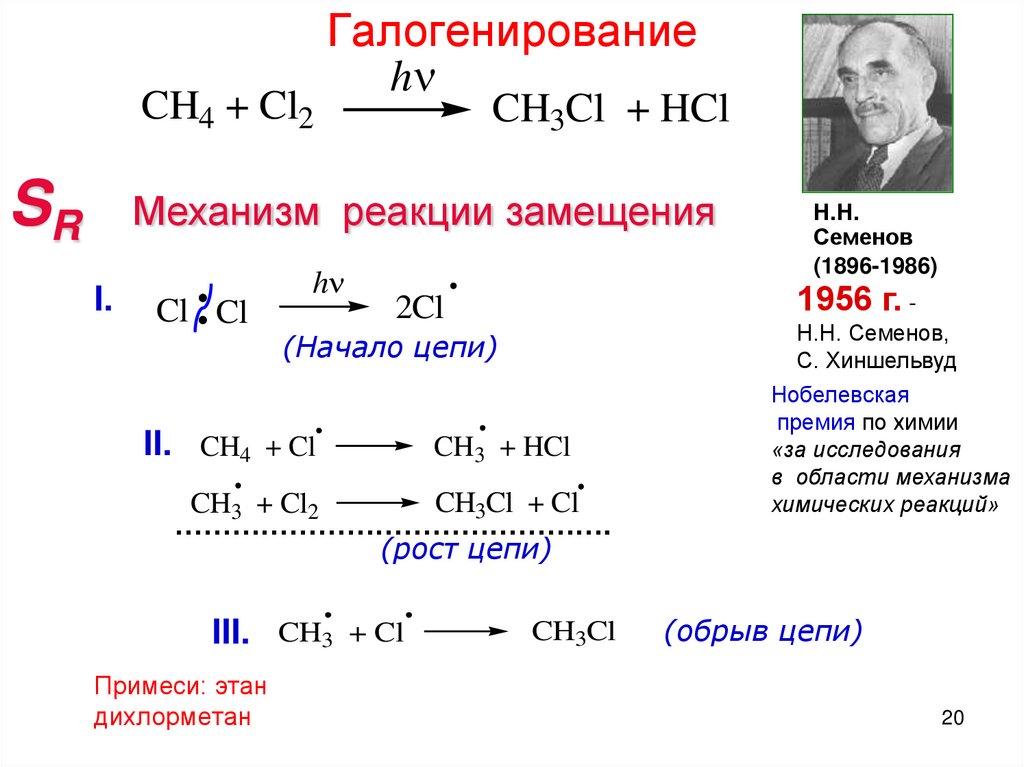
CH4 + Cl2SR
Галогенирование
h
CH3Cl + HCl
Механизм реакции замещения
I.
Cl Cl
h
1956 г. -
2Cl
(Начало цепи)
II. CH4 + Cl
CH3 + HCl
CH3Cl + Cl
CH3 + Cl2
……………………………………….
(рост цепи)
III. CH3 + Cl
Примеси: этан
дихлорметан
Н.Н.
Семенов
(1896-1986)
CH3Cl
Н.Н. Семенов,
С. Хиншельвуд
Нобелевская
премия по химии
«за исследования
в области механизма
химических реакций»
(обрыв цепи)
20
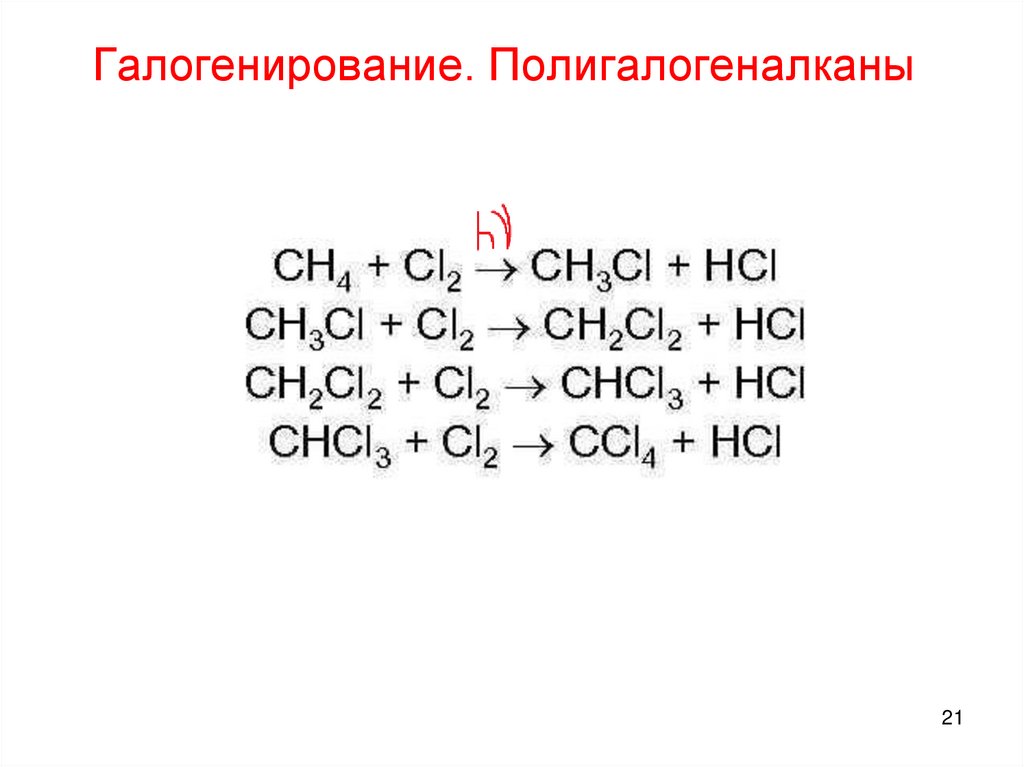
21.
Галогенирование. Полигалогеналканы21
22. Ингибиторы радикальных реакций
OHJ2
CH3
H3C
NO
H3C
OH
C
CH3
CH3
C
CH3
CH3
OCH3
(от лат. inhibeo - удерживаю)
CH3
CH3
+ CH3
CH3
OCH3
CH3
C
CH3
C
OH
CH3
OH
H3C
O
C
CH3
C
CH4 + CH3
CH3
CH3
OCH3
22
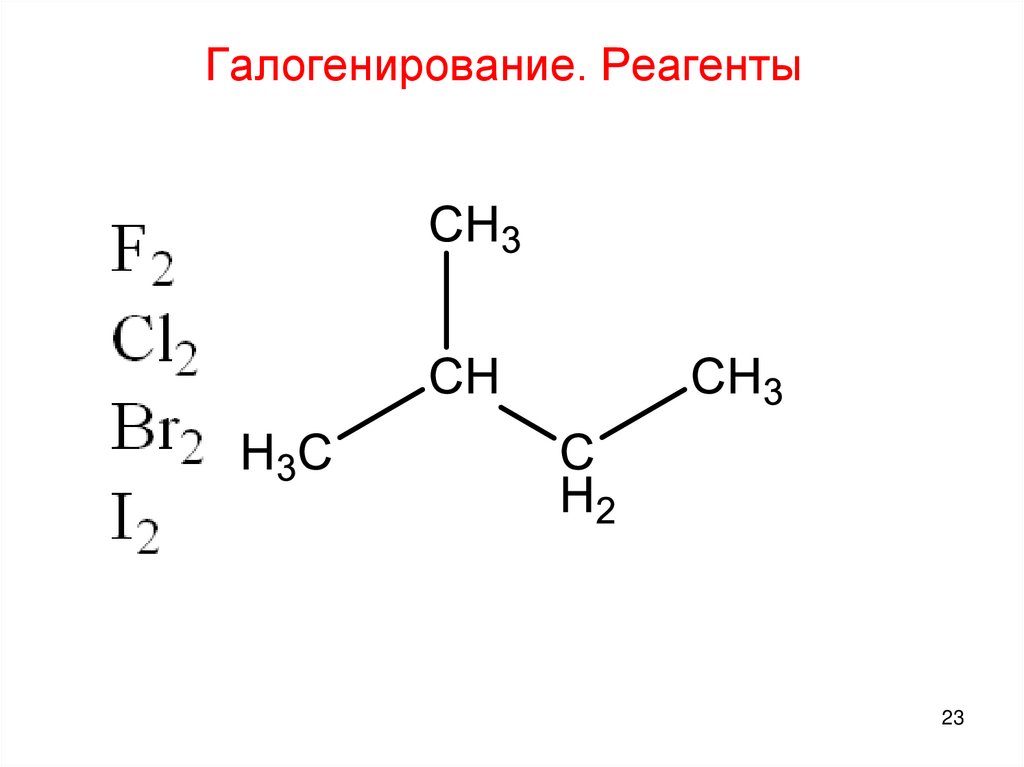
23.
Галогенирование. Реагенты23
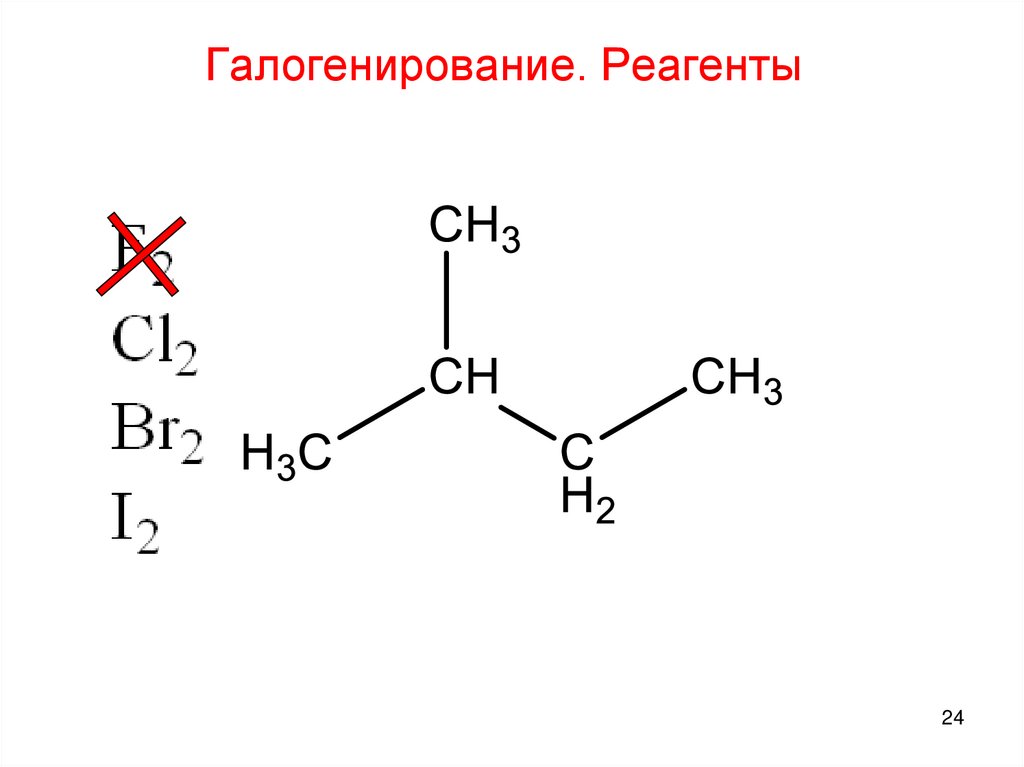
24.
Галогенирование. Реагенты24
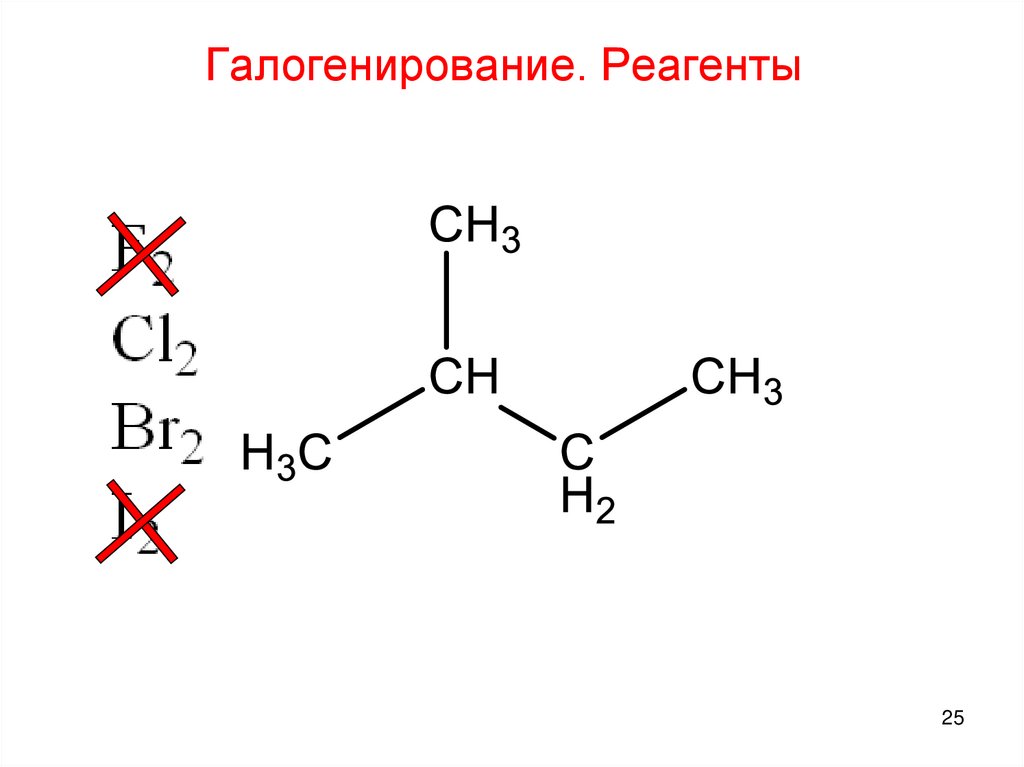
25.
Галогенирование. Реагенты25
26.
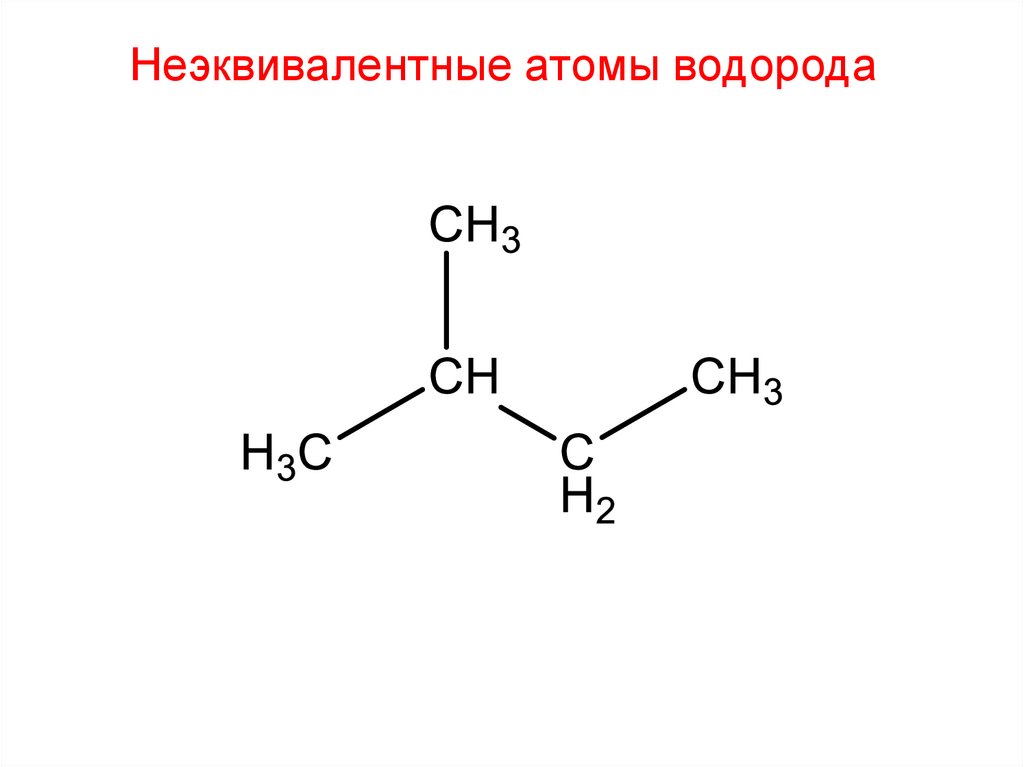
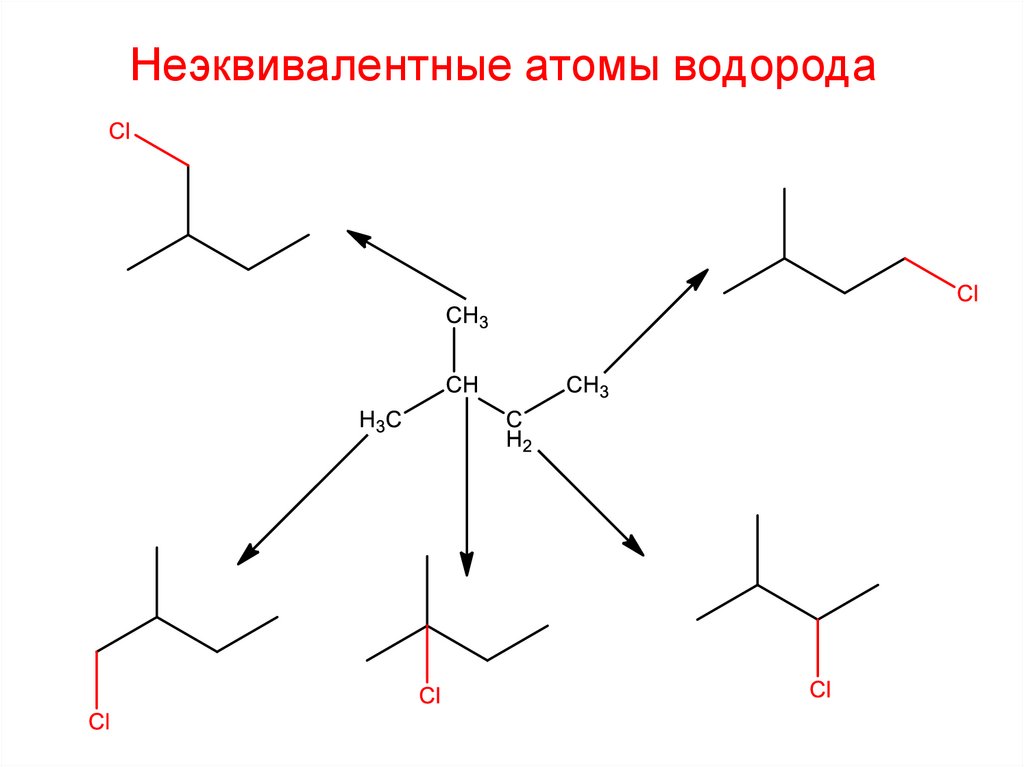
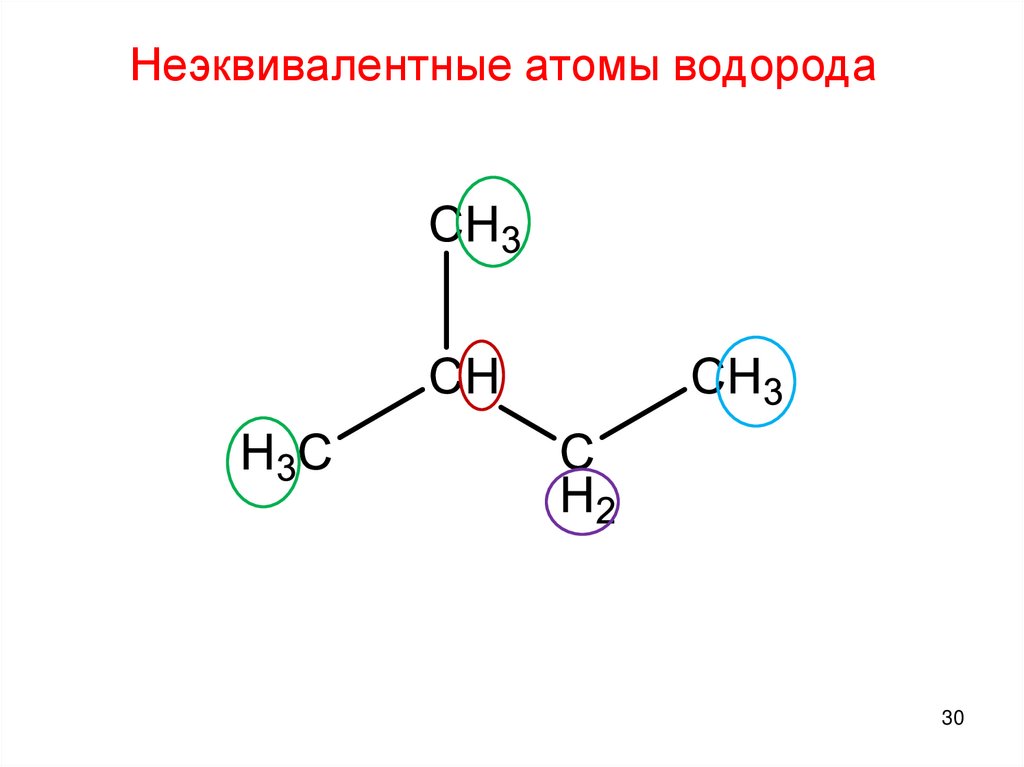
Неэквивалентные атомы водорода27.
Неэквивалентные атомы водорода28.
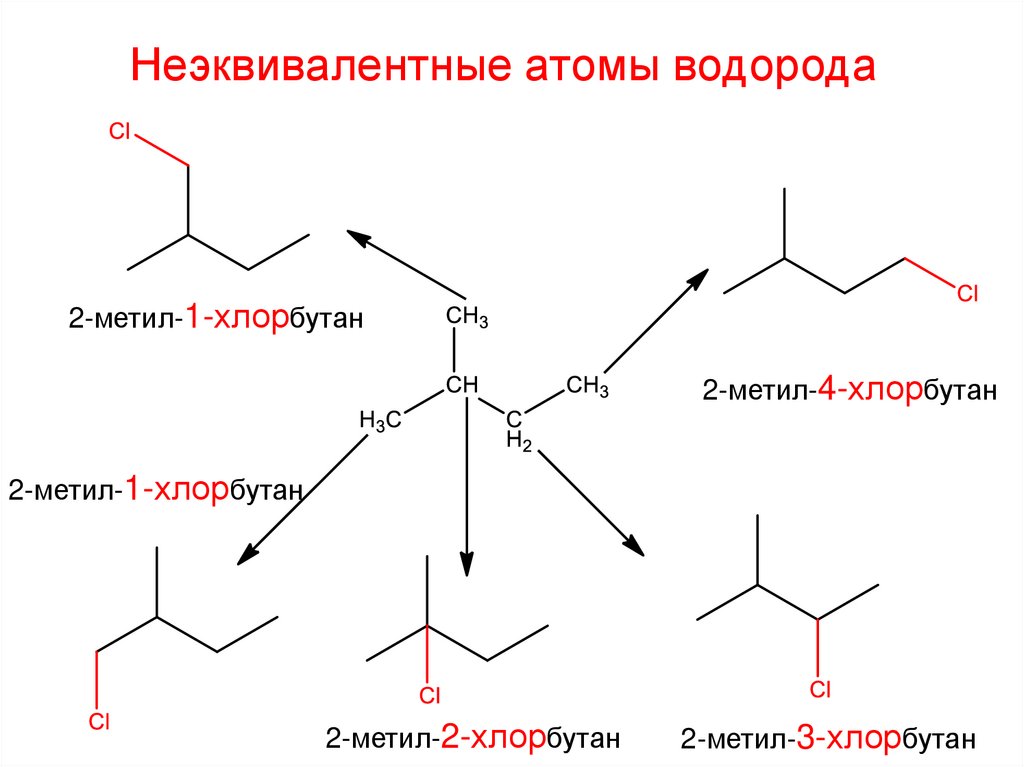
Неэквивалентные атомы водорода2-метил-1-хлорбутан
2-метил-4-хлорбутан
2-метил-1-хлорбутан
2-метил-2-хлорбутан
2-метил-3-хлорбутан
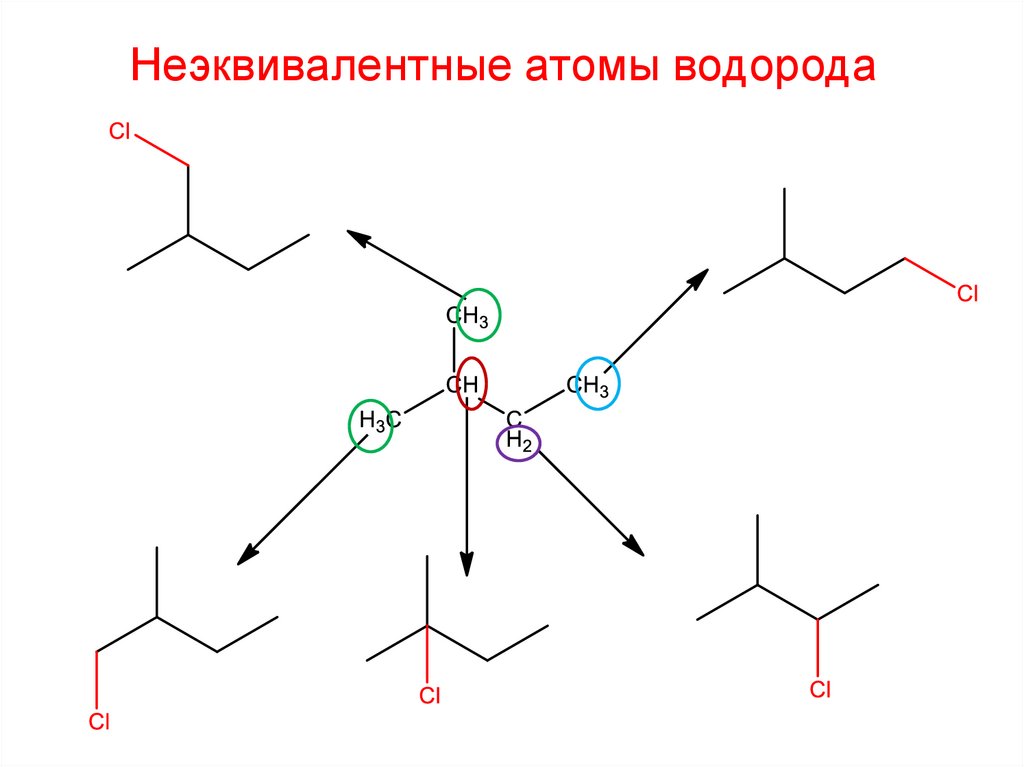
29.
Неэквивалентные атомы водорода30.
Неэквивалентные атомы водорода30
31.
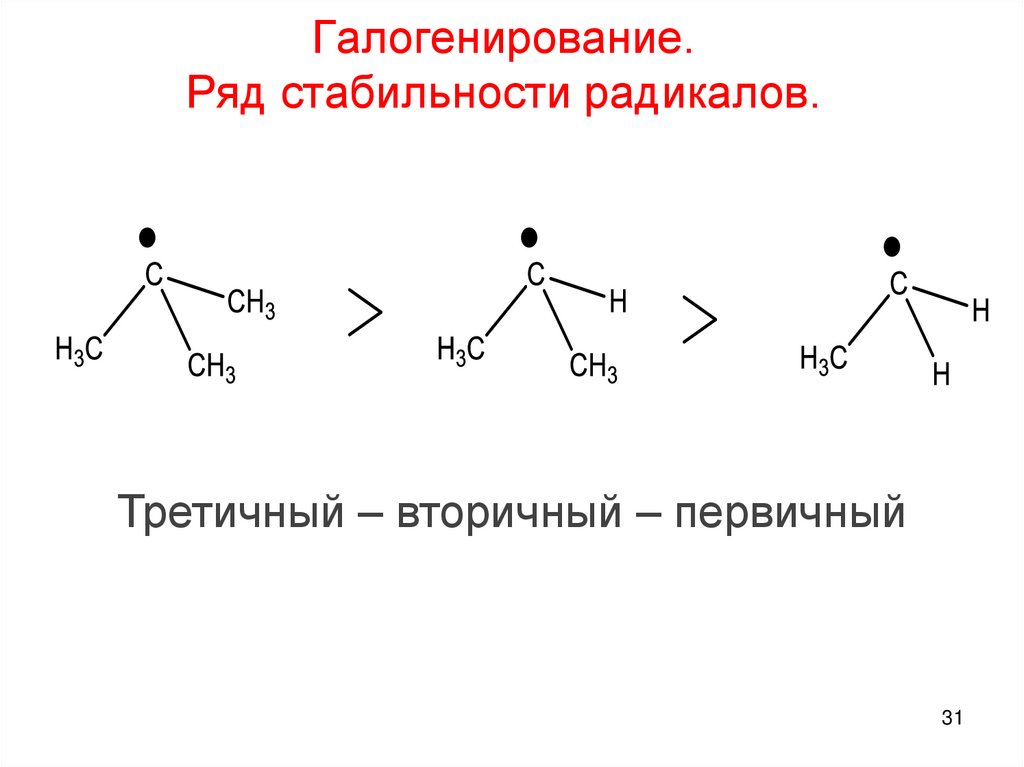
Галогенирование.Ряд стабильности радикалов.
Третичный – вторичный – первичный
31
32.
2) Нитрование(реакция М.И. Коновалова)
CH4 + HNO3(раствор) t˚С → CH3NO2 + H2O
нитрометан
3) Конверсия метана водяным паром с
образованием синтез – газа (СО + Н2)
CH4 + H2O 800˚C, Ni → СО + 3Н2
4) Реакции горения
(горят светлым не коптящим пламенем)
CnH2n+2 + (1,5n+0,5)O2 t°С → nCO2 + (n+1)H2O
32
33.
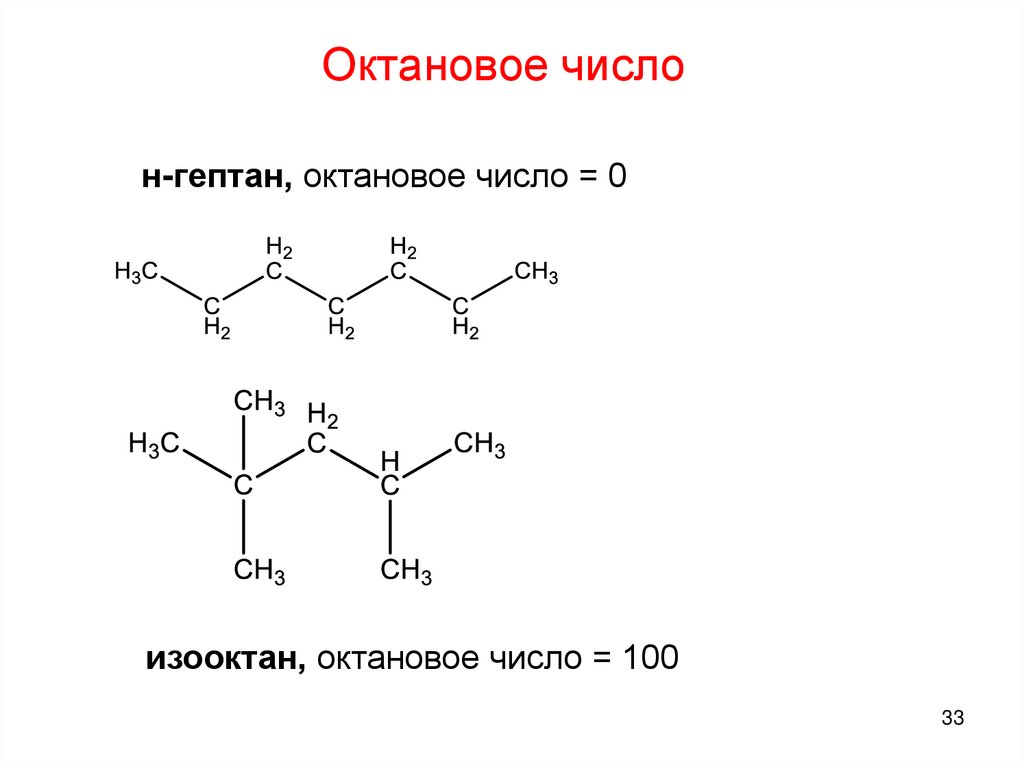
Октановое числон-гептан, октановое число = 0
изооктан, октановое число = 100
33
34.
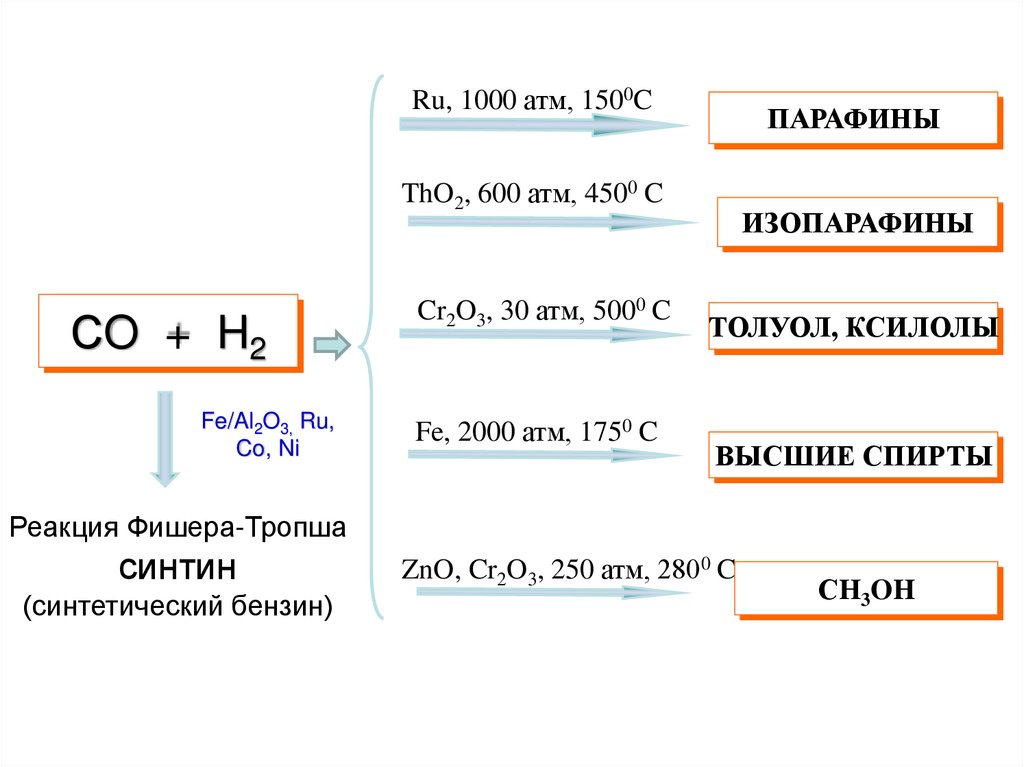
Ru, 1000 атм, 1500CПАРАФИНЫ
ThO2, 600 атм, 4500 C
СO + H2
Fe/Al2O3, Ru,
Co, Ni
Cr2O3, 30 атм, 5000 C
Fe, 2000 атм, 1750 C
ИЗОПАРАФИНЫ
ТОЛУОЛ, КСИЛОЛЫ
ВЫСШИЕ СПИРТЫ
Реакция Фишера-Тропша
синтин
(синтетический бензин)
ZnO, Cr2O3, 250 атм, 2800 C
СH3OH
35.
5) Неполный пиролиз метана принагревании до 1500 С происходит
образование ацетилена и водорода:
2CH4 1500°С → C2H2 + 3H2
6) Дегидрирование
CnH2n+2 t˚С, Ni или Pd → CnH2n + H2
7) Крекинг при температуре 700-1000°С
разрываются (-С-С-) связи:
C10H22 t°С → C5H12 + C5H10
алкан
алкен
8) Изомеризация
35
36.
ПОЛУЧЕНИЕ37.
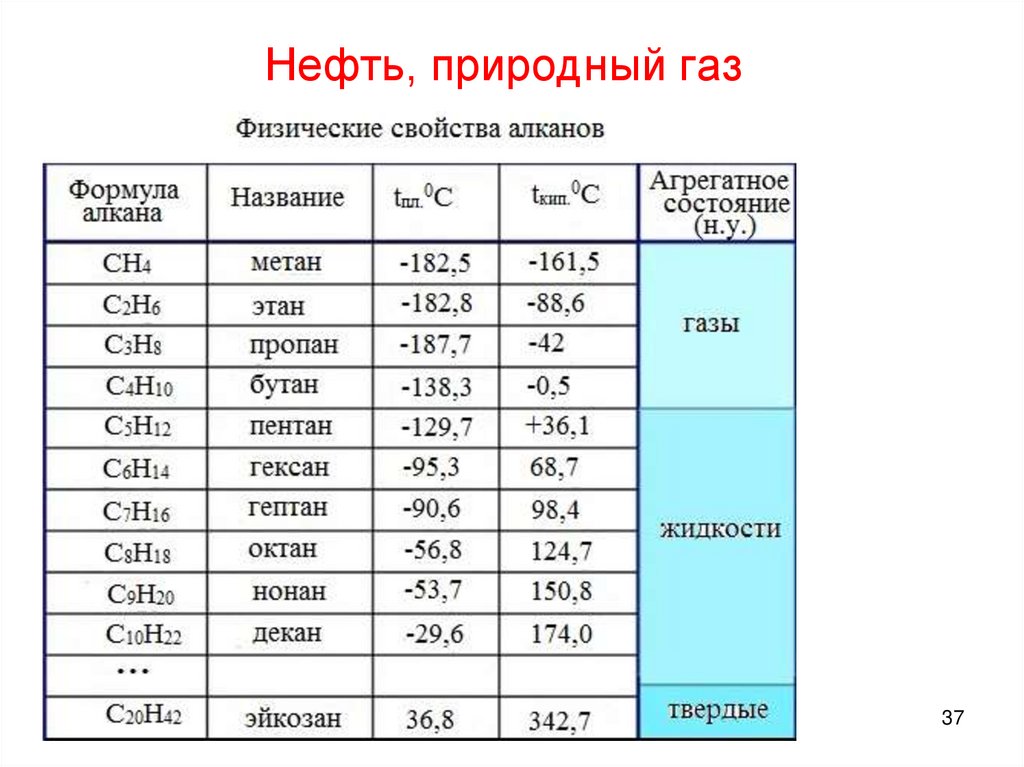
Нефть, природный газ37
38.
Нефть, природный газПриродный
газ СH4 – C4H10
Нефть
C5H12 – C30H62
38
39.
3940.
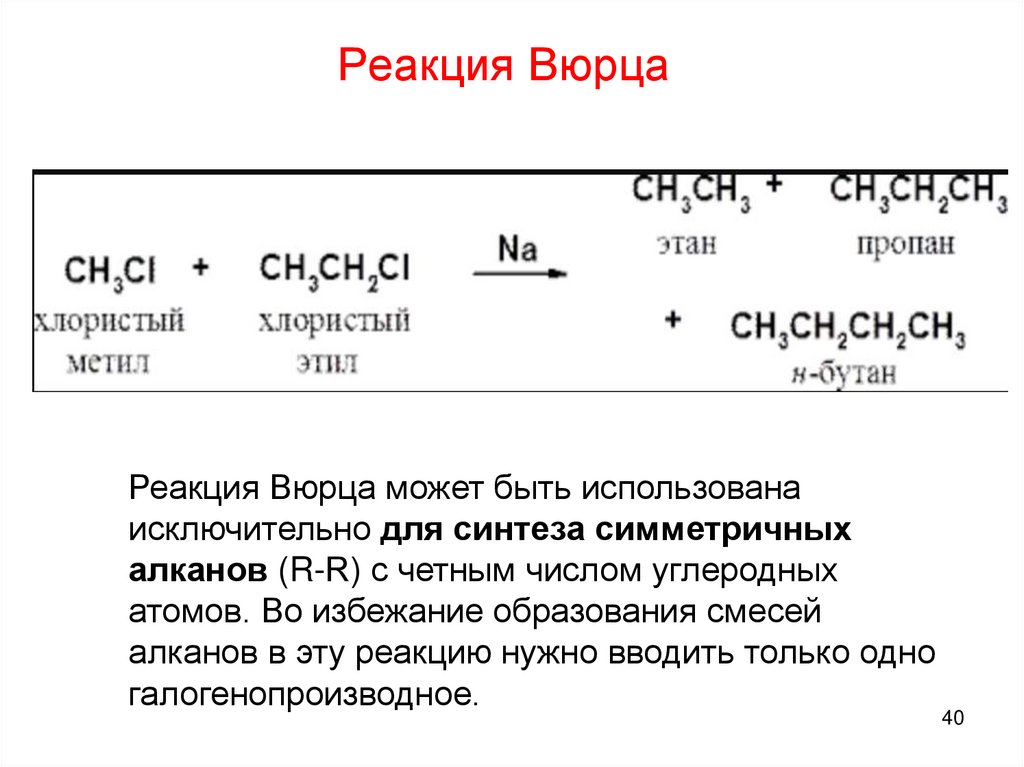
Реакция ВюрцаРеакция Вюрца может быть использована
исключительно для синтеза симметричных
алканов (R-R) с четным числом углеродных
атомов. Во избежание образования смесей
алканов в эту реакцию нужно вводить только одно
галогенопроизводное.
40
41.
Гидролиз карбидов4Al + 3C = Al4C3
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3
41
42.
6) Гидрирование непредельныхсоединений. Например:
CnH2n + H2t˚С, Ni или Pd → CnH2n+2
7) Крекинг при температуре 700-1000°С
разрываются (-С-С-) связи:
C10H22 t°С → C5H12 + C5H10
алкан
алкен
42
43.
Получение из солей карбоновых кислотРеакция Кольбе (электролиз)
2RCOONa + 2H2O = R-R + 2CO2 +2NaOH + H2
Сплавление безводных солей кислот со щелочью
RCOONa + NaOH = R-H + 2Na2CO3
43

















 Химия
Химия








