Похожие презентации:
Ковалентная химическая связь
1.
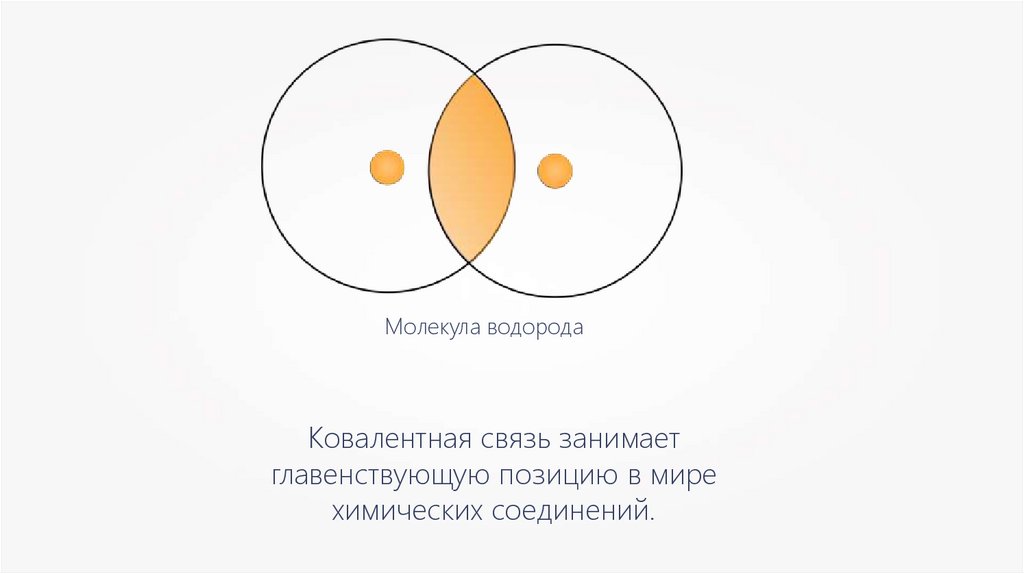
Молекула водородаКовалентная связь занимает
главенствующую позицию в мире
химических соединений.
2.
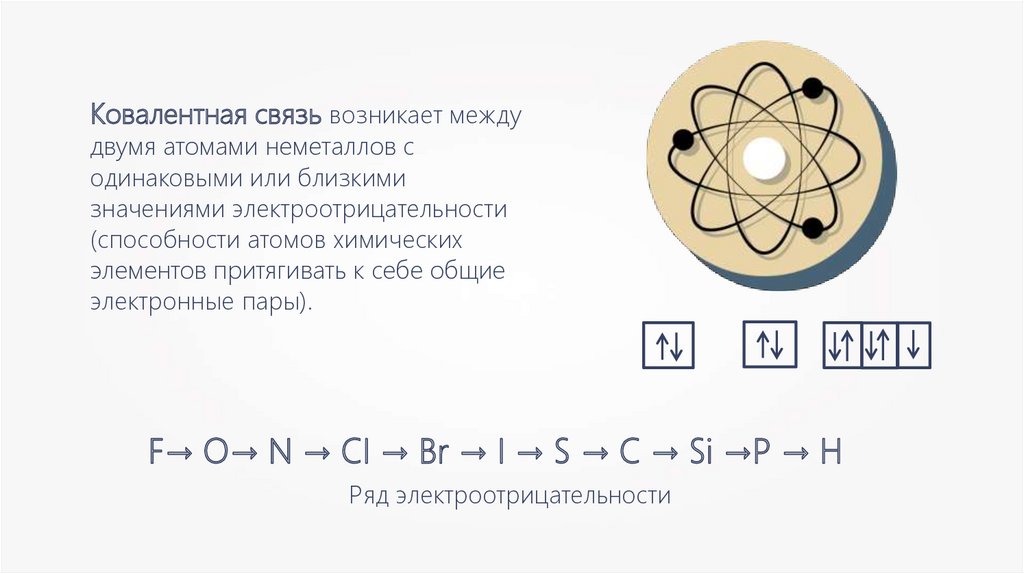
Ковалентная связь возникает междудвумя атомами неметаллов с
одинаковыми или близкими
значениями электроотрицательности
(способности атомов химических
элементов притягивать к себе общие
электронные пары).
F→ O→ N → CI → Br → I → S → C → Si →P → H
Ряд электроотрицательности
3.
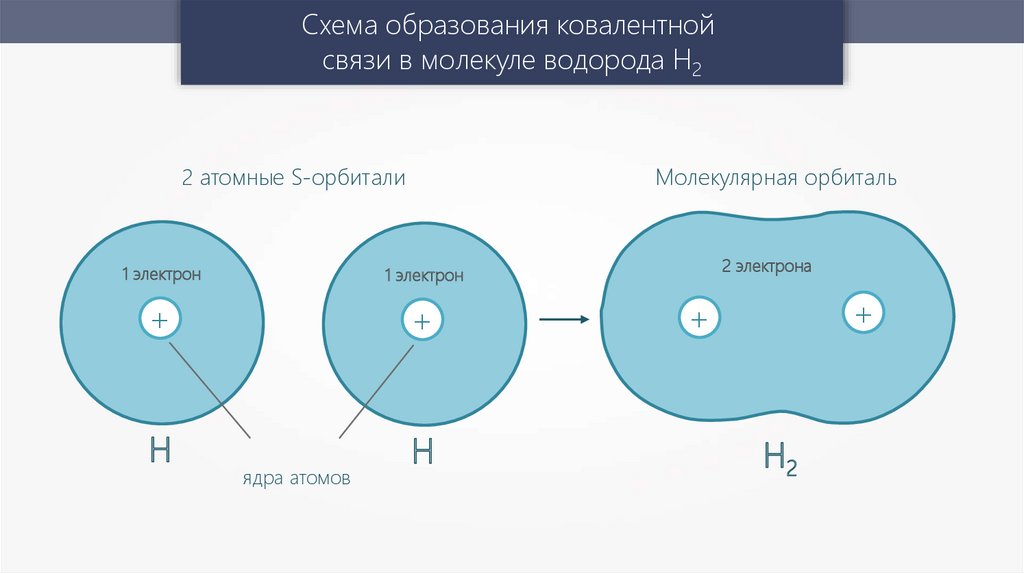
Схема образования ковалентнойсвязи в молекуле водорода Н2
Молекулярная орбиталь
2 атомные S-орбитали
1 электрон
1 электрон
+
+
H
H
ядра атомов
2 электрона
+
+
Н2
4.
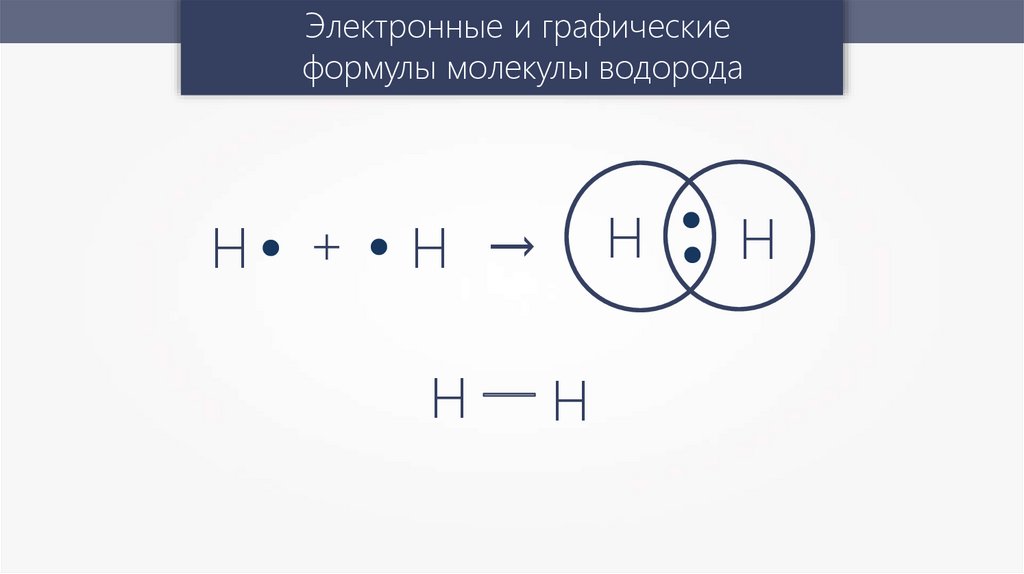
Электронные и графическиеформулы молекулы водорода
Н
+
Н →
Н—Н
Н
Н
5.
НН
Ковалентная химическая связь –
химическая связь между атомами,
которая осуществляется за счёт
образования общих электронных пар.
6.
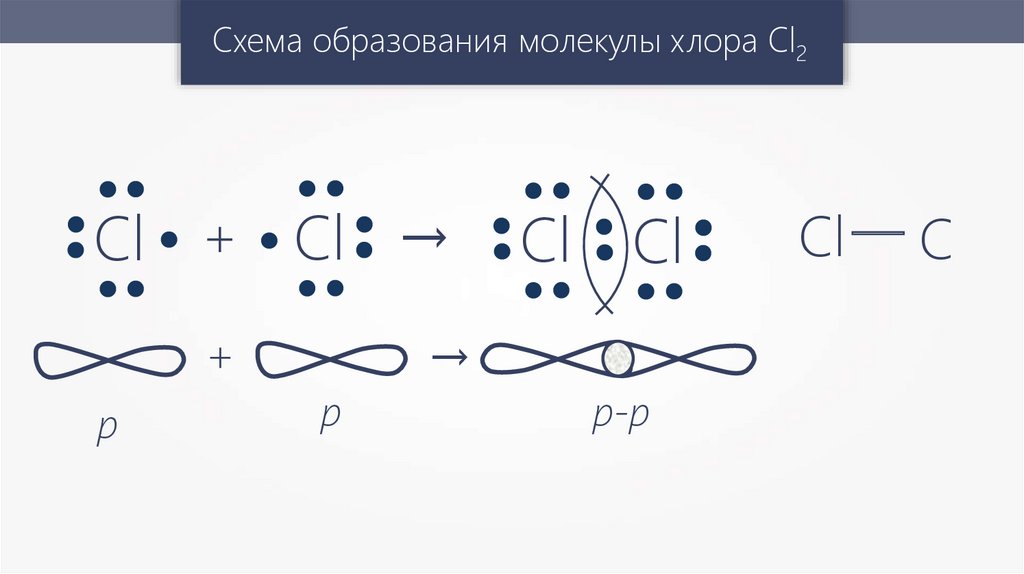
Схема образования молекулы хлора Cl2Cl + Cl →
+
p
p
→
Cl Cl
p-p
Cl — C
7.
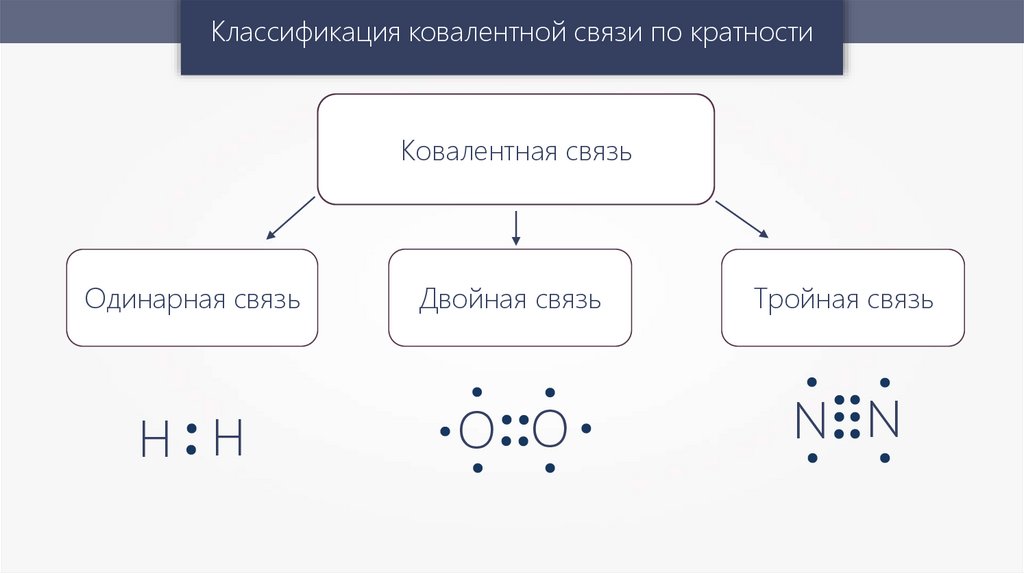
Классификация ковалентной связи по кратностиКовалентная связь
Одинарная связь
Двойная связь
Тройная связь
Н Н
O O
N N
8.
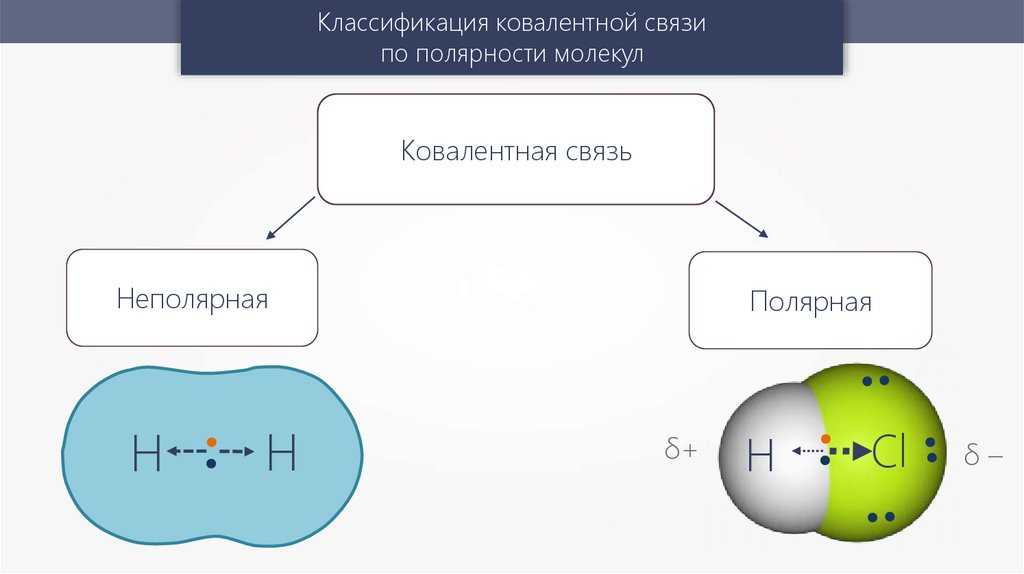
Классификация ковалентной связипо полярности молекул
Ковалентная связь
Неполярная
Н
Н
Полярная
δ+
H
Сl
δ–
9.
–+
Диполь — молекула с двумя
противоположно заряженными
полюсами.
10.
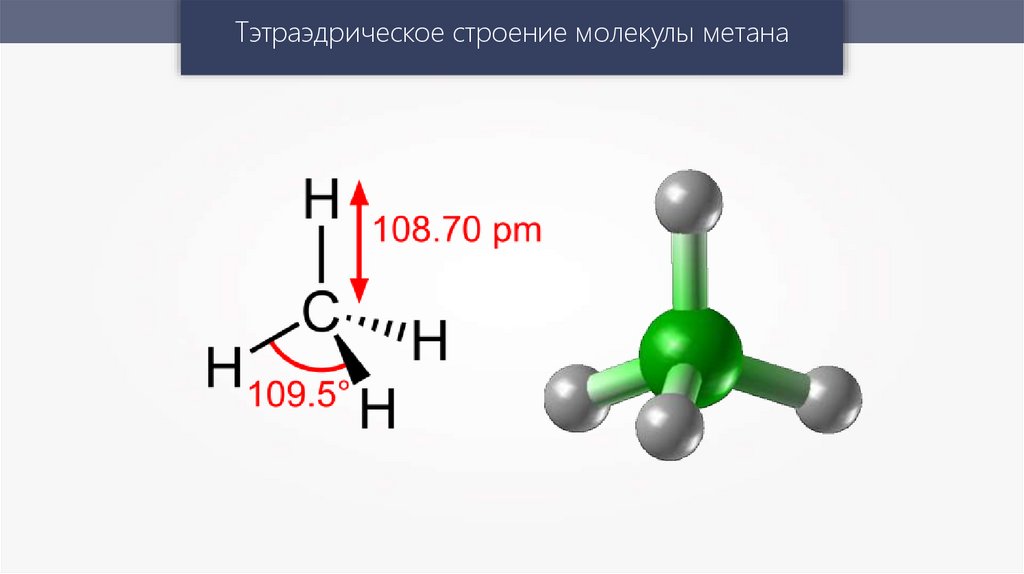
Тэтраэдрическое строение молекулы метана11.
Полярность молекулы зависитне только от полярности связей,
но и от её геометрического
строения.
12.
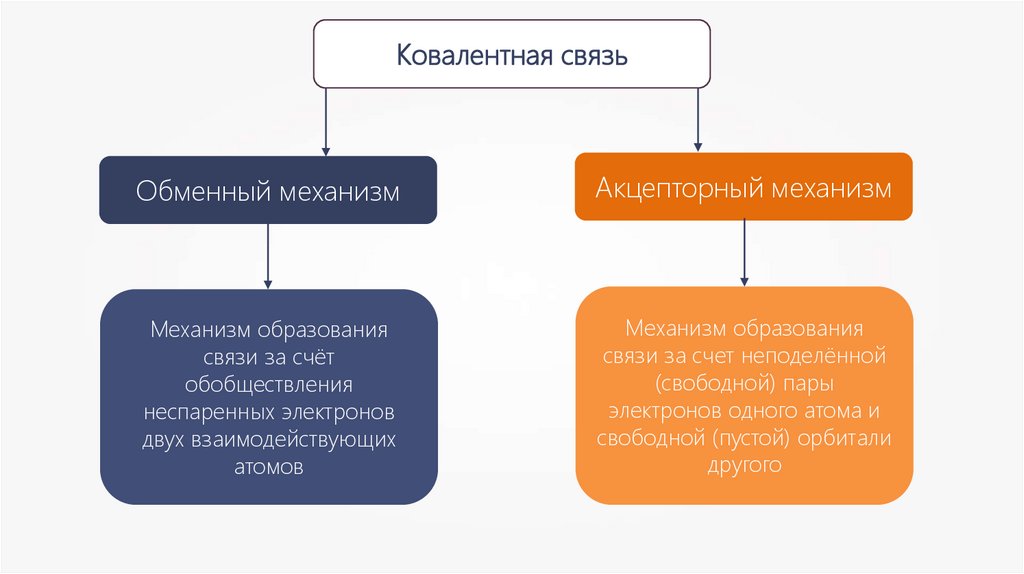
Ковалентная связьОбменный механизм
Акцепторный механизм
Механизм образования
связи за счёт
обобществления
неспаренных электронов
двух взаимодействующих
атомов
Механизм образования
связи за счет неподелённой
(свободной) пары
электронов одного атома и
свободной (пустой) орбитали
другого
13.
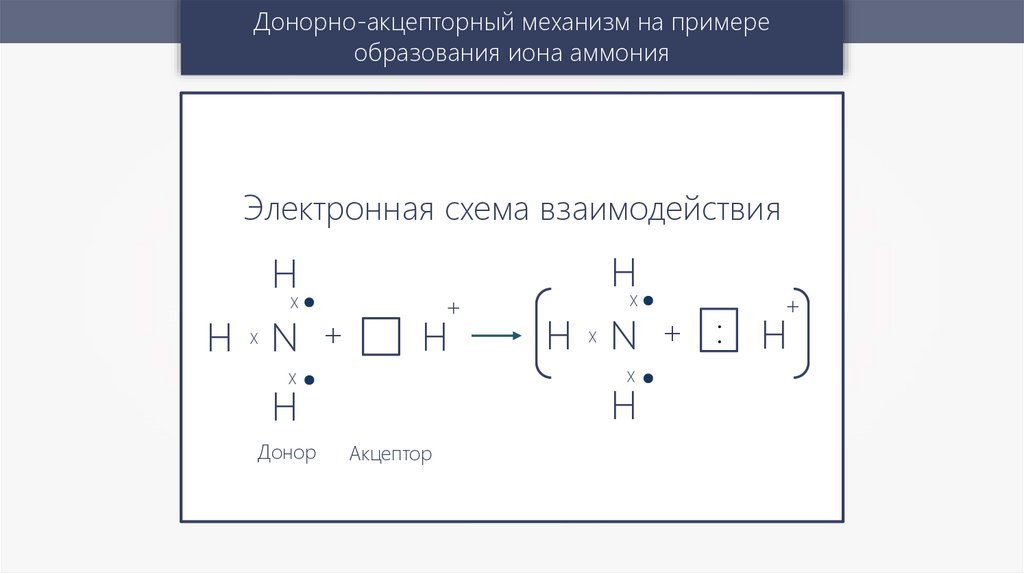
Донорно-акцепторный механизм на примереобразования иона аммония
Полное молекулярное уравнение
NH3 + HCl = NH4Cl
Сокращённое ионное уравнение
+
NH3 + H = NH4
14.
Донорно-акцепторный механизм на примереобразования иона аммония
Электронная схема взаимодействия
Н
X
Н N +
X
+
Н
X
X
Н
Н
Акцептор
+
Н N + : Н
X
X
Донор
Н
15.
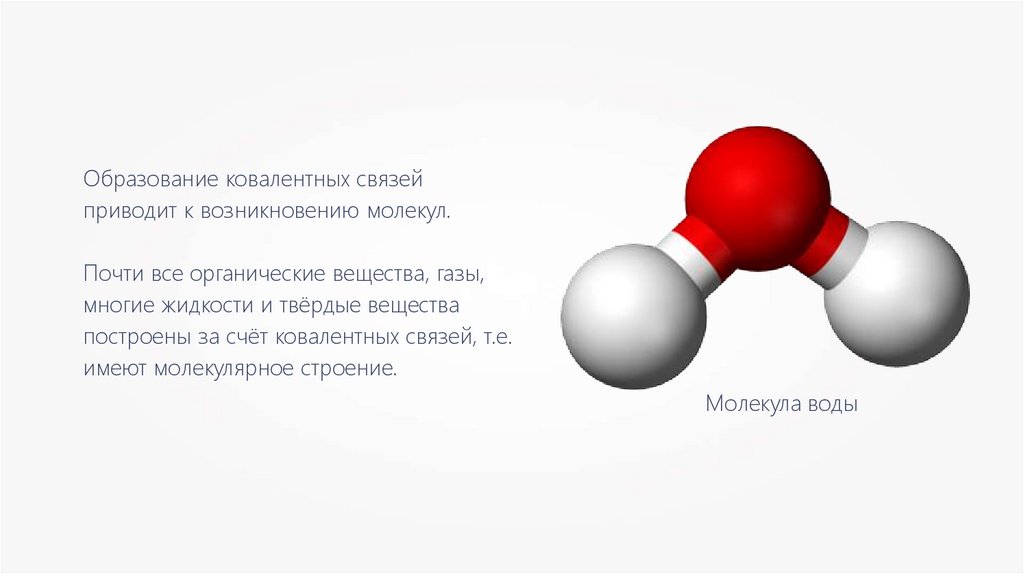
Образование ковалентных связейприводит к возникновению молекул.
Почти все органические вещества, газы,
многие жидкости и твёрдые вещества
построены за счёт ковалентных связей, т.е.
имеют молекулярное строение.
Молекула воды
16.
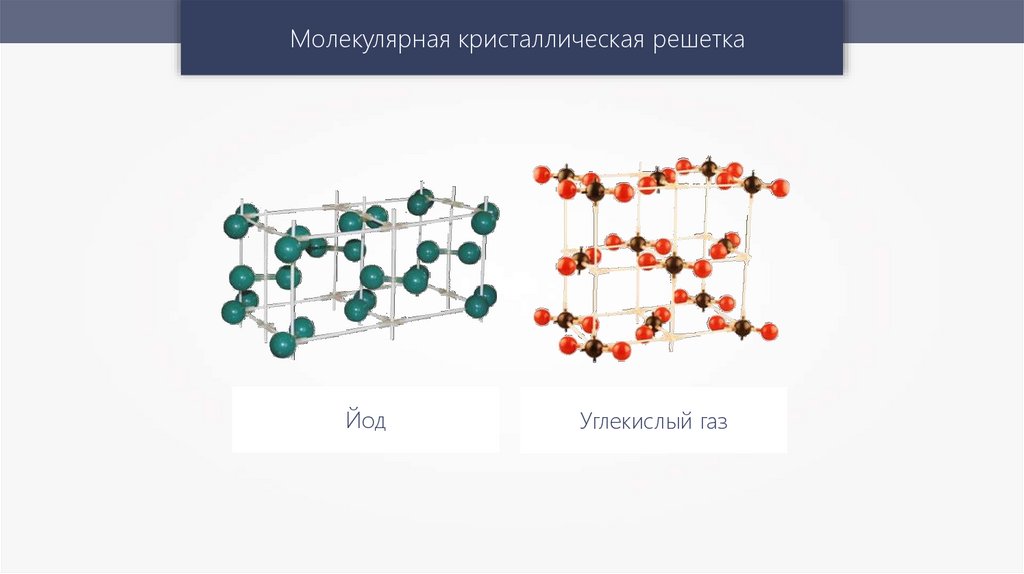
Молекулярная кристаллическая решеткаЙод
Углекислый газ
17.
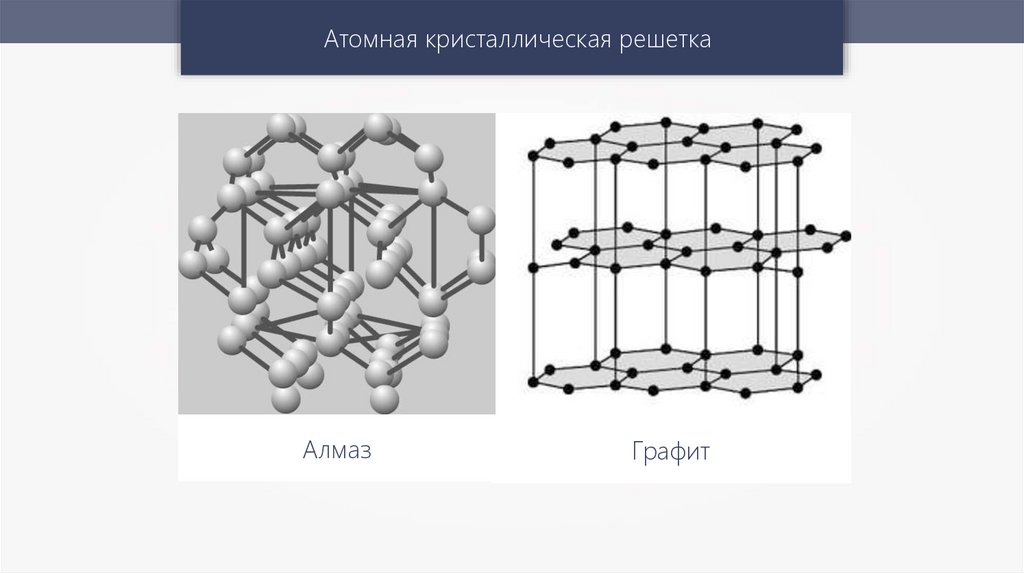
Атомная кристаллическая решеткаАлмаз
Графит




 Химия
Химия








