Похожие презентации:
Биология рака. Выход: инвазия и метастазирование
1.
Биология рака. Выход: инвазия и метастазированиеВыполнил студент 1.5.16в
Сейдинович Ален
2.
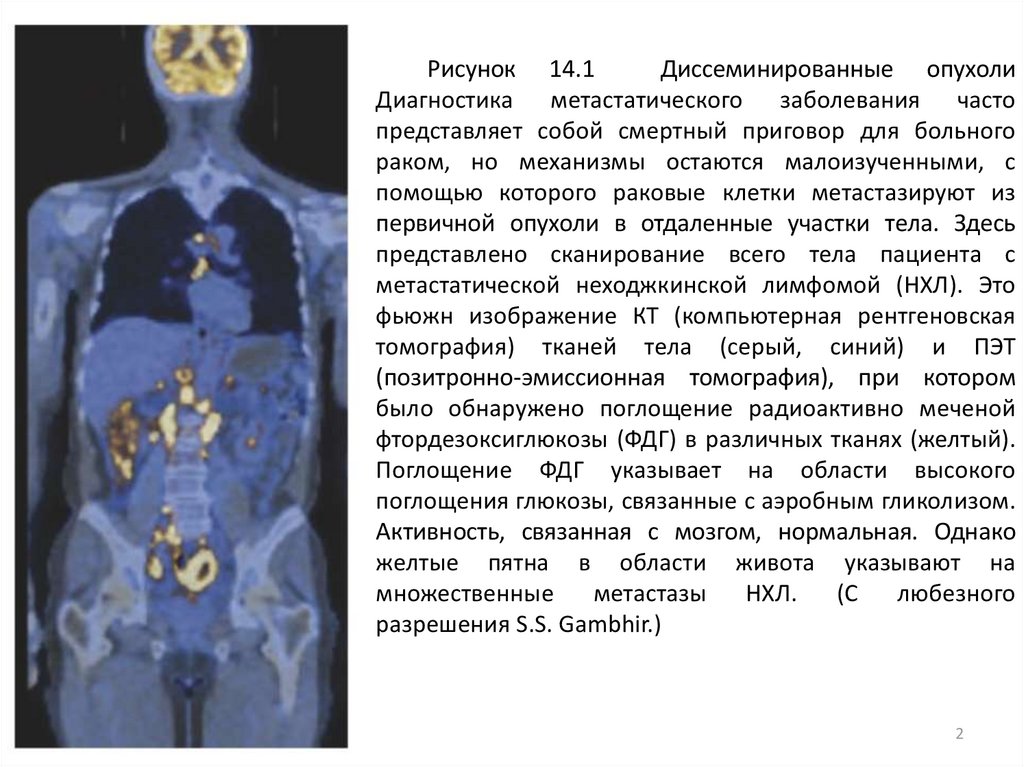
Рисунок 14.1Диссеминированные опухоли
Диагностика метастатического заболевания часто
представляет собой смертный приговор для больного
раком, но механизмы остаются малоизученными, с
помощью которого раковые клетки метастазируют из
первичной опухоли в отдаленные участки тела. Здесь
представлено сканирование всего тела пациента с
метастатической неходжкинской лимфомой (НХЛ). Это
фьюжн изображение КТ (компьютерная рентгеновская
томография) тканей тела (серый, синий) и ПЭТ
(позитронно-эмиссионная томография), при котором
было обнаружено поглощение радиоактивно меченой
фтордезоксиглюкозы (ФДГ) в различных тканях (желтый).
Поглощение ФДГ указывает на области высокого
поглощения глюкозы, связанные с аэробным гликолизом.
Активность, связанная с мозгом, нормальная. Однако
желтые пятна в области живота указывают на
множественные
метастазы
НХЛ.
(С
любезного
разрешения S.S. Gambhir.)
2
3.
Рисунок 14.2 Гистологияметастазов в различных тканях по
всему телу
(A) В модели опухолевого генеза
островковых клеток
поджелудочной железы на
трансгенных мышах Rip-Tag
метастазы через лимфатические
узлы может стимулироваться
принудительной экспрессией
VEGF-C - лимфангиогенного
фактора - в островковых
опухолевых клетках.
(B) Небольшой метастаз рака
груди человека (в центре)
(C) Присутствие скоплений
метастатических клеток
карциномы (синий) в костном
мозге (А, из С.Дж. Мандриота и
др., EMBO J. 20: 672–682, 2001. B,
любезно предоставлено Т.А. Ince.
C, любезно предоставлено П.
Ливиттом, Институт рака ДанаФарбер.)
3
4.
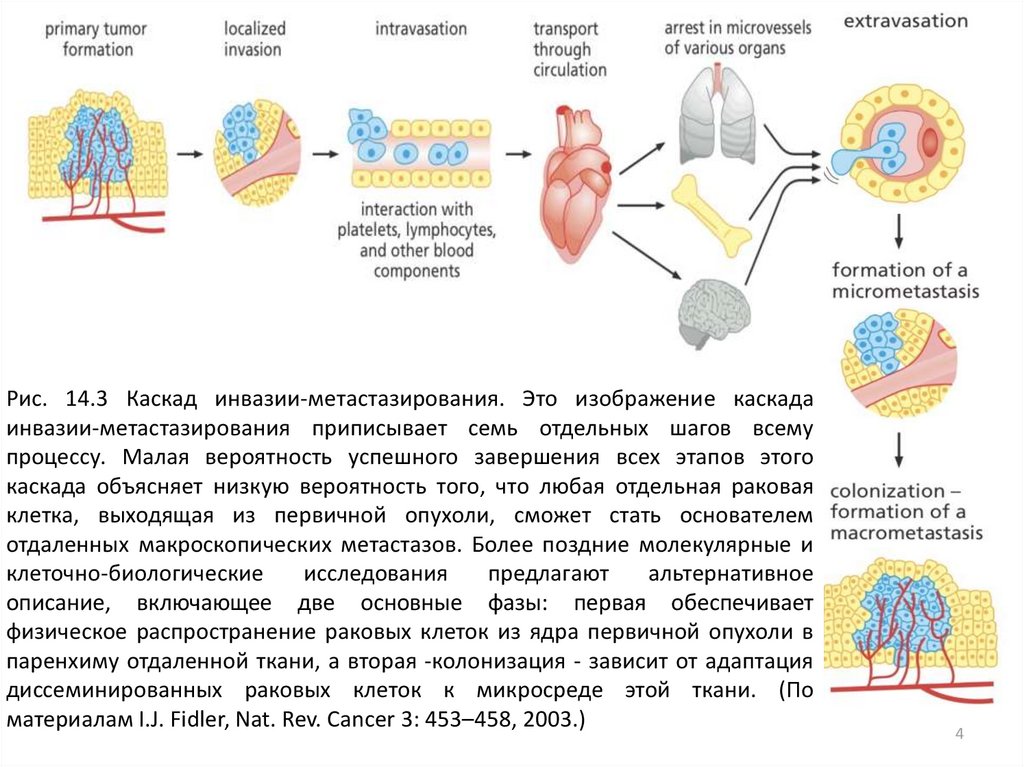
Рис. 14.3 Каскад инвазии-метастазирования. Это изображение каскадаинвазии-метастазирования приписывает семь отдельных шагов всему
процессу. Малая вероятность успешного завершения всех этапов этого
каскада объясняет низкую вероятность того, что любая отдельная раковая
клетка, выходящая из первичной опухоли, сможет стать основателем
отдаленных макроскопических метастазов. Более поздние молекулярные и
клеточно-биологические
исследования
предлагают
альтернативное
описание, включающее две основные фазы: первая обеспечивает
физическое распространение раковых клеток из ядра первичной опухоли в
паренхиму отдаленной ткани, а вторая -колонизация - зависит от адаптация
диссеминированных раковых клеток к микросреде этой ткани. (По
материалам I.J. Fidler, Nat. Rev. Cancer 3: 453–458, 2003.)
4
5.
Рисунок 14.4 Нарушение базальной мембраны(A) В более дифференцированных, менее агрессивных частях колоректальной карциномы
островки клеток карциномы, меченные антителом против цитокератина (красный),
окружены BM (зеленый), которые были обнаружены антителом, реактивным с цепью α3
ламинин. Строма между островками клеток карциномы выглядит черной.
(B) В тех частях опухоли, которые кажутся менее дифференцированными и более
инвазивными, это окрашивание выявляет края островков клеток карциномы (стрелки), в
которых отсутствуют БM и, таким образом, непосредственно прилегают к окружающей
строме. (Из S. Spaderna et al., Гастроэнтерология 131: 830–840, 2006.) n14.100, n14.101,
n14.102 / 14.04
5
6.
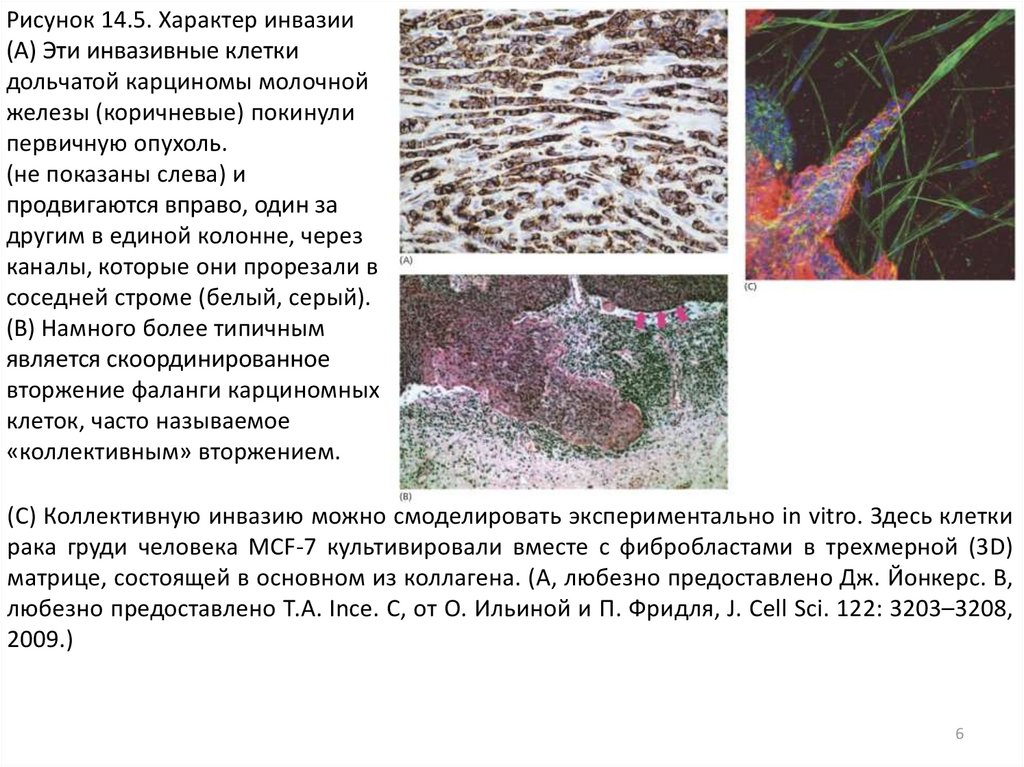
Рисунок 14.5. Характер инвазии(A) Эти инвазивные клетки
дольчатой карциномы молочной
железы (коричневые) покинули
первичную опухоль.
(не показаны слева) и
продвигаются вправо, один за
другим в единой колонне, через
каналы, которые они прорезали в
соседней строме (белый, серый).
(B) Намного более типичным
является скоординированное
вторжение фаланги карциномных
клеток, часто называемое
«коллективным» вторжением.
(C) Коллективную инвазию можно смоделировать экспериментально in vitro. Здесь клетки
рака груди человека MCF-7 культивировали вместе с фибробластами в трехмерной (3D)
матрице, состоящей в основном из коллагена. (A, любезно предоставлено Дж. Йонкерс. B,
любезно предоставлено Т.А. Ince. C, от О. Ильиной и П. Фридля, J. Cell Sci. 122: 3203–3208,
2009.)
6
7.
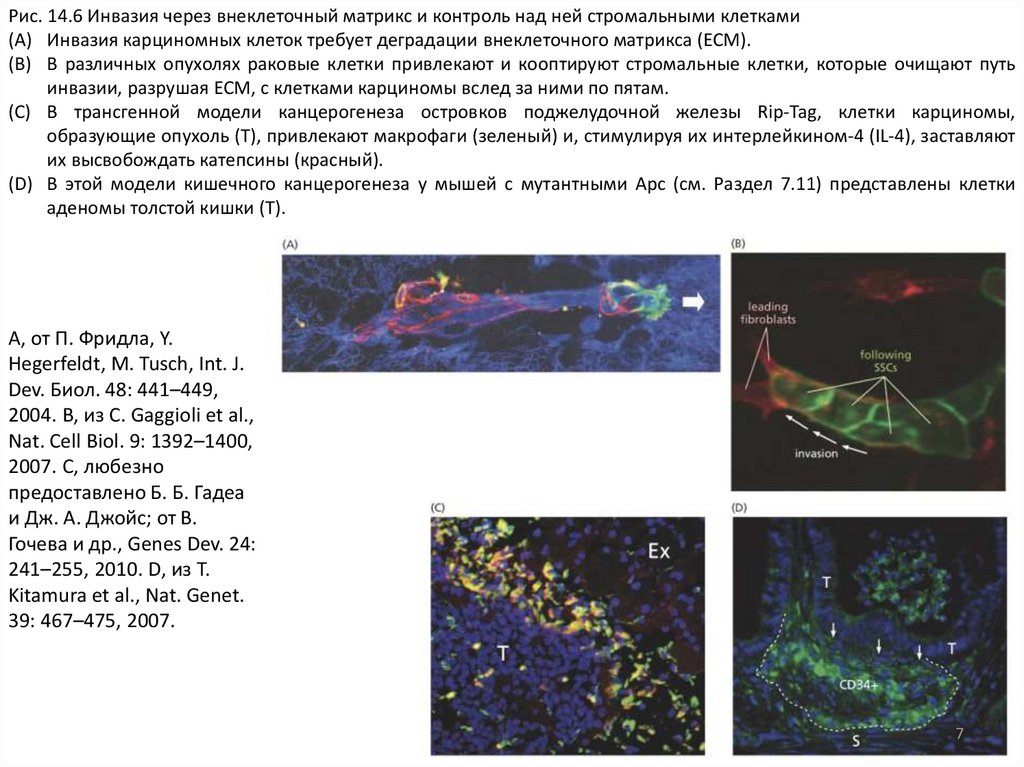
Рис. 14.6 Инвазия через внеклеточный матрикс и контроль над ней стромальными клетками(A) Инвазия карциномных клеток требует деградации внеклеточного матрикса (ECM).
(B) В различных опухолях раковые клетки привлекают и кооптируют стромальные клетки, которые очищают путь
инвазии, разрушая ECM, с клетками карциномы вслед за ними по пятам.
(C) В трансгенной модели канцерогенеза островков поджелудочной железы Rip-Tag, клетки карциномы,
образующие опухоль (T), привлекают макрофаги (зеленый) и, стимулируя их интерлейкином-4 (IL-4), заставляют
их высвобождать катепсины (красный).
(D) В этой модели кишечного канцерогенеза у мышей с мутантными Apc (см. Раздел 7.11) представлены клетки
аденомы толстой кишки (T).
А, от П. Фридла, Y.
Hegerfeldt, M. Tusch, Int. J.
Dev. Биол. 48: 441–449,
2004. B, из C. Gaggioli et al.,
Nat. Cell Biol. 9: 1392–1400,
2007. C, любезно
предоставлено Б. Б. Гадеа
и Дж. А. Джойс; от В.
Гочева и др., Genes Dev. 24:
241–255, 2010. D, из T.
Kitamura et al., Nat. Genet.
39: 467–475, 2007.
7
8.
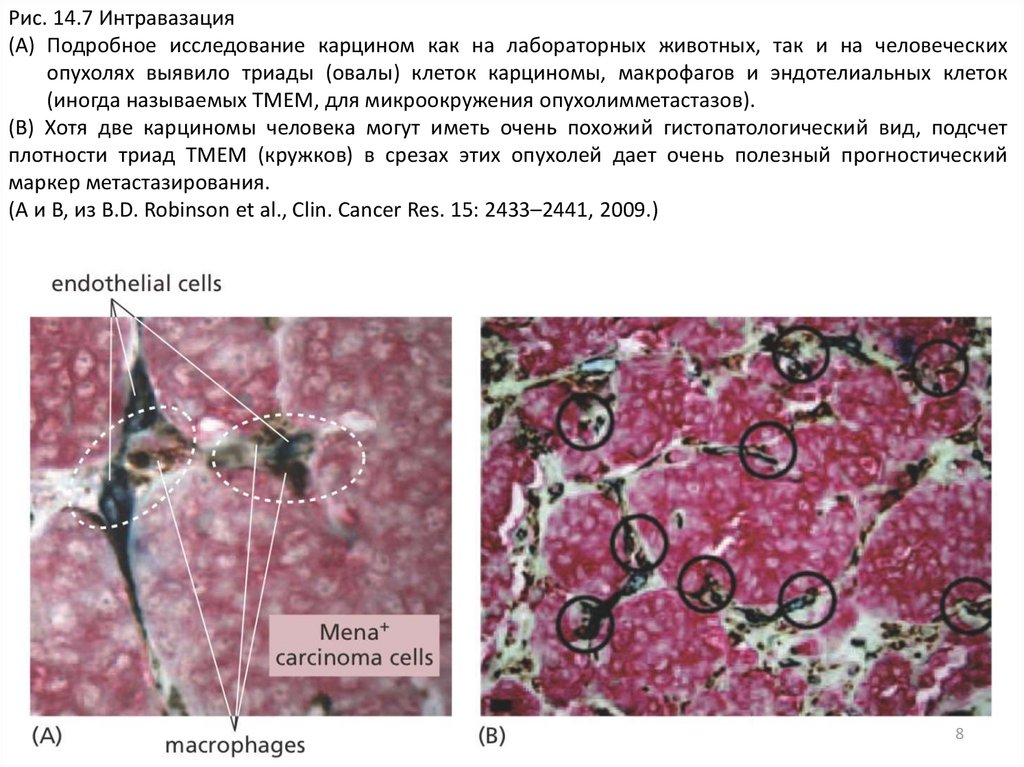
Рис. 14.7 Интравазация(A) Подробное исследование карцином как на лабораторных животных, так и на человеческих
опухолях выявило триады (овалы) клеток карциномы, макрофагов и эндотелиальных клеток
(иногда называемых TMEM, для микроокружения опухолимметастазов).
(B) Хотя две карциномы человека могут иметь очень похожий гистопатологический вид, подсчет
плотности триад TMEM (кружков) в срезах этих опухолей дает очень полезный прогностический
маркер метастазирования.
(A и B, из B.D. Robinson et al., Clin. Cancer Res. 15: 2433–2441, 2009.)
8
9.
Рис. 14.8 Прохождение опухолевых клеток покровотоку
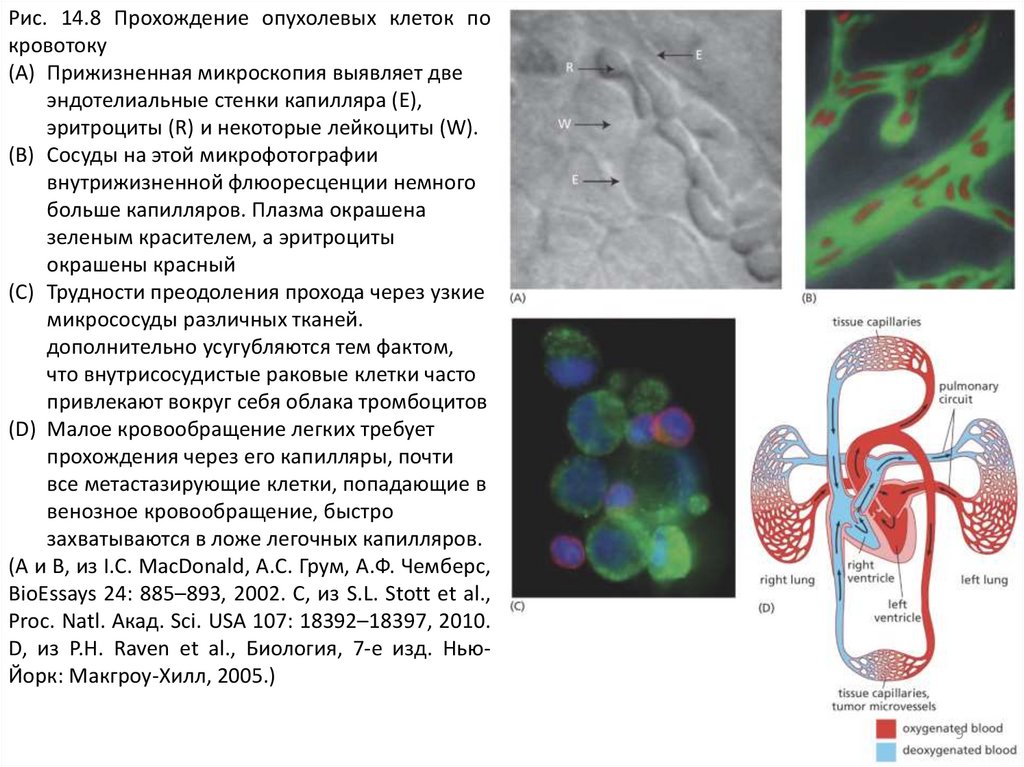
(A) Прижизненная микроскопия выявляет две
эндотелиальные стенки капилляра (E),
эритроциты (R) и некоторые лейкоциты (W).
(B) Сосуды на этой микрофотографии
внутрижизненной флюоресценции немного
больше капилляров. Плазма окрашена
зеленым красителем, а эритроциты
окрашены красный
(C) Трудности преодоления прохода через узкие
микрососуды различных тканей.
дополнительно усугубляются тем фактом,
что внутрисосудистые раковые клетки часто
привлекают вокруг себя облака тромбоцитов
(D) Малое кровообращение легких требует
прохождения через его капилляры, почти
все метастазирующие клетки, попадающие в
венозное кровообращение, быстро
захватываются в ложе легочных капилляров.
(A и B, из I.C. MacDonald, А.С. Грум, А.Ф. Чемберс,
BioEssays 24: 885–893, 2002. C, из S.L. Stott et al.,
Proc. Natl. Акад. Sci. USA 107: 18392–18397, 2010.
D, из P.H. Raven et al., Биология, 7-е изд. НьюЙорк: Макгроу-Хилл, 2005.)
9
10.
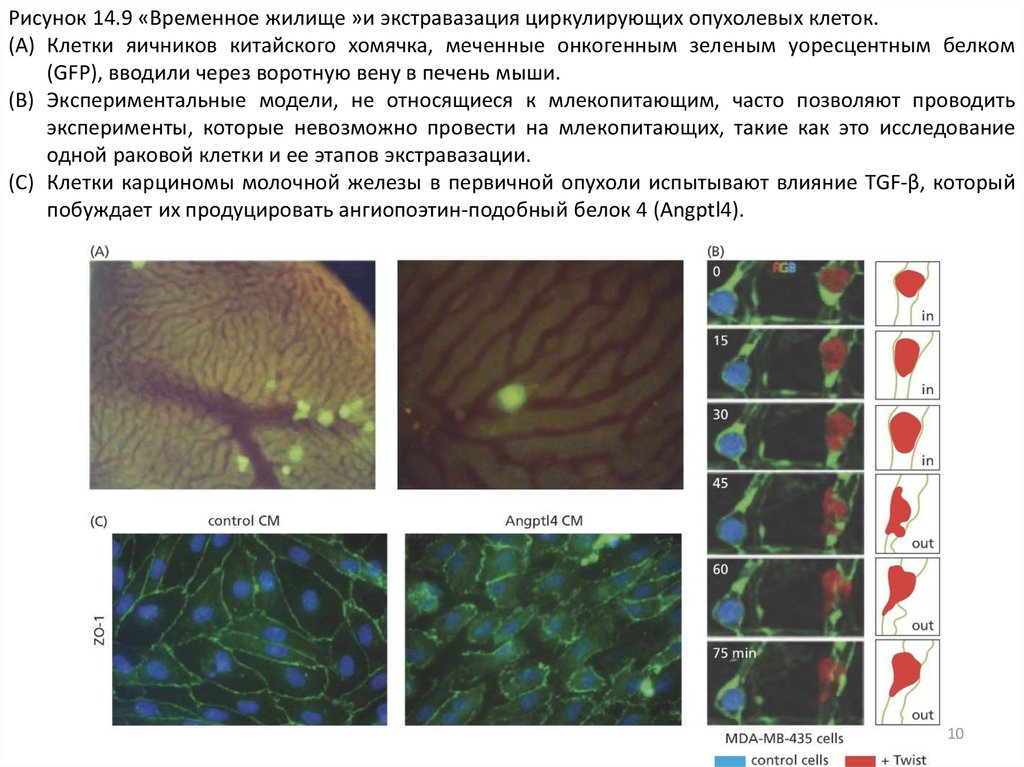
Рисунок 14.9 «Временное жилище »и экстравазация циркулирующих опухолевых клеток.(A) Клетки яичников китайского хомячка, меченные онкогенным зеленым уоресцентным белком
(GFP), вводили через воротную вену в печень мыши.
(B) Экспериментальные модели, не относящиеся к млекопитающим, часто позволяют проводить
эксперименты, которые невозможно провести на млекопитающих, такие как это исследование
одной раковой клетки и ее этапов экстравазации.
(C) Клетки карциномы молочной железы в первичной опухоли испытывают влияние TGF-β, который
побуждает их продуцировать ангиопоэтин-подобный белок 4 (Angptl4).
10
11.
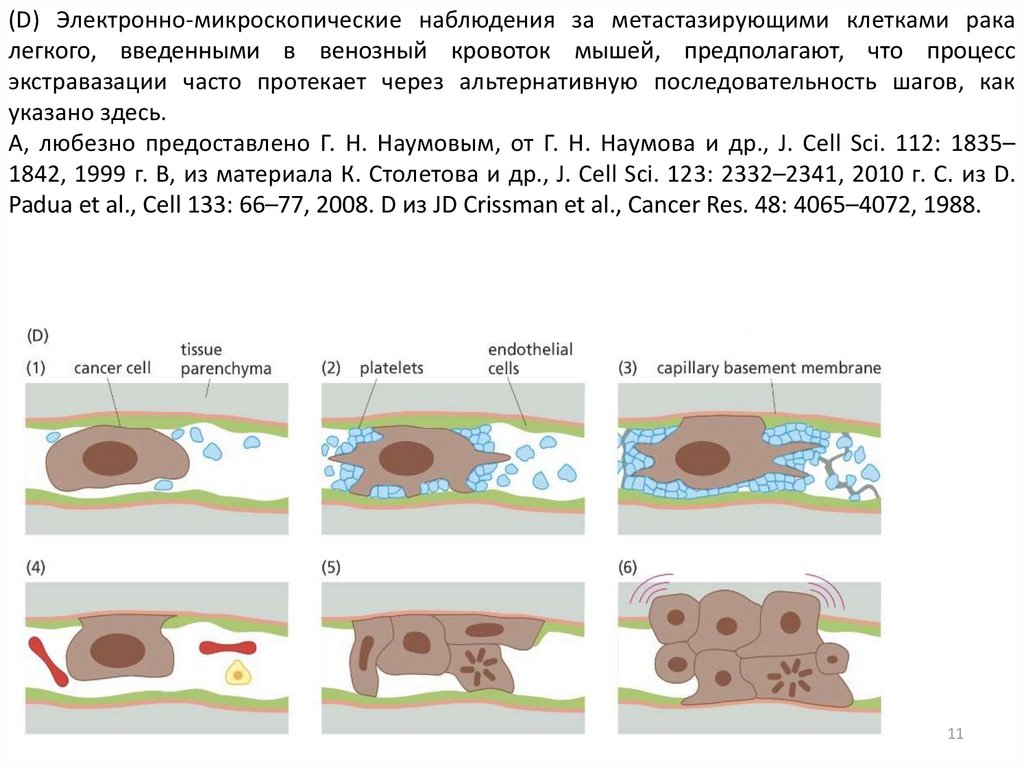
(D) Электронно-микроскопические наблюдения за метастазирующими клетками ракалегкого, введенными в венозный кровоток мышей, предполагают, что процесс
экстравазации часто протекает через альтернативную последовательность шагов, как
указано здесь.
A, любезно предоставлено Г. Н. Наумовым, от Г. Н. Наумова и др., J. Cell Sci. 112: 1835–
1842, 1999 г. B, из материала К. Столетова и др., J. Cell Sci. 123: 2332–2341, 2010 г. C. из D.
Padua et al., Cell 133: 66–77, 2008. D из JD Crissman et al., Cancer Res. 48: 4065–4072, 1988.
11
12.
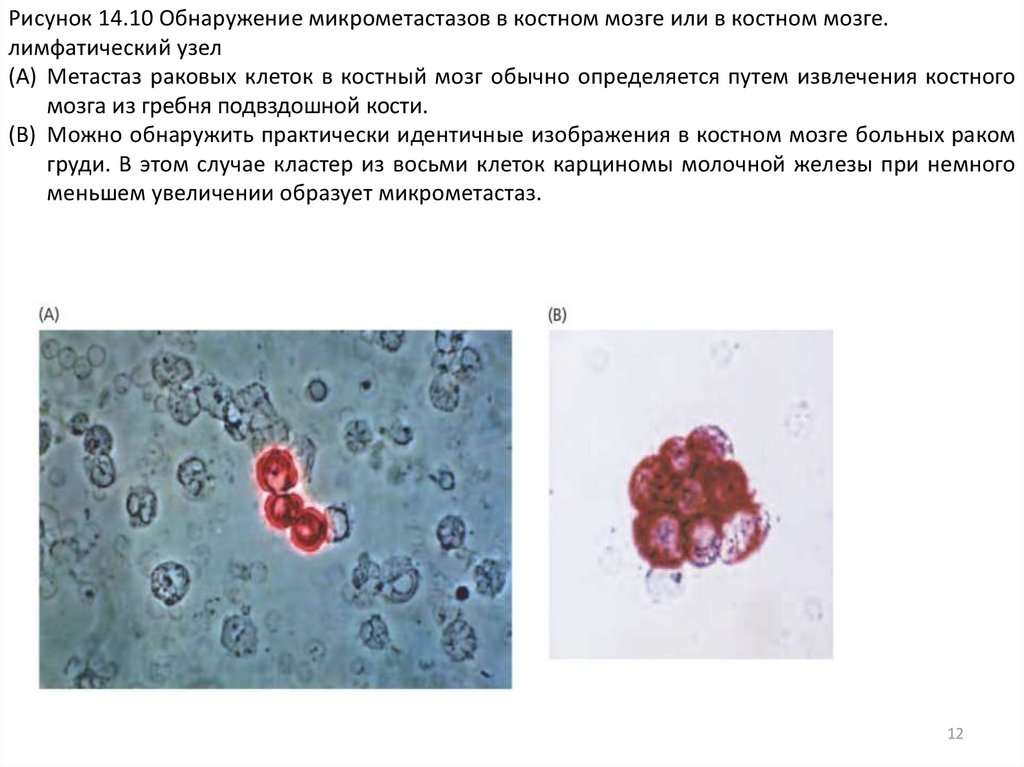
Рисунок 14.10 Обнаружение микрометастазов в костном мозге или в костном мозге.лимфатический узел
(A) Метастаз раковых клеток в костный мозг обычно определяется путем извлечения костного
мозга из гребня подвздошной кости.
(B) Можно обнаружить практически идентичные изображения в костном мозге больных раком
груди. В этом случае кластер из восьми клеток карциномы молочной железы при немного
меньшем увеличении образует микрометастаз.
12
13.
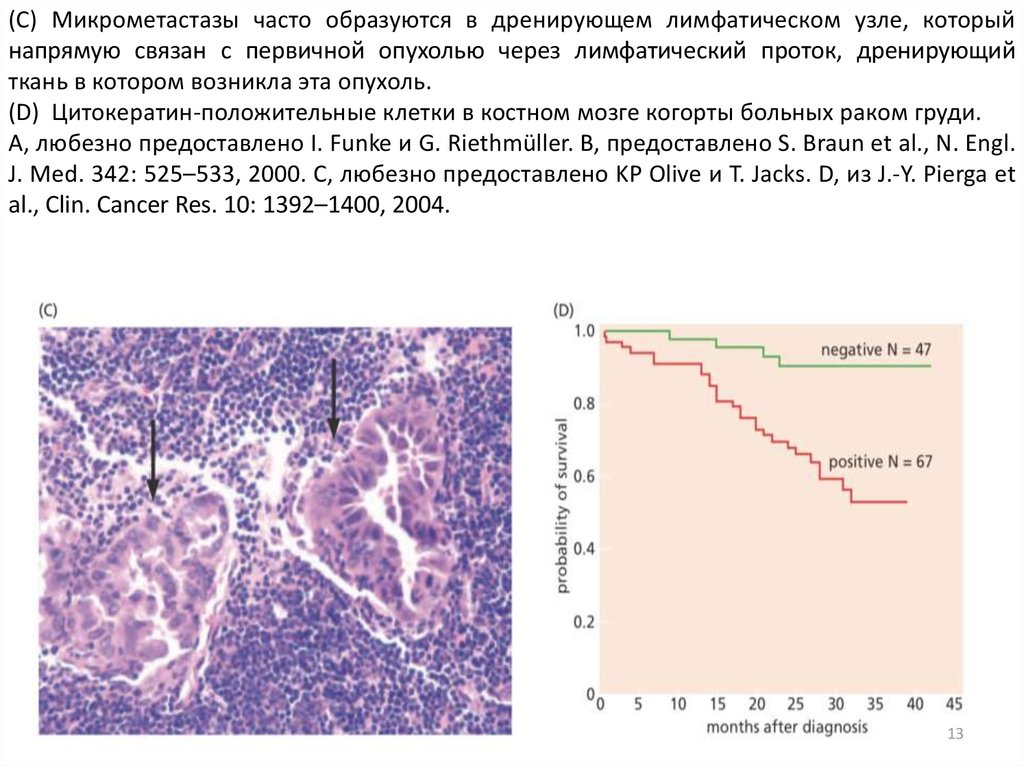
(C) Микрометастазы часто образуются в дренирующем лимфатическом узле, которыйнапрямую связан с первичной опухолью через лимфатический проток, дренирующий
ткань в котором возникла эта опухоль.
(D) Цитокератин-положительные клетки в костном мозге когорты больных раком груди.
A, любезно предоставлено I. Funke и G. Riethmüller. B, предоставлено S. Braun et al., N. Engl.
J. Med. 342: 525–533, 2000. C, любезно предоставлено KP Olive и T. Jacks. D, из J.-Y. Pierga et
al., Clin. Cancer Res. 10: 1392–1400, 2004.
13
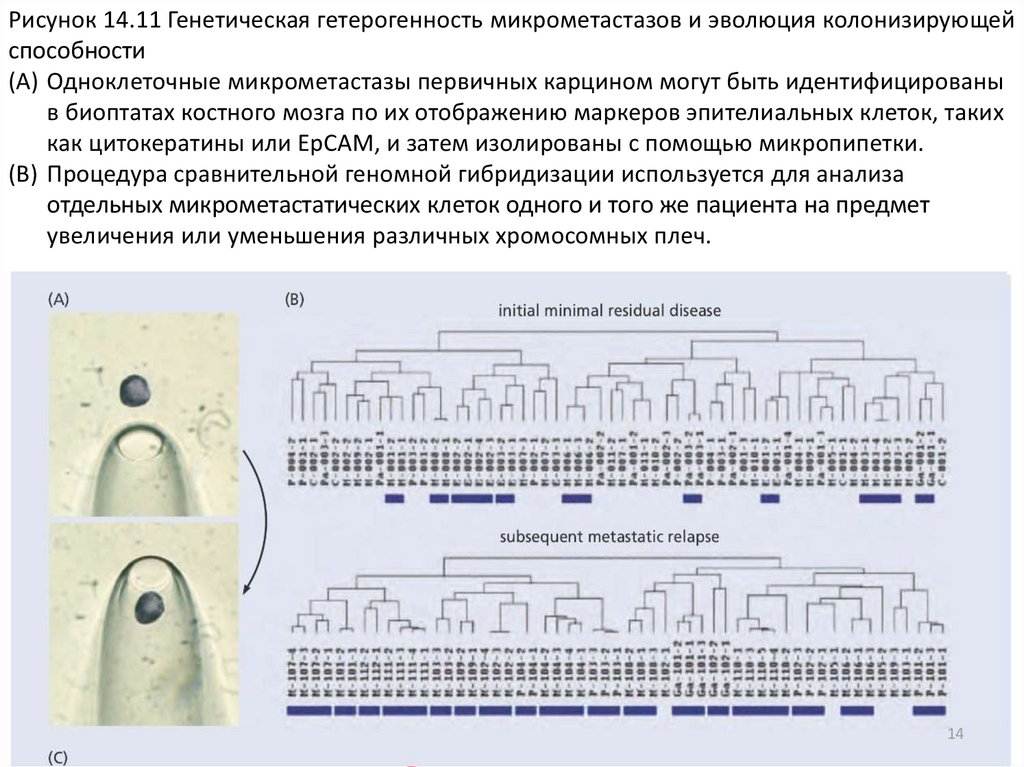
14.
Рисунок 14.11 Генетическая гетерогенность микрометастазов и эволюция колонизирующейспособности
(A) Одноклеточные микрометастазы первичных карцином могут быть идентифицированы
в биоптатах костного мозга по их отображению маркеров эпителиальных клеток, таких
как цитокератины или EpCAM, и затем изолированы с помощью микропипетки.
(B) Процедура сравнительной геномной гибридизации используется для анализа
отдельных микрометастатических клеток одного и того же пациента на предмет
увеличения или уменьшения различных хромосомных плеч.
14
15.
(С) Анализ, показанный на панели B, предлагает следующую умозрительную модель. Первоначальносформированная генетически гетерогенная популяция первичных опухолевых клеток засевает
одинаково гетерогенные микрометастазы по всему телу больного раком. Затем первичная опухоль
удаляется хирургическим путем, оставляя только микрометастазы и создавая состояние минимальной
остаточной болезни. Через несколько лет в том или ином участке тела одна из этих
микрометастатических клеток клоны (синие) приобретают способность колонизировать, т. е.
превращаться в макроскопический метастаз. Последний теперь действует как источник клеток,
которые генерируют новый каскад метастатического распространения по всему телу. (A и B , из CA
Klein et al., Lancet 360: 683–689, 2002.)
15
16.
Рис. 14.12. Сохранение одиночных спящих опухолевых клеток через много недель после введения впечень. Туморигенные клетки рака молочной железы мыши были помечены путем индукции их
образования, захватывают наночастицы стирола (диаметром 48 нм), помеченные флюоресцентным
красителем. Затем эти клетки вводили в брыжеечную вену, которая переносила их через воротную
вену в печень. Спустя одиннадцать недель опухолевые клетки все еще можно было обнаружить в
печени (белые стрелки). Важно отметить, что интенсивность флюоресценции многих из этих клеток
существенно не отличалась от интенсивности клеток вскоре после мечения, что указывает на то, что
эти клетки не делились ни разу после мечения. После выделения и культивирования in vitro потомки
многих из этих клеток оказывались канцерогенными при инъекции в жировые подушечки молочных
желез мышей-хозяев. (Более того, было обнаружено, что спящие раковые клетки полностью
устойчивы к химиотерапии, которая уменьшала на 75% размер метастазов, которые быстро росли у
тех же мышей.) (Из GN Naumov et al., Cancer Res. 62: 2162–2 2168, 2002.)
16
17.
Библиография1. «The Biology of CANCER» Robert A. Weinberg SECOND
EDITION
17





 Медицина
Медицина