Похожие презентации:
Окислительно-восстановительные реакции (ОВР)
1.
Окислительновосстановительные реакции(ОВР)
2. Классификация химических реакций
По числу и составу исходных веществ и продуктовреакции различают:
– реакции
присоединения
NH3 + HCl NH4Cl
– реакции разложения 2Cu(NO3)2 2CuO + 4NO2 + O2
Cu(OH)2 CuO + H2O
– реакции обмена
AgNO3 + KCl AgCl + KNO3
– реакции замещения 2AgNO3 + Cu 2Ag + Cu(NO3)2
По степени окисления реакции делят на:
реакции без изменения степени окисления;
реакции с изменением степени окисления.
3.
Следует различать понятия«степень окисления» и «валентность».
Степень окисления
–
условный
заряд
элемента
в
соединении,
вызванный смещением валентных
электронов к более электроотрицательному
атому, или заряд иона
элемента, вычисленный исходя из
предположения,
что
молекула
состоит только из ионов.
4.
Валентность– это свойство
атомов присоединять или замещать
определенное число атомов другого
элемента.
Количественно валентность
определяется числом химических
связей, образованных атомом.
5.
Окислительно-восстановительныереакции (ОВР) – химические
реакции, при протекании которых
изменяются степени окисления
одного или нескольких элементов,
входящих в состав реагирующих
веществ.
0
0
2 2
2Mg + O2 2Mg O
6. Любая ОВР состоит из процессов окисления и восстановления.
!!!Окисление – процесс отдачи
частицей электронов.
Частица (атом, молекула, ион),
которая отдает электроны,
называется восстановителем.
7.
Степень окисленияатома - восстановителя
повышается:
0
Mg
–
–
2e
восст-ль
(окисляется)
+2
Mg
8. Важнейшие восстановители
• Металлы в свободном состоянии:Mg, Fe, Cu и др.
• Соединения, содержащие
элементы в их минимальной
степени окисления:
–2
H2S,
–1
–3
KCl, NH3
9.
Восстановление – процессприсоединения электронов.
Частица (атом, молекула,
ион), которая присоединяет
электроны, называется
окислителем.
10.
Степень окисленияатома - окислителя
понижается:
O2 +
0
–
4e
2O
окис - ль
(восстанавливается)
–2
11. Важнейшие окислители
• Простые вещества(образованы
элементами VI -VII групп периодической системы):
O2, F2, Cl2
• Соединения, содержащие элементы в максимально положительной степени окисления:
+7
+6
+5
+6
KMnO4, K2Cr2O7, HNO3, H2SO4(конц.)
12.
Атомы в промежуточной степениокисления в зависимости от типа
реакции и условий ее протекания
могут быть как окислителями, так
и восстановителями, т.е.
проявляют ОВ двойственность:
0
+4
+4
+4
2-
Cl2, SO2, SO3 , NO2
13. Например:
H2SO4 – окислитель(степень окисления серы +6 – высшая)
H2SO3 – и окислитель, и восстановитель
(степень окисления серы +4 – промежуточная)
H2S – восстановитель
(степень окисления серы –2 – низшая).
14.
!!!Ок-ль + ē, ст. ок. ↓
Вос-ль – ē, ст. ок. ↑
15. Классификация ОВР
1. Межмолекулярные:атомы
окислителя и восстановителя
находятся в составе разных
молекул:
–1
0
–1
0
2NaI + Cl2 = 2NaCl + I2
в-ль ок-ль
16.
Внутримолекулярные:окислитель и восстановитель в
виде атомов разных элементов
входят в состав одной и той же
молекулы:
2.
+5
–2
–1
0
2 K I O3 = 2KI + 3O2
ок-ль в-ль
17.
3. Реакции диспропорционирования:атомы одного и того же элемента
в промежуточной степени окисления
и окисляются (повышают степень
окисления), и восстанавливаются
(понижают степень окисления):
0
Cl2
–1
+1
+ 2KOH = KCl + KClO + H2O
и ок-ль, и в-ль
18.
На протекание ОВР могут оказыватьвоздействие следующие факторы:
природа окислителя и восст-ля
концентрация окислителя
температура
характер среды (кислая,
нейтральная или щелочная).
19.
Zn + H2SO4(разб) = ZnSO4 + H2Cu + H2SO4(разб) ≠
Cu + 2H2SO4(конц) = CuSO4 + SO2 + 2H2O
3Cu + 8HNO3(pазб) = 3Cu(NO3)2 + 2NO + 4H2O
20.
Для составления полных молекулярных уравнений ОВР используются два метода:метод электронного баланса;
метод ионно-электронного
баланса.
21.
Основные принципы составленияуравнений ОВР :
соблюдение закона сохранения
массы (равенство числа атомов
одного и того же элемента до и после
реакции);
соблюдение закона сохранения
суммарного заряда (равенство суммы
зарядов исходных и конечных веществ).
22.
Метод электронного баланса –метод нахождения коэффициентов в
уравнениях ОВР, при котором
рассматривается обмен электронами
между атомами, изменяющими свою
степень окисления.
Число электронов, отданных восстановителем, равно числу электронов,
полученных окислителем.
23.
Методэлектронного
баланса
универсален: позволяет на формальной основе (с использованием понятия
«степень окисления») устанавливать
стехиометрические соотношения
в
процессах окисления-восстановления
в любых гомогенных и гетерогенных
средах.
24. Пример:
KClO3 KCl O2Cl 5
6e
Cl 1
|
2
2O 2
4e
O02
|
3
2Cl 5
6O 2
2Cl 1 3O02
2KClO3 2KCl 3O2
25.
Методионно – электронного
баланса основан на модели реально существующих частиц, присутствующих в водных растворах.
Метод используется для записи
реакций в водных растворах.
26.
Для уравнивания кислородав ионно-молекулярных
полуреакциях используют:
H2O
+
H в кислой среде
–
OH в щелочной среде
27.
Правило кислой среды:в ту часть полуреакции, в которой
не хватает кислорода, на каждый
недостающий кислород добавляется
по одной молекуле H2O, в противоположную часть – необходимое
для уравнивания водорода число
катионов H+.
28.
Правило щелочной среды:в ту часть полуреакции, в
которой не хватает
кислорода,
на каждый недостающий кислород
добавляется по два гидроксид-иона
–
OH , а в противоположную часть –
необходимое для
уравнивания
водорода число молекул H2O.
29.
В нейтральной среде в зависимостиот продуктов реакции используется
или
правило
кислой среды, или
правило щелочной среды.
30.
ПРАВИЛА СОСТАВЛЕНИЯ ОВР:1. Составить
частные
уравнения
процессов окисления и восстановления.
Вещества записывают в форме, в
которой
существуют
в
растворе:
сильные электролиты – в виде ионов,
слабые электролиты, нерастворимые
вещества, газ – в виде молекул.
31.
2. Осуществить материальныйбаланс атомов с участием
ионов среды:
H+ – в кислой,
ОH– – в щелочной,
H2O (в кислой и щелочной),
затем – электронный баланс.
32.
3. Подобратькоэффициенты
в
уравнениях:
число
электронов,
отданных восстановителем, равно
числу электронов,
принимаемых
окислителем.
4. Сложить частные уравнения
с учетом подобранных коэф-тов.
5. Составить полное молекулярное
уравнение.
33.
!!!Порядок уравнивания:
1.
2.
3.
4.
Э
О
Н
ē
(элемент – окисл., восст.)
(кислород)
(водород)
(электроны)
34.
Кислая средаKMnO4 + KCl + H2SO4 =
= MnSO4 + K2SO4 + Cl2 + H2O
35.
1. Записывают схему реакции с указанием степенейокисления элементов и выделяют элементы,
которые изменили свои степени окисления:
+1 +7
2
+1 1
1 6 2
+2 6 2
+1 6 2
0
+1 2
K Mn O4 + K Cl + H 2 S O4 Mn S O4 + K 2 S O4 + Cl2 + H 2 O
KMnO4 – окислитель, поскольку имеет в своем
составе атом Mn+7, находящийся в максимальной
степени окисления.
KCl – восстановитель, так как атом хлора имеет
минимальную степень окисления – 1.
H2SO4 – среда.
В кислой среде ион MnO4– (Mn+7) восстанавливается
до Mn2+.
Анион Cl– будет окисляться до Cl2 .
36.
2. Приводят эту схему в ионномолекулярной форме, чтобыопределить реальные частицы,
существующие в растворе:
K +
MnO 4
+ K + Cl + 2H +
2
SO 4
Mn 2 + SO 24 + 2K + SO 24 + Cl 2 + H 2O.
37.
3. Выделяют частицы, в состав которыхвходят элементы, изменяющие свои
степени окисления, и записывают
ионные схемы процессов
восстановления и окисления:
MnO4
Cl
Mn
Cl2
2
38.
4. Чтобы получить полуреакции, следуетсоблюдать баланс по числу атомов каждого
элемента. Поскольку в данном примере
среда кислая, для уравнивания полуреакций
пользуются правилом кислой среды:
MnO4
2Cl
8H
Mn
Cl2
2
4H 2O
39.
5. Определяют суммарные заряды влевых и правых частях полуреакций и
добавлением или вычитанием
электронов уравнивают полуреакции по
зарядам:
MnO 4
8H 5e Mn
7
4H 2O
2
2Cl 2e Cl2
2
2
0
40.
6. Устанавливают дополнительныемножители для окислителя
и восстановителя на основании того,
что число электронов, отданных
восстановителем, должно быть равно
числу электронов, принятых
окислителем:
MnO4
8H 5e Mn
2Cl 2e Cl2
2
4H 2O 5
2
10
2
5
41.
7. Первую полуреакцию умножают на 2,вторую – на 5 и складывают правые и
левые части полуреакций, в результате
чего получают суммарное ионномолекулярное уравнение реакции:
MnO 4
8H 5e Mn
2
4H 2O 5
2Cl 2e Cl2
2MnO 4
2
16H 10Cl 2Mn
2
10
2
5
8H 2O 5Cl 2
42.
8. Записывают окончательное уравнение вмолекулярной форме:
2KMnO4 + 10KCl + 8H2SO4 =
= 2MnSO4 + 6K2SO4 + 5Cl2 + 8H2O
Фиолетовый раствор KMnO4
превращается в прозрачный бесцветный
раствор MnSO4 .
43. Щелочная среда
+1 +72
+1 +3 2
+1 2 +1
1
+6
2
+1 +5 2
+1 2
K Mn O4 Na N O 2 K O H K 2 Mn O 4 Na N O3 H 2 O
KMnO4 – окислитель, поскольку имеет в своем
составе атом Mn+7, находящийся в максимальной
степени окисления.
NaNO2 – восстановитель, так как у атома азота
промежуточная степень окисления +3.
KOH – среда.
В щелочной среде ион MnO4– (Mn+7)
восстанавливается до MnO42– (Mn+6).
Анион NO2– (N+3) будет окисляться до NO3– (N+5).
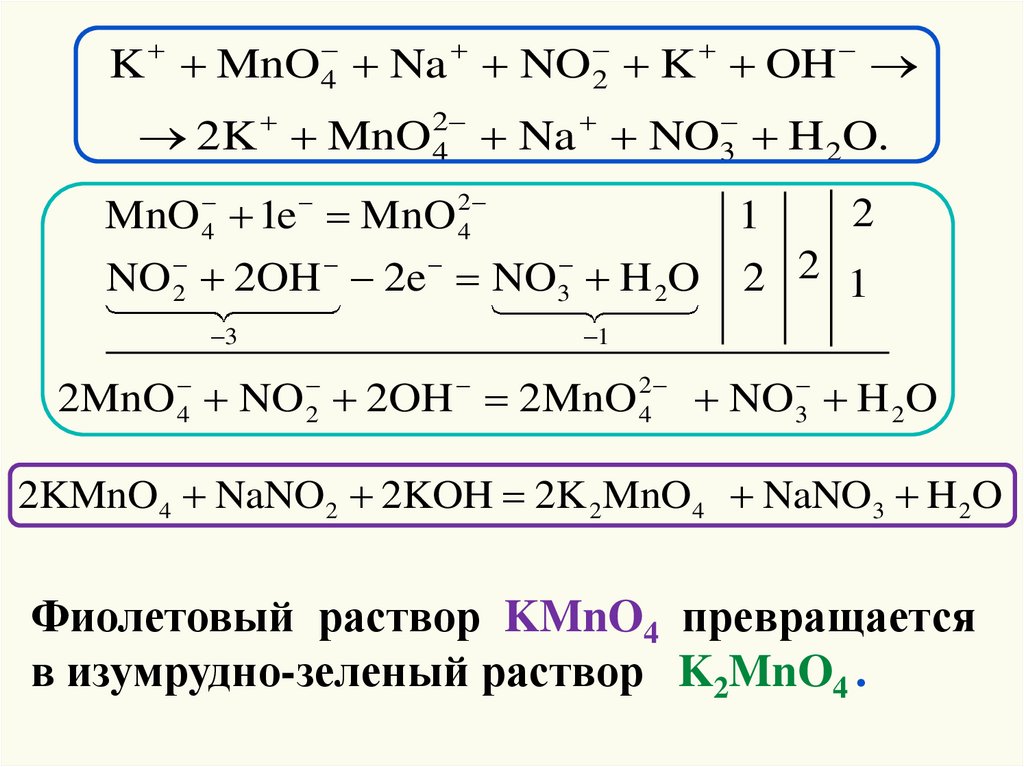
44.
K MnO 4 Na NO 2 K OH2K MnO 24 Na NO3 H 2O.
MnO 4 1e MnO 24
2
1
3
NO 2OH 2e NO H 2O
3
2
2 2 1
1
2MnO 4 NO 2 2OH 2MnO 42 NO 3 H 2O
2KMnO4 NaNO2 2KOH 2K 2 MnO4 NaNO3 H 2O
Фиолетовый раствор KMnO4 превращается
в изумрудно-зеленый раствор K2MnO4 .
45. Нейтральная среда
2KMnO4 3NaNO2 H 2O 2MnO2 3NaNO3 2KOHKMnO4 – окислитель, поскольку имеет в своем составе атом
Mn+7, находящийся в максимальной степени окисления.
NaNO2 – восстановитель, так как у атома азота
промежуточная степень окисления +3.
H2O – среда.
В нейтральной среде ион MnO4– (Mn+7) восстанавливается до
MnO2 (Mn+4). Анион NO2– (N+3) окисляется до NO3– (N+5).
Фиолетовый раствор KMnO4 превращается в бурый
осадок MnO2 .
46.
Окислительные свойстваперманганата калия KMnO4
H+ (H2SO4)
кислая
MnO4
–
фиолетовый
р-р
H2O
нейтральная
OH– (NaOH)
щелочная
Mn2+
бесцветный р-р
MnO2
бурый осадок
MnO42–
зеленый р-р


















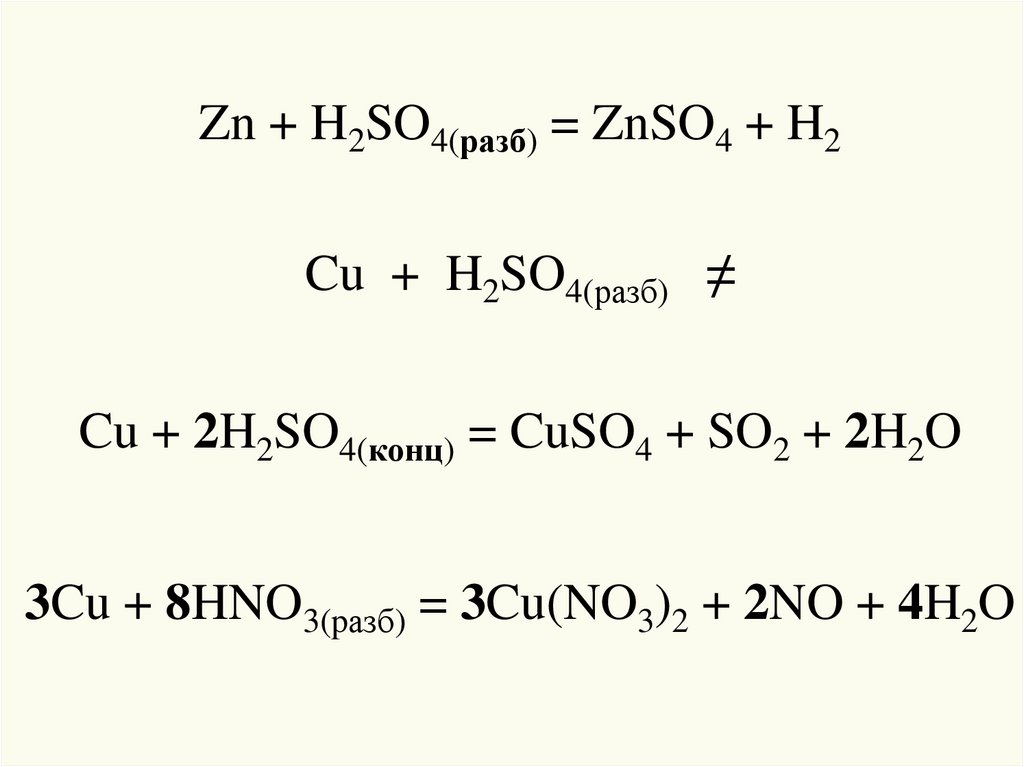


























 Химия
Химия








