Похожие презентации:
Углерод и кремний. Лекция №15
1.
ГОУ ВПО «Донбасская Национальная академия строительства иархитектуры»,
кафедра «Прикладная химия»
Курс лекций по дисциплине «Химия»
для студентов 1 курса
Направление подготовки – 08.03.01 Строительство
Составил:
Ташкинов Ю.А.
Макеевка, 2020
1
2.
23.
Электронно-графическая конфигурация внешнего электронногослоя атомов элементов IVA-группы – ns2np2, например: у углерода
– 2s22p2, у кремния – 3s23p2.
В соединениях с другими элементами атомы углерода и
кремния могут проявлять степени окисления -4, +2, +4, для
элементов-полуметаллов и металлов в их соединениях с
другими элементами (кроме гидридов) более характерны
положительные степени окисления +2 и+4.
3
4.
В земной коре содержится 0,093% углерода по массе, причем онвстречается как в свободном состоянии, так и в виде химических
соединений с другими элементами.
Углерод является основой органической жизни на Земле.
4
5.
Уголь, торф, нефть и природный газ - продукты разложения растительного мираЗемли древнейших времен.
Самое мягкое ископаемое – торф – содержит остатки растений, в нем имеется не
более 50-60% углерода. Бурый уголь содержит 65-70% углерода. Каменный уголь
содержит 75-95% углерода. Самый твердый уголь – антрацит – может содержать
91-98% углерода.
5
6.
При нагревании углеродосодержащих соединений без доступавоздуха образуется аморфный углерод:
кокс, древесный уголь, костяной уголь, сажа.
Кокс получают при сухой перегонке каменного угля, широко
используется как восстановитель в процессах промышленного
получения металлов из руд.
6
7.
В виде углекислого газа углерод входит в состав атмосферы (0,03% пообъему).
7
8.
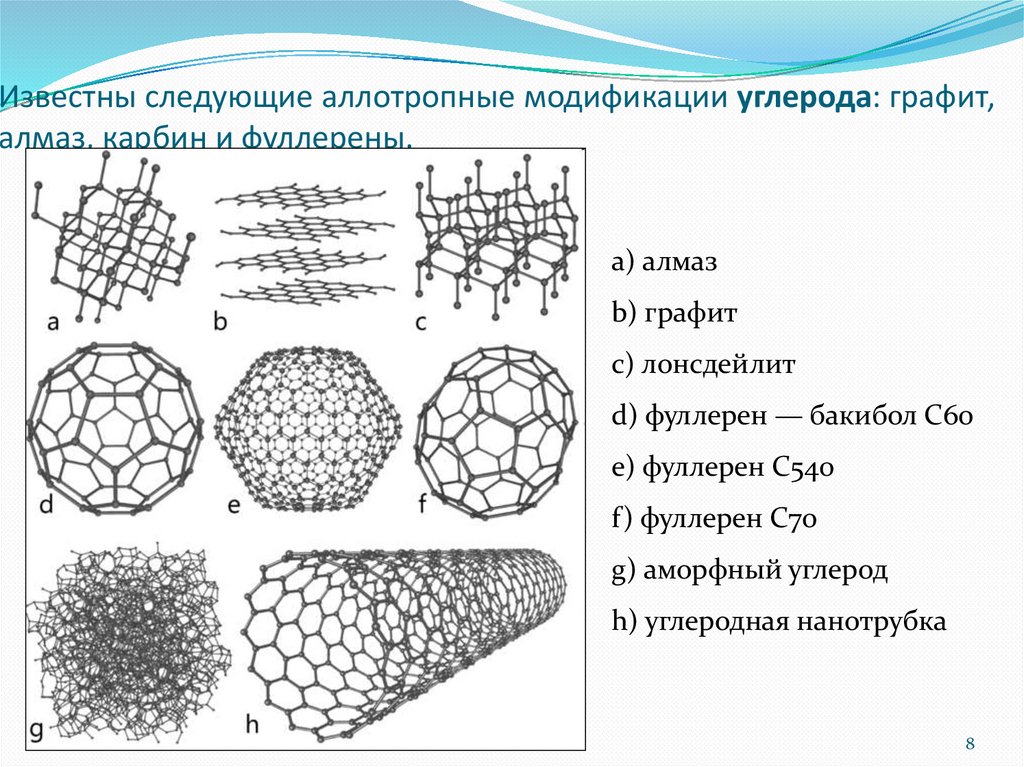
Известны следующие аллотропные модификации углерода: графит,алмаз, карбин и фуллерены.
a) алмаз
b) графит
c) лонсдейлит
d) фуллерен — бакибол C60
e) фуллерен C540
f) фуллерен C70
g) аморфный углерод
h) углеродная нанотрубка
8
9.
910.
1011.
1112.
1213.
1314.
1415.
1516.
1617.
1718.
1819.
1920.
2021.
2122.
2223.
2324.
2425.
2526.
2627.
2728.
2829.
2930.
3031.
3132.
3233.
3334.
3435.
3536.
3637.
3738.
3839.
Для углерода и кремния характерна невысокая химическаяактивность: большинство реакций с их участием протекают
только при высокой температуре. Химические свойства
различных аллотропных модификаций углерода сходны,
отличаются лишь условия протекания реакций, потому что
энергия разрыва связей между атомами в алмазе, графите и
других модификациях углерода различны.
В химических реакциях с простыми веществами углерод и
кремний проявляют как окислительные, так и
восстановительные свойства.
В реакциях со сложными веществами, например с оксидами
металлов, углерод и кремний чаще всего проявляют
восстановительные свойства.
39
40.
Графит используется в карандашной промышленности. Также его используют вкачестве смазки при особо высоких или низких температурах.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал.
Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого,
ограненные алмазы — бриллианты используются в качестве драгоценных камней в
ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и
стечению исторических обстоятельств, бриллиант неизменно является самым
дорогим драгоценным камнем.
В фармакологии и медицине широко используются различные соединения углерода
— производные угольной кислоты и карбоновых кислот.
Карболен (активированный уголь), применяется для абсорбции и выведения из
организма различных токсинов.
40
41.
Методы получения: лабораторные ипромышленные.
Углерод
Неполное сжигание метана:
СН4 + О2 = С + 2Н2О
Оксид углерода (II)
В промышленности:
Оксид углерода (II) получают в особых печах,
называемых газогенераторами, в результате двух
последовательно протекающих реакций. В нижней
части газогенератора, где кислорода достаточно,
происходит полное сгорание угля и образуется оксид
углерода (IV):
C + O2 = CO2 + 402 кДж.
41
42.
По мере продвижения оксида углерода (IV) снизу вверхпоследний соприкасается с раскалённым углём:
CO2 + C = CO – 175 кДж.
Получающийся газ состоит из свободного азота и оксида
углерода (II). Такая смесь называется генераторным
газом. В газогенераторах иногда через раскалённый
уголь продувают водяной пар:
C + H2O = CO + H2 – Q, «CO + H2» - водяной газ.
В лаборатории:
Действуя на муравьиную кислоту концентрированной
серной кислотой, которая связывает воду:
HCOOH H2O + CO .
42
43.
Оксид углерода (IV)В промышленности:
Побочный продукт при производстве извести:
CaCO3 CaO + CO2 .
В лаборатории:
При взаимодействии кислот с мелом или мрамором:
CaCO3 + 2HCl CaCl2 + CO2 + H2O.
Карбиды
Карбиды получают при помощи
металлов или их оксидов с углём.
прокаливания
43
44.
Угольная кислотаПолучают растворением оксида углерода (IV) в воде.
Так как угольная кислота очень не прочное
соединение, то эта реакция обратима:
CO2 + H2O H2CO3.
Кремний
В промышленности:
При нагревании смеси песка и угля:
2C + SiO2 Si + 2CO.
В лаборатории:
При взаимодействии смеси чистого песка с порошком
магния:
2Mg + SiO2 2MgO + Si.
44
45.
Кремниевая кислотаПолучают при действии кислот на растворы её солей.
При этом она выпадает в виде студенистого осадка:
Na2SiO3 + HCl 2NaCl + H2SiO3
2H+ + SiO32- H2SiO3
45
46.
Химические свойства.Щелочи переводят кремний в соли кремниевой
кислоты с выделением водорода :Si + 2КОН + H2O=
К2Si03 + 2Н2
С
водой углерод и кремний реагируют лишь при
высоких температурах:
С + Н2О ¬ СО + Н2
Si + ЗН2О = Н2SiO3 + 2Н2
Углерод в отличие от кремния непосредственно
взаимодействует с водородом: С + 2Н2 = СН4
46
47.
Карбиды.Соединения углерода с металлами и другими
элементами, которые по отношению к углероду
являются электроположительными, называются
карбидами.
При взаимодействии карбида алюминия с водой
образуется метан
Al4C3 + 12H2O = 4Al (OH)3 + 3CH4
При взаимодействии с водой карбида кальция –
ацетилен:
CaC2 + 2H2O = Ca (OH)2 + C2H2
47
48.
ПрименениеУглерод определяется тем, что
свыше 90 % всех первичных
источников потребляемой в мире
энергии приходится на
органическое топливо.
Гидрокарбонат натрия продают в
аптеках
и
продовольственных
магазинах под названием питьевой
соды.Питьевую соду применяют в
кондитерском
деле
и
хлебопечении.
48
49.
Оксид углерода (IV)Получение сахара.
Тушение пожаров.
Производство фруктовых вод.
«Сухой лёд».
49
50.
Оксид кремния (IV)Силикатных кирпичи.
Керамические изделия.
Стекло.
50
51.
Силикаты.Клей.
51








































 Химия
Химия








