Похожие презентации:
Химические равновесия в растворах. Константы равновесия при различном выборе стандартных состояний для участников реакции
1.
Лекция 14Химические равновесия в растворах.
Константы равновесия при различном
выборе стандартных состояний для
участников реакции. Химическое
равновесие в разбавленном растворе.
Влияние инертного растворителя.
Гетерогенные химические равновесия.
Расчет равновесного состава и выходов
продуктов при протекании нескольких
химических реакций (на примере реакции
образования NH3, гидрирования этилена)
2.
Лекция 13Уравнения Гиббса-Дюгема-Маргулеса.
Обобщенное уравнение Гиббса-Дюгема.
Мольные (интегральные) и парциальные мольные
величины. Их определение для бинарных
растворов.
Зависимость парциальных мольных объемов от
состава в системе Н2О - С2Н5ОН
3.
29-ого октября лекция будет2-ого ноября лекция будет
5-ого ноября ЛЕКЦИИ не БУДЕТ!
9-ого ноября лекция будет
4.
Выберите для каждого химпотенциала (левая колонка)название (правая колонка).
3 балла
Формат ответа: Номер химпот. ; номер названия.
1) i RT ln ai
0
i
2) j RT ln x j
j
fk
3) k RT ln 0
p
0
k
4) l RT ln xl
0
l
pk
5) i RT ln 0
pk
0
i
1) Химпот. в реальном ж-д растворе.
2) Химпот. в идеальном ж-д растворе.
3) Химпот. в реальном ж-д растворе,
если пар – идеальный газ.
4) Химпот. в реальном газе.
5) Химпот. в разбавленном тв. растворе.
5.
Выберите правильные утверждения1) При добавке примеси температура плавления чистой
жидкости всегда понижается
2) Повышение температуры кипения жидкости всегда
пропорционально мольной доле примеси
3) Над любым раствором парциальное давление
компонента пропорционально его мольной доле в
растворе
4) Над любым раствором парциальное давление
компонента пропорционально его активности в
растворе
5) Осмотическое давление возникает при установлении
мембранного равновесия.
2 балла
6.
pi ( xi )ai ( xi ) pi ( xi ) pi xi 1 ai xi ; T const
pi xi 1
fi pi ( xi )
1
ai ( xi ) pi ( xi )
f i xi 1 ai xi
fi xi 1
i xi
fi pi ( xi ) i pi xi
Только, если пар идеальный газ!
7.
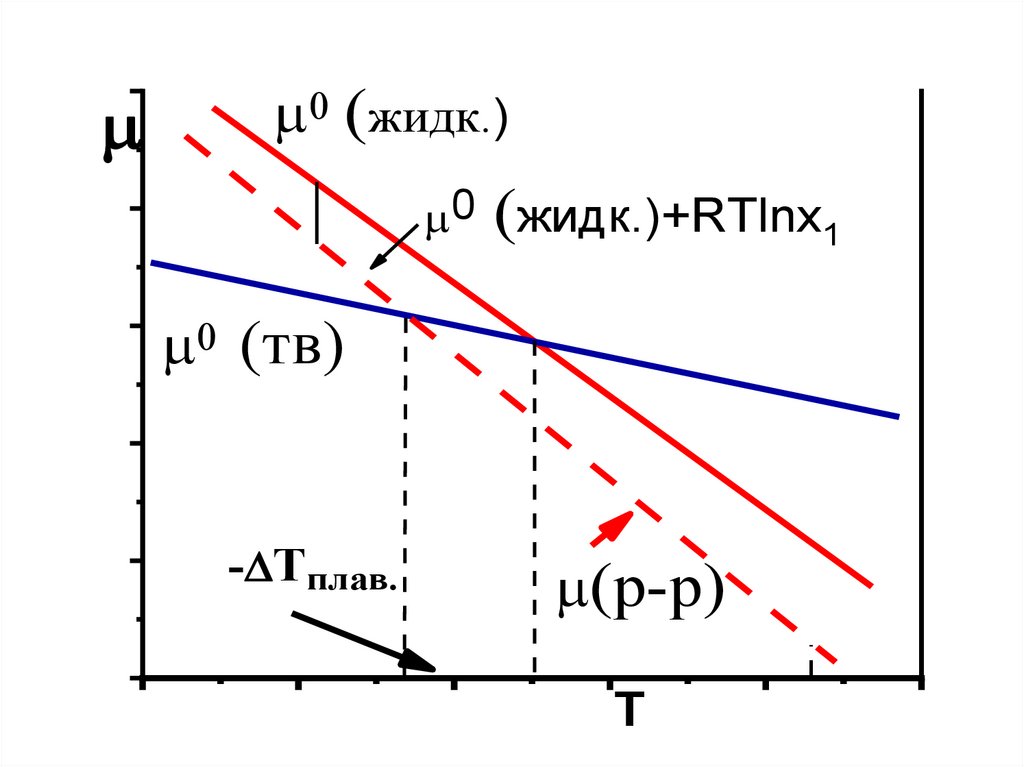
0 (жидк.)0 (жидк.)+RTlnx1
0 (тв)
-DTплав.
(р-р)
T
8.
Выберите правильные утверждения2 балла
1) Активность в растворах – безразмерная величина
2) Активности компонента всегда растет с увеличением мольной
доли компонента
3) Активность компонента не может быть меньше его мольной доли
4) Активность компонента не может быть больше единицы, если за
стандартное состояние выбран
μ0
5) Активность компонента в растворе может иметь экстремумы
по составу
9.
Выберите правильные утверждения2 балла
1) Расслоившейся раствор – это неравновесное состояние
2) Расслаивание раствора - самопроизвольный процесс
3) В азеотропе химические потенциалы компонентов μ1(ж) и μ1(п) равны.
4) В азеотропе мольные доли компонентов х1(ж) и х1(п) равны.
5) Азеотроп может образоваться в системе жидкий раствор – твердый
раствор.
10.
Выберите правильные формулы1.
G *
1
x1 T , p
2.
V *
V1 V2
x1 T , p
3.
F
F*
n1 n2
4.
5.
2G * 1 2
2
x
x
x
1 1 1
V
V1
n1 S , p
2 балла
11.
ХИМИЧЕСКИЕ РАВНОВЕСИЯ в ЖИДКИХ и ТВЕРДЫХРАСТВОРАХ
12.
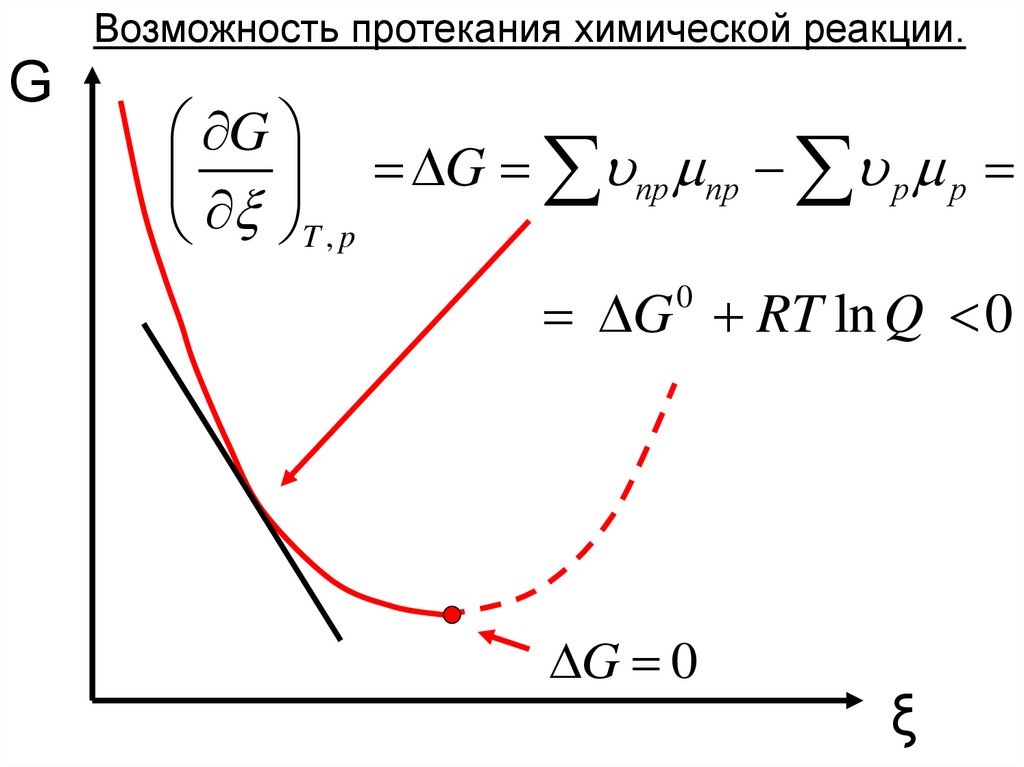
Возможность протекания химической реакции.G
G
DG пр пр р р
T , p
DG RT ln Q 0
0
DG 0
ξ
13.
GСист2NO2 N2O4
N2O4 2NO2
nN2O4
0,0
0,5
1,0
DGР=ции
4
2NO2 N2O4
2
N2O4 2NO2
0
-2
-4
0,0
0,2
0,4
0,6
0,8
1,0
1,2 nN2O4
14.
ФазаГаз:
Ид.
Реал.
p
(T ) RT ln 0
p
f
0
(T ) RT ln 0
p
Жд.,тв.:
Ид.
(T , p) RT ln x
0
0
Реал.
0 (T , p) RT ln a
Жд.,тв.:
Раз. р-р.
(T , p) RT ln x
(T , p ) RT ln a
Растворитель !
,
0
0 (ид.,T , p0 1бар)
0
0
0
S ;
0
T p
p T
0 ( T , p, x 1)
0
0
0
0
S
;
V
T
p
p
T
( T , p) lim RT ln x
x 0
S
;
V
T
p
p
T
15.
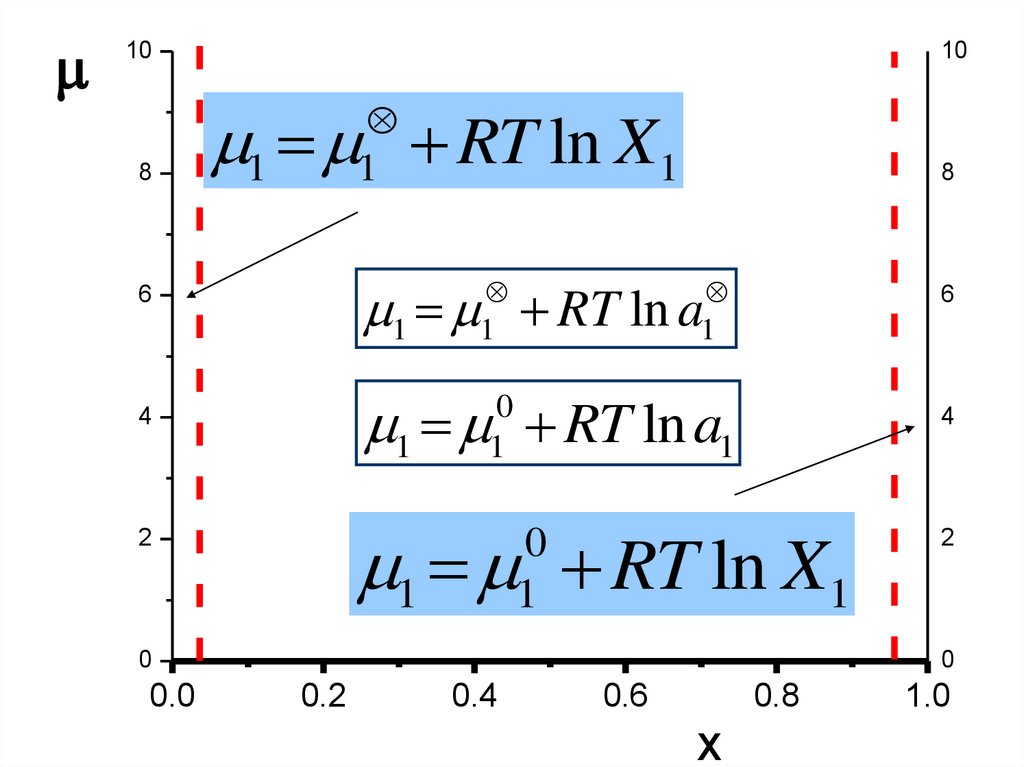
108
10
1 RT ln X1
1
8
1 RT ln a
1
6
1
6
1 RT ln a1
0
1
4
4
1 RT ln X1
0
1
2
0
0.0
2
0
0.2
0.4
0.6
0.8
X
1.0
16.
Электрохимический потенциал.I)
A( I ) A( I ), хим ZF ( I ) A ,(, хим
RT ln a A ZF ( I )
F 96.485 Кулон моль -1
( H 2 0)
OH
,( H 2 0)
OH
RT ln xOH F ( H 2O )
17.
ИЗОТЕРМЫ ХИМИЧЕСКИХ РЕАКЦИЙ18.
Изотерма химической реакции. Идеальны газыG
DGr N 2O4 2 NO2 0
T , p
N O p, T
2 4
0
N 2O4
(T ) RT ln
pN2O4
p
0
N 2O4
; NO2 p, T
0
NO2
рN 2O4
DGT
2
RT ln 2
рNO
2
0
DGT DGT RT ln Q 0
0
N 2O4
0
NO2
(T ) RT ln
DG RT ln K ; e
0
T
рN 2O4
K 2
p NO
2
0
pNO
2
p
pN 2O4
2
NO2
DGT DGT0 RT ln Q равн 0; Q равн K
DGT0
RT
pNO2
p
pN 2O4
2
NO2
0
0
0
19.
Изотерма химической реакции. Реальные газыG
DGr N 2O4 2 NO2 0
T , p
N O p, T
2 4
0
N 2O4
(T ) RT ln
f N2O4
p
0
N 2O4
; NO2 p, T
0
NO2
f N 2O4
DGT
2
RT ln 2
f NO
2
0
DGT DGT RT ln Q 0
0
N 2O4
0
NO2
(T ) RT ln
DG RT ln K ; e
0
T
f N 2O4
K 2
f NO
2
0
pNO
2
p
pN 2O4
2
NO2
DGT DGT0 RT ln Q равн 0; Q равн K
DGT0
RT
f NO2
p
pN 2O4
2
NO2
0
0
0
20.
Изотерма химической реакции. РастворыG
DGr пр пр p p 0
i
j
T , p
i p, T i0 (T , p, x 1) RT ln ai ; j p, T j (T ) RT ln a j
i, j продукты, реагенты
aпр
0,
0,
DGT пр пр реаг реаг RT ln
реаг
а реаг
пр
aпр
а реаг
реаг
пр
DGT DGT0, RT ln Q 0, 0; Q 0,
0,
0,
DGT DGT0, RT ln Q равн
0; Q равн
K 0,
0,
T
DG
RT ln K
0,
; e
DGT0,
RT
K
0,
a прпр
a реаг
реаг
равн
0,
0,
0
21.
CH3COOH + C2H5OH = H2O + CH3COOC2H5(к)
(в)
(с)
(э)
Общий случай
э э0 RT ln aэ ; в в0 RT ln aв ;
к к0 RT ln aк с с0 RT ln aс
DG 0,0.0.0 в0 э0 к0 с0 ;
K 0,0.0,0
aв0 aэ0
0 0,
aк aс
e
DG 0,0,0,0
RT
(Случай
K 0,0.0.0
0, 0,0,0
)
22.
CH3COOH + C2H5OH = H2O + CH3COOC2H5(к)
(с)
(в)
(э)
Вода - растворитель
э э RT ln хэ ; в в0 RT ln хв ;
к к RT ln хк с с RT ln хс
DG 0, , , в0 э к с ; e
K
0, , ,
хв хэ
,
хк хс
(Случай
DG 0, , ,
RT
0, , ,
K 0, , ,
), xв 1
23.
CH3COOH + C2H5OH = H2O + CH3COOC2H5(к)
(с)
(в)
(э)
Спирт - растворитель
э э RT ln хэ ; в в RT ln хв ;
к к RT ln хк с с0 RT ln хс
DG , , ,0 в э к с0 ; e
K
, , ,0
хв хэ
,
хк хс
(Случай
DG , , ,0
RT
, , ,0
K , , ,0
), xс 1
24.
CH3COOH + C2H5OH = H2O + CH3COOC2H5(к)
(с)
(в)
(э)
Инертный растворитель – R (Р)
э э RT ln хэ ; в в RT ln хв ;
к к RT ln хк с с RT ln хс
DG ( III ) в э к с ;
K
, , ,
K
хв хэ
,
хк хс
, , ,
( R) K
e
DG , , ,
RT
(Случай
, , ,
( P)
, , ,
K , , ,
)
25.
ФазаГаз:
Ид.
Реал.
p
(T ) RT ln 0
p
f
0
(T ) RT ln 0
p
Жд.,тв.:
Ид.
(T , p) RT ln x
0
0
Реал.
0 (T , p) RT ln a
Жд.,тв.:
Раз. р-р.
(T , p) RT ln x
(T , p ) RT ln a
Растворитель !
,
0
0 (ид.,T , p0 1бар)
0
0
0
S ;
0
T p
p T
0 ( T , p, x 1)
0
0
0
0
S
;
V
T
p
p
T
( T , p) lim RT ln x
x 0
S
;
V
T
p
p
T
26.
H OHH 2O
H 0
2
( H 2 0)
эл.OH
( H 2 0)
эл. H
0
H 2O
RT ln xH 2O
,( H 2 0)
OH
RT ln xOH F ( H 2O )
,( H 2 0)
H
RT ln xH F ( H 2O )
27.
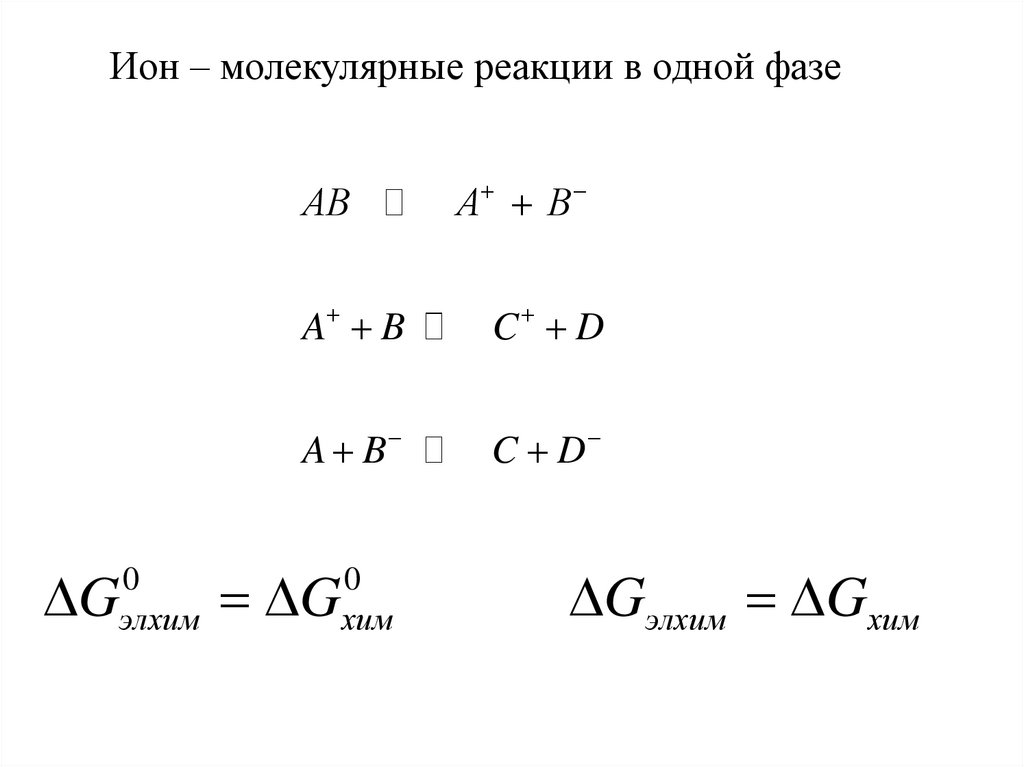
Ион – молекулярные реакции в одной фазеАB
DG
0
элхим
A B
A B
C D
A B
C D
DG
0
хим
DGэлхим DGхим
28.
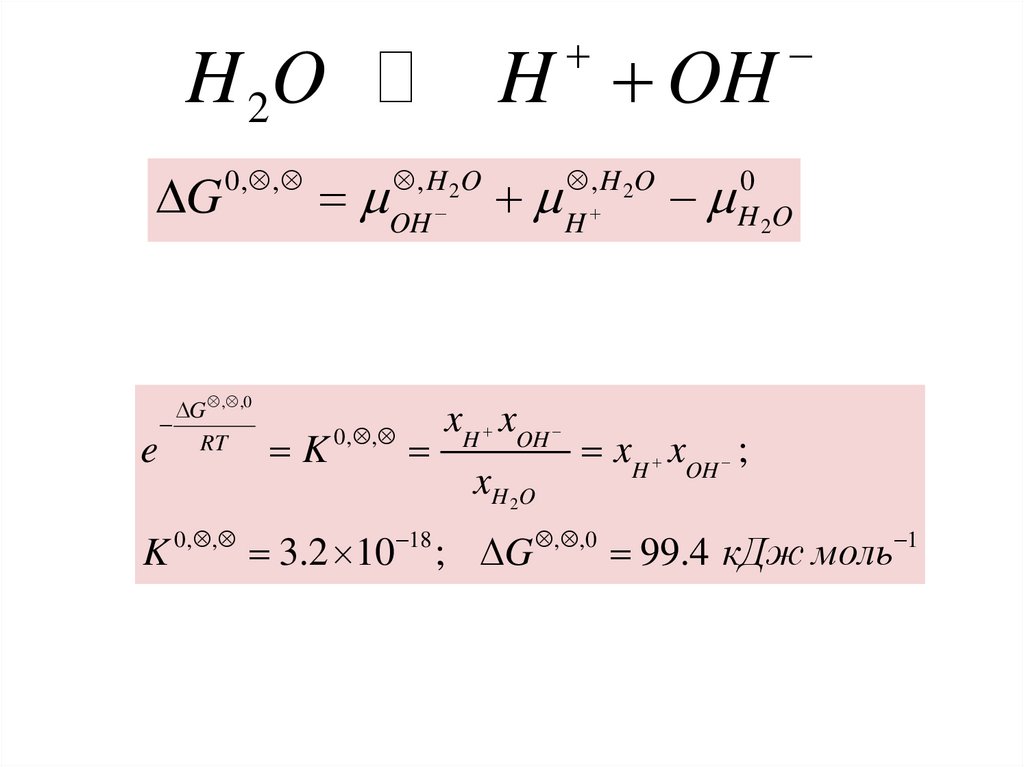
H OHH 2O
DG
e
0, ,
DG , ,0
RT
K
, H 2O
OH
0, ,
xH xOH
xH 2 O
, H 2O
H
0
H 2O
xH xOH ;
K 0, , 3.2 10 18 ; DG , ,0 99.4 кДж моль 1
29.
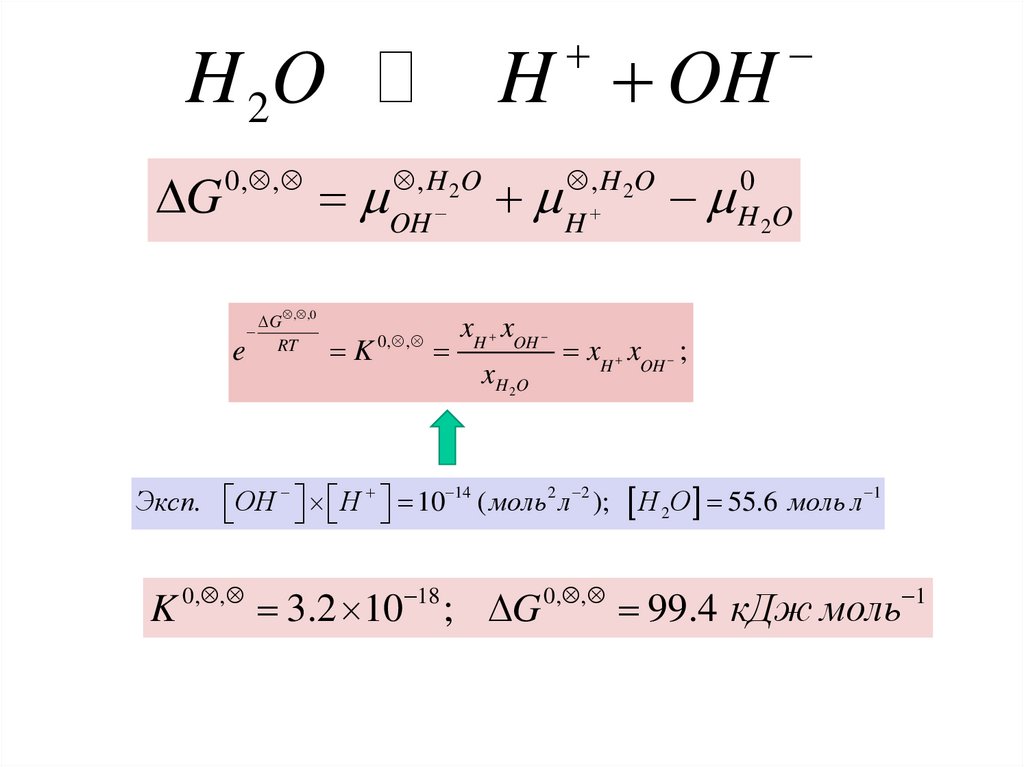
H OHH 2O
DG
0, ,
e
DG , ,0
RT
K
, H 2O
OH
0, ,
xH xOH
xH 2 O
, H 2O
H
K
18
3.2 10 ; DG
0
H 2O
xH xOH ;
Эксп. OH H 10 14 ( моль2 л 2 );
0, ,
0, ,
H 2O 55.6 моль л 1
99.4 кДж моль
1
30.
ЗАКОН РАУЛЯ и ЗАКОН ГЕНРИp ( x) p 0 x 1 x
ЗАКОН ГЕНРИ
p ( x) k x x, x 0, X lim RT ln x
x 0
с 0
p (с) k M c, c 0, C lim RT ln 0 ; с 1М
C 0
с
m
p (m) km c, c 0, m lim RT ln 0 ; m 0 1М
m 0
m
31.
Cвязь между стандартными потенциалами С0 = 1Мc0
раст
1 x RT ln x1 RT ln
RT ln
c
раст
0
с0
c1
c1
RT ln
RT ln c RT ln
c
c
раст
0
0
x
RT ln
с
x
c0
раст.
32.
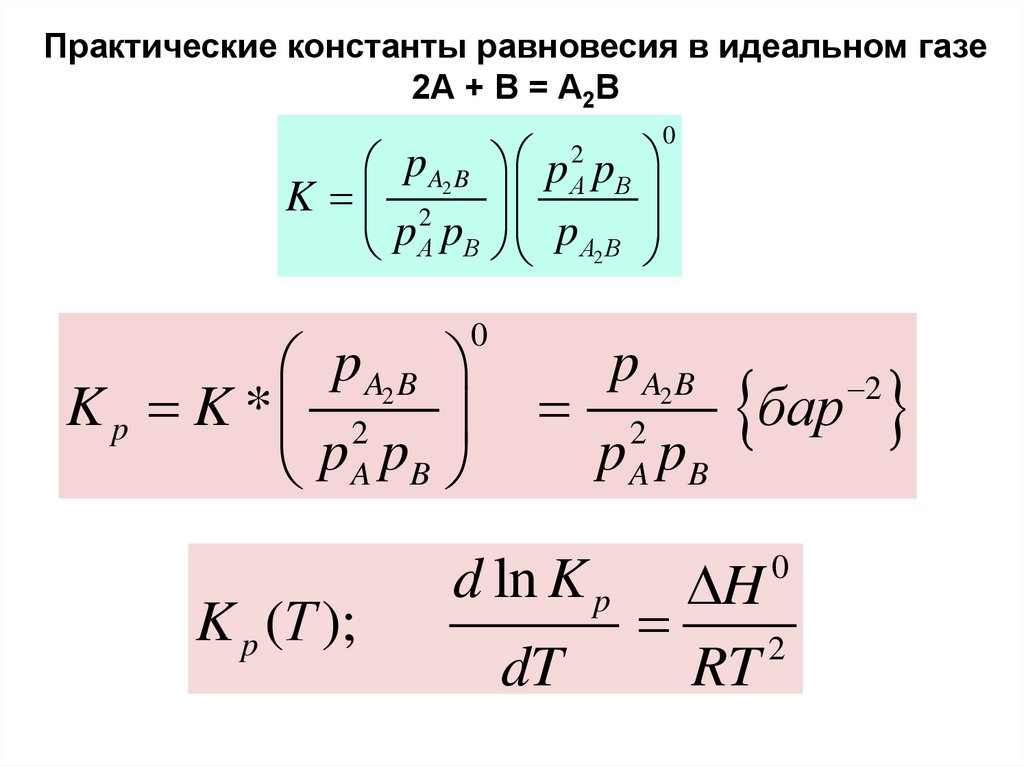
Практические константы равновесия33.
Практические константы равновесия в идеальном газе2А + В = А2В
p A2 B p pB
K 2
p
p
А B p A2 B
2
А
p A2 B
K p K * 2
p A pB
K p (Т );
0
p A2 B
2
A
p pB
d ln K p
dT
0
бар
2
DH
2
RT
0
34.
Практические константы равновесия в идеальном газе2А + В = А2В
p A2 B p pB
K 2
p
p
А B p A2 B
2
А
0
0
p A2 B
p A2 B
2
2
K с K * 2 RT 2 RT
p A pB
p A pB
c A2 B
2
2 М
c AcB
d ln Kс DН 2 RT DU
2
dT
RT
RT 2
0
Kс (Т );
0
35.
Практические константы равновесияв разбавленном растворе
Инертный растворитель!
K
Kс
сA2 B
сс
2
A B
х A2 B
х х
2
А B
xA2 B
М x x
2
2
A B
pacт
2
K * pacт
2
d ln раст
DH
d ln K c
K с (Т , p );
2
2
dT p RT
dT
p
36.
Зависимость констант равновесия от давления37.
GdG SdT Vdp;
V;
p T
0
ln
K
D
V
d DGT0 RTd ln K ;
RT
p T
38.
ФазаГаз:
Ид.
Реал.
p
(T ) RT ln 0
p
p
0
(T ) RT ln 0
p
Жд.,тв.:
Ид.
(T , p) RT ln x
Реал.
Жд.,тв.:
Раз. р-р.
0
0
0 (T , p) RT ln a
(T , p) RT ln x
Растворитель !
,
0
0 (ид.,T , p0 1бар)
0
0
0
S ;
0
T p
p T
0 ( T , p, x 1)
0
0
0
0
S
;
V
T
p
p
T
( T , p) lim RT ln x
x 0
S
;
V
T
p
p
T
39.
K QФаза
Газ:
Ид.
p A2 B p pB
K (T ) 2
p A pB p A2 B
2
A
0
f A2 B p pB
2
f A f B p A2 B
2
A
Реал.
Жд.,тв.:
Ид. 0
(x=1)
Реал.
K (T , p)
K (T , p)
0
0
x A2 B
2
A B
x x
a A2 B
2
A B
a a
0
d ln K DH
2
RT
dT
0
d ln K 0
DH 0
2
dT
RT
р
d ln K 0
DV 0
RT
dp T
0
40.
K QФаза
Раз.
р=р:
0
0,
K (T , p)
K (T , p)
xA2 B
2
A B
x x
Раст-ль!
Раз.
р=р:
K (T , p)
x A2 B
2
A B
d ln K 0
DH 0
2
dT
RT
р
d ln K 0
DV 0
RT
dp T
d ln K
DH
2
dT
RT
р
x x
d ln K
DV
RT
dp T
Растворитель!
41.
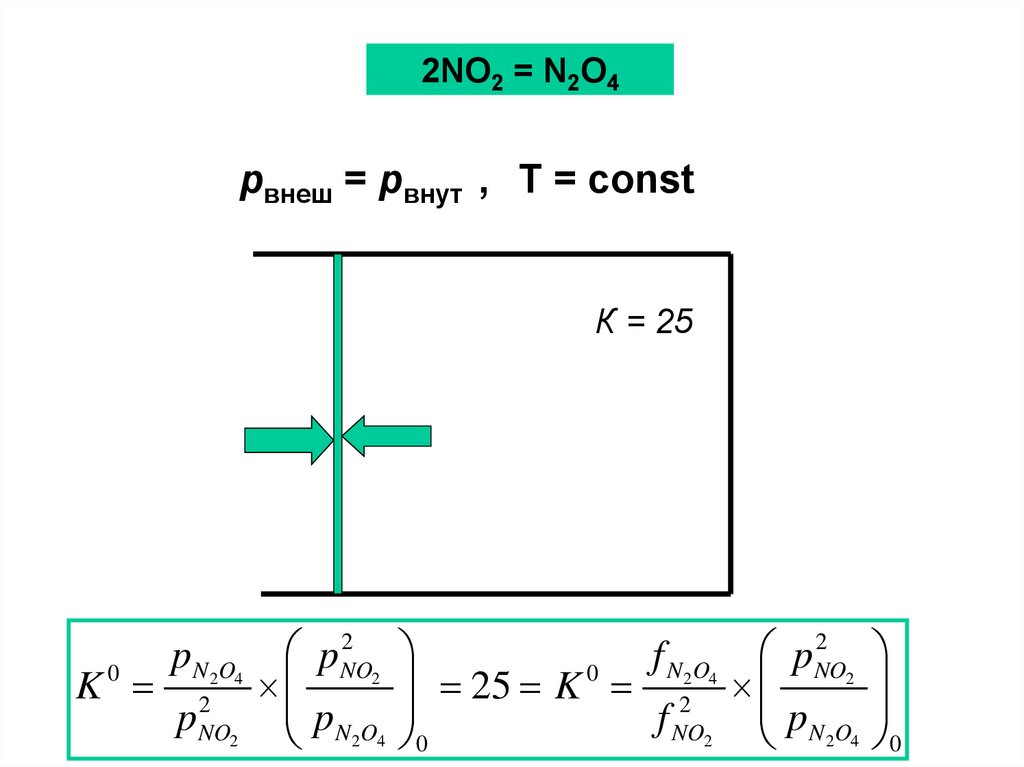
2NO2 = N2O4pвнеш = pвнут , T = const
К = 25
K
0
pN 2O4
p
2
NO2
2
pNO
2
pN O
2 4
2
f
p
N 2O4
NO2
0
25
K
2
f NO2 pN 2O4
0
0
42.
2A+ B = A2BВода - растворитель
d ln K , , ,
DV , , ,
dp
RT
T
К , , , T ,1 бар 1.2 104
К , , , T ,1000 бар 2.0 104
Не
2A + B = А2В
pвнеш = pвнут = pинерт (1-1000 бар)
T = 1000 K
43.
Гетерогенные равновесия. Равновесия с участиемчистых жидких и твердых фаз.
44.
СаСO3 твCaO тв CO2 ( газ )
DG CaO CO2 CaCO3 0
СаO и CaCO3 не смешиваются
CaO
0
СaO
; CaCO3
0
CaCO3
; CO2
0
CO2
p
RT ln 0
p 1бар
pCO2
pCO2
G
0
0
0
0
D
G
D
G
RT
ln
RT
ln
0
СаО
СO2
0
0
CaCO3
p 1бар
p 1бар
T , p
e
DG 0
RT
Q рав. K
pCO2
p 0 1бар
45.
СаСO3 твCaO тв CO2 ( газ )
DG CaO CO2 CaCO3 0
СаO и CaCO3 образуют твердый раствор
0
0
0
CaO СaO
RT ln aCaO ; CaCO CaCO
RT ln aCaO ; CO CO
RT ln
3
3
3
2
2
p
p 0 1бар
pCO2 aCaO
aCaO pCO2
G
0
0
0
0
D
G
D
G
RT
ln
RT
ln
0
СаО
СO2
0
0
CaCO3
aCaCO3 p 1бар
aCaCO3 p 1бар
T , p
e
DG 0
RT
Q рав. K
aCaO pCO2
aCaCO3 p 0 1бар
46.
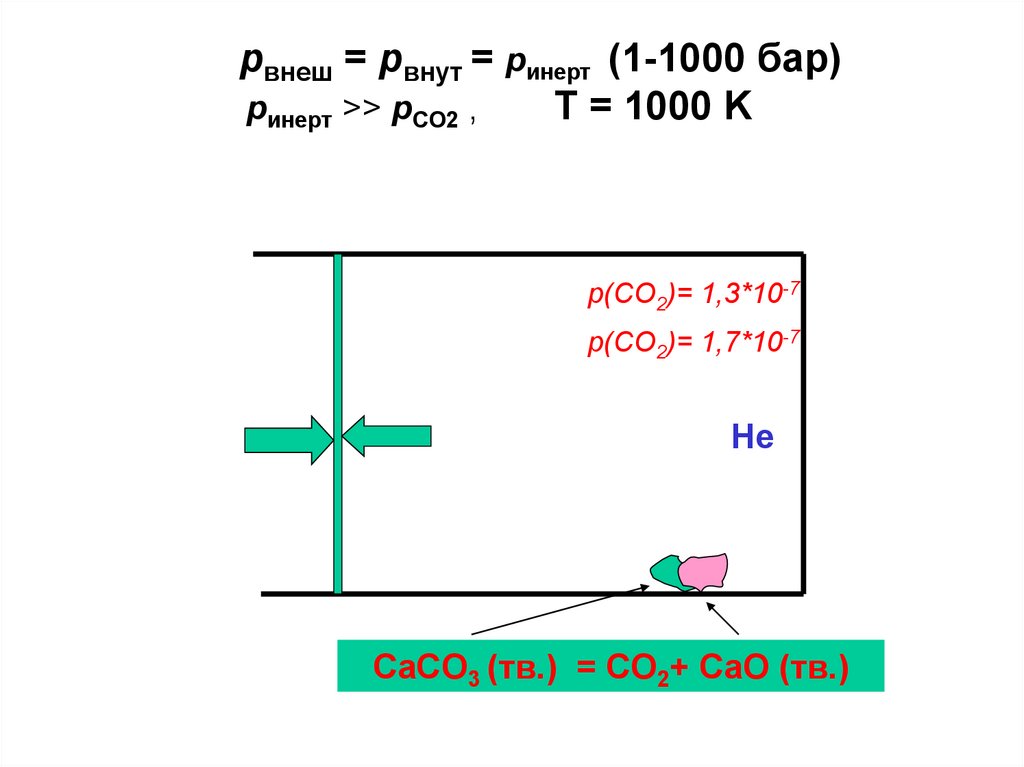
pвнеш = pвнут = pинерт (1-1000 бар)pинерт >> pCO2 ,
T = 1000 K
p(CO2)= 1,3*10-7
p(CO2)= 1,7*10-7
Не
CaCO3 (тв.) = CO2+ CaO (тв.)
47.
Гетерогенные равновесия.Минимум или минимальное значение ?
48.
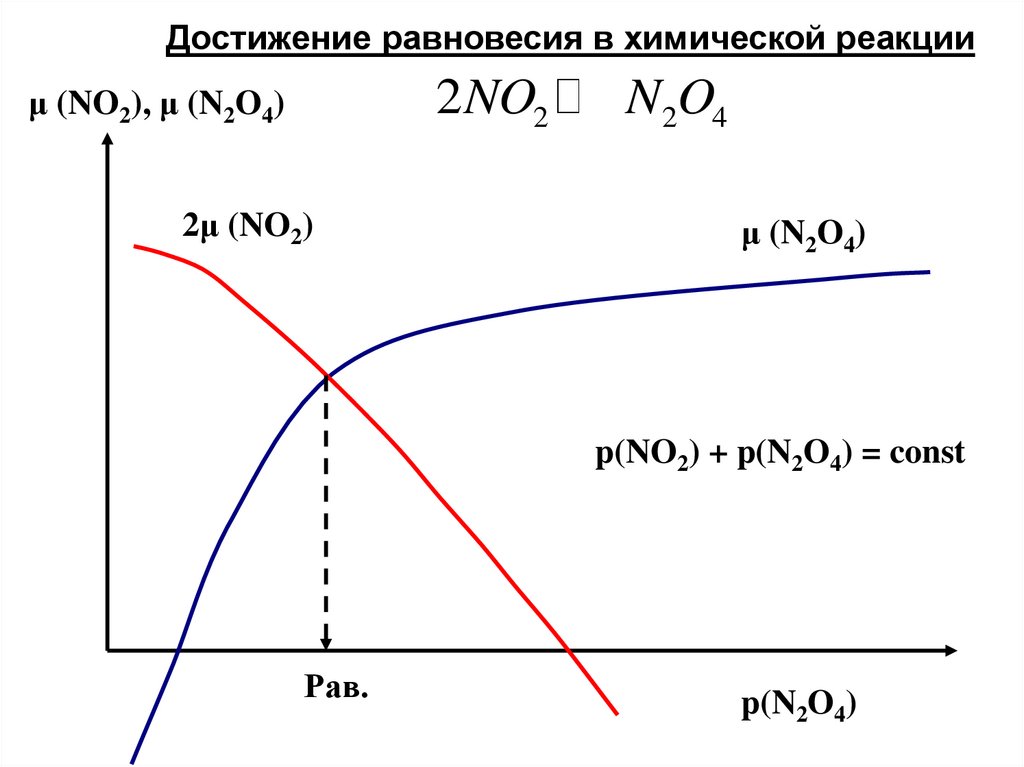
Достижение равновесия в химической реакции2NO2
μ (NO2), μ (N2O4)
2μ (NO2)
N2O4
μ (N2O4)
p(NO2) + p(N2O4) = const
Рав.
p(N2O4)
49.
GT,pСамопроизвольное течение
химической реакции
2NO2 N2O4
2NO2 N2O4
N2O4 2 NO2
(dG )T , p 0
Равновесие, ∆G=0
ξ=p(N2O4)
50.
Достижение равновесия в гетерогенной реакцииμ
3KF тв AlF3 тв
K 3 AlF6 тв
3μ (KF)+μ (AlF3) = 3μ0 (KF)+μ0 (AlF3)
μ (K3AlF6) = μ0 (K3AlF6)
T, pобщ. = const
n (К3AlF6)
51.
GТ,рДостижение равновесия в гетерогенной реакции
3KF тв AlF3 тв
K 3 AlF6 тв
G
0
0
0
0
D
G
D
G
3
0
KF3
AlF3
K3 AlF6
T , p
Q 1
минимальное значение G , не минимум ! DG 0
ξ = nAlF3
52.
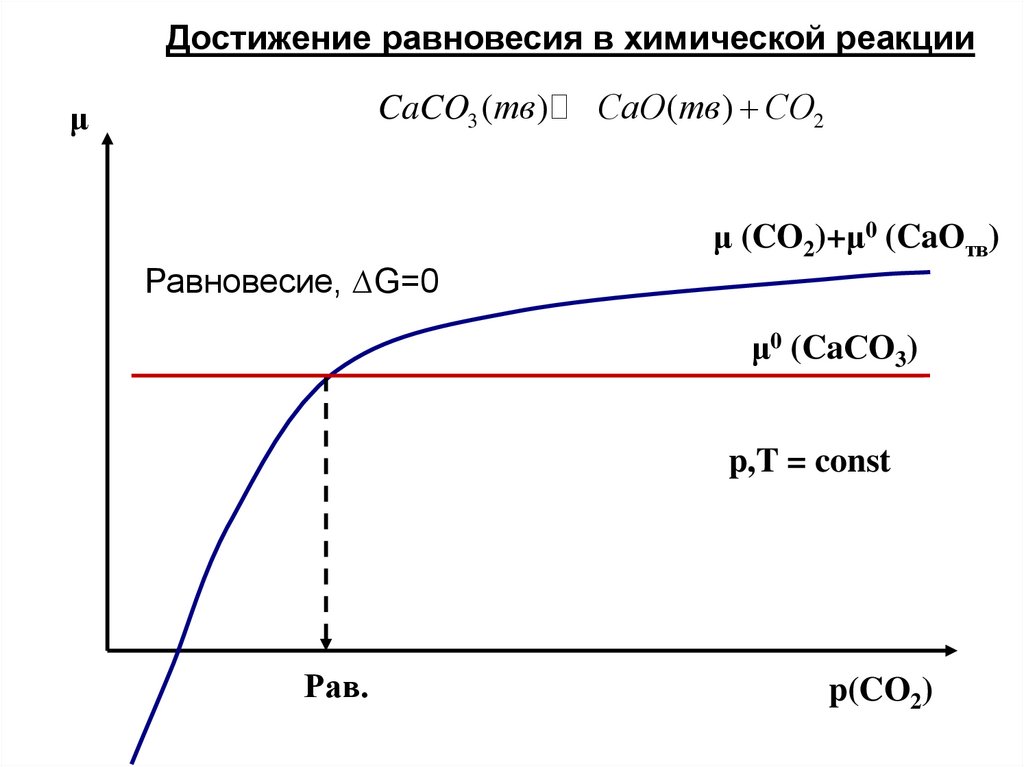
Достижение равновесия в химической реакцииCaCO3 (тв )
μ
СaO (тв ) СO2
μ (CO2)+μ0 (CaOтв)
Равновесие, ∆G=0
μ0 (CaСO3)
p,T = const
Рав.
p(CO2)
53.
GT,pСамопроизвольное течение
химической реакции
СaO (тв ) СO2
CaCO3 (тв )
CaCO3 (тв ) СaO (тв ) СO2
СaO (тв ) СO2 CaCO3 (тв )
(dG )T , p 0
Равновесие
рСО2











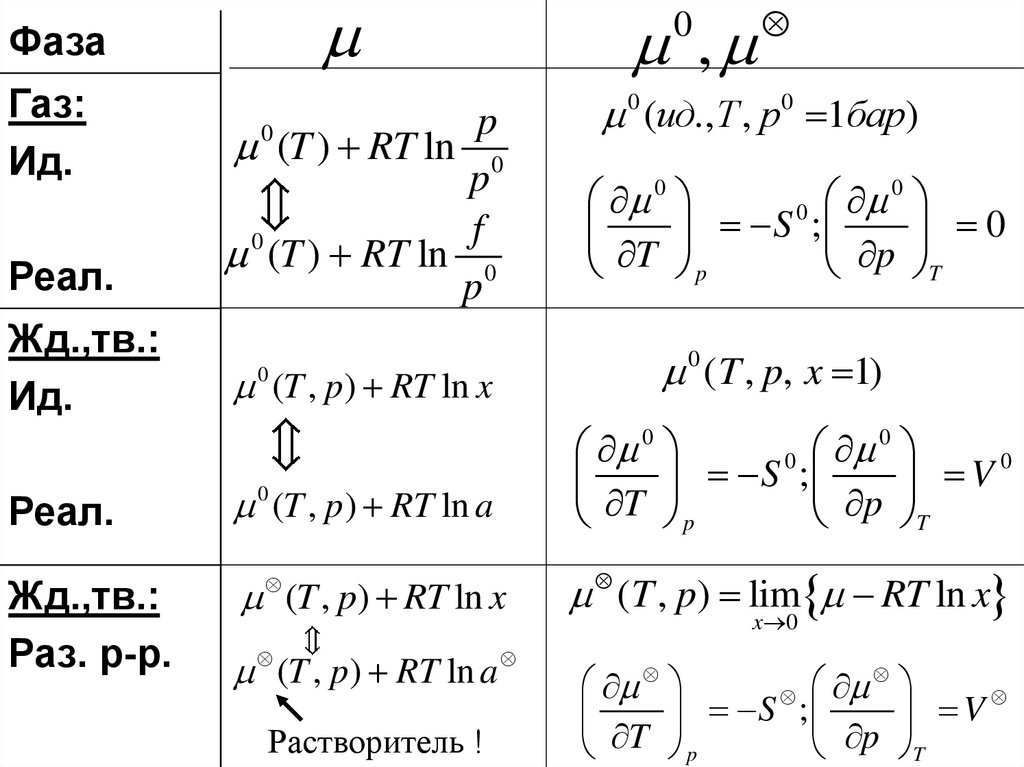










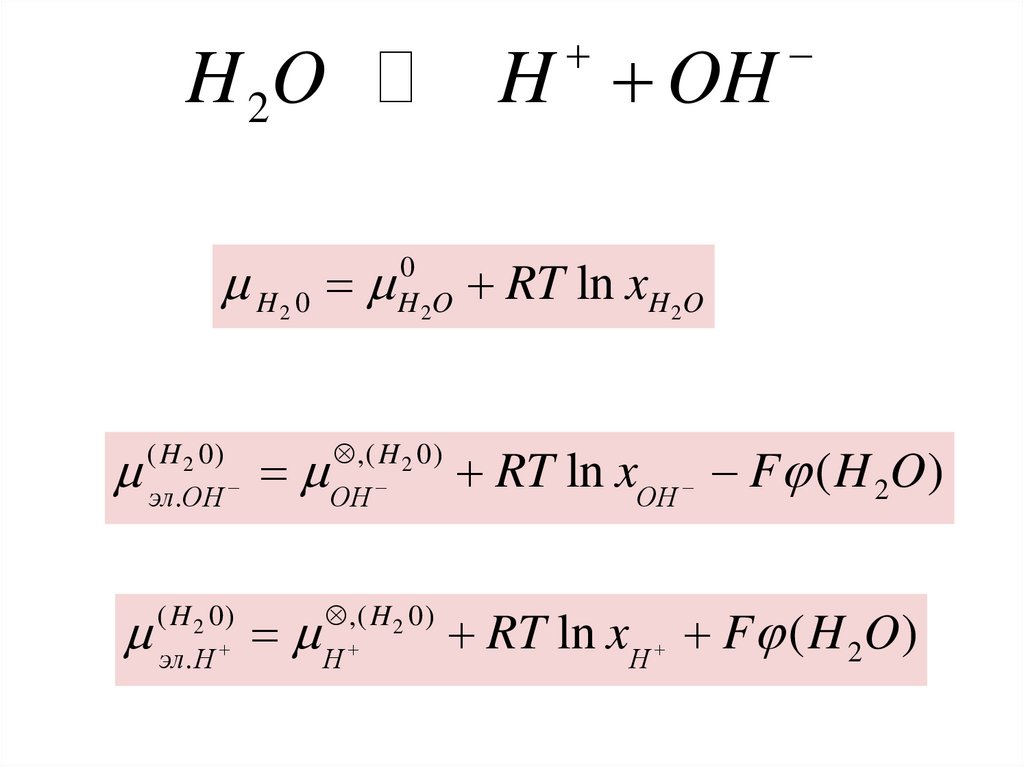



















 Химия
Химия








