Похожие презентации:
Галогены
1.
Галогены2.
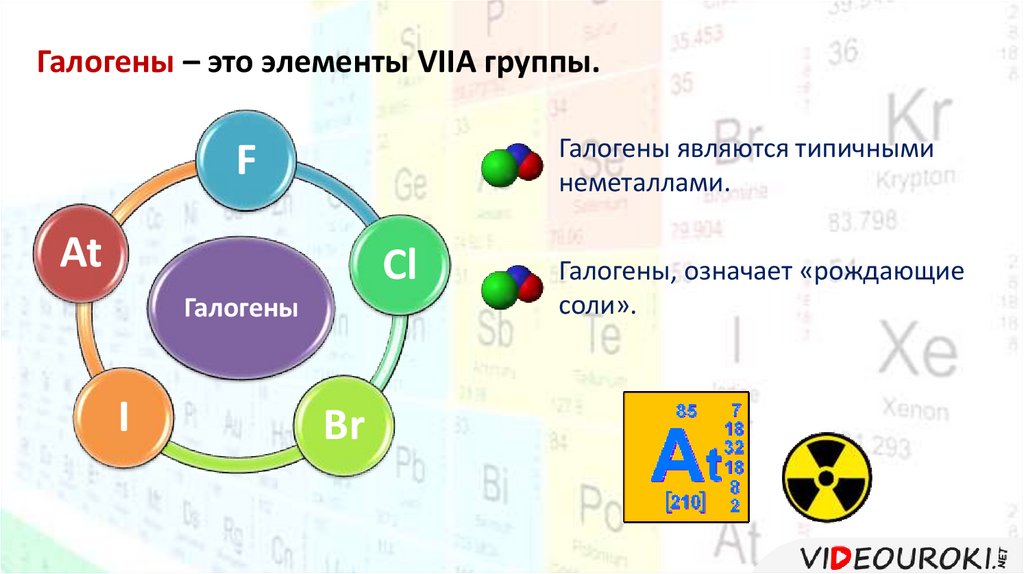
Галогены – это элементы VIIA группы.Галогены являются типичными
неметаллами.
F
At
Cl
Галогены
I
Br
Галогены, означает «рождающие
соли».
3.
2 7Хлор Cl
+17
2 8 7
Бром Br
F0 + 1ē → F-
+35
Cl0 + 1ē → Cl-
2 8 18 7
Йод I
Br0 + 1ē → Br-
+53
2 8 18 18 7
Астат At
+85
2 8 18 32 18 7
I0 + 1ē → I-
2Na + Cl2 = 2NaCl
+9
-1
Фтор F
4.
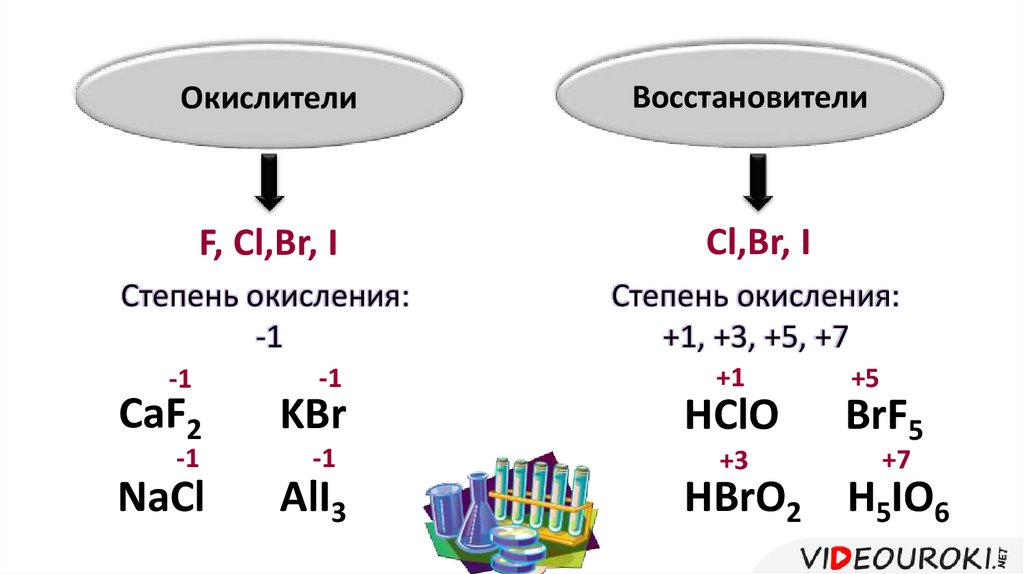
ОкислителиВосстановители
F, Cl,Br, I
Cl,Br, I
Степень окисления:
-1
Степень окисления:
+1, +3, +5, +7
-1
CaF2
-1
NaCl
-1
KBr
-1
AlI3
+1
HClO
+3
+5
BrF5
+7
HBrO2 H5IO6
5.
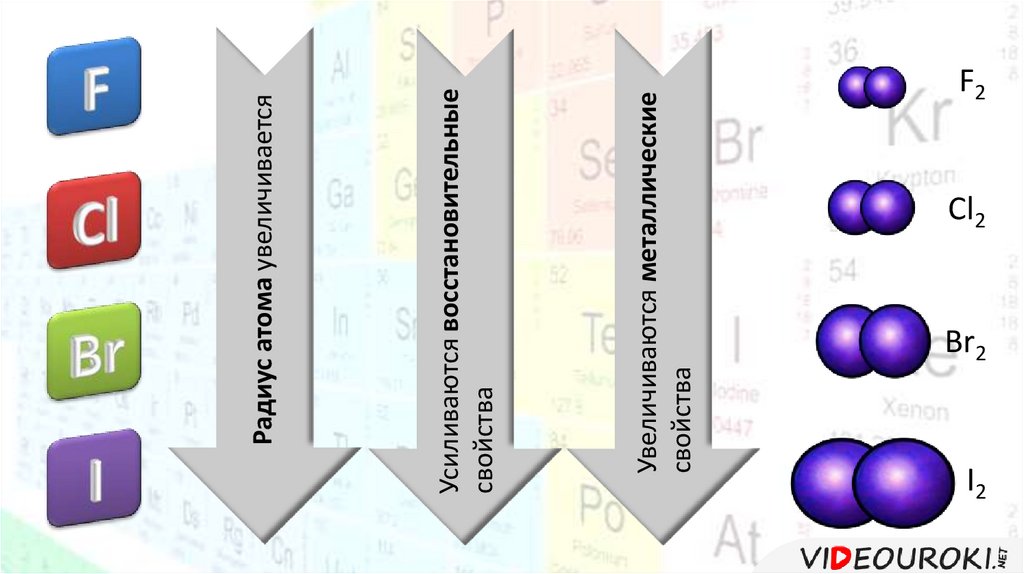
Увеличиваются металлическиесвойства
Усиливаются восстановительные
свойства
Радиус атома увеличивается
F2
Cl2
Br2
I2
6.
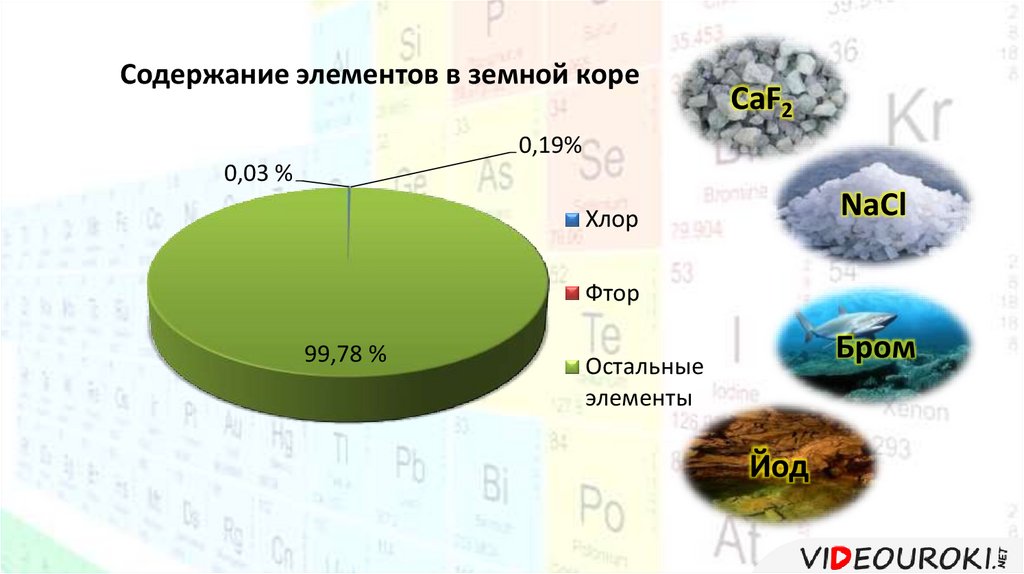
Содержание элементов в земной кореCaF2
0,19%
0,03 %
NaCl
Хлор
Фтор
99,78 %
Бром
Остальные
элементы
Йод
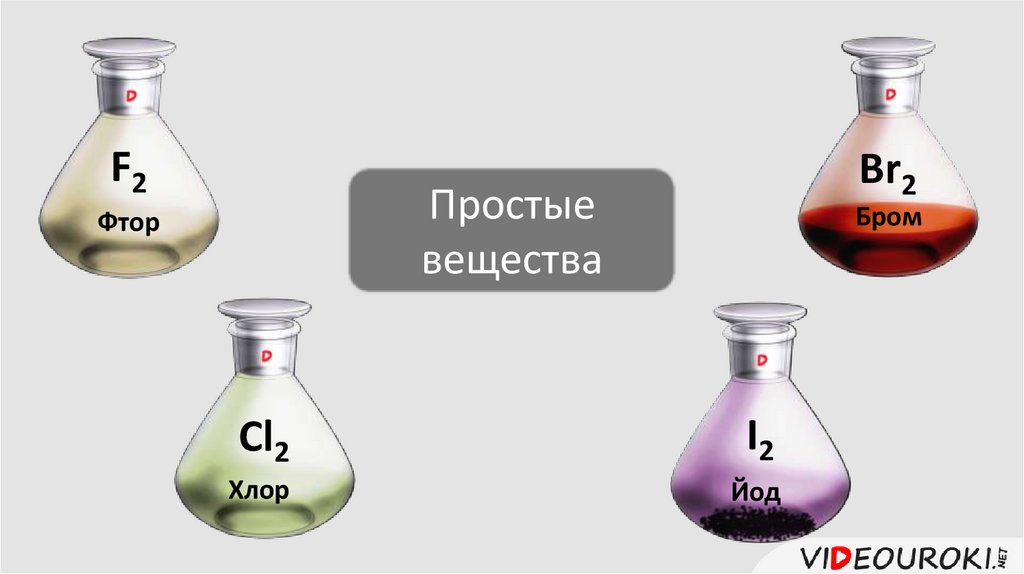
7.
F2Br2
Простые
вещества
Фтор
Бром
Cl2
I2
Хлор
Йод
8.
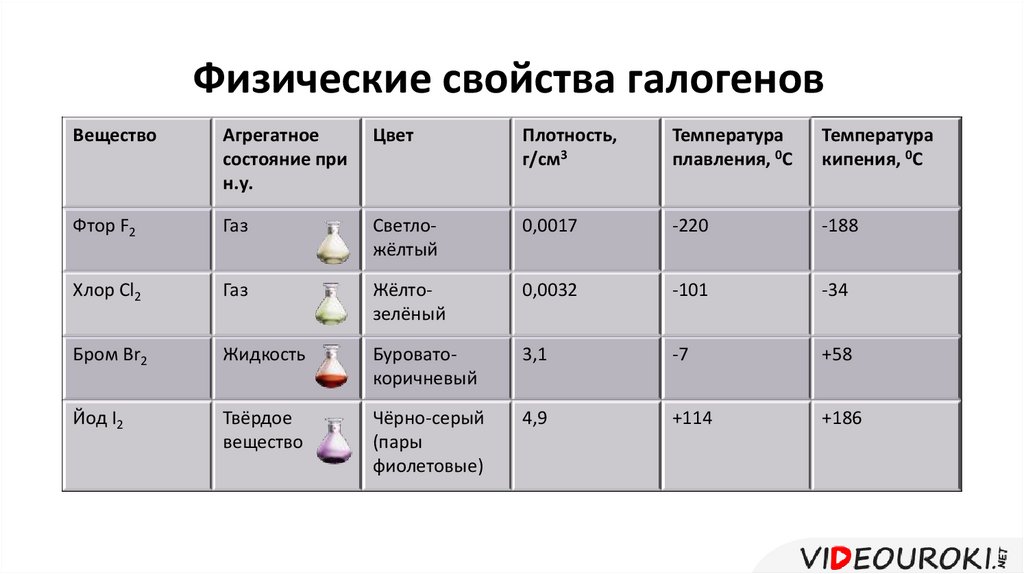
Физические свойства галогеновВещество
Агрегатное
состояние при
н.у.
Цвет
Плотность,
г/см3
Температура
плавления, 0С
Температура
кипения, 0С
Фтор F2
Газ
Светложёлтый
0,0017
-220
-188
Хлор Cl2
Газ
Жёлтозелёный
0,0032
-101
-34
Бром Br2
Жидкость
Буроватокоричневый
3,1
-7
+58
Йод I2
Твёрдое
вещество
Чёрно-серый
(пары
фиолетовые)
4,9
+114
+186
9.
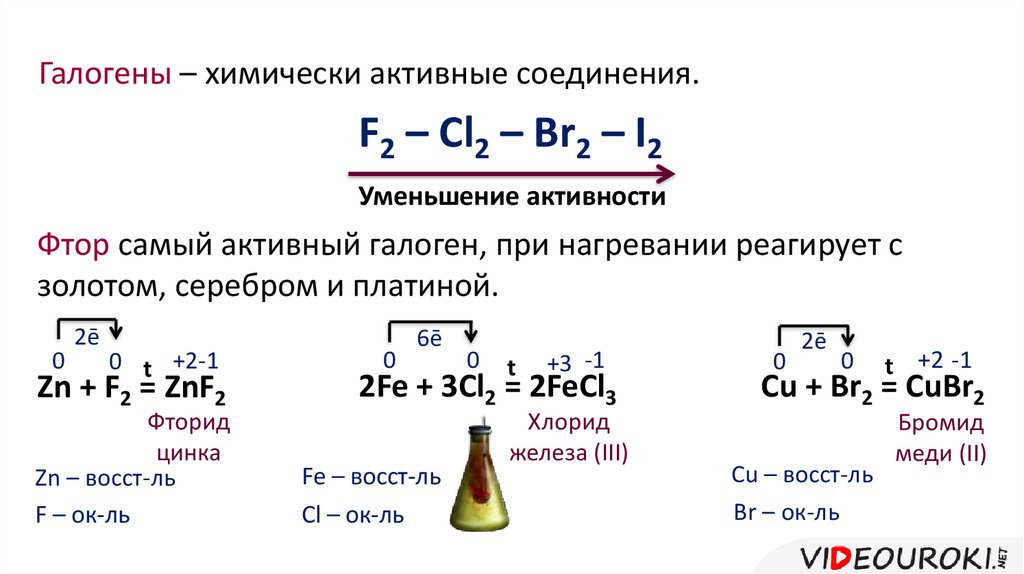
Галогены – химически активные соединения.F2 – Cl2 – Br2 – I2
Уменьшение активности
Фтор самый активный галоген, при нагревании реагирует с
золотом, серебром и платиной.
0
2ē
0 t +2-1
Zn + F2 = ZnF2
Фторид
цинка
Zn – восст-ль
F – ок-ль
0
6ē
0
t
+3 -1
2Fe + 3Cl2 = 2FeCl3
Fe – восст-ль
Cl – ок-ль
Хлорид
железа (III)
0
2ē
0
t +2 -1
Cu + Br2 = CuBr2
Cu – восст-ль
Br – ок-ль
Бромид
меди (II)
10.
06ē
0
+3-1
Более активный галоген вытесняет из
соли менее активный.
2Al + 3I2 = 2AlI3
Йодид
алюминия
Al – восст-ль
I – ок-ль
0
-1
-1
0
Cl2 + 2NaBr = 2NaCl + Br2
2ē
Cl – ок-ль
Br – восс-ль
0
-1
Хлорид Бром
натрия
-1
0
Br2 + 2KI = 2KBr + I2
2ē
Br – ок-ль
I – восст-ль
Бромид Йод
калия
11.
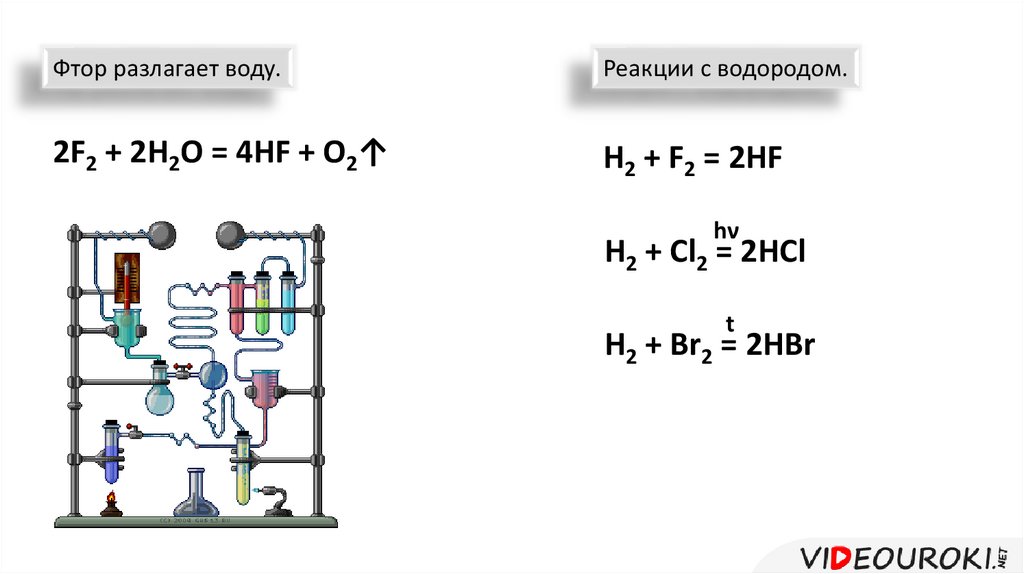
Фтор разлагает воду.Реакции с водородом.
2F2 + 2H2O = 4HF + O2↑
H2 + F2 = 2HF
hν
H2 + Cl2 = 2HCl
t
H2 + Br2 = 2HBr
12.
От греч. фторос –«разрушающий».
Получен в 1886 году
французским химиком
А. Муссаном, который
был удостоен за это
Нобелевской премии.
От греч. хлорос –
«жёлто-зелёный».
Открыт шведским
химиком
К. Шееле в
1774 году.
От греч. бромос –
«зловонный».
Открыт в 1826 году
французским химиком
А. Баларом.
От греч. иодэс –
«фиолетовый».
Получен в 1811 году
французским
учёным Б. Куртуа
13.
Галогены – это элементы VIIA группы.Молекулы галогенов двухатомны.
Они являются сильными окислителями, самый сильный –
фтор.
Степень окисления фтора -1, остальные галогены могут
иметь степень окисления и +1, +3, +5, +7.
В природе встречаются только в виде соединений.
14.
Физические свойства их разнообразны: это газы (фтор ихлор), жидкость – бром и твёрдое вещество – йод.
С увеличением молекулярной массы у галогенов
увеличиваются температуры кипения и плавления.
Галогены реагируют с металлами, с водородом и
растворами солей, при этом более активный галоген
вытесняет из соли менее активный.






 Химия
Химия








