Похожие презентации:
Правовые основы проведения клинических исследований
1.
Правовые основы проведенияклинических исследований
Младший юрист практики здравоохранения и
коммерции
Карина Колобова
Июнь 2020
www.pgplaw.ru
2.
Блок 11
Общие вопросы проведения
КИ в РФ
3.
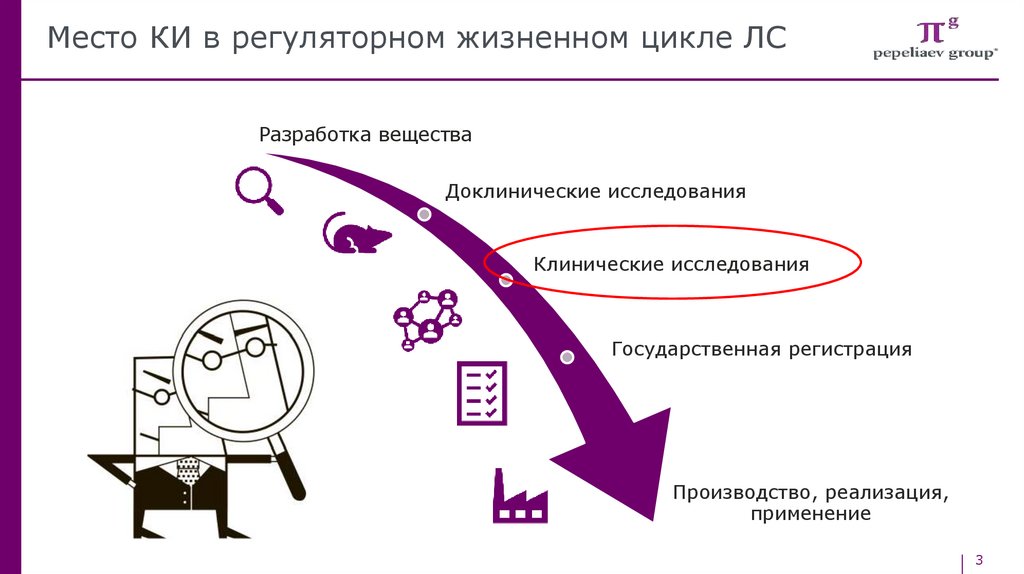
Место КИ в регуляторном жизненном цикле ЛСРазработка вещества
Доклинические исследования
Клинические исследования
Государственная регистрация
Производство, реализация,
применение
3
4.
Что такое клиническое исследование?Клиническое
исследование
лекарственного
препарата
изучение
диагностических,
лечебных,
профилактических,
фармакологических
свойств
лекарственного препарата в процессе его применения у человека, в том числе
процессов всасывания, распределения, изменения и выведения, путем применения
научных методов оценок в целях получения:
1. Доказательств безопасности, качества и эффективности лекарственного препарата,
2. Данных
о
нежелательных
реакциях
организма
человека
на
применение
лекарственного препарата и
3. Об эффекте его взаимодействия с другими лекарственными препаратами и (или)
пищевыми продуктами.
В РФ проведение КИ необходимо для референтного лекарственного препарата лекарственного препарата, который впервые регистрируется в РФ, и который в
дальнейшем используется для оценки биоэквивалентности или терапевтической
эквивалентности воспроизведенного или биоаналогового (биоподобного) лекарственного
препарата (дженерика).
4
5.
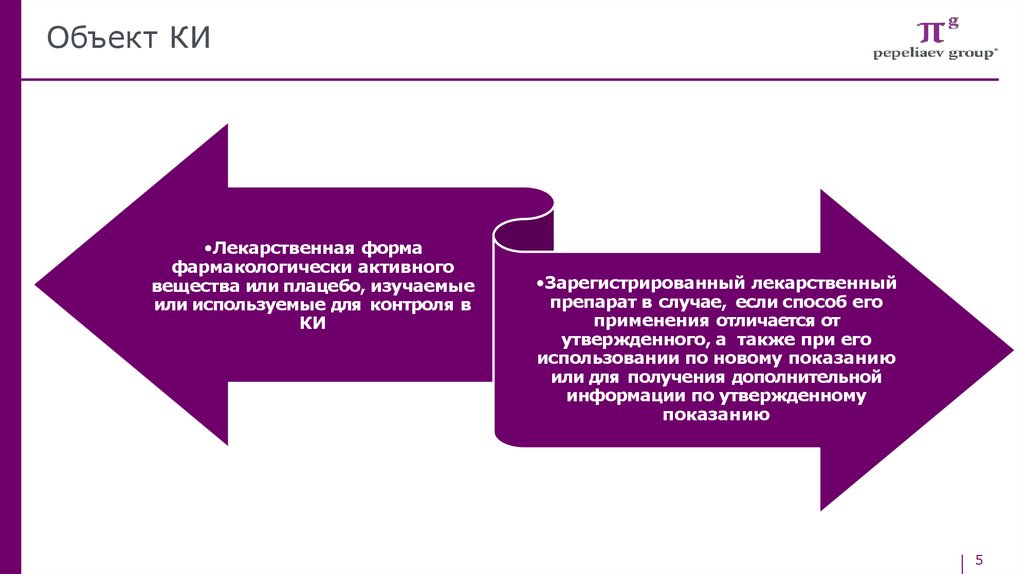
Объект КИ•Лекарственная форма
фармакологически активного
вещества или плацебо, изучаемые
или используемые для контроля в
КИ
•Зарегистрированный лекарственный
препарат в случае, если способ его
применения отличается от
утвержденного, а также при его
использовании по новому показанию
или для получения дополнительной
информации по утвержденному
показанию
5
6.
Цели проведения КИ• установление безопасности лекарственных препаратов для здоровых
добровольцев и (или) переносимости их здоровыми добровольцами, за
исключением таких исследований лекарственных препаратов, произведенных
за пределами Российской Федерации;
• подбор оптимальных дозировок лекарственного препарата и курса
лечения для пациентов с определенным заболеванием, оптимальных доз и
схем вакцинации иммунобиологическими лекарственными препаратами
здоровых добровольцев;
• установление
безопасности
лекарственного
препарата
и
его
эффективности для пациентов с определенным заболеванием,
профилактической
эффективности
иммунобиологических
лекарственных
препаратов для здоровых добровольцев;
• изучение возможности расширения показаний для медицинского
применения
и
выявления
ранее
неизвестных
побочных
действий
зарегистрированных лекарственных препаратов.
6
7.
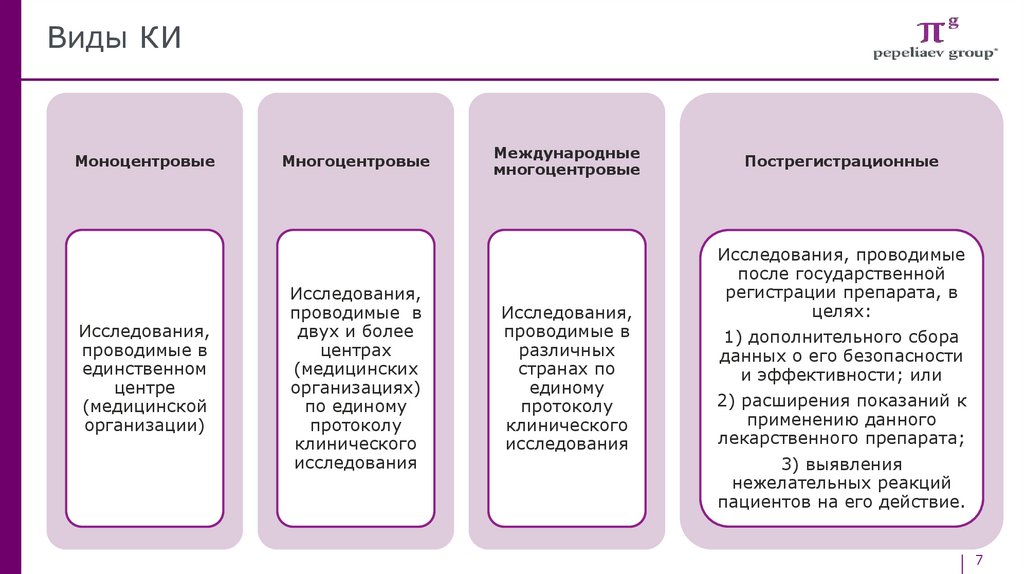
Виды КИМоноцентровые
Исследования,
проводимые в
единственном
центре
(медицинской
организации)
Многоцентровые
Исследования,
проводимые в
двух и более
центрах
(медицинских
организациях)
по единому
протоколу
клинического
исследования
Международные
многоцентровые
Исследования,
проводимые в
различных
странах по
единому
протоколу
клинического
исследования
Пострегистрационные
Исследования, проводимые
после государственной
регистрации препарата, в
целях:
1) дополнительного сбора
данных о его безопасности
и эффективности; или
2) расширения показаний к
применению данного
лекарственного препарата;
3) выявления
нежелательных реакций
пациентов на его действие.
7
8.
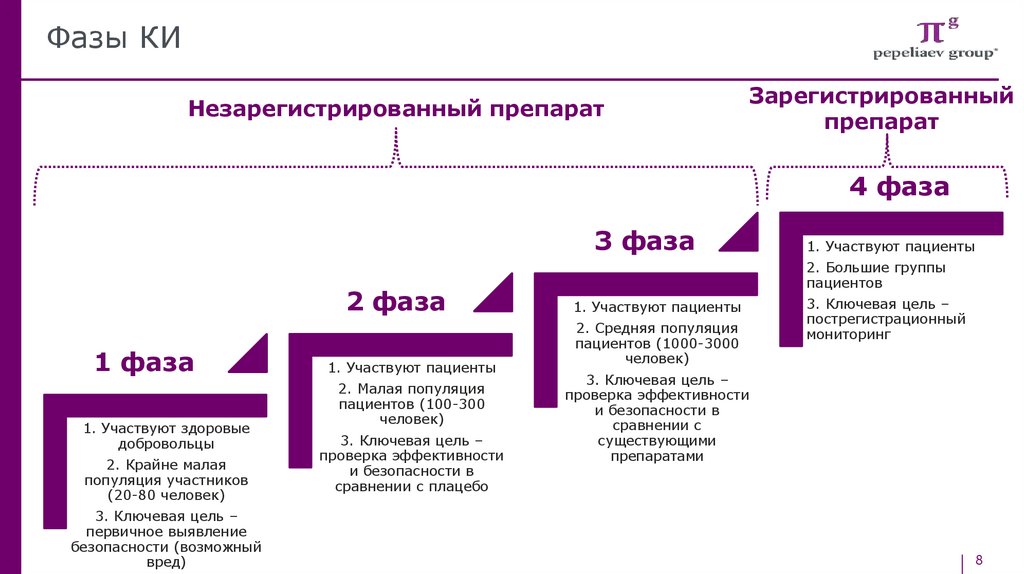
Фазы КИНезарегистрированный препарат
Зарегистрированный
препарат
4 фаза
3 фаза
2 фаза
1 фаза
1. Участвуют здоровые
добровольцы
2. Крайне малая
популяция участников
(20-80 человек)
3. Ключевая цель –
первичное выявление
безопасности (возможный
вред)
1. Участвуют пациенты
2. Малая популяция
пациентов (100-300
человек)
3. Ключевая цель –
проверка эффективности
и безопасности в
сравнении с плацебо
1. Участвуют пациенты
2. Большие группы
пациентов
1. Участвуют пациенты
2. Средняя популяция
пациентов (1000-3000
человек)
3. Ключевая цель –
пострегистрационный
мониторинг
3. Ключевая цель –
проверка эффективности
и безопасности в
сравнении с
существующими
препаратами
8
9.
Фазы КИ1 Фаза – клинико - фармакологические исследования, первый опыт применения вещества
ограниченным количеством здоровых добровольцев в условиях стационара для оценки профиля
безопасности, токсичности, определения безопасного диапазона
дозировки и выявления
побочных эффектов.
2 Фаза – применение у пациентов с определенным заболеванием. Цель - установление
эффективности, определение оптимальных режимов дозирования, оценка безопасности.
• Фаза IIa
(pilot studies) – терапевтические пилотные
исследования.
Исследуется
фармакологические свойства вещества (активность, безопасность, устанавливается популяция
пациентов, режим дозирования, зависимость эффекта от дозы, критерии
оценки
эффективности и т.д.). Испытания проводятся на ограниченном числе пациентов (100-300),
за которыми осуществляется тщательное наблюдение, иногда в стационаре.
• Фаза IIb (pivotal trial) – более обширные исследования у пациентов с заболеванием,
которое является основным показанием к назначению нового вещества.
9
10.
Фазы КИ3 Фаза: Дополнительная проверка исследуемого вещества для определения безопасности и
эффективности, контроля побочных эффектов и сравнения со стандартными методами
терапии. Применение вещества на нескольких сот до
нескольких тысяч людей с
определенным заболеванием. Как правило, это многоцентровые испытания.
Чаще
всего
исследования
являются
двойными
слепыми
контролируемыми,
рандомизированными, а условия исследований максимально приближены к обычной
реальной рутинной медицинской практике.
Полученные данные являются основой для создания инструкций по применению и для
решения о регистрации препарата.
4 Фаза: пострегистрационные исследования.
10
11.
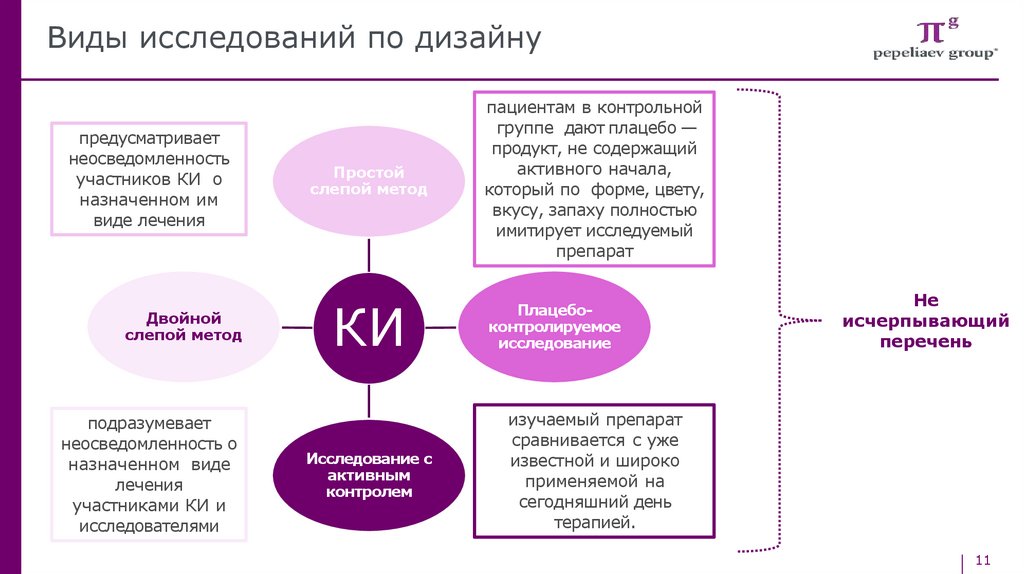
Виды исследований по дизайнупредусматривает
неосведомленность
участников КИ о
назначенном им
виде лечения
Двойной
слепой метод
подразумевает
неосведомленность о
назначенном виде
лечения
участниками КИ и
исследователями
Простой
слепой метод
КИ
Исследование с
активным
контролем
пациентам в контрольной
группе дают плацебо —
продукт, не содержащий
активного начала,
который по форме, цвету,
вкусу, запаху полностью
имитирует исследуемый
препарат
Плацебоконтролируемое
исследование
Не
исчерпывающий
перечень
изучаемый препарат
сравнивается с уже
известной и широко
применяемой на
сегодняшний день
терапией.
11
12.
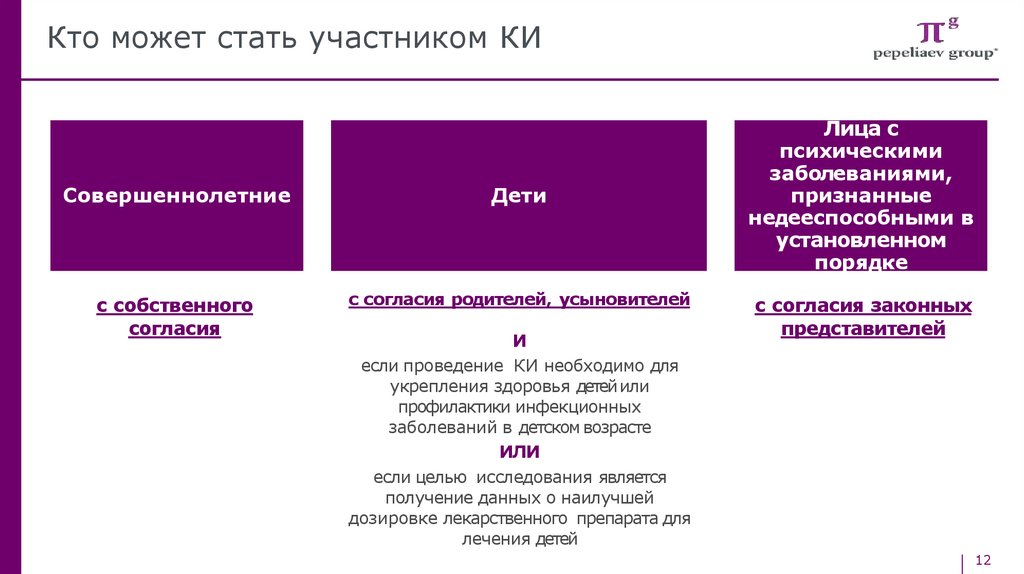
Кто может стать участником КИСовершеннолетние
Дети
с собственного
согласия
с согласия родителей, усыновителей
И
если проведение КИ необходимо для
укрепления здоровья детей или
профилактики инфекционных
заболеваний в детском возрасте
ИЛИ
если целью исследования является
получение данных о наилучшей
дозировке лекарственного препарата для
лечения детей
Лица с
психическими
заболеваниями,
признанные
недееспособными в
установленном
порядке
с согласия законных
представителей
12
13.
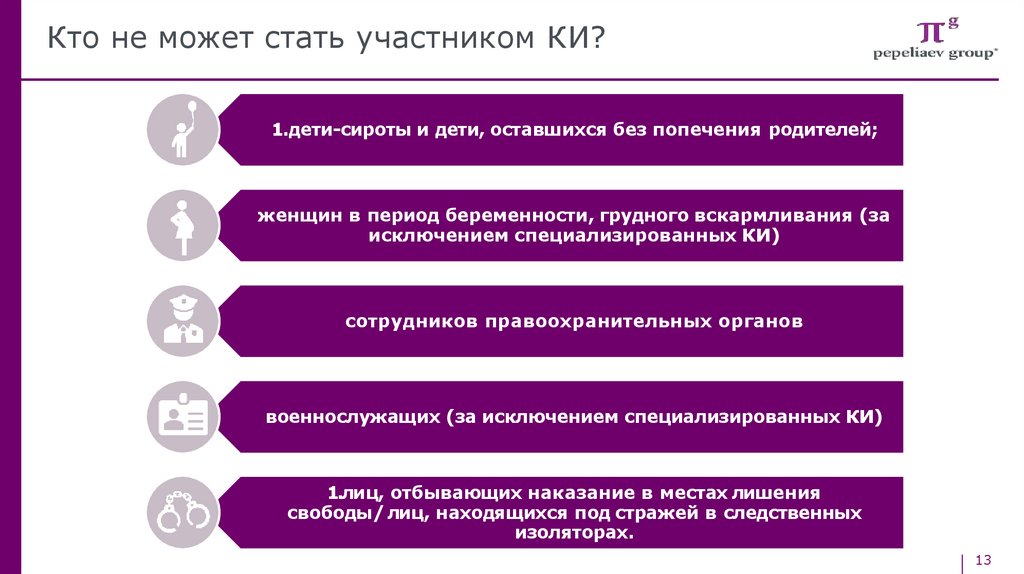
Кто не может стать участником КИ?1.дети-сироты и дети, оставшихся без попечения родителей;
женщин в период беременности, грудного вскармливания (за
исключением специализированных КИ)
сотрудников правоохранительных органов
военнослужащих (за исключением специализированных КИ)
1.лиц, отбывающих наказание в местах лишения
свободы/ лиц, находящихся под стражей в следственных
изоляторах.
13
14.
Блок 22
Участники КИ и их
функциональные роли
15.
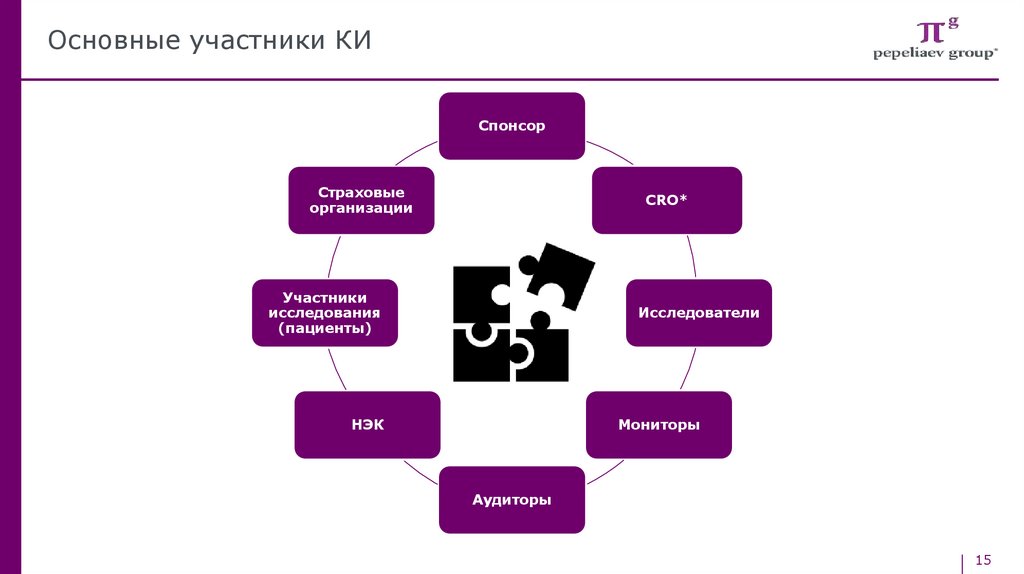
Основные участники КИСпонсор
Страховые
организации
CRO*
Участники
исследования
(пациенты)
Исследователи
НЭК
Мониторы
Аудиторы
15
16.
Этический комитет: функцииЭкспертный совет организации (независимый этический комитет) призван защищать
права, безопасность и благополучие всех субъектов исследования.
Рассматривает и утверждает
следующие документы
•Рассматривает возможность проведения
исследования
Оценивает соответствие компетенции
исследователей
Одобряет исследовательские центры
Периодически рассматривает
документацию
Контролирует информированность
пациентов (гарант защиты прав пациентов)
Контролирует выплаты пациентам
протокол (поправки к протоколу);
письменную форма информированного согласия и ее
последующие редакции, предлагаемые исследователем
для использования в исследовании;
описание действий, направленных на привлечение
субъектов к участию в исследовании (например,
рекламные объявления);
письменные материалы, которые будут предоставлены
субъектам исследования;
брошюра исследователя;
известная информация, касающаяся безопасности;
информация о выплатах и компенсациях субъектам
исследования;
текущую редакцию резюме исследователя и (или) другие
материалы, подтверждающие его квалификацию;
другие документы, которые могут потребоваться ЭСО
(НЭК) для выполнения его обязанностей.
16
17.
Этический комитет: состав• не менее 5 человек;
• по
крайней
мере
1
человек,
не
специализирующийся в области научных
исследований (деятельности);
• по
крайней
мере
1
человек,
не
являющийся сотрудником медицинского
учреждения (исследовательского центра),
в котором проводится исследование.
!
Решение о проведении КИ –
несотрудники исследователя или спонсора
+ отсутствие заинтересованности
Исследователи могут
участвовать,
предоставлять
информацию по любым
аспектам исследования,
но не могут участвовать
в прениях или в
голосовании.
Можно привлекать
дополнительных
независимых
экспертов по узким
вопросам
17
18.
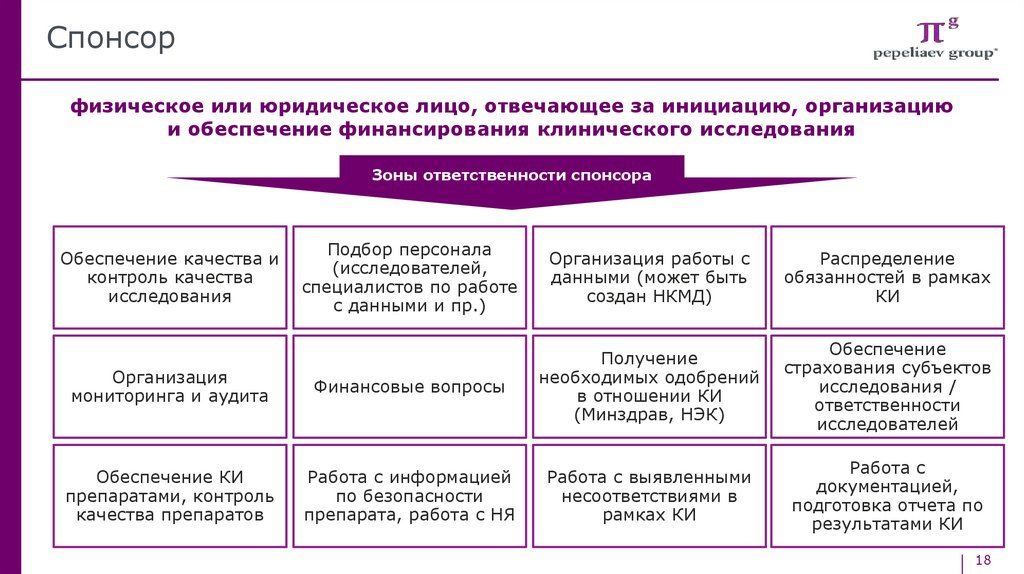
Спонсорфизическое или юридическое лицо, отвечающее за инициацию, организацию
и обеспечение финансирования клинического исследования
Зоны ответственности спонсора
Подбор персонала
(исследователей,
специалистов по работе
с данными и пр.)
Организация работы с
данными (может быть
создан НКМД)
Распределение
обязанностей в рамках
КИ
Организация
мониторинга и аудита
Финансовые вопросы
Получение
необходимых одобрений
в отношении КИ
(Минздрав, НЭК)
Обеспечение
страхования субъектов
исследования /
ответственности
исследователей
Обеспечение КИ
препаратами, контроль
качества препаратов
Работа с информацией
по безопасности
препарата, работа с НЯ
Работа с выявленными
несоответствиями в
рамках КИ
Работа с
документацией,
подготовка отчета по
результатами КИ
Обеспечение качества и
контроль качества
исследования
18
19.
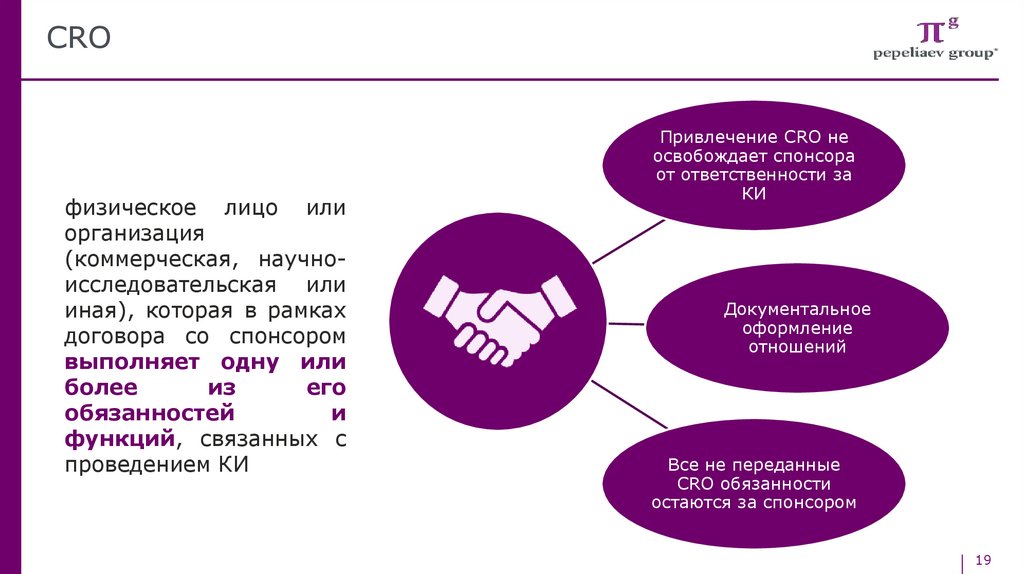
CROфизическое лицо или
организация
(коммерческая, научноисследовательская или
иная), которая в рамках
договора со спонсором
выполняет одну или
более
из
его
обязанностей
и
функций, связанных с
проведением КИ
Привлечение CRO не
освобождает спонсора
от ответственности за
КИ
Документальное
оформление
отношений
Все не переданные
CRO обязанности
остаются за спонсором
19
20.
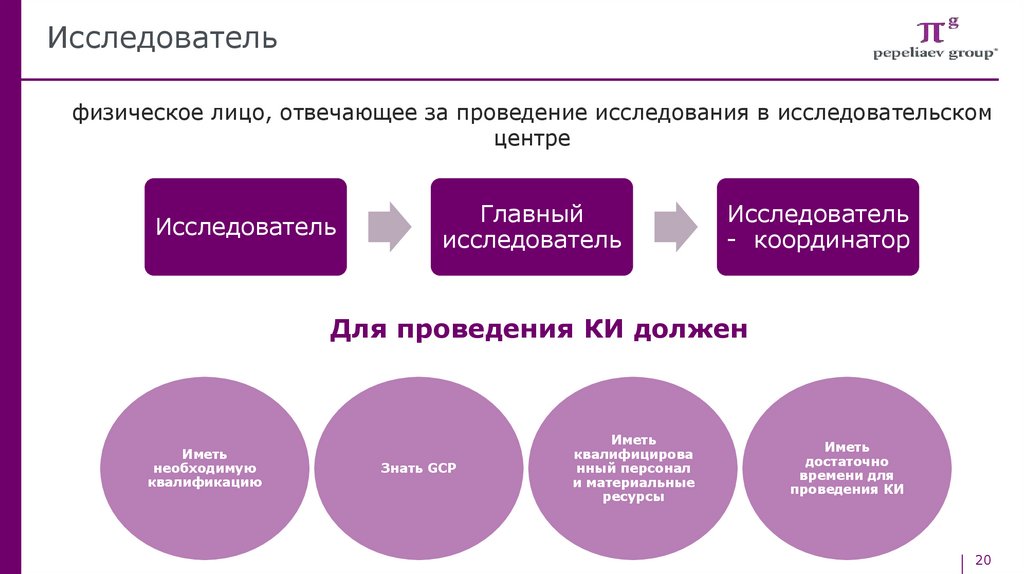
Исследовательфизическое лицо, отвечающее за проведение исследования в исследовательском
центре
Исследователь
Главный
исследователь
Исследователь
- координатор
Для проведения КИ должен
Иметь
необходимую
квалификацию
Знать GCP
Иметь
квалифицирова
нный персонал
и материальные
ресурсы
Иметь
достаточно
времени для
проведения КИ
20
21.
ИсследовательВ рамках проведения КИ должен:
Нести ответственность за все решения медицинского характера / оказание медицинской помощи
Придерживаться протокола, обеспечить соблюдение протокола подчиненным персоналом,
оформлять любые отклонения от протокола
Нести ответственность за учет и применение исследуемого препарата, а также обеспечение
надлежащего хранения препарата и пр.
Соблюдать рандомизацию и контролировать случаи раскрытия кода
Получать информированное согласие от субъектов исследования
Вести документацию и отчетность в рамках своей зоны ответственности, включая первичную
документацию, периодическую и итоговую отчетность
Предоставлять спонсору информацию о безопасности исследуемого препарата, включая НЯ
21
22.
МониторыМонитор – основное связующее звено между исследователем и
спонсором
Цель мониторинга – проверка, что:
права
и
защищены;
благополучие
Назначаются спонсором
субъектов
представленные
данные
являются
точными, полными и подтверждаются
первичной документацией;
исследование
проводится
в
соответствии с утвержденной текущей
версией протокола (поправок к нему),
настоящих Правил и применимыми
требованиями.
Как правило, посещают
исследовательские
центры до, во время и
после окончания
исследования
По итогам мониторинга
составляют отчет
22
23.
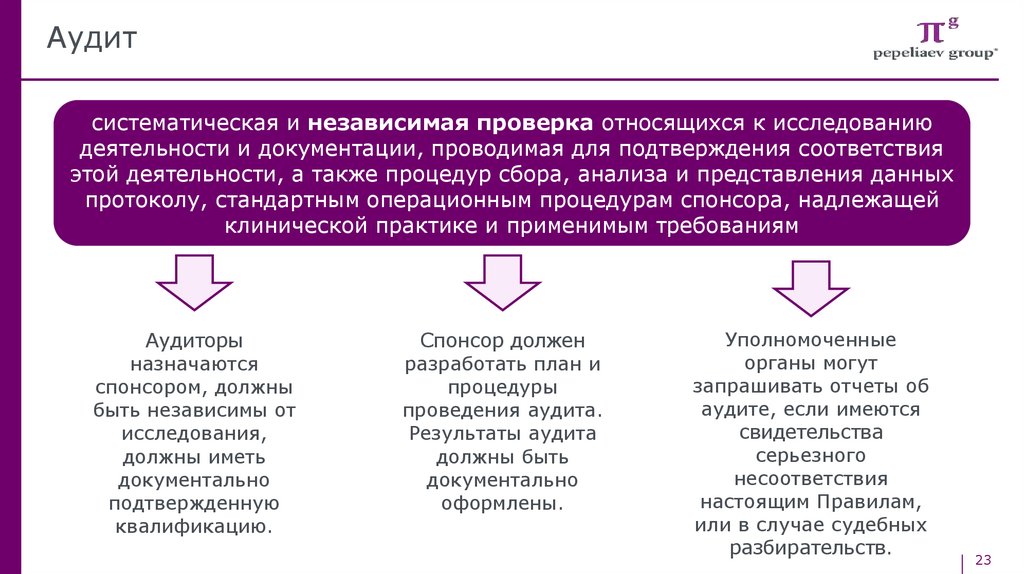
Аудитсистематическая и независимая проверка относящихся к исследованию
деятельности и документации, проводимая для подтверждения соответствия
этой деятельности, а также процедур сбора, анализа и представления данных
протоколу, стандартным операционным процедурам спонсора, надлежащей
клинической практике и применимым требованиям
Аудиторы
назначаются
спонсором, должны
быть независимы от
исследования,
должны иметь
документально
подтвержденную
квалификацию.
Спонсор должен
разработать план и
процедуры
проведения аудита.
Результаты аудита
должны быть
документально
оформлены.
Уполномоченные
органы могут
запрашивать отчеты об
аудите, если имеются
свидетельства
серьезного
несоответствия
настоящим Правилам,
или в случае судебных
разбирательств.
23
24.
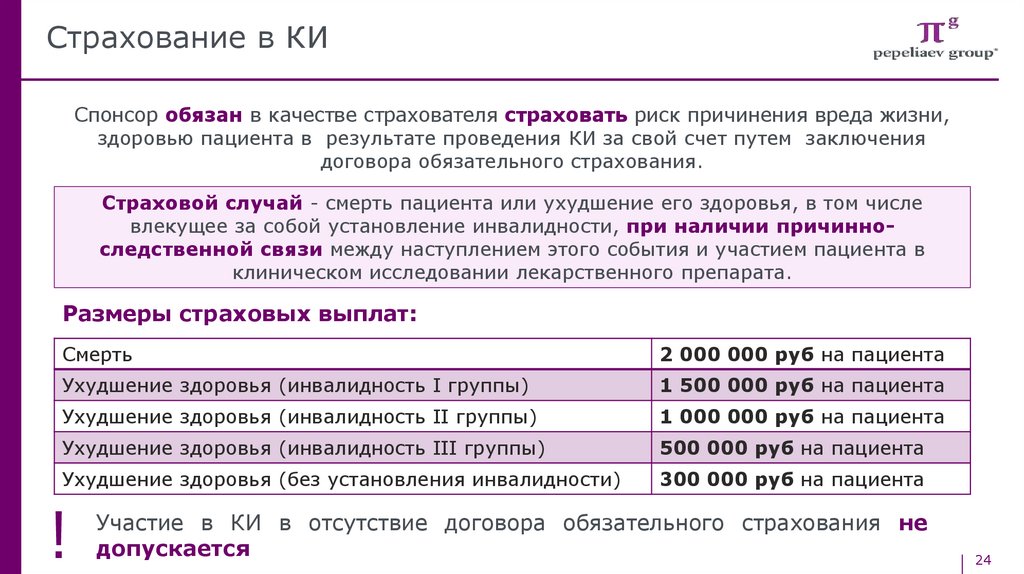
Страхование в КИСпонсор обязан в качестве страхователя страховать риск причинения вреда жизни,
здоровью пациента в результате проведения КИ за свой счет путем заключения
договора обязательного страхования.
Страховой случай - смерть пациента или ухудшение его здоровья, в том числе
влекущее за собой установление инвалидности, при наличии причинноследственной связи между наступлением этого события и участием пациента в
клиническом исследовании лекарственного препарата.
Размеры страховых выплат:
Смерть
2 000 000 руб на пациента
Ухудшение здоровья (инвалидность I группы)
1 500 000 руб на пациента
Ухудшение здоровья (инвалидность II группы)
1 000 000 руб на пациента
Ухудшение здоровья (инвалидность III группы)
500 000 руб на пациента
Ухудшение здоровья (без установления инвалидности)
300 000 руб на пациента
!
Участие в КИ в отсутствие договора обязательного страхования не
допускается
24
25.
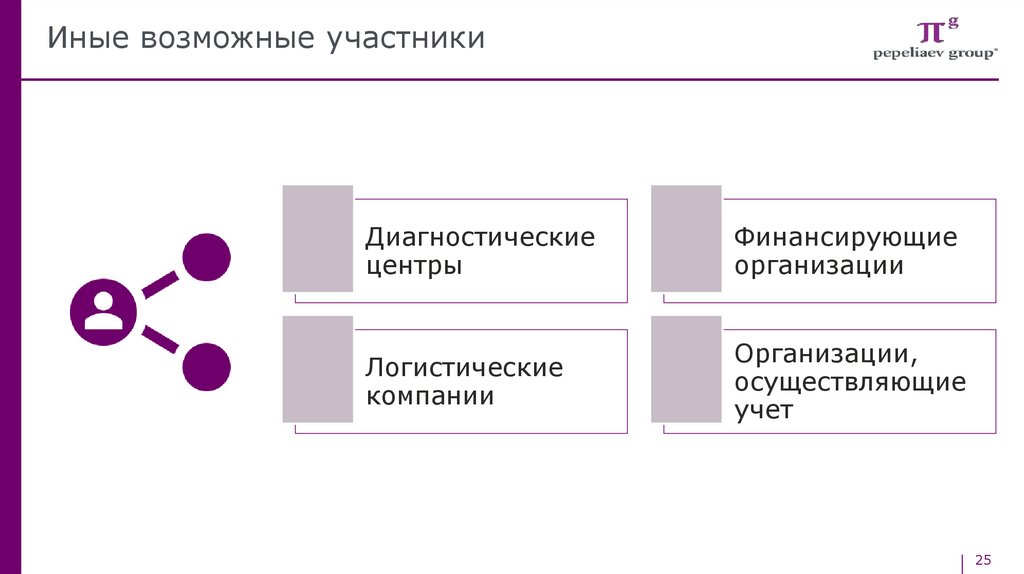
Иные возможные участникиДиагностические
центры
Финансирующие
организации
Логистические
компании
Организации,
осуществляющие
учет
25
26.
Блок 33
Обязательные документы в
рамках КИ
27.
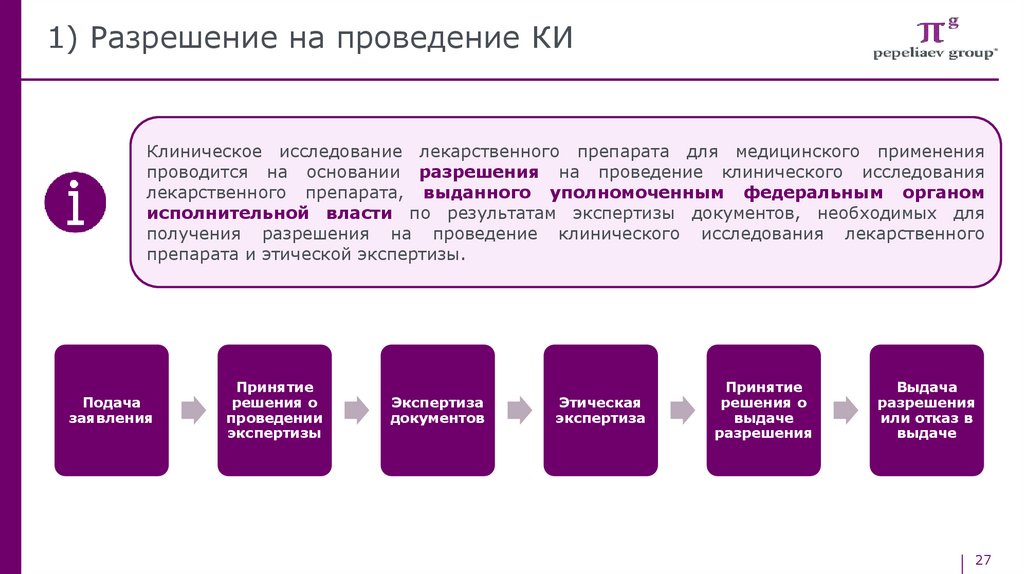
1) Разрешение на проведение КИКлиническое исследование лекарственного препарата для медицинского применения
проводится на основании разрешения на проведение клинического исследования
лекарственного препарата, выданного уполномоченным федеральным органом
исполнительной власти по результатам экспертизы документов, необходимых для
получения разрешения на проведение клинического исследования лекарственного
препарата и этической экспертизы.
Подача
заявления
Принятие
решения о
проведении
экспертизы
Экспертиза
документов
Этическая
экспертиза
Принятие
решения о
выдаче
разрешения
Выдача
разрешения
или отказ в
выдаче
27
28.
Разрешение на КИ и реестрУполномоченный федеральный орган исполнительной
власти ведет реестр выданных разрешений на
проведение
клинических
исследований
лекарственного препарата, содержащий указание
на их цель или цели, в установленном этим органом
порядке. Реестр находится в публичном доступе.
28
29.
2) Информированное согласие (информационныйлисток пациента)
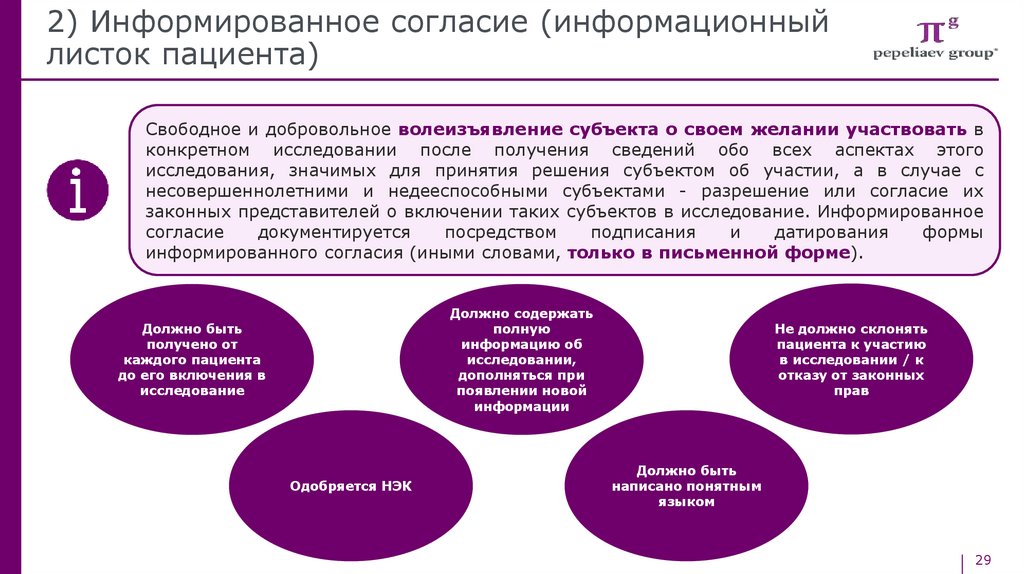
Свободное и добровольное волеизъявление субъекта о своем желании участвовать в
конкретном исследовании после получения сведений обо всех аспектах этого
исследования, значимых для принятия решения субъектом об участии, а в случае с
несовершеннолетними и недееспособными субъектами - разрешение или согласие их
законных представителей о включении таких субъектов в исследование. Информированное
согласие
документируется
посредством
подписания
и
датирования
формы
информированного согласия (иными словами, только в письменной форме).
Должно содержать
полную
информацию об
исследовании,
дополняться при
появлении новой
информации
Должно быть
получено от
каждого пациента
до его включения в
исследование
Одобряется НЭК
Не должно склонять
пациента к участию
в исследовании / к
отказу от законных
прав
Должно быть
написано понятным
языком
29
30.
Содержание Листка Пациента (Patient informationsheet)
Информация, ни в устной или ни в письменной форме не должна содержать формулировок, прямо или косвенно
склоняющих субъекта отказаться от законных прав, а также формулировок, прямо или косвенно освобождающих
исследователя, медицинское учреждение, спонсора или их представителей от ответственности за халатность.
Требования к
информированию
пациента по 61ФЗ
о лекарственном препарате и сущности КИ;
о безопасности ЛП, его ожидаемой эффективности и степени риска для пациента;
об условиях участия пациента в клиническом исследовании лекарственного препарата;
о цели или целях и продолжительности КИ лекарственного препарата;
о действиях пациента в случае непредвиденных эффектов влияния лекарственного препарата для
медицинского применения на состояние его здоровья;
об условиях обязательного страхования жизни, здоровья пациента;
о гарантиях конфиденциальности участия пациента в клиническом исследовании лекарственного препарата
для медицинского применения.
Требования к
информированию
пациента по GCP
об обязанностях субъекта;
о компенсации и (или) лечении, планируемых выплатах субъекту, планируемые расходы субъекта, если
таковые ожидаются, связанные с его участием в исследовании;
о добровольности участия
о порядке доступа мониторов, аудиторов, ЭСО (НЭК) и уполномоченных органов в к оригинальным
медицинским записям субъекта
о контактных лицах, к которым можно обратиться для получения дополнительной информации о КИ, а также в
случае причинения вреда здоровью субъекта в результате его участия в исследовании;
об обстоятельствах и (или) причинах, по которым участие субъекта в КИ может быть прекращено;
о предполагаемой длительности участия субъекта в исследовании;
о приблизительном количестве субъектов, которых предполагается включить в исследование.
Требования НЭК
Иные требования
30
31.
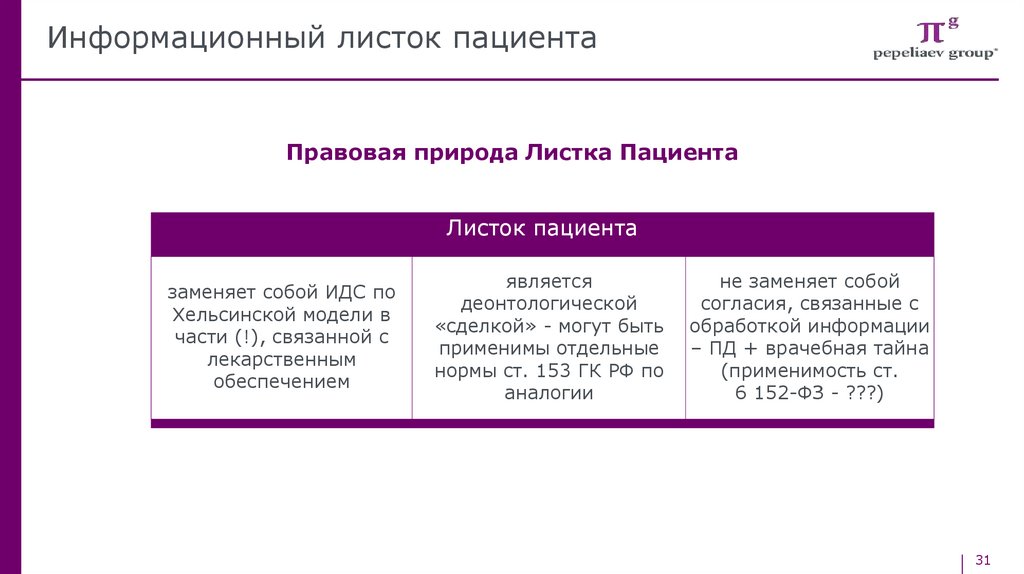
Информационный листок пациентаПравовая природа Листка Пациента
Листок пациента
заменяет собой ИДС по
Хельсинской модели в
части (!), связанной с
лекарственным
обеспечением
является
деонтологической
«сделкой» - могут быть
применимы отдельные
нормы ст. 153 ГК РФ по
аналогии
не заменяет собой
согласия, связанные с
обработкой информации
– ПД + врачебная тайна
(применимость ст.
6 152-ФЗ - ???)
31
32.
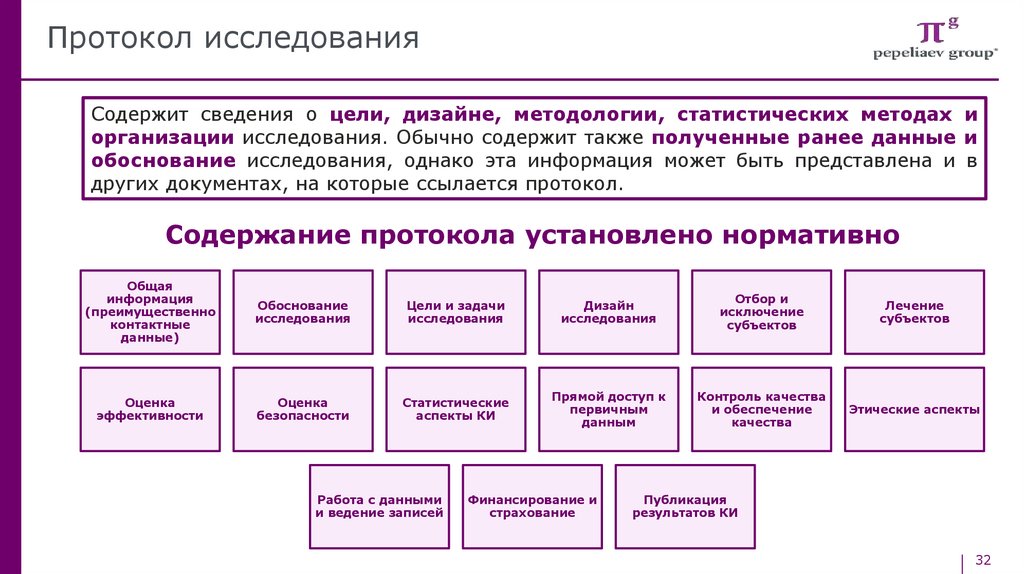
Протокол исследованияСодержит сведения о цели, дизайне, методологии, статистических методах и
организации исследования. Обычно содержит также полученные ранее данные и
обоснование исследования, однако эта информация может быть представлена и в
других документах, на которые ссылается протокол.
Содержание протокола установлено нормативно
Общая
информация
(преимущественно
контактные
данные)
Обоснование
исследования
Цели и задачи
исследования
Дизайн
исследования
Отбор и
исключение
субъектов
Лечение
субъектов
Оценка
эффективности
Оценка
безопасности
Статистические
аспекты КИ
Прямой доступ к
первичным
данным
Контроль качества
и обеспечение
качества
Этические аспекты
Работа с данными
и ведение записей
Финансирование и
страхование
Публикация
результатов КИ
32
33.
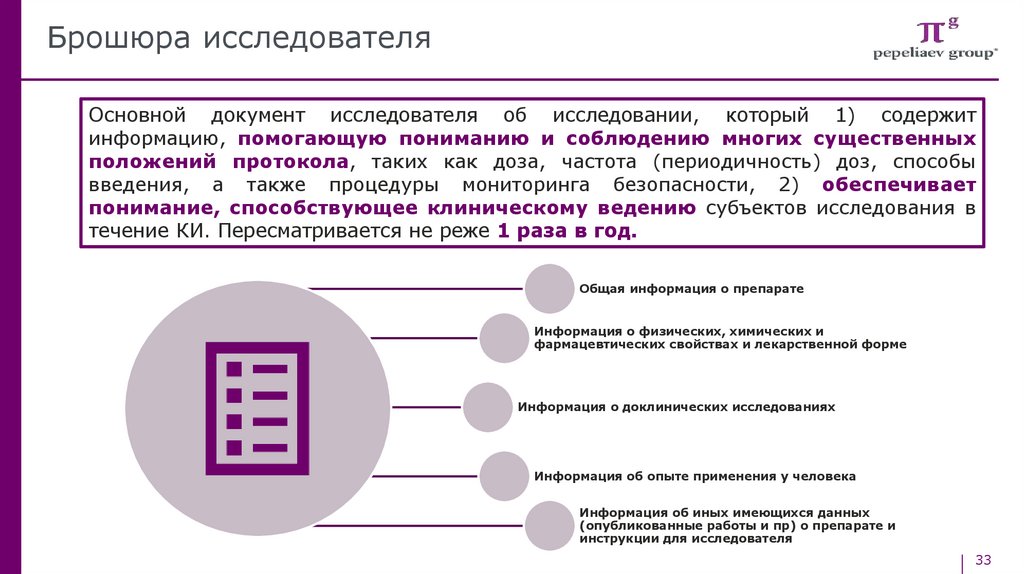
Брошюра исследователяОсновной документ исследователя об исследовании, который 1) содержит
информацию, помогающую пониманию и соблюдению многих существенных
положений протокола, таких как доза, частота (периодичность) доз, способы
введения, а также процедуры мониторинга безопасности, 2) обеспечивает
понимание, способствующее клиническому ведению субъектов исследования в
течение КИ. Пересматривается не реже 1 раза в год.
Общая информация о препарате
Информация о физических, химических и
фармацевтических свойствах и лекарственной форме
Информация о доклинических исследованиях
Информация об опыте применения у человека
Информация об иных имеющихся данных
(опубликованные работы и пр) о препарате и
инструкции для исследователя
33
34.
Блок 44
Договоры в рамках КИ
35.
Основные положенияКлиническое исследование лекарственного препарата для медицинского
применения проводится в соответствии с договором о проведении
клинического исследования лекарственного препарата для медицинского
применения, заключаемым между организацией, получившей разрешение
уполномоченного федерального органа исполнительной власти на организацию
проведения такого исследования, и медицинской организацией,
осуществляющей проведение такого исследования.
Договор
Датированное и подписанное соглашение между двумя или более
сторонами, которое устанавливает договоренности, касающиеся
распределения объема работ и обязанностей при проведении
клинического исследования, а также, если уместно, финансовых
вопросов. Основой договора может служить протокол исследования.
Решение Совета Евразийской экономической комиссии от 03.11.2016 N 79
"Об утверждении Правил надлежащей клинической практики Евразийского экономического
союза"
35
36.
Существенные условия договора на проведениеКИ
1) Условия и сроки проведения КИ;
2) Определение
общей
стоимости
программы КИ с указанием сумм,
предназначающихся
для
выплат
(со)исследователям;
3)Определение
формы
представления результатов КИ в
Минздрав (!)
Содержание
договора
является
предметом
проверки
Росздравнадзора
36
37.
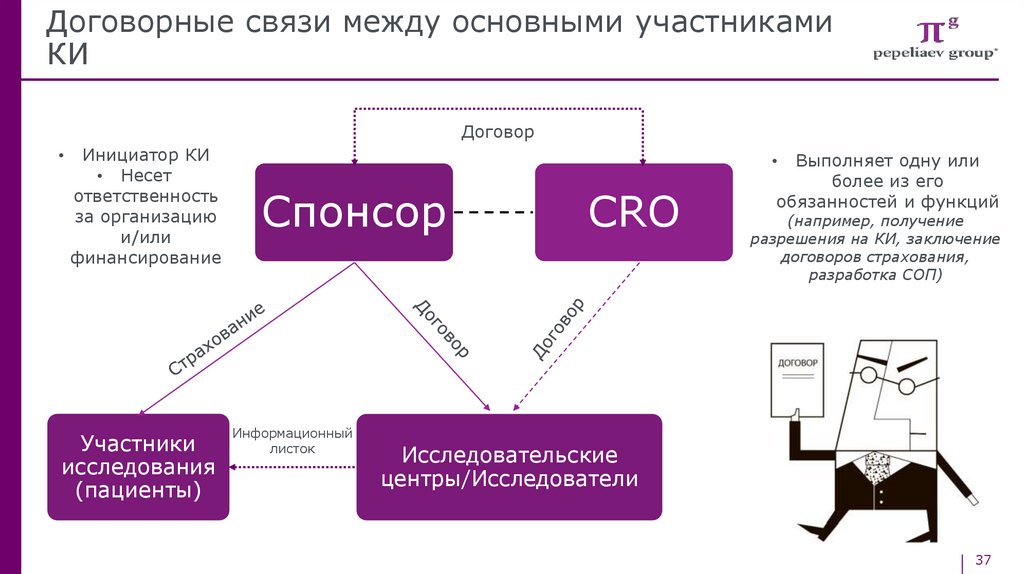
Договорные связи между основными участникамиКИ
Договор
Инициатор КИ
• Несет
ответственность
за организацию
и/или
финансирование
Участники
исследования
(пациенты)
Выполняет одну или
более из его
обязанностей и функций
Спонсор
Информационный
листок
CRO
(например, получение
разрешения на КИ, заключение
договоров страхования,
разработка СОП)
Исследовательские
центры/Исследователи
37
38.
Содержание договора между спонсором и CRO• выполнение заказа (работ) или оказание услуг по
организации КИ;
• в результате КИ может появиться новый объект
интеллектуальных прав;
Алеаторный
для третьих
лиц
• организация оказания медицинских услуг в пользу
третьего лица (!);
• внедрение и поддержание СМК КИ (рандомизация,
аудиты etc);
• обязанность совершение ethical decision making
(этический комитет) и patient ethical treatment
(обязанности по выводу/вводу пациентов в
исследование);
• обязанность по информационному обмену и охране
информации (152-ФЗ, ст. 13 323-ФЗ) при сохранении
возможности раскрытия в целях КИ (аудит, мониторинг)
Этикоправовая
нагрузка на
всех
участников
процесса
Большое
кол-во
нормативных
императивных
требований
Невозможность
деления
ответственност
и
38
39.
Содержание договора между спонсором/CRO иисследовательским центром/исследователем
• оказание медицинских услуг в пользу третьим лицом (!);
• обязанность соблюдения GCP и протокола исследования;
• согласие на соблюдение процедуры регистрации данных,
утвержденной спонсором;
• согласие на проведение мониторинга, аудитов спонсора и
инспекицй;
• согласие хранение основных документов, связанных с
исследованием до тех пор, пока спонсор не сообщит, что эти
документы больше не требуются;
Содержание
договора
является
предметом
проверки
Росздравнадзора
• финансовые вопросы организации КИ в данном центре;
• обязательства по учету и соблюдению условий хранения
исследуемого ЛП.
39
40.
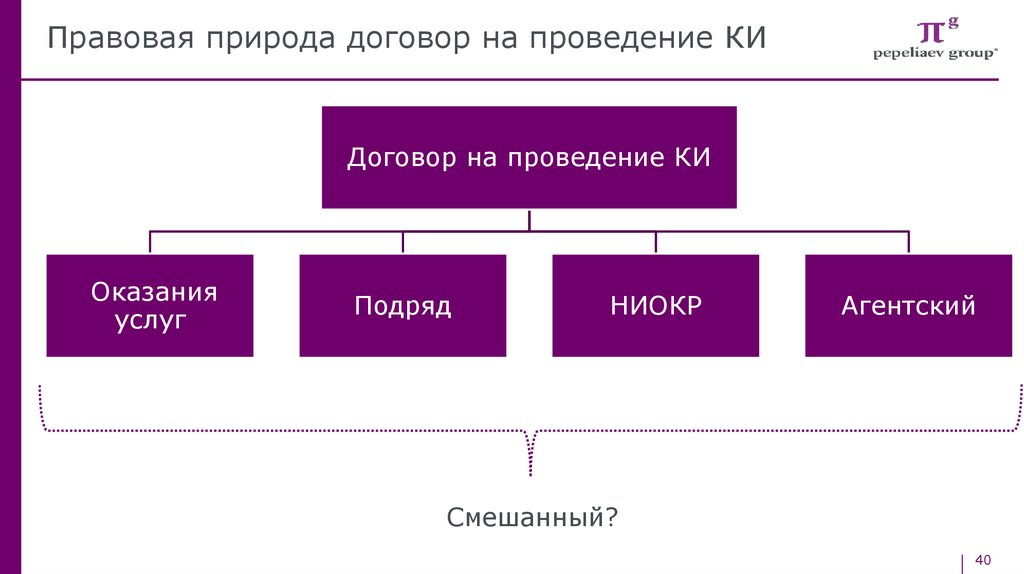
Правовая природа договор на проведение КИДоговор на проведение КИ
Оказания
услуг
Подряд
НИОКР
Агентский
Смешанный?
40
41.
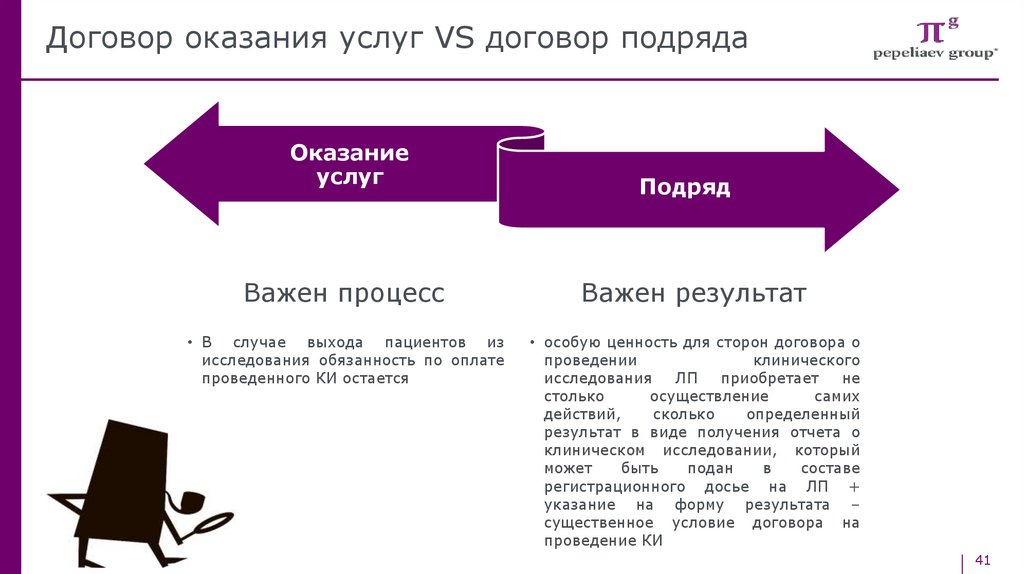
Договор оказания услуг VS договор подрядаОказание
услуг
Подряд
Важен процесс
Важен результат
• В случае выхода пациентов из
исследования обязанность по оплате
проведенного КИ остается
• особую ценность для сторон договора о
проведении
клинического
исследования
ЛП
приобретает
не
столько
осуществление
самих
действий,
сколько
определенный
результат в виде получения отчета о
клиническом исследовании, который
может
быть
подан
в
составе
регистрационного досье на ЛП +
указание на форму результата –
существенное условие договора на
проведение КИ
41
42.
Правовая природа договора на проведение КИПочему проблема работы vs услуги может быть важной?
Услуги
Работы
По умолчанию должны быть оказаны исполнителем
лично (необходимо отдельно предусматривать
возможность привлечения третьих лиц)
По умолчанию подрядчик может привлечь к исполнению
третьих лиц (субподрядчиков)
Возможен односторонний отказ с возмещением
исполнителю только фактически понесенных расходов
Возможен односторонний отказ с уплатой части цены
пропорциональной выполненным работам + убытки
«Работоподобные» услуги
«Поскольку стороны в силу статьи 421 Гражданского кодекса вправе определять условия
договора по своему усмотрению, обязанности исполнителя по договору возмездного
оказания услуг могут включать в себя не только совершение определенных действий
(деятельности), но и представление заказчику результата своих действий»
- Постановление Президиума ВАС РФ от 24.01.2012 N 11563/11 по делу N А41-27081/10
42
43.
Блок 55
Контроль за проведением КИ
44.
Проверки в рамках КИ• Контроль
за
проведением
Росздравнадзор
КИ
осуществляет
• Плановые/ внеплановые проверки в соответствии с
Федеральным законом от 26.12.2008 №
294ФЗ «О
защите прав юридических лиц и
индивидуальных
предпринимателей
при
осуществлении государственного контроля (надзора)
и муниципального контроля
• http:/ / www.roszdravnadzor.ru/control/plan
Ежегодный план проверок Росздравнадзора
-
44
45.
Возможные нарушения• Не обеспечено направления в Минздрав сообщения о
начале КИ;
• Не
обеспечено
своевременное
назначение
исследователей/со-исследователей, принимающих участие
в проведении КИ;
• Нарушения в работе НЭК (несоблюдение положений,
регламентирующих деятельность НЭК , отсутствие СОП и
прочее);
• Отклонения от протокола;
• Нарушения, связанные с информированных согласием
пациента (до пациента не
доведена новая редакция
формы согласия; нарушение процедуры получения
согласия;
пациент
не
был
своевременно
проинформирован по вопросам, которые должны быть
отражены в форме информированного согласия и прочее);
• Нарушения
в
сфере
хранения
исследуемого
лекарственного препарата, его учета инвентаризации и
пр.
45
46.
Блок 66
Новые возможности для КИ
47.
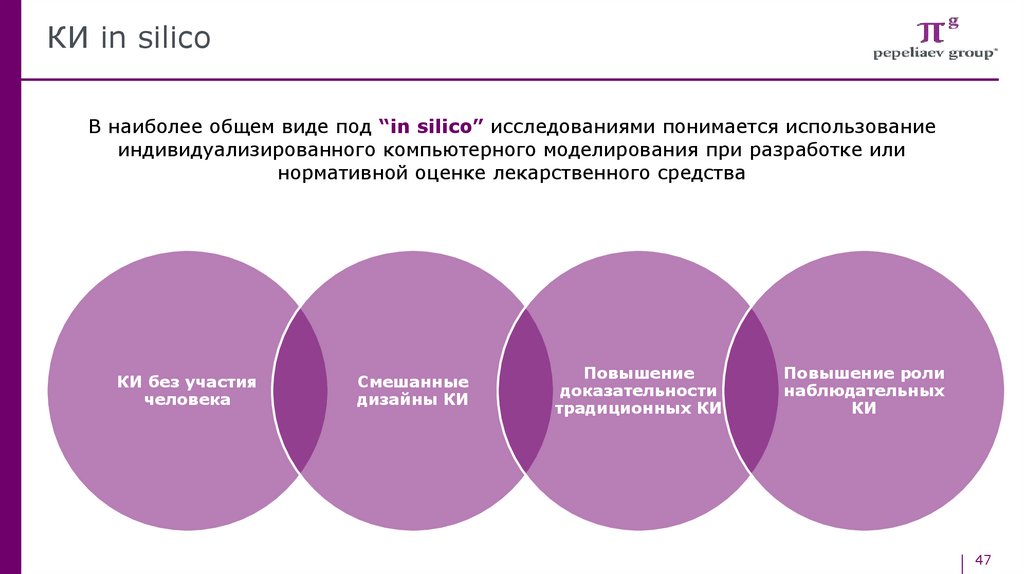
КИ in silicoВ наиболее общем виде под “in silico” исследованиями понимается использование
индивидуализированного компьютерного моделирования при разработке или
нормативной оценке лекарственного средства
КИ без участия
человека
Смешанные
дизайны КИ
Повышение
доказательности
традиционных КИ
Повышение роли
наблюдательных
КИ
47
48.
Основные проблемы для интеграциивозможностей
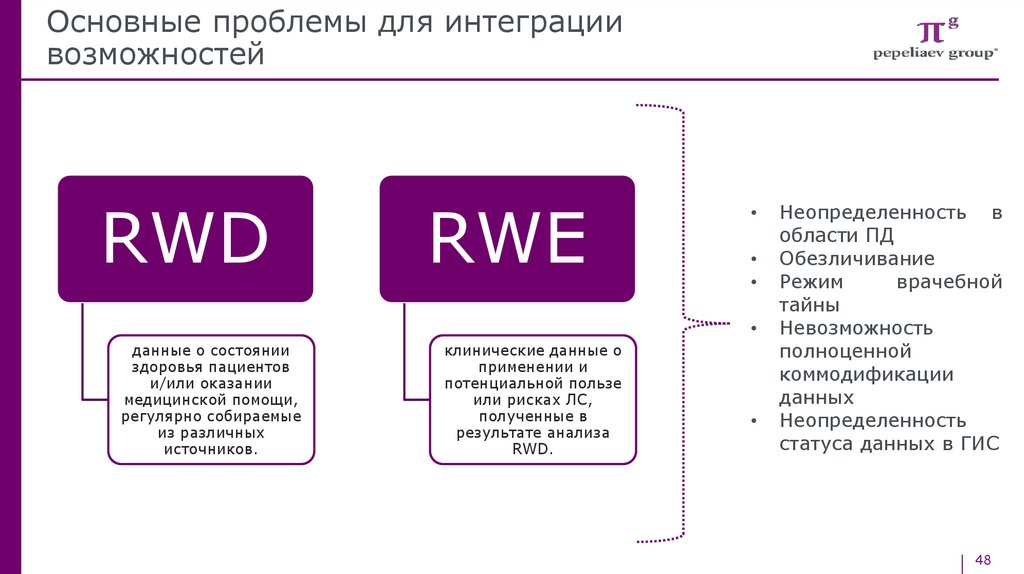
RWD
RWE
данные о состоянии
здоровья пациентов
и/или оказании
медицинской помощи,
регулярно собираемые
из различных
источников.
клинические данные о
применении и
потенциальной пользе
или рисках ЛС,
полученные в
результате анализа
RWD.
Неопределенность в
области ПД
Обезличивание
Режим
врачебной
тайны
Невозможность
полноценной
коммодификации
данных
Неопределенность
статуса данных в ГИС
48
49.
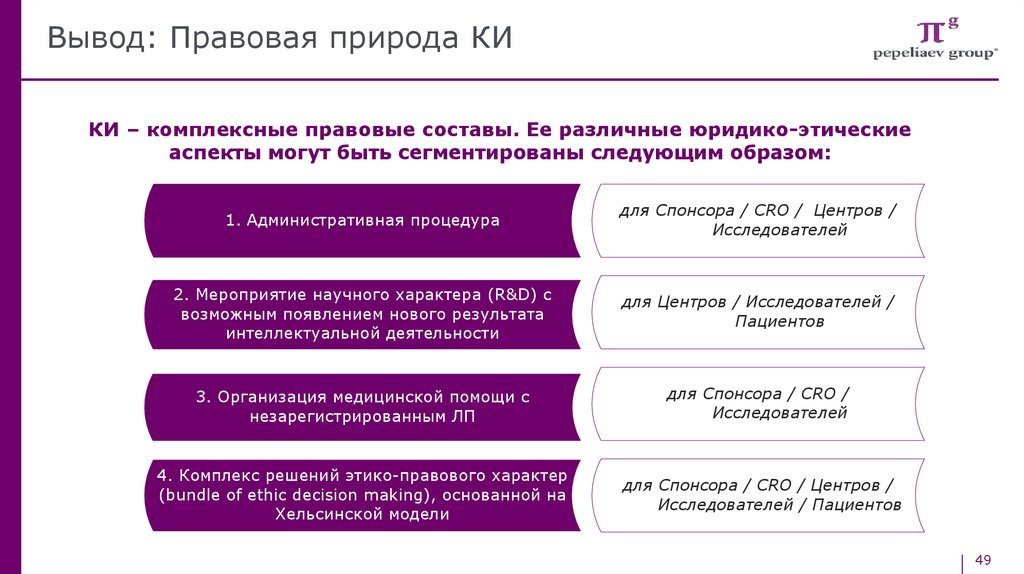
Вывод: Правовая природа КИКИ – комплексные правовые составы. Ее различные юридико-этические
аспекты могут быть сегментированы следующим образом:
1. Административная процедура
для Спонсора / CRO / Центров /
Исследователей
2. Мероприятие научного характера (R&D) с
возможным появлением нового результата
интеллектуальной деятельности
для Центров / Исследователей /
Пациентов
3. Организация медицинской помощи с
незарегистрированным ЛП
для Спонсора / CRO /
Исследователей
4. Комплекс решений этико-правового характер
(bundle of ethic decision making), основанной на
Хельсинской модели
для Спонсора / CRO / Центров /
Исследователей / Пациентов
49
50.
Контактные данныеКарина Колобова
Младший практики
здравоохранения и коммерции
[email protected]
Тел. 8-985-687-48-74
50
51.
Контактная информация● Москва
● Санкт-Петербург
● Красноярск
● Южно-Сахалинск
● Пекин
● Шанхай
www.pgplaw.ru
[email protected]
+7 (495) 767-00-07
+7 (495) 765-00-07


























 Медицина
Медицина








