Похожие презентации:
Структура периодической системы химических элементов (8 класс)
1.
Тема:Структура периодической системы химических элементов8 класс
2.
Цель обучения8.2.1.1 - объяснять физический смысл атомного номера,
группы, периода
2
3.
Сабақты бекітуВеликие слова великого химика:
По-видимому, периодическому закону – будущее
не грозит разрушением, а только надстройки и
развитие обещает …
Д.И.МЕНДЕЛЕЕВ,
10 июля 1905 года
3
4.
Психологический настройПриветствую вас
на уроке химии.
Хорошего вам настроения
и
желания учиться!
4
5.
Выход к теме урока:Менделеева таблица,
Каковы ж ее границы,
Число периодов в ней семь
Они известны почти всем,
Групп в таблице ровно восемь,
Это всех запомнить просим,
Элементов больше ста
Вряд ли вместит голова:
Номер первый – водород,
Номер восемь – кислород,
Шестой номер – углерод.
6.
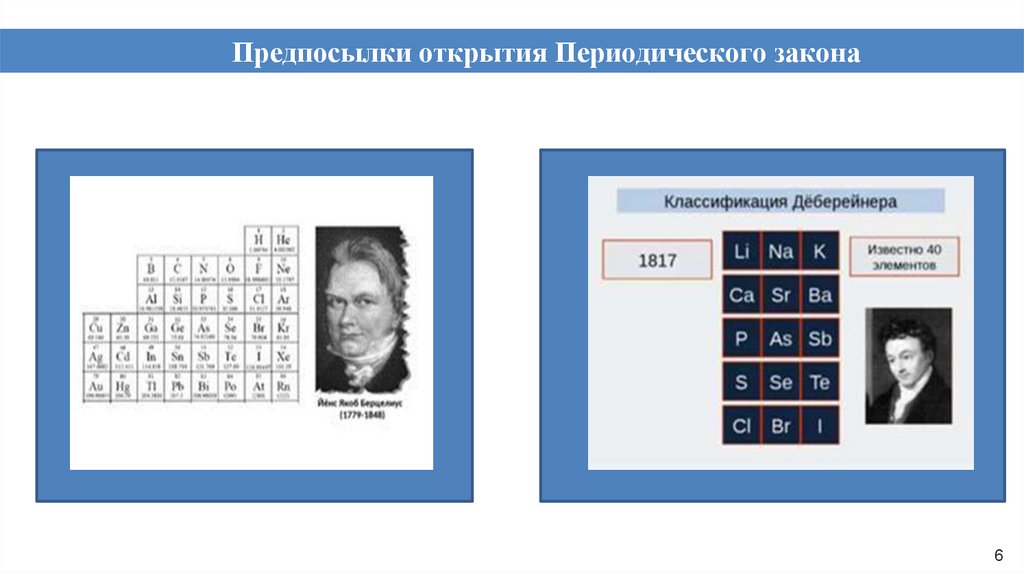
Предпосылки открытия Периодического закона6
7.
Попытки систематизации химических элементов7
8.
Жизнь и деятельность Дмитрия Ивановича Менделеева27.01.1834-20.01.1907 гг
Русский учёный-энциклопедист, химик, физик, метролог,
экономист, педагог, приборостроитель, воздухоплаватель.
Профессор Санкт-Петербургского университета. Среди
известных открытий – периодический закон химических
элементов. Автор выдающегося труда «Основы химии».
Д.И.Менделеев родился 27 января (8 февраля) 1834 г. в
г.Тобольске.
Он был семнадцатым ребенком в семье.
Закончив в родном городе гимназию, он поступил в СанктПетербурге в Главный педагогический институт. Окончив его
с золотой медалью, он уехал в научную командировку за
границу на два года. После возвращения он начал читать
лекций по химии в Петербургском университете. Менделеев
решил написать в качестве учебного пособия студентам
фундаментальную книгу – «Основы химии».
15 лет напряженной работы предшествовало открытию
периодического закона.
9.
Рассказ Менделеева об открытии им Периодического закона:«Заподозрив о существовании взаимосвязи между элементами
еще в студенческие годы, я не уставал обдумывать эту
проблему со всех сторон, собирал материалы, сравнивал и
сопоставлял цифры. Наконец настало время, когда проблема
созрела, когда решение, казалось, вот-вот готово было
сложиться в голове. В течение нескольких недель я спал
урывками, пытаясь найти тот магический принцип, который
сразу привел бы в порядок всю груду накопленного за 15 лет
материала. И вот в одно прекрасное утро, проведя бессонную
ночь и отчаявшись найти решение, я прилег на диван в
кабинете и заснул. И во сне мне совершенно явственно
представилась таблица. Я тут же проснулся и набросал
увиденную во сне таблицу на первом же подвернувшемся под
руку клочке бумаги».
Менделеев сам придумал
легенду, будто бы
Периодическая таблица
приснилась ему во сне, для
настырных поклонников науки,
не понимающих, что такое
озарение.
10.
Периодический закон Д.И.МенделееваПериодический закон был
открыт 1 марта в 1869 году
«Свойства элементов, а
потому и свойства
образуемых ими простых
и сложных тел, стоят в
периодической
зависимости от их
атомного веса».
Современная формулировка:
«Свойства химических
элементов и образуемых ими
простых и сложных веществ
находятся в периодической
зависимости от величины
заряда их атомных ядер».
11.
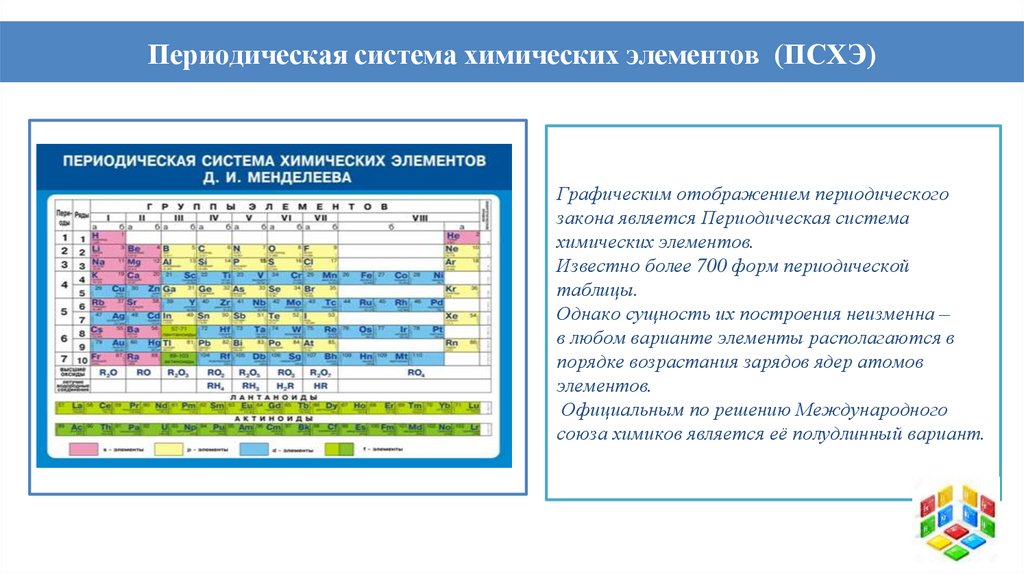
Периодическая система химических элементов (ПСХЭ)Графическим отображением периодического
закона является Периодическая система
химических элементов.
Известно более 700 форм периодической
таблицы.
Однако сущность их построения неизменна –
в любом варианте элементы располагаются в
порядке возрастания зарядов ядер атомов
элементов.
Официальным по решению Международного
союза химиков является её полудлинный вариант.
12.
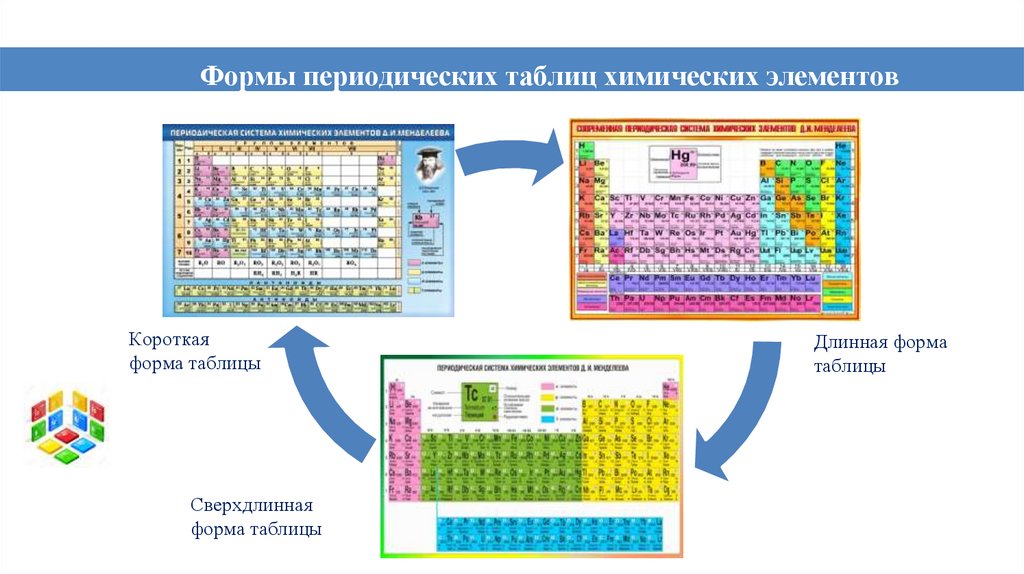
Формы периодических таблиц химических элементовКороткая
форма таблицы
Сверхдлинная
форма таблицы
Длинная форма
таблицы
13.
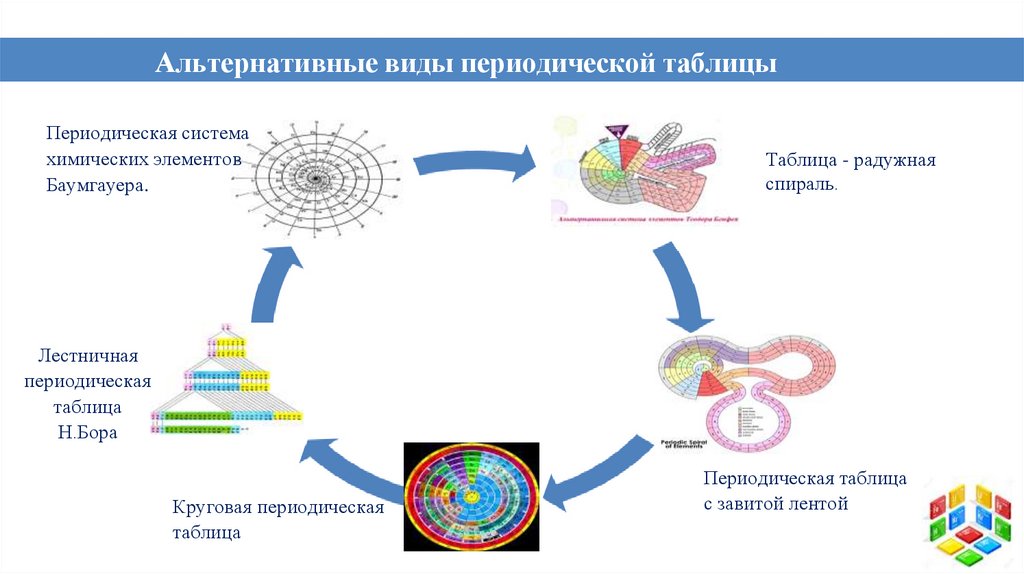
Альтернативные виды периодической таблицыхимических элементов
Периодическая система
химических элементов
Баумгауера.
Таблица - радужная
спираль.
Лестничная
периодическая
таблица
Н.Бора
Круговая периодическая
таблица
Периодическая таблица
с завитой лентой
14.
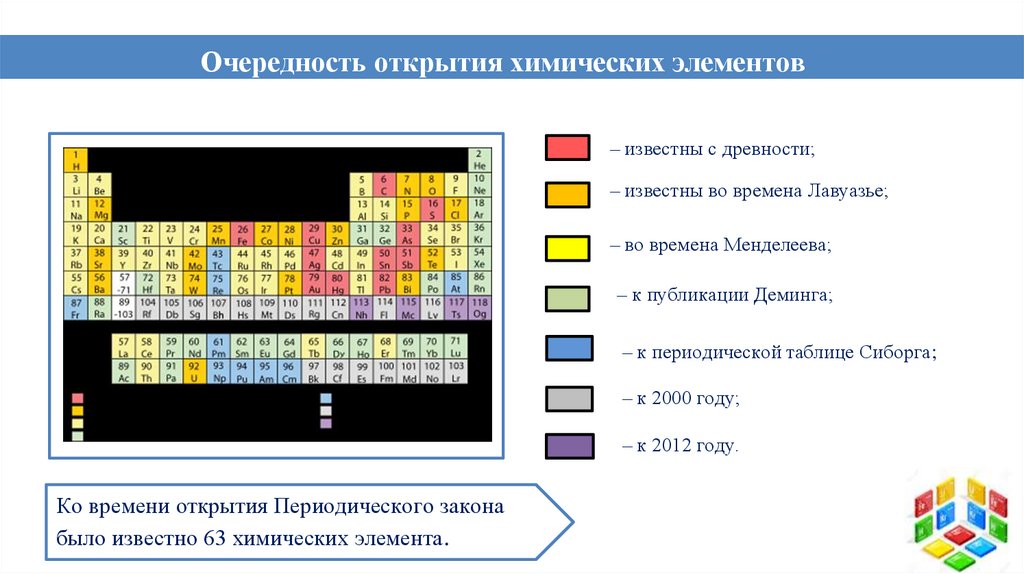
Очередность открытия химических элементовэлементов.
– известны с древности;
– известны во времена Лавуазье;
– во времена Менделеева;
– к публикации Деминга;
– к периодической таблице Сиборга;
– к 2000 году;
– к 2012 году.
Ко времени открытия Периодического закона
было известно 63 химических элемента.
15.
Металлы и неметаллы в Периодической таблицеЕсли в периодической таблице элементов Д.И. Менделеева
провести диагональ от бора к астату, то слева внизу по
диагонали будут находиться элементы-металлы (к ним же
относятся элементы побочных подгрупп), а справа вверху –
элементы-неметаллы.
Элементы, расположенные вблизи диагонали
(Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойственным
характером.
К элементам - металлам относятся s - элементы I и II групп,
все d- и f - элементы, а также p- элементы главных
подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb,Bi)
и VI (Po). Наиболее типичные элементы – металлы
расположены в начале периодов (начиная со второго).
Неметаллы расположены в правом верхнем углу
периодической таблицы (два s-элемента (H2 и He) и
остальные р-элементы).
16.
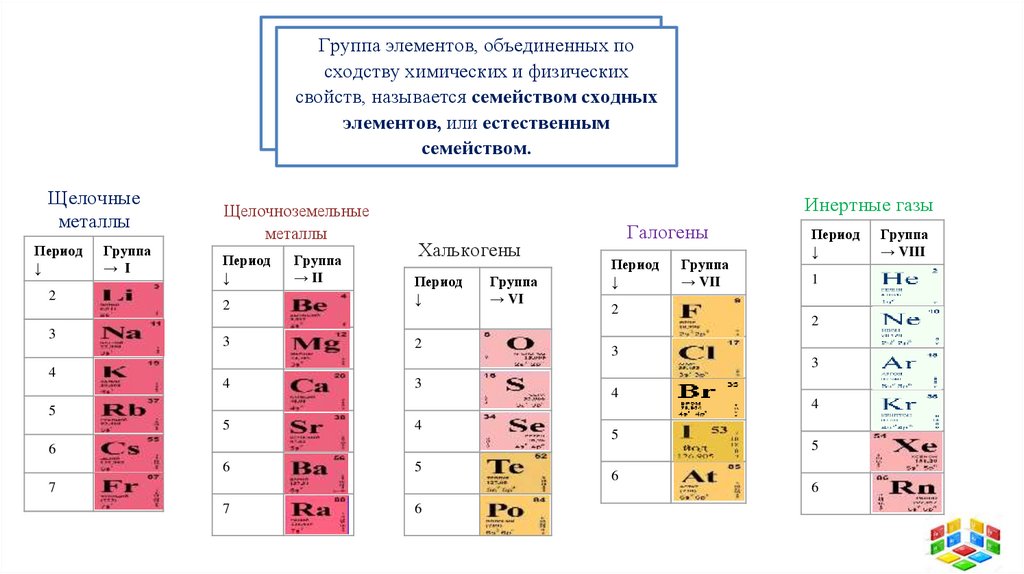
Группа элементов, объединенных посходству химических и физических
свойств, называется семейством сходных
элементов, или естественным
семейством.
Щелочные
металлы
Период
↓
2
3
4
Группа
→ I
Щелочноземельные
металлы
Период
↓
2
3
4
Группа
→ II
Инертные газы
Халькогены
Период
↓
2
3
Группа
→ VI
Галогены
Период
↓
2
3
4
5
5
4
6
5
5
6
7
7
6
6
Группа
→ VII
Период
↓
1
2
3
4
5
6
Группа
→ VIII
17.
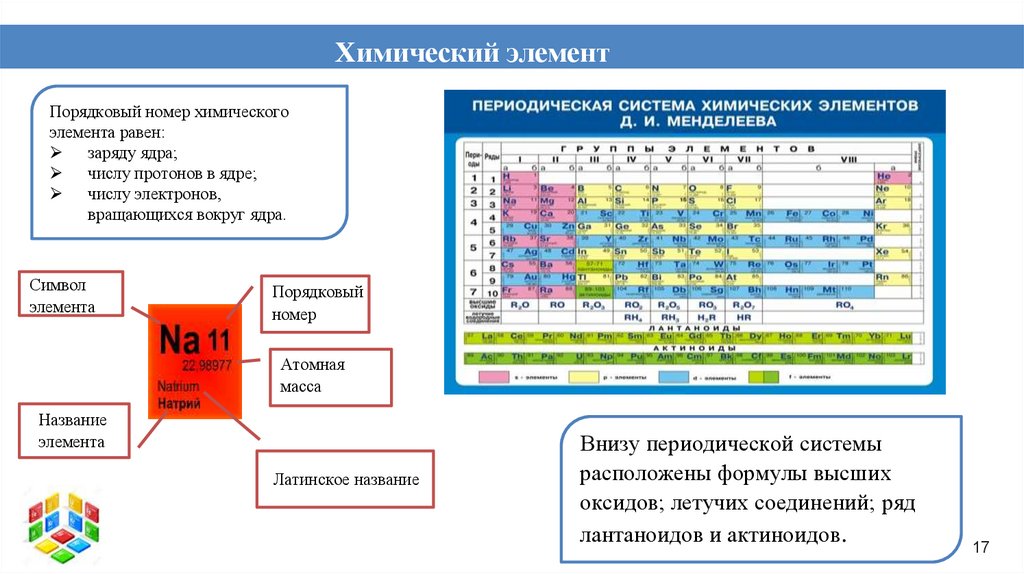
Химический элементПорядковый номер химического
элемента равен:
заряду ядра;
числу протонов в ядре;
числу электронов,
вращающихся вокруг ядра.
Символ
элемента
Порядковый
номер
Атомная
масса
Название
элемента
Латинское название
Внизу периодической системы
расположены формулы высших
оксидов; летучих соединений; ряд
лантаноидов и актиноидов.
17
18.
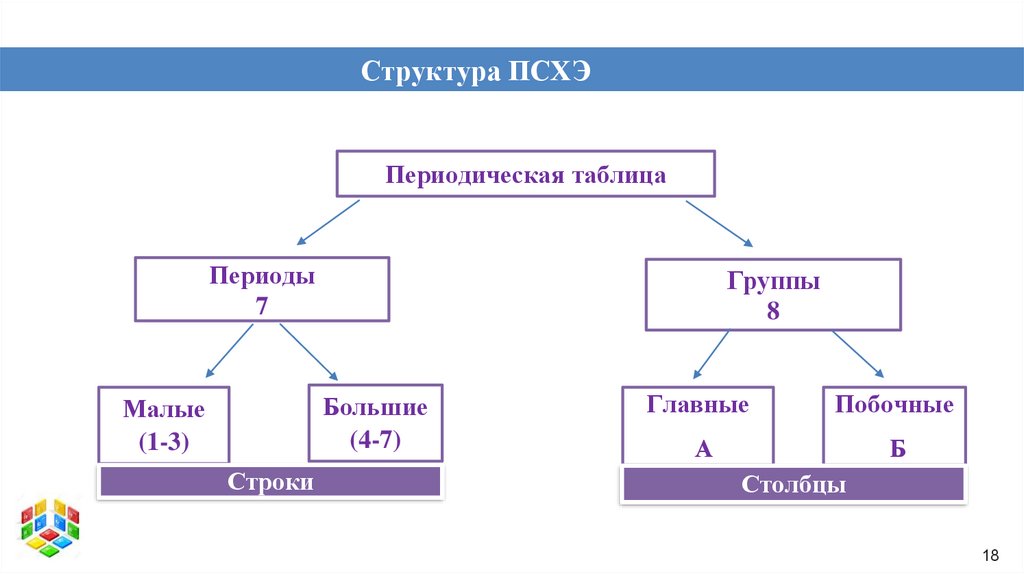
Структура ПСХЭПериодическая таблица
Периоды
7
Группы
8
Большие
(4-7)
Малые
(1-3)
Строки
Главные
Побочные
А
Б
Столбцы
18
19.
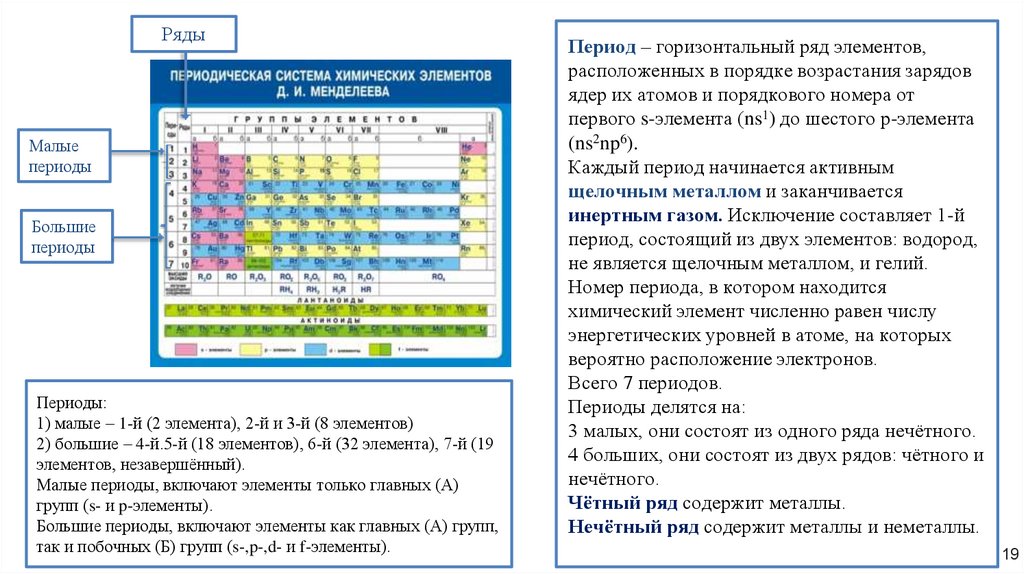
РядыМалые
периоды
Большие
периоды
Периоды:
1) малые – 1-й (2 элемента), 2-й и 3-й (8 элементов)
2) большие – 4-й.5-й (18 элементов), 6-й (32 элемента), 7-й (19
элементов, незавершённый).
Малые периоды, включают элементы только главных (А)
групп (s- и p-элементы).
Большие периоды, включают элементы как главных (А) групп,
так и побочных (Б) групп (s-,p-,d- и f-элементы).
Период – горизонтальный ряд элементов,
расположенных в порядке возрастания зарядов
ядер их атомов и порядкового номера от
первого s-элемента (ns1) до шестого р-элемента
(ns2np6).
Каждый период начинается активным
щелочным металлом и заканчивается
инертным газом. Исключение составляет 1-й
период, состоящий из двух элементов: водород,
не является щелочным металлом, и гелий.
Номер периода, в котором находится
химический элемент численно равен числу
энергетических уровней в атоме, на которых
вероятно расположение электронов.
Всего 7 периодов.
Периоды делятся на:
3 малых, они состоят из одного ряда нечётного.
4 больших, они состоят из двух рядов: чётного и
нечётного.
Чётный ряд содержит металлы.
Нечётный ряд содержит металлы и неметаллы.
19
20.
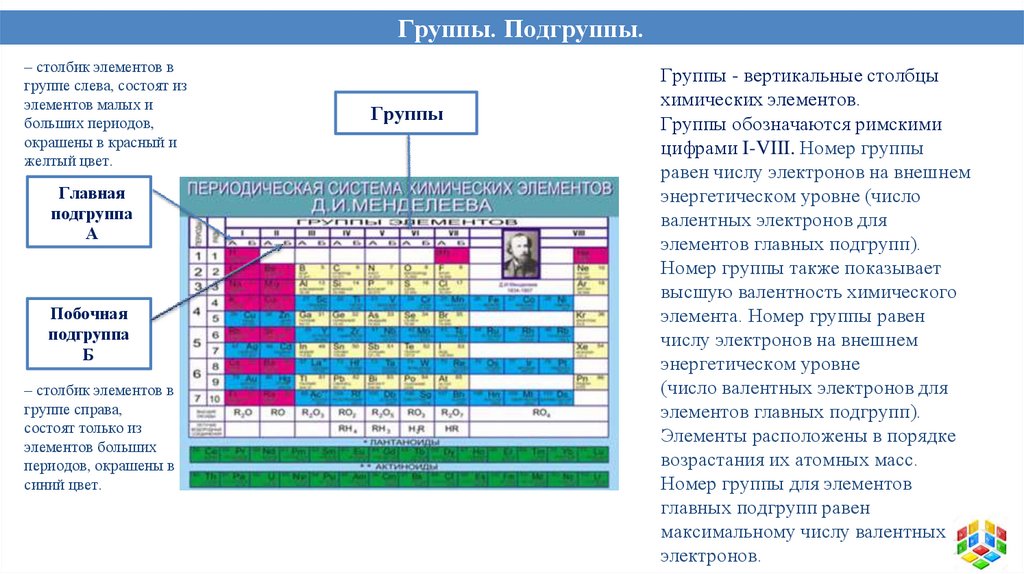
Группы. Подгруппы.– столбик элементов в
группе слева, состоят из
элементов малых и
больших периодов,
окрашены в красный и
желтый цвет.
Главная
подгруппа
А
Побочная
подгруппа
Б
– столбик элементов в
группе справа,
состоят только из
элементов больших
периодов, окрашены в
синий цвет.
Группы
Группы - вертикальные столбцы
химических элементов.
Группы обозначаются римскими
цифрами I-VIII. Номер группы
равен числу электронов на внешнем
энергетическом уровне (число
валентных электронов для
элементов главных подгрупп).
Номер группы также показывает
высшую валентность химического
элемента. Номер группы равен
числу электронов на внешнем
энергетическом уровне
(число валентных электронов для
элементов главных подгрупп).
Элементы расположены в порядке
возрастания их атомных масс.
Номер группы для элементов
главных подгрупп равен
максимальному числу валентных
электронов.
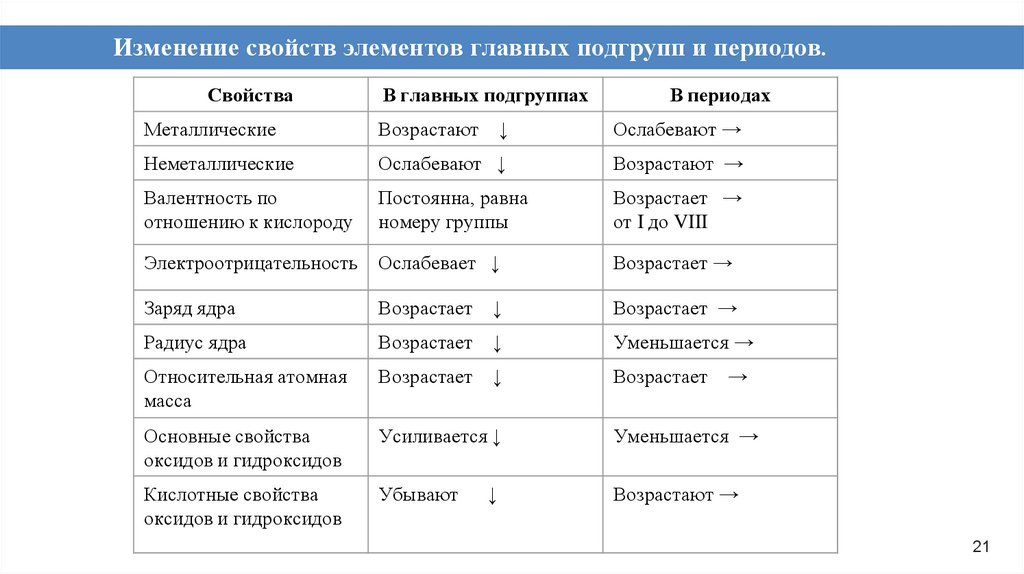
21.
Изменение свойств элементов главных подгрупп и периодов.Свойства
В главных подгруппах
В периодах
Металлические
Возрастают ↓
Ослабевают →
Неметаллические
Ослабевают ↓
Возрастают →
Валентность по
отношению к кислороду
Постоянна, равна
номеру группы
Возрастает →
от I до VIII
Электроотрицательность
Ослабевает ↓
Возрастает →
Заряд ядра
Возрастает ↓
Возрастает →
Радиус ядра
Возрастает ↓
Уменьшается →
Относительная атомная
масса
Возрастает ↓
Возрастает →
Основные свойства
оксидов и гидроксидов
Усиливается ↓
Уменьшается →
Кислотные свойства
оксидов и гидроксидов
Убывают
Возрастают →
↓
21
22.
Значение Периодического законаПериодический закон, является одним из
основных законов природы.
Построенная на его основе периодическая
система химических элементов не только
помогает ориентироваться в огромном
множестве окружающих нас веществ, но и
позволяет предсказывать их строение и
свойства.
23.
ЗадачаНеизвестный элемент находится в I группе, относительная молекулярная
масса высшего оксида 231,736.Назовите этот элемент.
а) Серебро; б) Рубидий; в) Натрий
Решение:
Дано:
R2O
Mr (R2O) =231,736
R-?
Mr(R2O) =231,736
Ar(O) =16
2х+16 = 231,736
2х = 231,736 –16
2х = 215,736
х = 107,868
Данная атомная масса (Ar) соответствует элементу Ag.
Ответ: Серебро.
23
24.
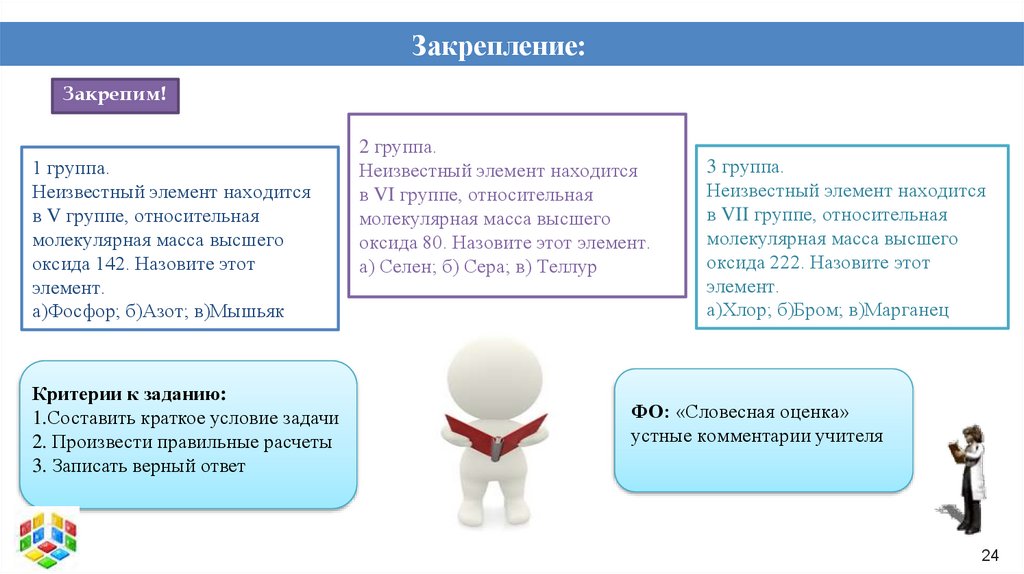
Закрепление:Закрепим!
1 группа.
Неизвестный элемент находится
в V группе, относительная
молекулярная масса высшего
оксида 142. Назовите этот
элемент.
а)Фосфор; б)Азот; в)Мышьяк
Критерии к заданию:
1.Составить краткое условие задачи
2. Произвести правильные расчеты
3. Записать верный ответ
2 группа.
Неизвестный элемент находится
в VI группе, относительная
молекулярная масса высшего
оксида 80. Назовите этот элемент.
а) Селен; б) Сера; в) Теллур
3 группа.
Неизвестный элемент находится
в VII группе, относительная
молекулярная масса высшего
оксида 222. Назовите этот
элемент.
а)Хлор; б)Бром; в)Марганец
Пожелание
ФО: «Словесная
оценка»
устные комментарии учителя
24
25.
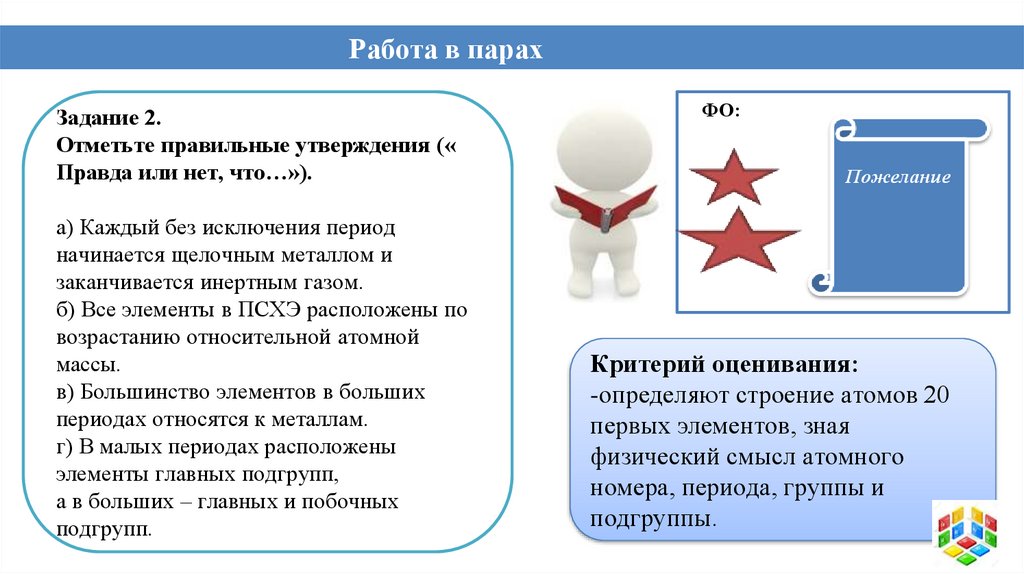
Работа в парахЗадание 2.
Отметьте правильные утверждения («
Правда или нет, что…»).
а) Каждый без исключения период
начинается щелочным металлом и
заканчивается инертным газом.
б) Все элементы в ПСХЭ расположены по
возрастанию относительной атомной
массы.
в) Большинство элементов в больших
периодах относятся к металлам.
г) В малых периодах расположены
элементы главных подгрупп,
а в больших – главных и побочных
подгрупп.
ФО:
Пожелание
Критерий оценивания:
-определяют строение атомов 20
первых элементов, зная
физический смысл атомного
номера, периода, группы и
подгруппы.
26.
Индивидуальная работа.Задание 3.
Определить положение в ПС (период, группа, подгруппа)
элементов № 14, 25, 34, 36, 53.
Критерий оценивания:
-находят элемент в ПС по порядковому
номеру;
-определяют период, группу и подгруппу.
ФО: письменные комментарии
от учителя каждому ученику
через обратную связь
26
27.
Оцените свою работу на уроке- Не понятно
- Есть затруднения
- Хорошо
- Отлично













 Химия
Химия