Похожие презентации:
Общие закономерности реакций спиртов
1.
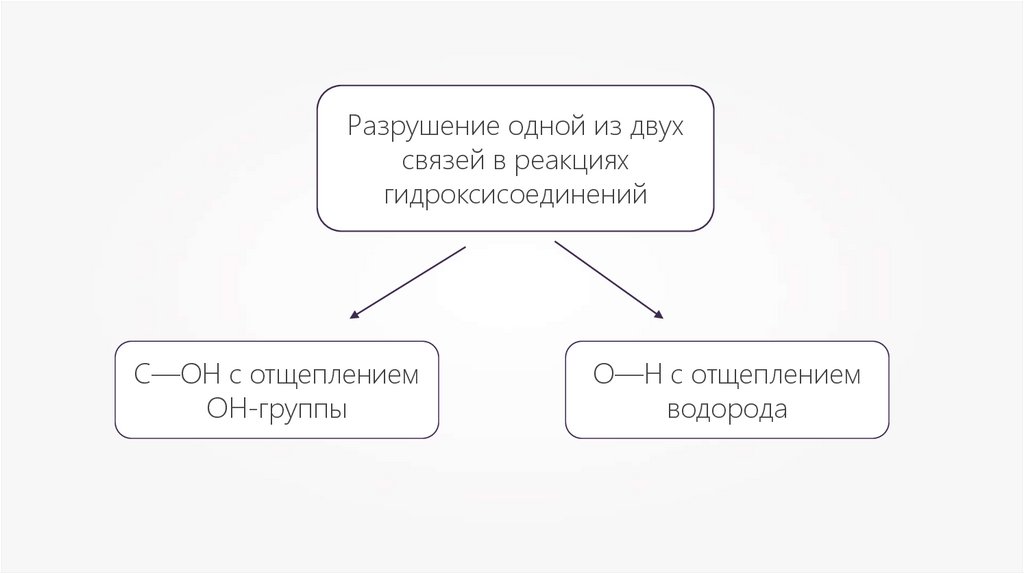
Разрушение одной из двухсвязей в реакциях
гидроксисоединений
С—ОН с отщеплением
ОН-группы
О—Н с отщеплением
водорода
2.
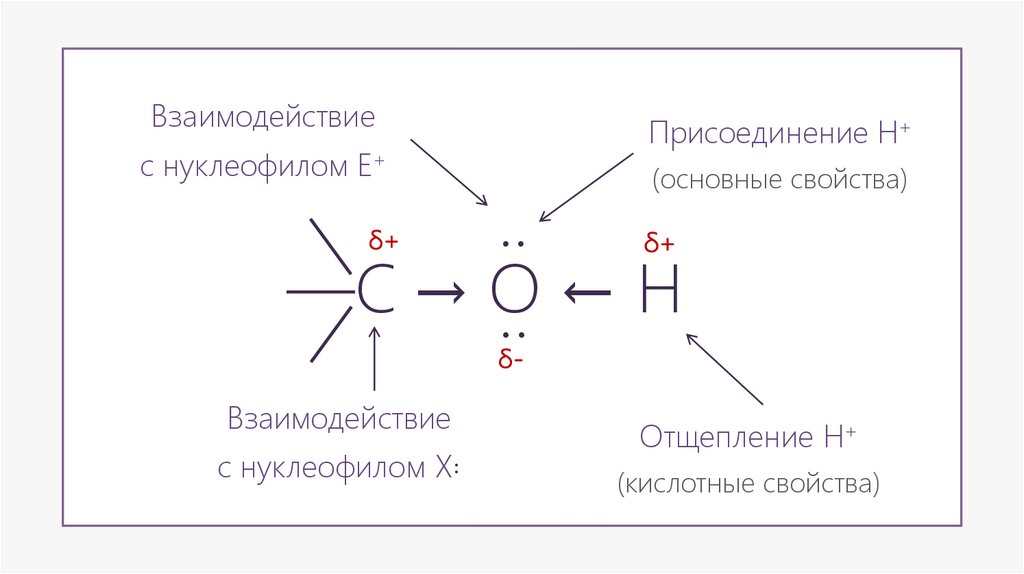
ВзаимодействиеПрисоединение H+
с нуклеофилом E+
(основные свойства)
..
—С → О ← H
δ+
δ+
..
δ-
Взаимодействие
с нуклеофилом X꞉
Отщепление H+
(кислотные свойства)
3.
Гидроксисоединения могутвступать в многочисленные
реакции, давая различные
классы соединений.
4.
Общие закономерностиреакций спиртов:
– реакционная способность
первичных одноатомных
спиртов выше, чем вторичных;
– вторичные спирты химически
более активны, чем третичные;
– для двухатомных спиртов
наблюдается повышенная
реакционная способность.
5.
Взаимодействие с активными металлами(щелочными и щёлочноземельными)
При взаимодействии
с активными металлами спирты
проявляют свойства слабых
кислот и образуют соли,
называемые алкоголятами.
2CH3OH + 2Na = 2CH3ONa + H2↑
алкоголят
6.
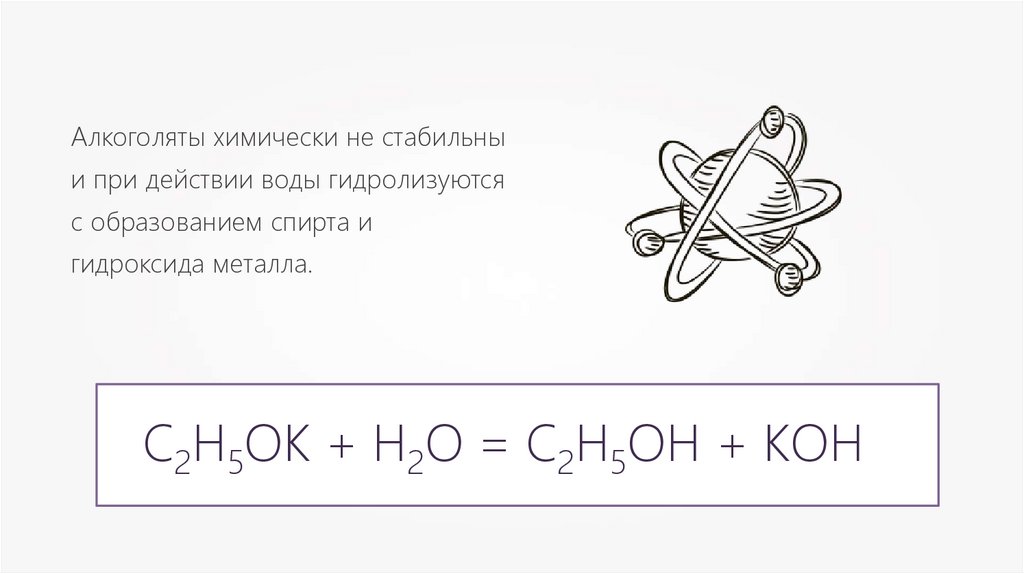
Алкоголяты химически не стабильныи при действии воды гидролизуются
с образованием спирта и
гидроксида металла.
C2H5OК + H2O = C2H5OH + КOH
7.
Спирты не взаимодействуютс растворами щелочей.
8.
HO—CH2—CH2—OH + 2NaOH == NaO—CH2—CH2—ONa + 2H2O
9.
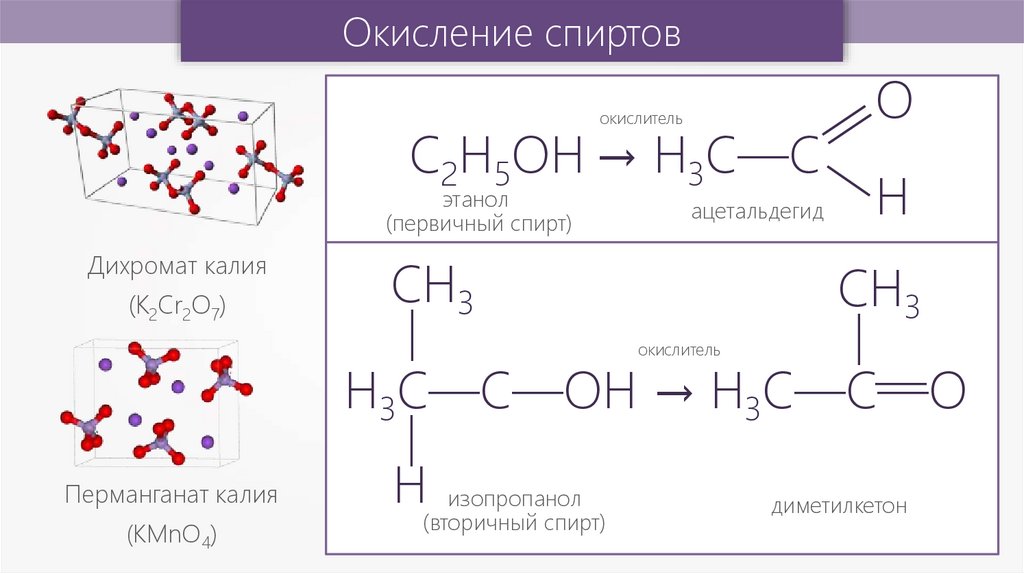
Окисление спиртовокислитель
С2Н5ОH → H3C—C
этанол
(первичный спирт)
Дихромат калия
СН3
H
СН3
окислитель
—
—
(K2Cr2O7)
ацетальдегид
О
—
—
H3C—C—OH → H3C—C—O
Перманганат калия
(КМnО4)
Н
изопропанол
(вторичный спирт)
диметилкетон
10.
Восстановление спиртовВосстановление спиртов приводит
к образованию углеводородов, содержащих
то же количество атомов углерода, что и
молекула исходного спирта.
11.
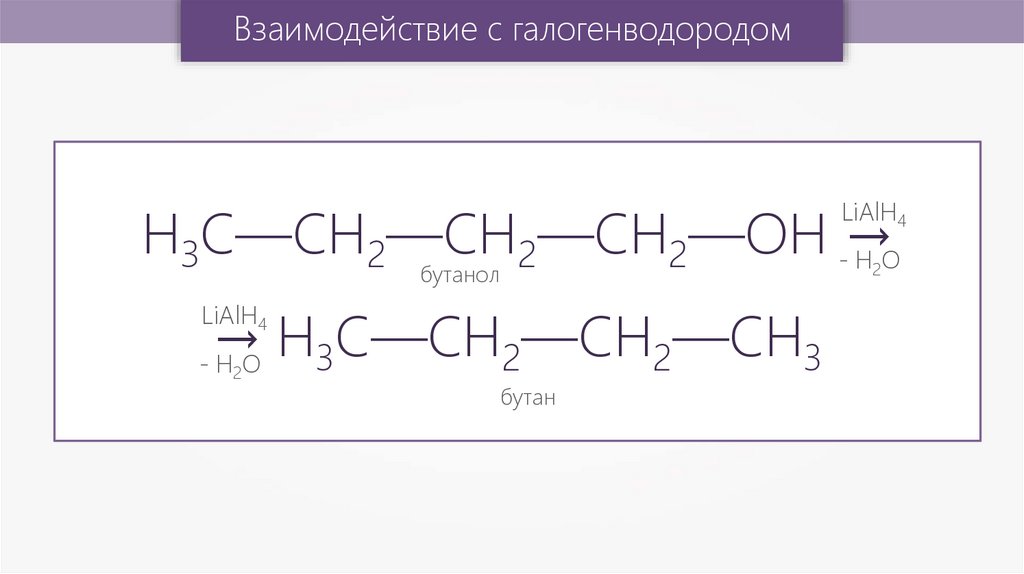
Взаимодействие с галогенводородомH3C—CH2—CH2—CH2—OH -→
HO
LiAlH4
2
бутанол
→ H3С—CH2—CH2—СН3
LiAlH4
- H2O
бутан
12.
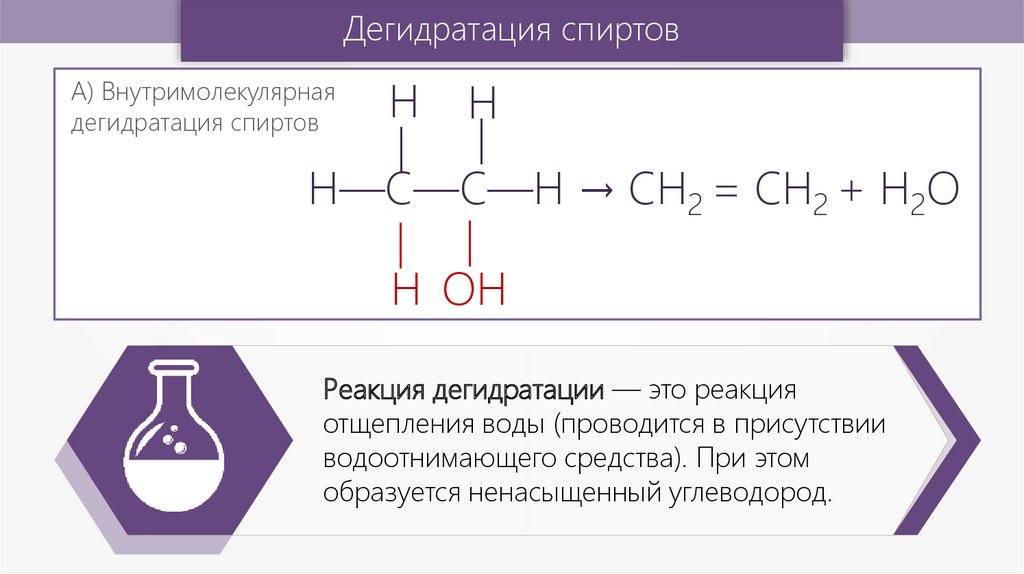
Дегидратация спиртов—
—
Н
—
Н
—
А) Внутримолекулярная
дегидратация спиртов
Н—С—С—Н → CH2 = CH2 + H2O
Н ОН
Реакция дегидратации — это реакция
отщепления воды (проводится в присутствии
водоотнимающего средства). При этом
образуется ненасыщенный углеводород.
13.
Дегидратация спиртовБ) Межмолекулярная
дегидратация спиртов
C2H5OH → C2H5—O—C2H5 + H2O
диэтиловый эфир
C2H5OH
Реакция дегидратации — это реакция
отщепления воды (проводится в присутствии
водоотнимающего средства). При этом
образуется ненасыщенный углеводород.
14.
Реакции спиртов с минеральными иорганическими кислотами с образованием
сложных эфиров
H2SO4(конц.), t
СH3—CООH + HOCH3 → CH3—COOCH3 + H2O
→
уксусная (этановая) метиловый спирт
кислота
(метанол)
метилацетат
15.
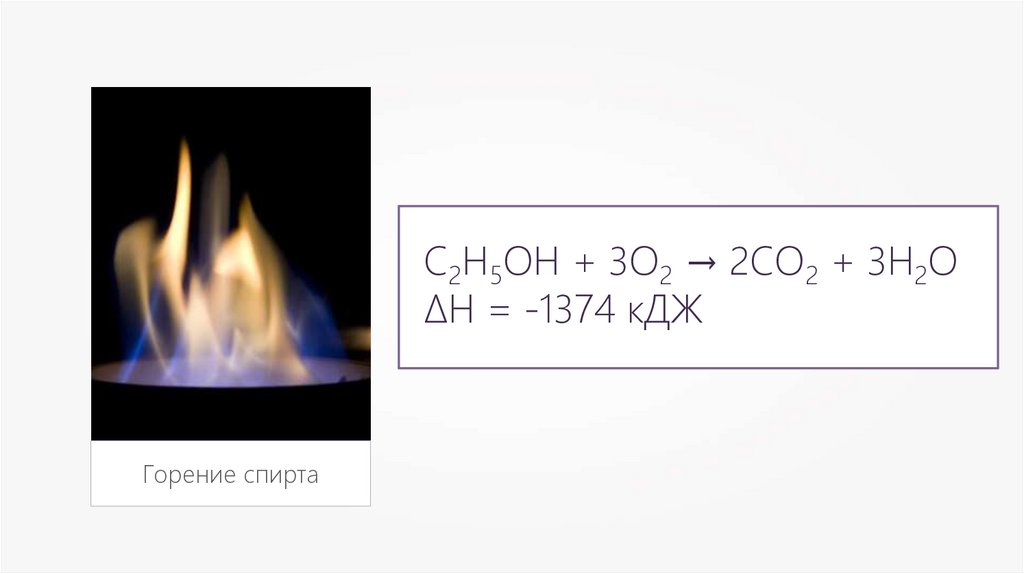
С2Н5ОН + 3О2 → 2СО2 + 3Н2О∆Н = -1374 кДЖ
Горение спирта
16.
Спирты можно использоватьдля получения всевозможных
органических соединений,
применяемых в качестве
органических растворителей
при производстве полимеров,
красителей и лекарственных
препаратов.
17.
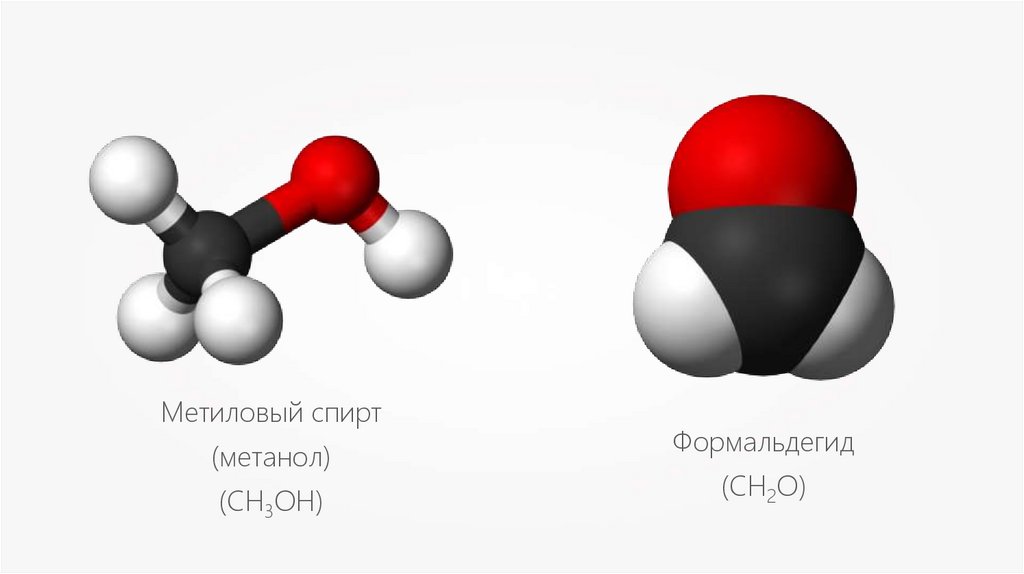
Метиловый спирт(метанол)
(СН3OH)
Формальдегид
(CH2O)
18.
Большие объёмы метанолаиспользуют при добыче и
транспорте природного газа.
19.
Метанол — наиболее токсичноесоединение среди всех спиртов.
100 мл
смертельная доза при
приёме внутрь
20.
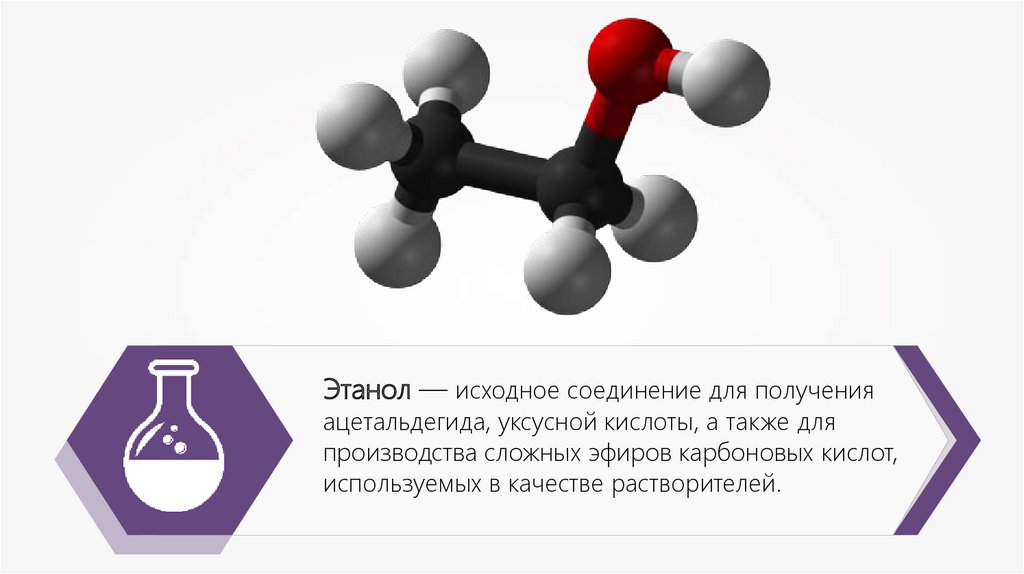
Этанол — исходное соединение для полученияацетальдегида, уксусной кислоты, а также для
производства сложных эфиров карбоновых кислот,
используемых в качестве растворителей.
21.
Этанол — основной компонентвсех спиртных напитков, его
широко применяют в медицине
как дезинфицирующее
средство.
VanHelsing.16
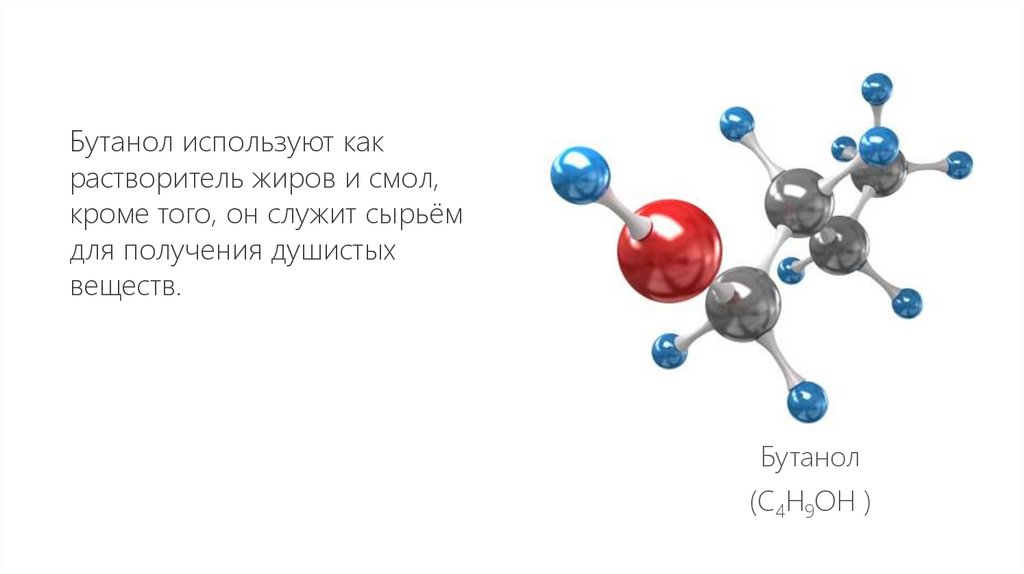
22.
Бутанол используют какрастворитель жиров и смол,
кроме того, он служит сырьём
для получения душистых
веществ.
Бутанол
(С4H9OH )
23.
ЖасминБензиловый спирт
(С6Н5—CH2—OH)
Гиацинт

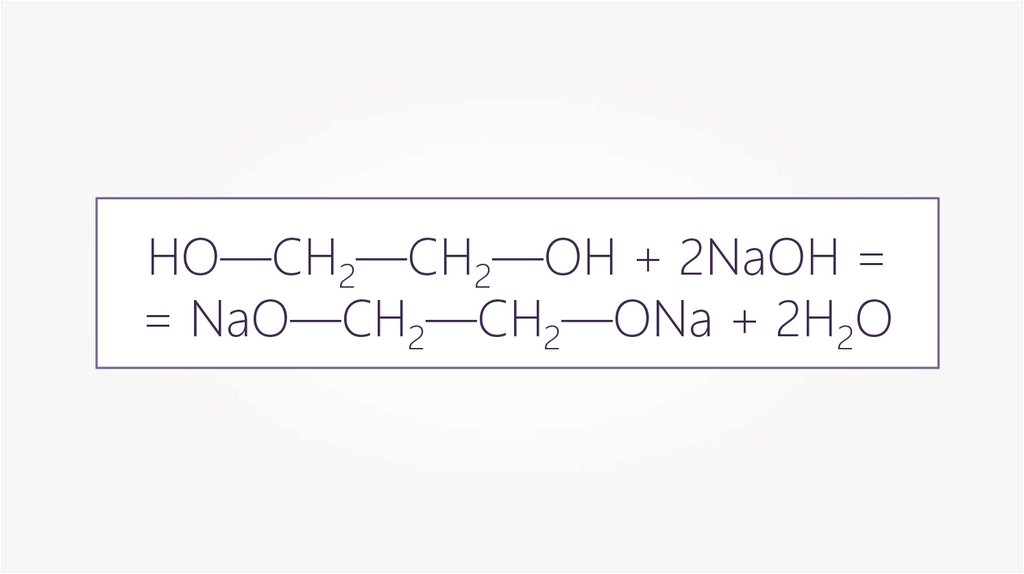









 Химия
Химия