Похожие презентации:
Закономерности изменения свойств галогенов
1. Закономерности изменения свойств галогенов
2. Учебная цель:
10.2.1.5 объяснятьзакономерности изменения
физических и химических
свойств галогенов в группе
3.
Положение галогенов в ПСХЭГруппы элементов
Пери –
оды
I
1
Н
2
Li
3
Na
6.939
3
Литий
11 Мg
22,9898
Калий
29
Сu
85,47
Ag
196,967
ЛВС
112,40
55 Ва
132,905
Аu
[223]
Бор
Скандий
Иттрий
Сd In
114,82
Барий
80
200,59
Rа
Индий
*
138,81
Hg ТI
[226]
49
Кремний
VI
204,37
91,22
81
Sn
VII
Радий
R2О
RO
118,69
Таллий
Гафний
41
92,906
Свинец
Rf
Nb
Ниобий
73
180,948
Та
Тантал
[262]
Сера
VIII
Db
9
51,996
Хром
Фтор
34 Br
Селен
42
95,94
Мо
183.85
52 I
[263]
55,847
W
58,9332
Со
Кобальт
75
186,2
Re
Рений
44
101,07
Ru
Рутений
45
102,905
Rh
Родий
[262]
Борий
RO2
R2O5
RO3
R2O7
RH4
RH3
RH2
RH
18
58,71
39,948
Ni
Никель
36
83,80
46
106,4
Pd
Палладий
54
131,30
Ксенон
76
190,2
Оs
77
192,2
Ir
Иридий
78
195,09
Рt
Платина
Rn
85
Bh
10
20,183
Xe
Радон
Астат
107
28
4.0026
Криптон
Осмий
210
Nе
Кr
53
84 At
Сиборгий
27
126,9044
[210]
Sg
Fe
Железо
Йод
Полоний
106
Технеций
78,96
Теллур
74
[99]
26
35
Тс
43
Гелий
Аргон
79,904
Бром
2
Ar
17
Хлор
Не
Неон
35,453
Марганец
78,96
Галогены
18,9984
Cr 25
Мn
44,956
24
83 Ро
Висмут
105
32,064
Вольфрам
208,980
F
17 Cl
51 Тe
121,75
Актиний Резерфордий Дубний
R2O3
Кислород
Молибден
Сурьма
82 Вi
207,19
8
15,9994
33 Se
74,9216
Мышьяк
50 Sb
Олово
** Ас 104
88 89
138,81
[261]
Франций
Zr
Цирконий
Pb
Фосфор
32 As
72,59
О
15 S
30,9738
Ванадий
Германий
40
Азот
7
14,0067
Ti 23
V
50,942
La 72
Hf
178.49
Лантан
Ртуть
87
Y
88,905
N
14 P
28,086
31 Ge
26,9815
38 39
56 57
Углерод
Титан
Галлий
137.34
6
12,01115
Sc 22
47,90
44,956
Zn Ga
87,62
С
13 Si
26,9815
Алюминий
Кадмий
Золото
Fr
48
5
10,811
20 21
Стронций
Цезий
79
65,37
37 Sr
Серебро
Cs
40,08
Кальций
30
В
12 Al
24,312
Цинк
Рубидий
47
4
9,0122
Магний
19 Сa
39,102
107,868
Высшие
оксиды
Ве
Бериллий
Натрий
Rb
7
V
Водород
Медь
6
IV
1
63,546
5
III
1,00797
К
4
II
108
[265]
Hs
Хассий
109
[266]
Мt
Мейтнерий
RO4
86
[222]
4.
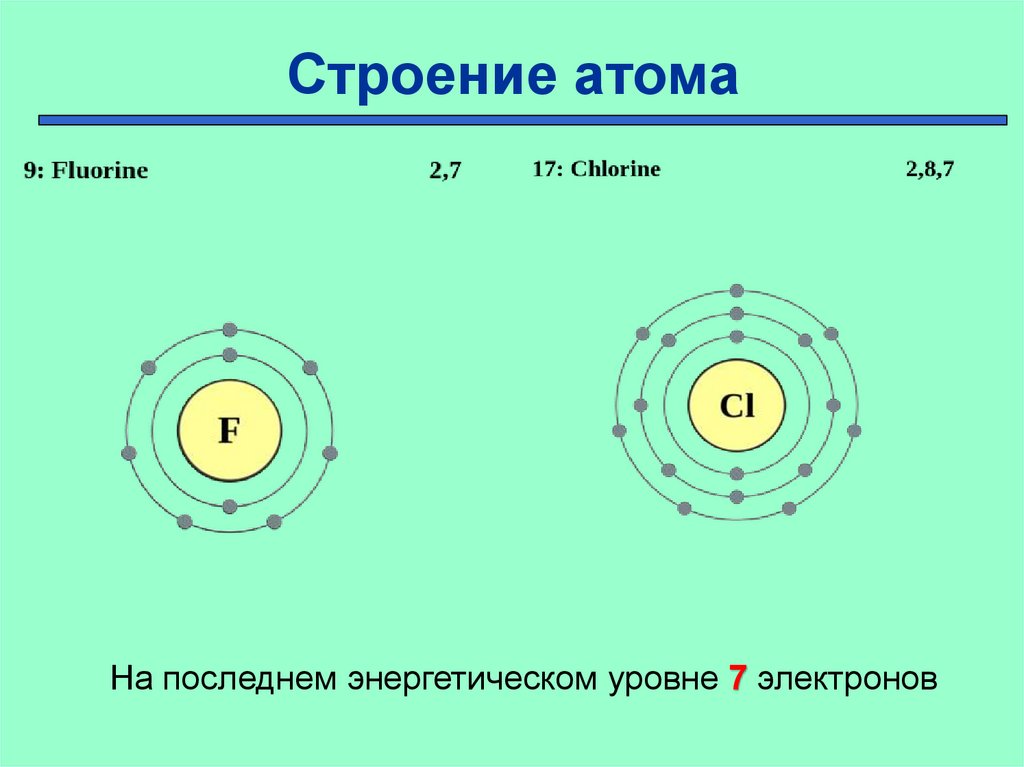
Строение атомаНа последнем энергетическом уровне 7 электронов
5.
Строение атомаНа последнем энергетическом уровне 7 электронов
6. Изменение свойств галогенов в группе сверху вниз
• Заряд ядра-…?• Радиус атома-…?
+9 ) )
• Количество валентных
2 7
электронов равно-…?
+17 ) ) )
• Притяжение валентных
287
электронов к ядру-…?
• Способность отдавать
электроны -…?
+35 ) ) ) )
• Неметаллические
2 8 18 7
свойства-…?
• Окислительная
способность -…?
+53 ) ) ) ) )
• Электроотрицательность2 8 18 18 7
…?
7.
ФТОРГруппы элементов
I
II
III
IV
V
VI
VII
VIII
1
Фтор/Fluorum (F)
II
2
Внешний вид
Бледно-жёлтый газ.
простого вещества Очень ядовит.
III
3
I
Электронная
коефигуранция
ЭО
(по Полингу)
4
IV
5
6
V
7
8
VI
9
VII
10
F2
[He] 2s2 2p5
4 (САМЫЙ
электроотрицательный ЭЛЕМЕНТ)
Степень окисления −1 (ВСЕГДА)
Плотность
(при −189 °C)1,108
г/см ³
53,53К
Температура
плавления
Температура
85,01 К
кипения
8.
ХЛОРГруппы элементов
I
I
II
III
2
III
3
IV
5
6
V
7
8
9
VII
10
VI
Внешний вид
простого
вещества
Электронная
коефигуранция
ЭО
(по Полингу)
Степень
окисления
Плотность
4
VI
V
VII
VIII
Хлор / Chlorum (Cl)
1
II
IV
Cl2
Температура
плавления
Температура
кипения
Газ жёлто-зеленого
цвета с резким
запахом. Ядовит.
[Ne] 3s2 3p5
3,16
7, 6, 5, 4, 3, 1, −1
(при −33.6 °C)1,56
г/см ³
172.2 К
238.6 К
9.
БРОМГруппы элементов
I
I
II
III
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
V
VI
VII
VIII
Бром / Bromum (Br)
1
II
IV
Br2
Внешний вид
простого
вещества
Электронная
конфигуранция
ЭО
(по Полингу)
Степень
окисления
Плотность
Температура
плавления
Температура
кипения
Красно-бурая
жидкость с резким
запахом
[Ar] 3d10 4s2 4p5
2,96
7, 5, 3, 1, -1
3,12 г/см³
265,9 К
331,9 К
10.
ЙОДГруппы элементов
I
I
II
III
II
III
V
VI
металлическим
блеском
3
IV
5
6
V
7
8
9
10
VIII
Черно-фиолетовые
Внешний вид
простого вещества кристаллы с
2
VI
VII
Ио́д / Iodum (I)
1
4
VII
IV
I2
Электронная
конфигуранция
ЭО
(по Полингу)
Степень
окисления
Плотность
[Kr] 4d10 5s2 5p5
Температура
плавления
Температура
кипения
386,7 К
2,66
7, 5, 3, 1, -1
4,93г/см³
457,5 К
11.
АСТАТГруппы элементов
I
I
II
III
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
V
VI
VII
VIII
Аста́т / Astatium (At)
1
II
IV
At2
Внешний вид
простого
вещества
Электронная
конфигуранция
ЭО
(по Полингу)
Степень
окисления
Плотность
Нестабильные
чёрно-синие
кристаллы
[Xe] 4f14 5d10 6s2 6p5
Температура
плавления
Температура
кипения
517 К
2,2
7, 5, 3, 1, −1
n/a г/см
582 К
12. Галогены
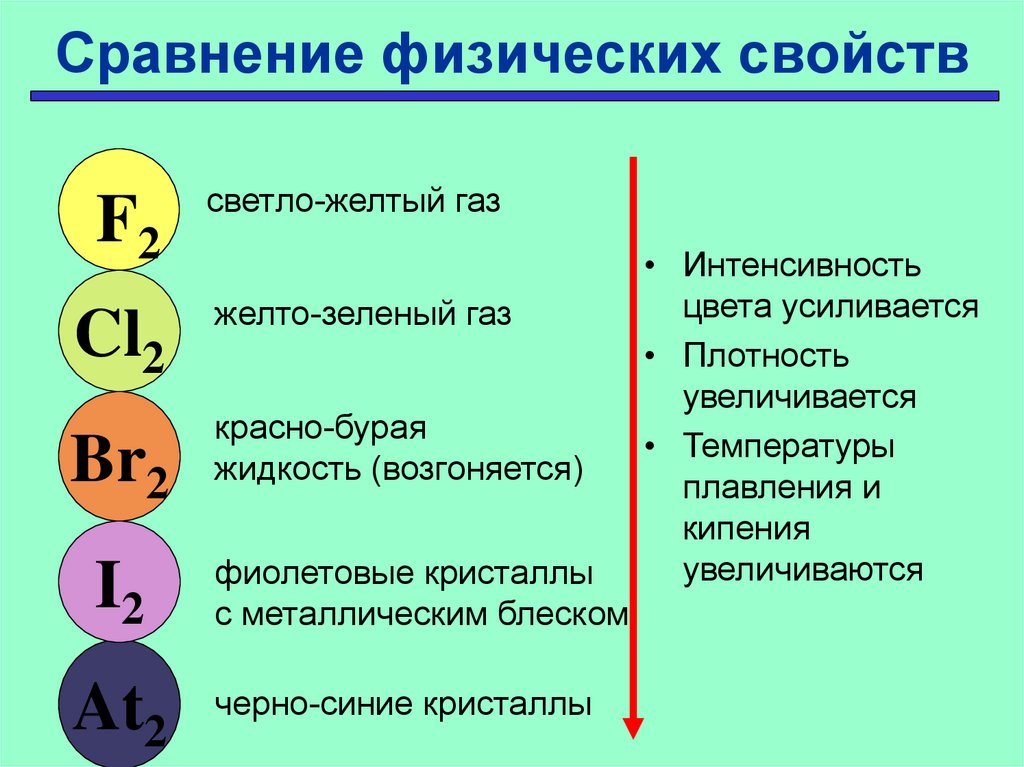
13. Сравнение физических свойств
F2светло-желтый газ
Cl2
желто-зеленый газ
Br2
I2
At2
красно-бурая
жидкость (возгоняется)
фиолетовые кристаллы
с металлическим блеском
черно-синие кристаллы
• Интенсивность
цвета усиливается
• Плотность
увеличивается
• Температуры
плавления и
кипения
увеличиваются
14.
Возгонка йодаКристаллический йод
обладает
способностью при
нагревании
переходить из
твердого состояния
в газообразное,
минуя жидкое
(возгонка),
превращаясь в
фиолетовые пары.
15.
Химические свойства галогенов16.
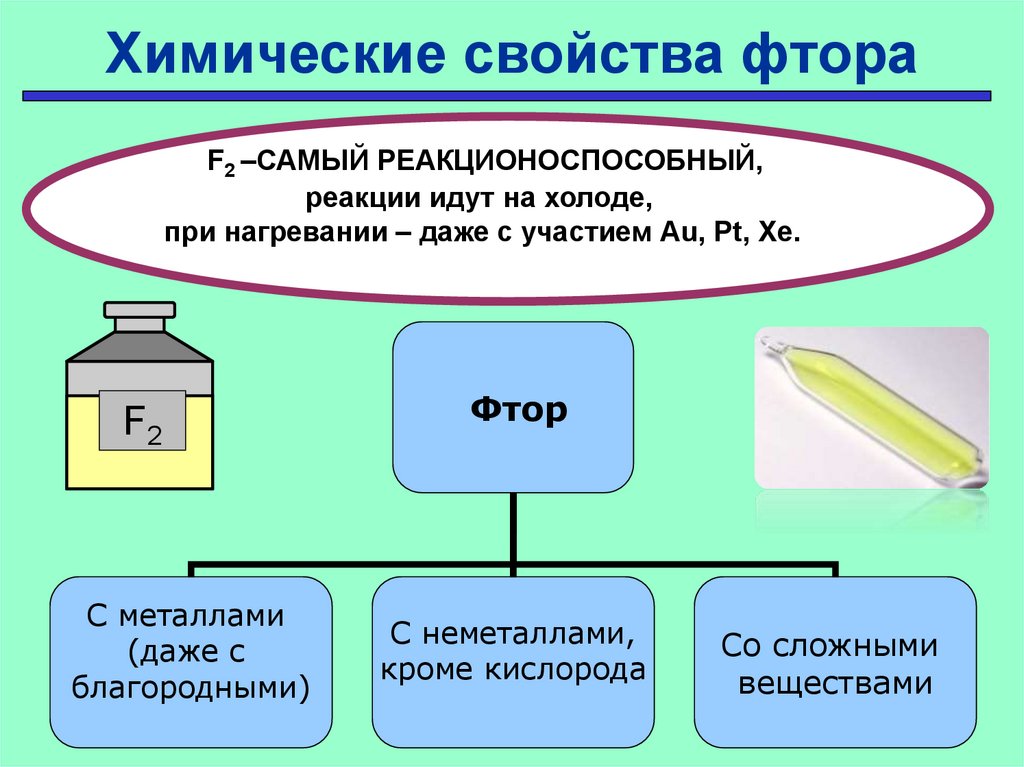
Химические свойства фтораF2 –САМЫЙ РЕАКЦИОНОСПОСОБНЫЙ,
реакции идут на холоде,
при нагревании – даже с участием Au, Pt, Xe.
F2
С металлами
(даже с
благородными)
Фтор
С неметаллами,
кроме кислорода
Проверить
Со сложными
веществами
17.
Химические свойства хлораCl2 - сильно реакционоспособен (искл. C,
O2, N2 и некот. др.).
Отбеливает ткани и бумагу.
Cl2
С металлами
(кроме
благородных)
Хлор
С неметаллами,
кроме кислорода
и азота,углерода
Со сложными
веществами
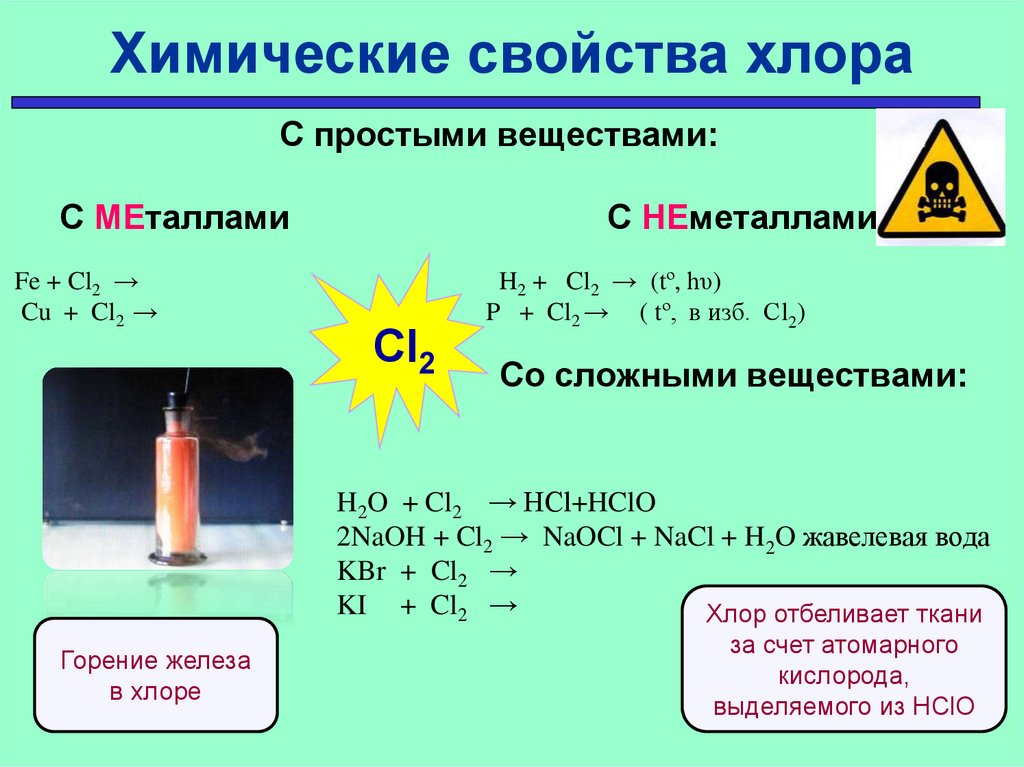
18.
Химические свойства хлораС простыми веществами:
С МЕталлами
Fe + Cl2 →
Cu + Cl2 →
С НЕметаллами
Cl2
H2 + Cl2 → (tº, hυ)
P + Cl2 → ( tº, в изб. Сl2)
Со сложными веществами:
H2O + Cl2 → HCl+HClO
2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода
KBr + Cl2 →
KI + Cl2 →
Хлор отбеливает ткани
Горение железа
в хлоре
за счет атомарного
кислорода,
выделяемого из НClO
19.
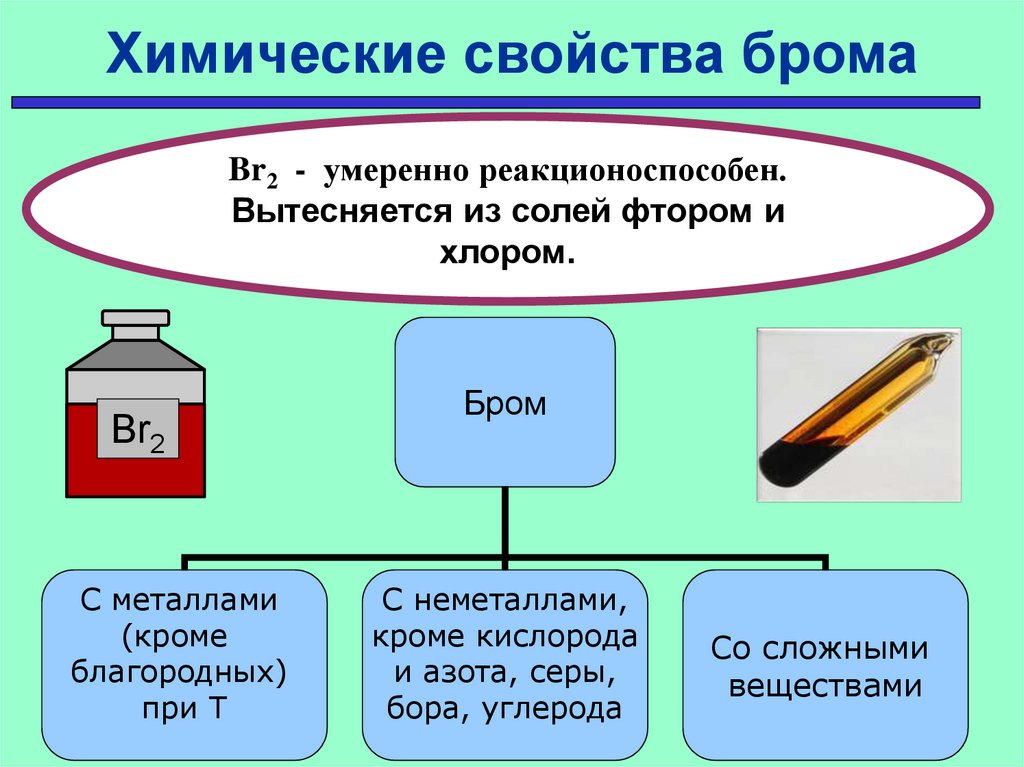
Химические свойства бромаBr2 - умеренно реакционоспособен.
Вытесняется из солей фтором и
хлором.
Br2
С металлами
(кроме
благородных)
при Т
Бром
С неметаллами,
кроме кислорода
и азота, серы,
бора, углерода
Со сложными
веществами
20.
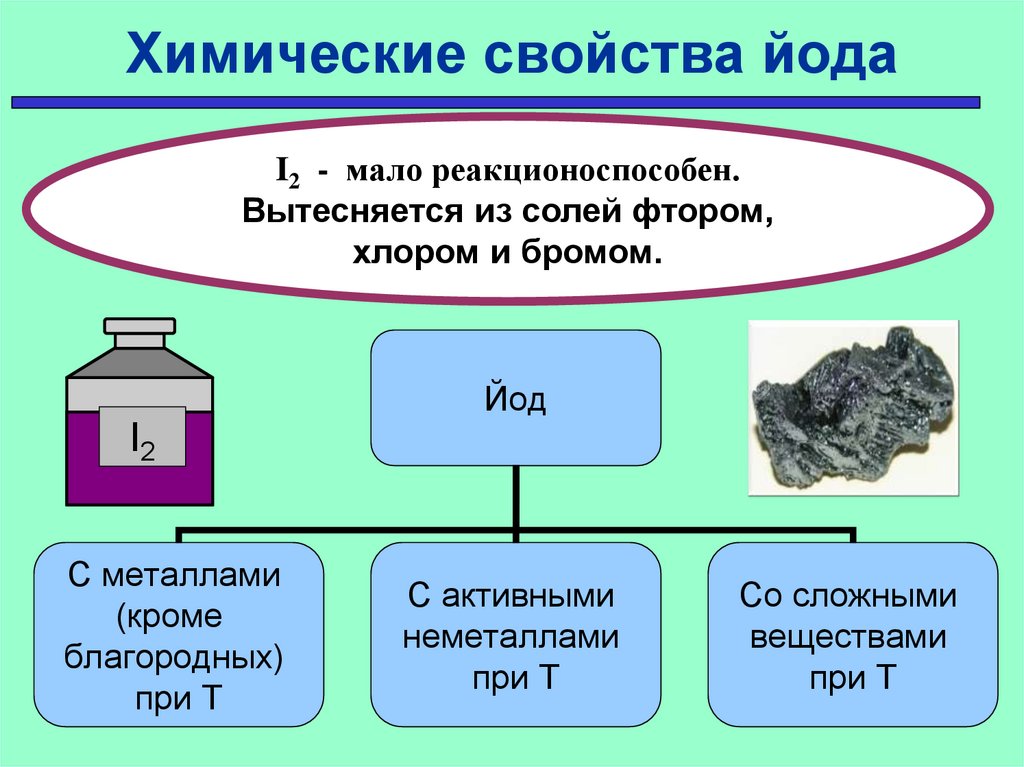
Химические свойства йодаI2 - мало реакционоспособен.
Вытесняется из солей фтором,
хлором и бромом.
Йод
I2
С металлами
(кроме
благородных)
при Т
С активными
неметаллами
при Т
Со сложными
веществами
при Т
21. Закрепление. Тест.
1. Наиболее ярко выраженывосстановительные свойства у
А) фтора
Б) хлора
В) брома
Г) иода.
22.
2. Сила галогеноводородных кислотвозрастает в ряду
А) НСl, НВr, НI;
Б) НI, НВr, НСl;
В) НВr, НI, НСl;
Г) НI, НСl, НВr.
23.
3. Наиболее ярко выраженыокислительные свойства у
А) фтора
Б) хлора
В) брома
Г) иода.
24.
4. С какими из перечисленных веществ хлорне взаимодействует?
А) Водой;
Б) раствором хлорида натрия;
В) раствором бромида натрия;
Г) раствором щелочи.
25.
5. Электронную формулу внешнегоэнергетического уровня, общую для всех
атомов галогенов, можно записать в виде
А) ns2np2
Б) ns2np3
В) ns2np4
Г) ns2np5.
26.
6. Среди галогенов – простых веществ жидким являетсяА) фтор
Б) хлор
В) бром
Г) иод.
27.
7. Раствор фтора в воде получить нельзя, таккак
А) фтор не растворяется в воде;
Б) фтор разлагает воду;
В) фтор частично растворяется в воде;
Г) фтор вытесняет из воды водород.
28.
8. Среди галогенов – простых веществ твердым являетсяА) фтор
Б) хлор
В) бром
Г) йод.
29.
• 9. Хлор взаимодействует с водой поуравнению _____________________
• 10. Хлор взаимодействует с холодным
раствором гидроксида калия по уравнению
_____________________________________
30.
1.Г
2.А
3.А
4.Б
5.Г
6.В
7.Б
8.Г
9. Cl2 + H2O = HCl + HClO
10. Cl2 + 2KOH = KCl + KClO + H2O
31. Учебные задания
• Оформить и выучить конспект поматериалам презентации.

























 Химия
Химия