Похожие презентации:
Альдегиды и кетоны
1.
Альдегиды и кетоны2.
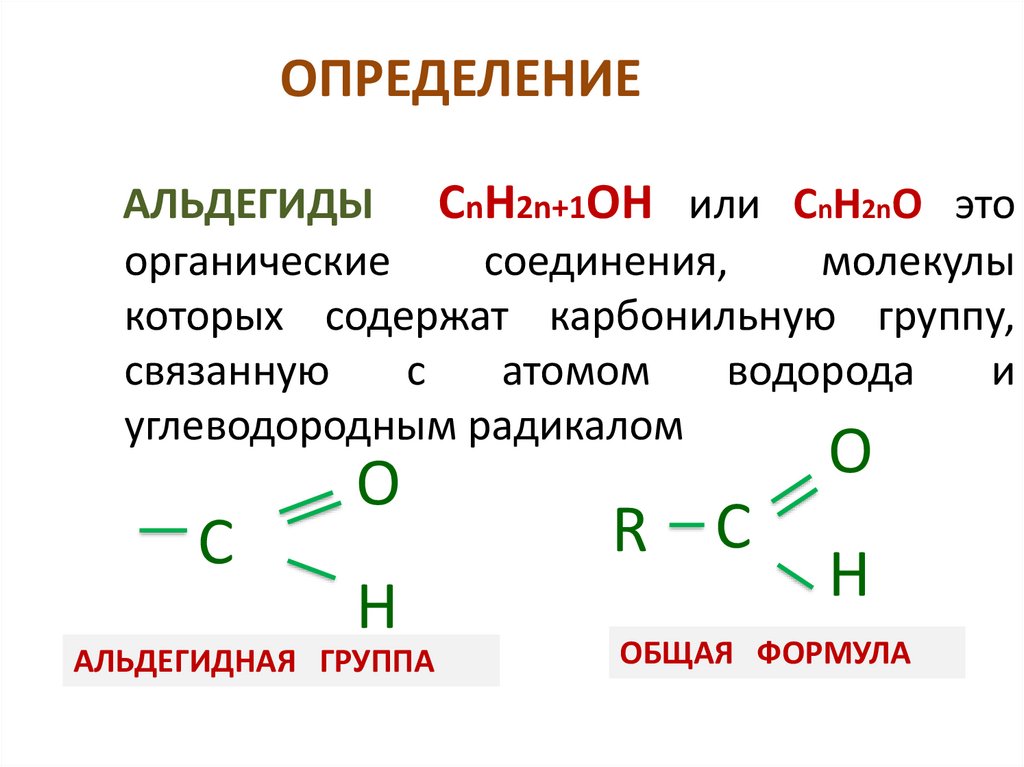
ОПРЕДЕЛЕНИЕАЛЬДЕГИДЫ СnH2n+1OН или СnH2nO это
органические
соединения,
молекулы
которых содержат карбонильную группу,
связанную
с
атомом
водорода
и
углеводородным радикалом
С
O
H
АЛЬДЕГИДНАЯ ГРУППА
O
R С
H
ОБЩАЯ ФОРМУЛА
3.
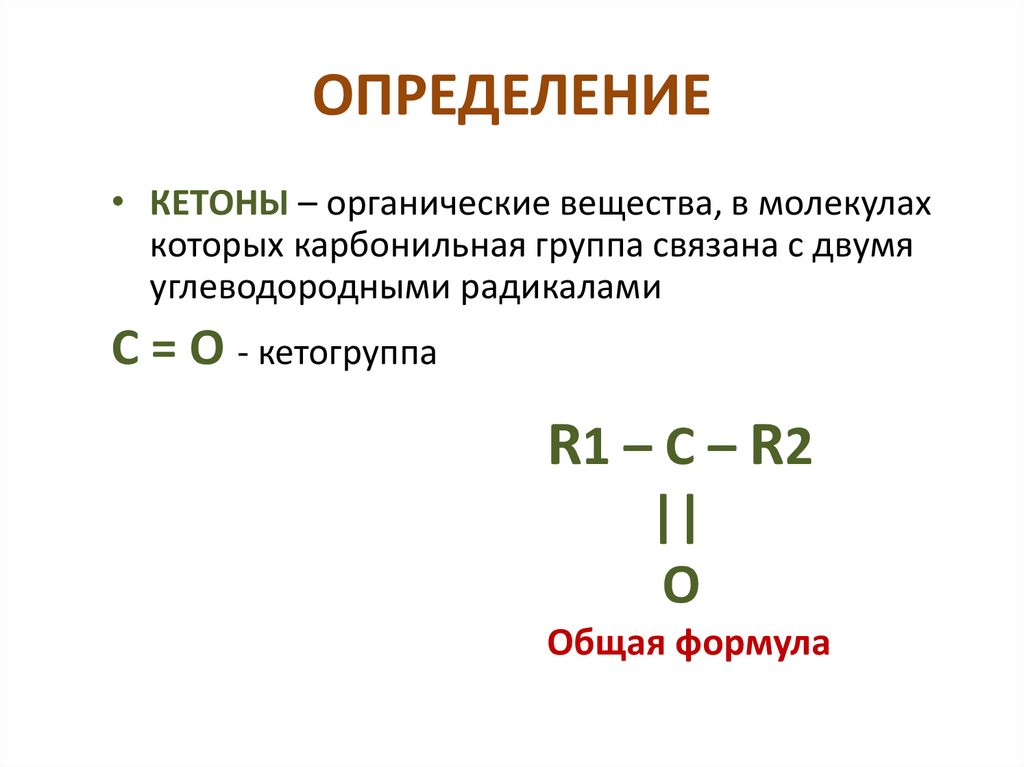
ОПРЕДЕЛЕНИЕ• КЕТОНЫ – органические вещества, в молекулах
которых карбонильная группа связана с двумя
углеводородными радикалами
С = О - кетогруппа
R1 – C – R2
||
O
Общая формула
4.
5.
• Первый член ряда альдегидов – формальдегид, в его молекуле карбонильная группасвязана только с атомами водорода —
H2C=O.
• Простейший представитель кетонов –
ацетон CH3—C (O)—CH3.
6.
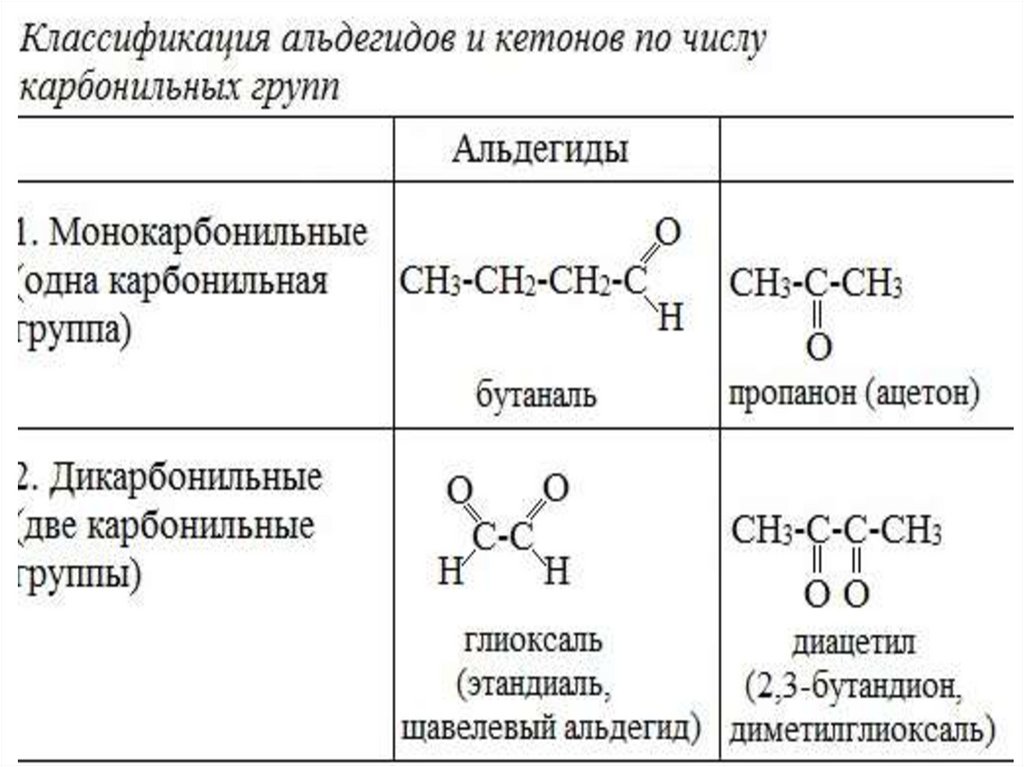
• Если в молекулах альдегидов или кетоновсодержатся две карбонильные группы, то
такие соединения
являются диальдегидами или дикетонами
соответственно.
• Например, диальдегидом
является глиоксаль, а дикетоном –
диацетил.
7.
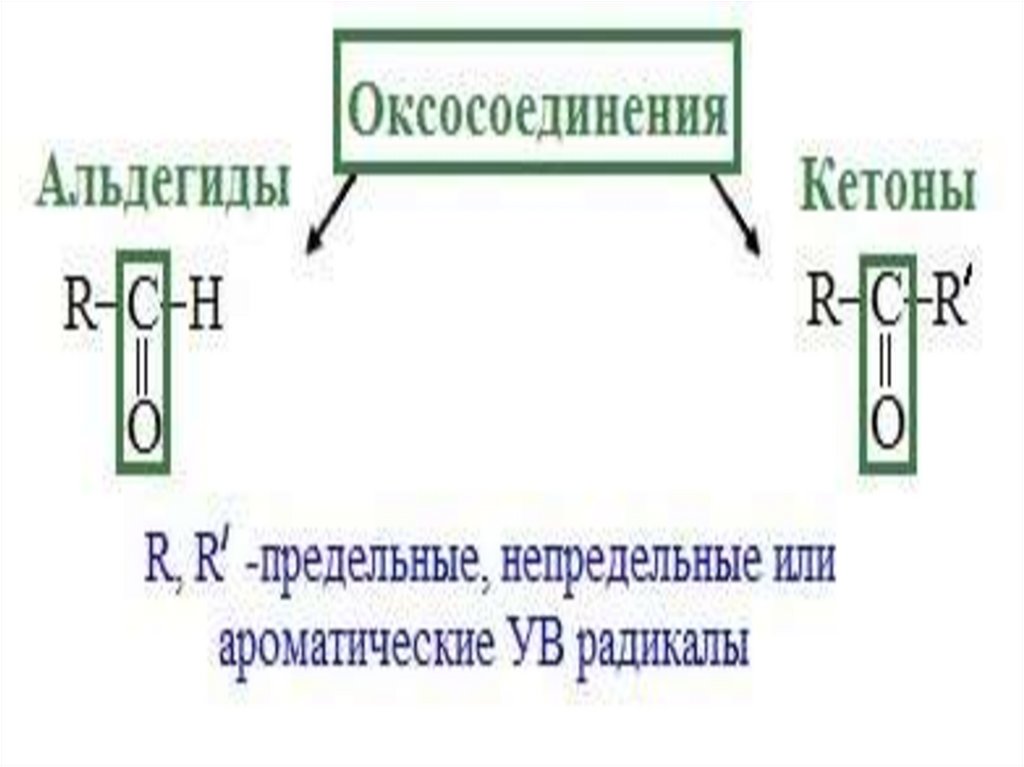
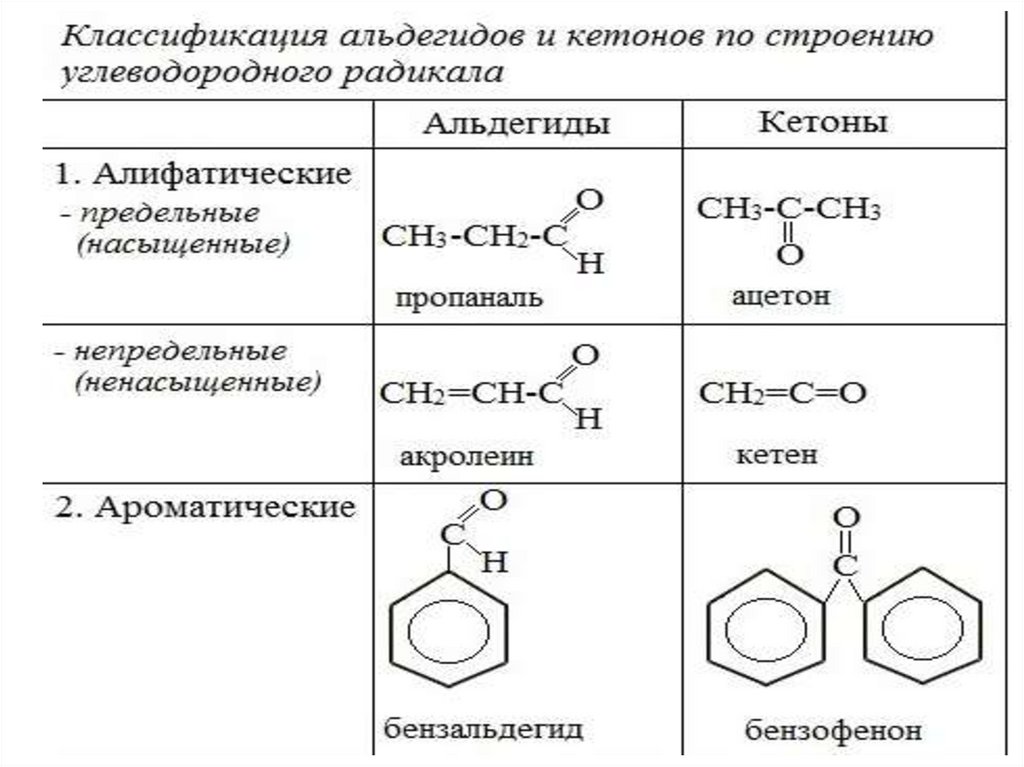
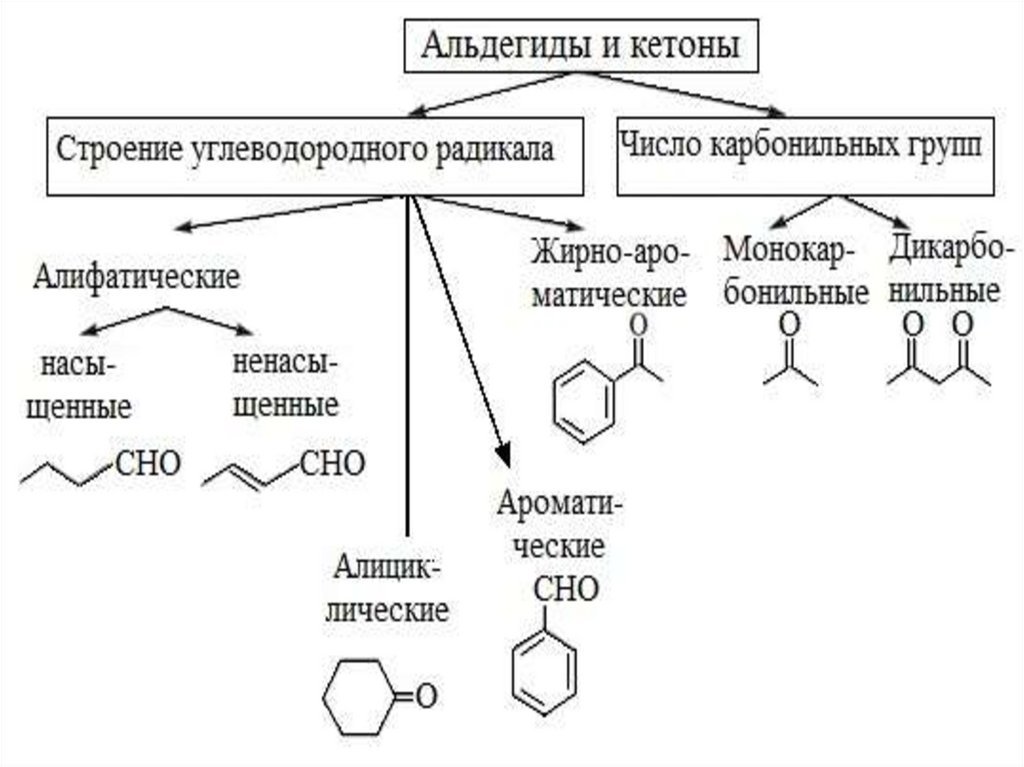
Классификация альдегидов икетонов
• Альдегиды
и кетоны классифицируют по строению
углеводородного радикала и по числу
карбонильных групп.
8.
9.
10.
11.
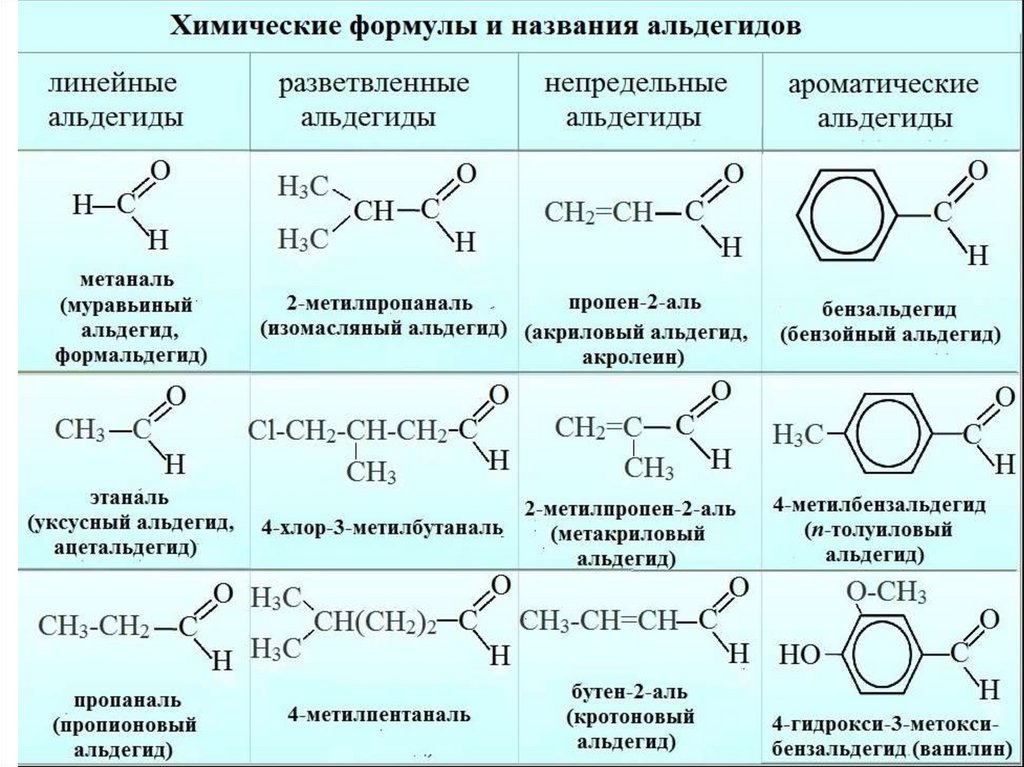
Номенклатура альдегидов• Название альдегида по международной
номенклатуре
(систематической) образуется от
названия соответствующего алкана с
таким же числом атомов углерода с
добавлением окончания –аль. Нумерацию
углеродной цепи начинают от атома
углерода альдегидной
группы (карбонильный атом углерода).
12.
13.
• Наличие кратных связей или боковых цепей вмолекуле альдегида обозначается аналогично
алканам.
Нередко в названиях альдегидов положение заместителей
указывают греческими буквами α, β, γ и др. (буквой α
обозначают атом углерода, соседний с альдегидной группой).
14.
15.
• Для альдегидов широко применяются тривиальныеназвания. Они образуются из
соответствующих тривиальных названий
карбоновых кислот, в которые альдегиды
превращаются при окислении
16.
17.
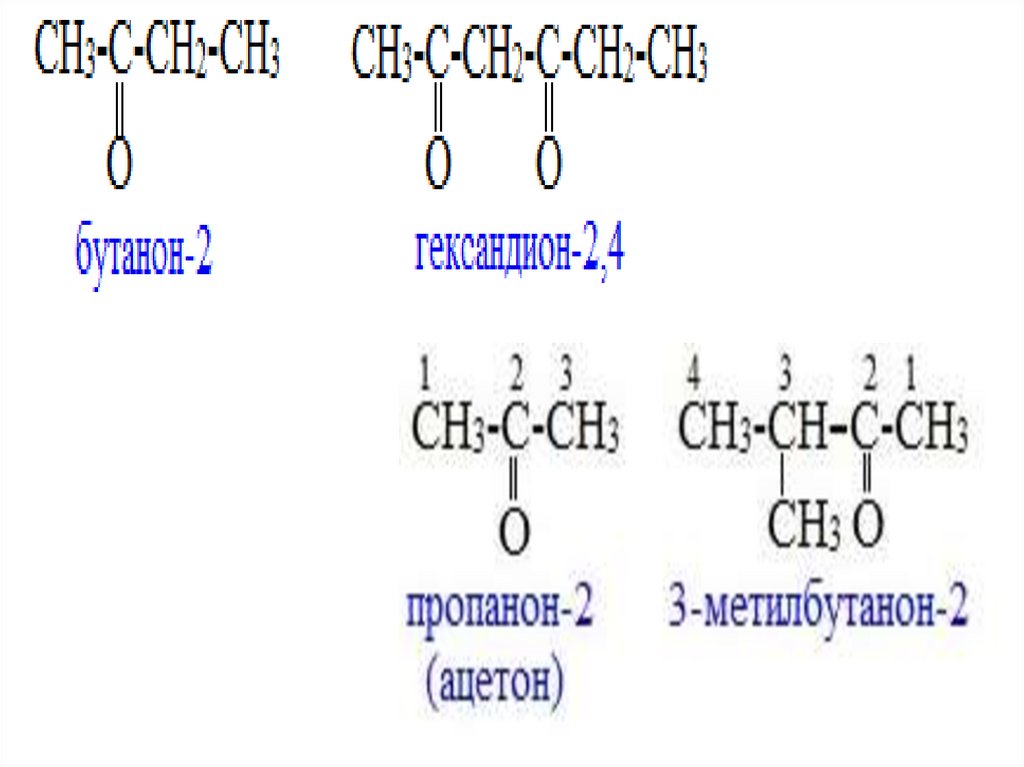
Номенклатура кетонов• По заместительной номенклатуре
ИЮПАК кетоны называют как предельные
углеводороды с тем же числом атомов С главной
углеродной цепи с добавлением суффикса он или –дион и следом за ним цифрового
локанта.
• Локант – цифра или буква, которая указывает
положение функциональной группы в молекуле.
18.
19.
20.
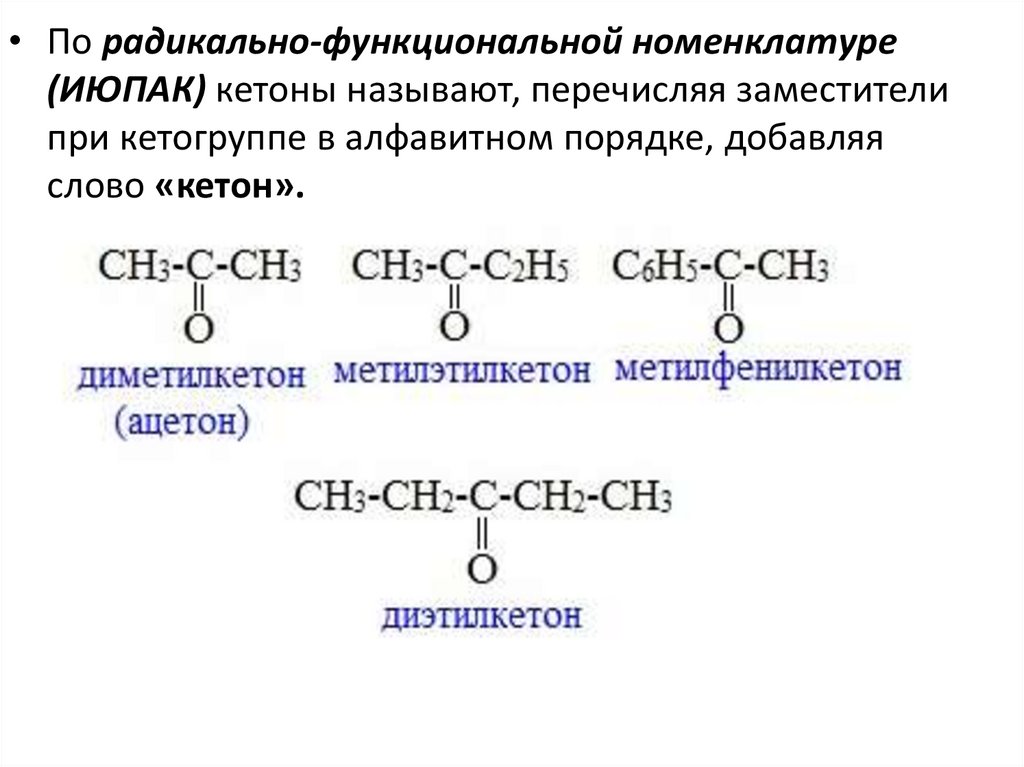
• По радикально-функциональной номенклатуре(ИЮПАК) кетоны называют, перечисляя заместители
при кетогруппе в алфавитном порядке, добавляя
слово «кетон».
21.
• При наличии двух одинаковых или разных радикаловуказывают, симметрично (симм-) или несимметрично
(несимм— ) они расположены по отношению к кетонной
группировке.
У некоторых кетонов, также как и у альдегидов,
сохраняются тривиальные названия. Простейший
алифатический кетон имеет тривиальное название ацетон.
22.
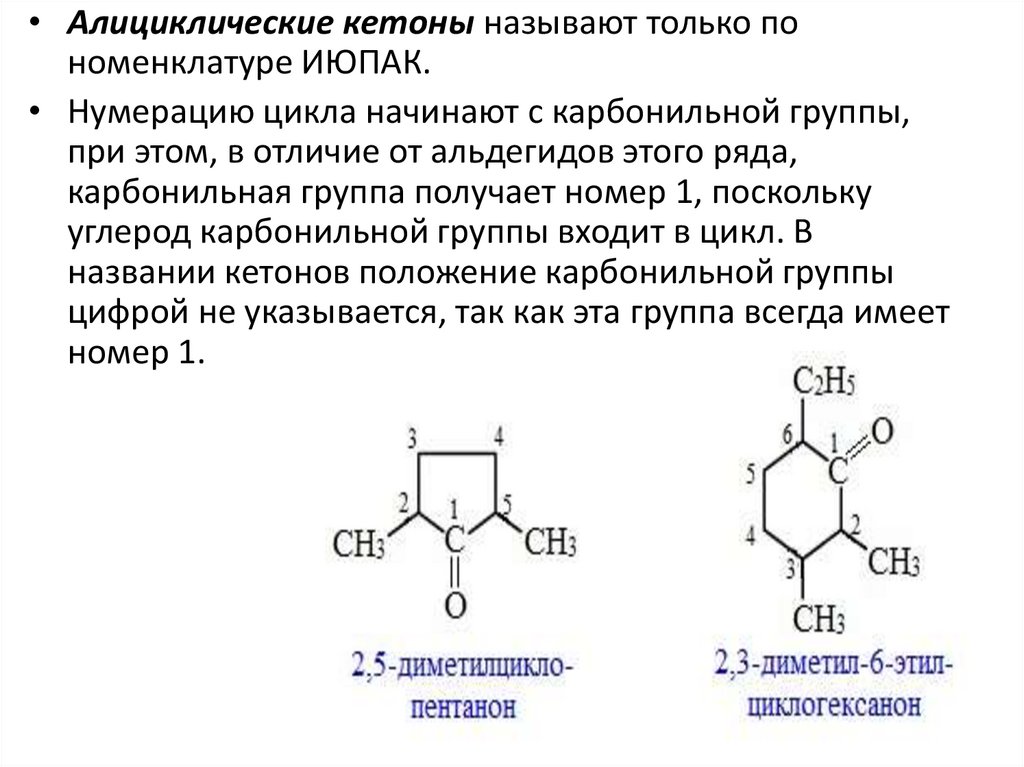
• Алициклические кетоны называют только пономенклатуре ИЮПАК.
• Нумерацию цикла начинают с карбонильной группы,
при этом, в отличие от альдегидов этого ряда,
карбонильная группа получает номер 1, поскольку
углерод карбонильной группы входит в цикл. В
названии кетонов положение карбонильной группы
цифрой не указывается, так как эта группа всегда имеет
номер 1.
23.
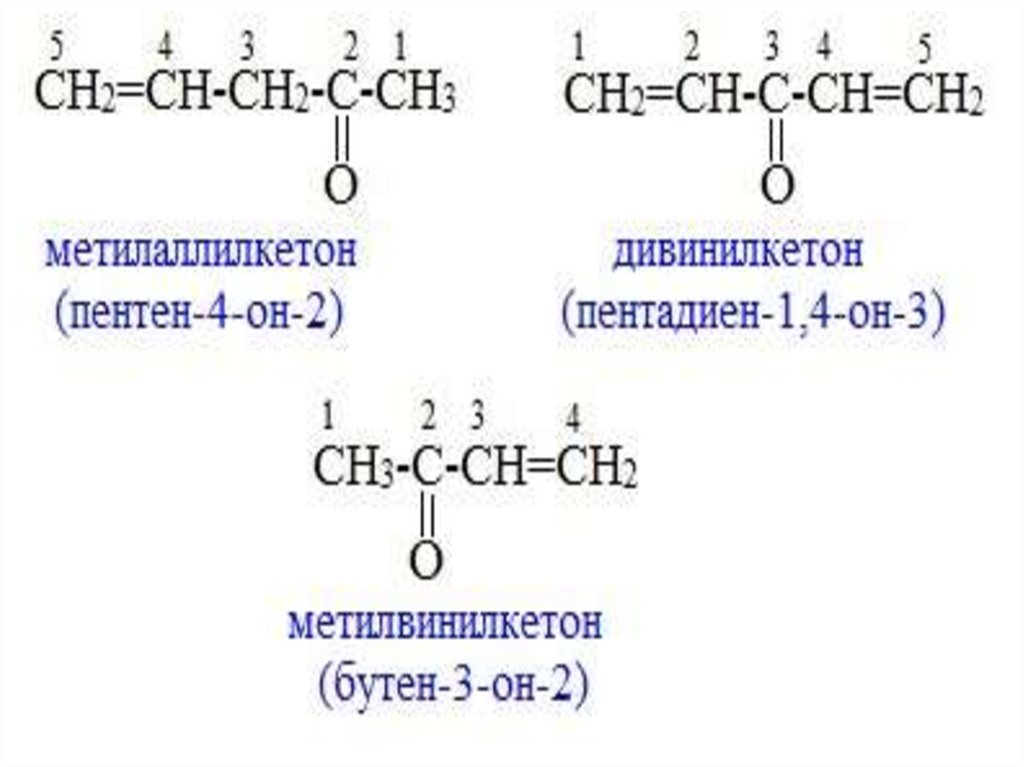
Непредельные кетоны• Кетоны этого ряда называют как по радикалофункциональной номенклатуре (для кетонов простого
строения), так и по систематической международной
номенклатуре. В последнем случае выбирается
наиболее длинная цепь, несущая карбонильную группу
и кратную связь.
• К названию соответствующего алкена добавляется
окончание «он» и цифрами указывается положение
кратной связи и карбонильной группы, которая в
этом случае должна получить наименьший номер.
24.
25.
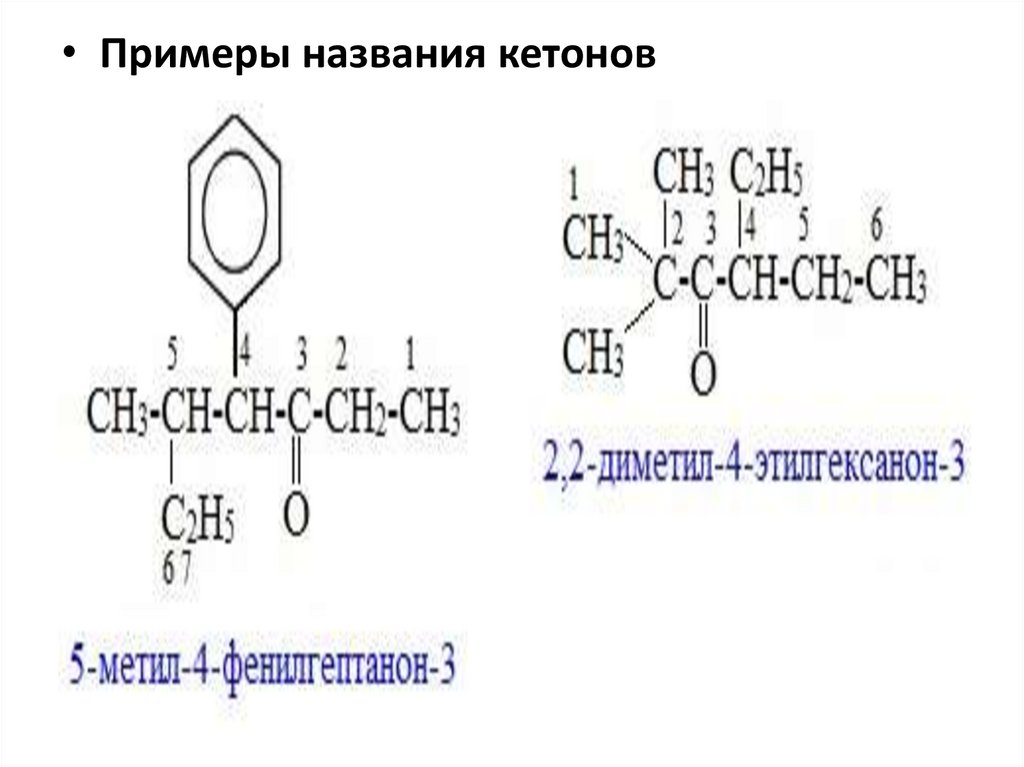
• Примеры названия кетонов26.
Изомерия альдегидов икетонов
• Для альдегидов и кетонов характерна структурная
изомерия
• Для карбонильных соединений возможна
пространственная изомерия: оптическая (если
углеводородный радикал содержит
асимметрический углеродный атом, как,
например, в глицериновом альдегиде CHO-C*H
(OH) -CH2OH) и цис-транс-изомерия (например, в
кротоновом альдегиде CH3-CH=CH-CHO).
27.
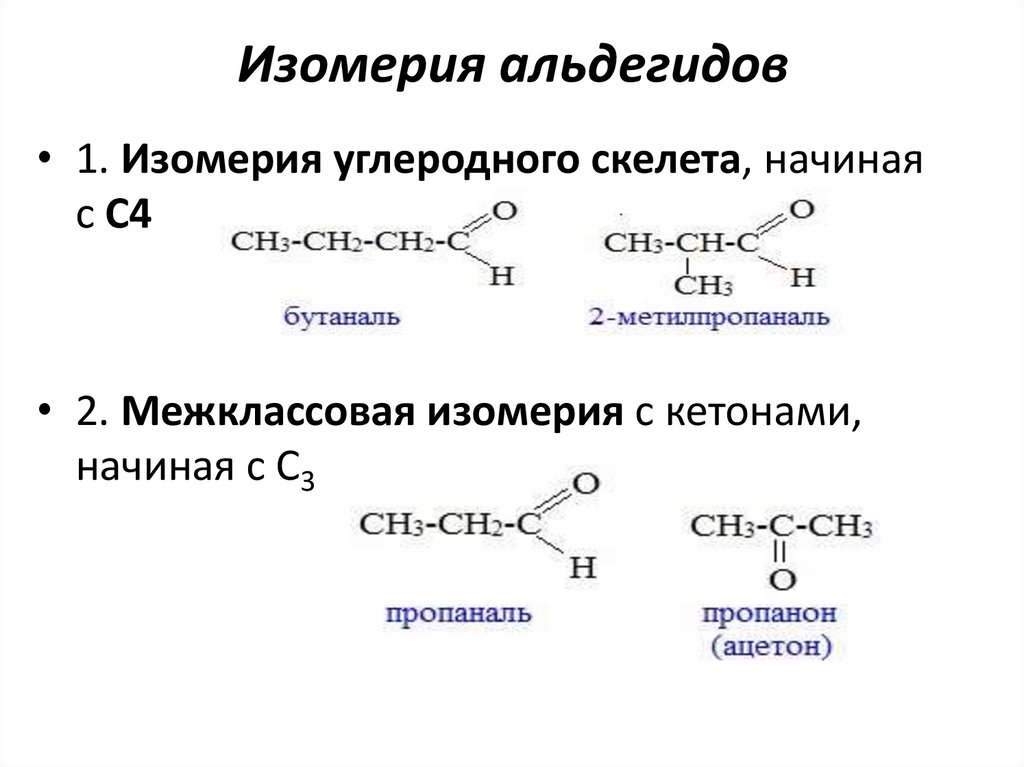
Изомерия альдегидов• 1. Изомерия углеродного скелета, начиная
с С4
• 2. Межклассовая изомерия с кетонами,
начиная с С3
28.
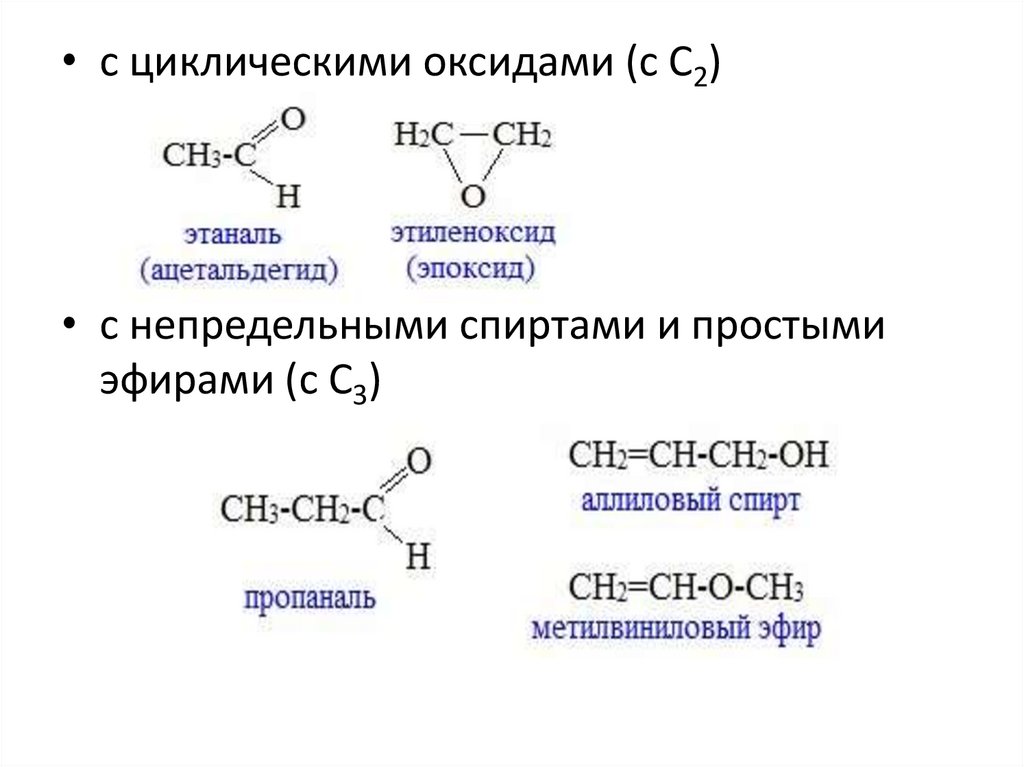
• с циклическими оксидами (с С2)• с непредельными спиртами и простыми
эфирами (с С3)
29.
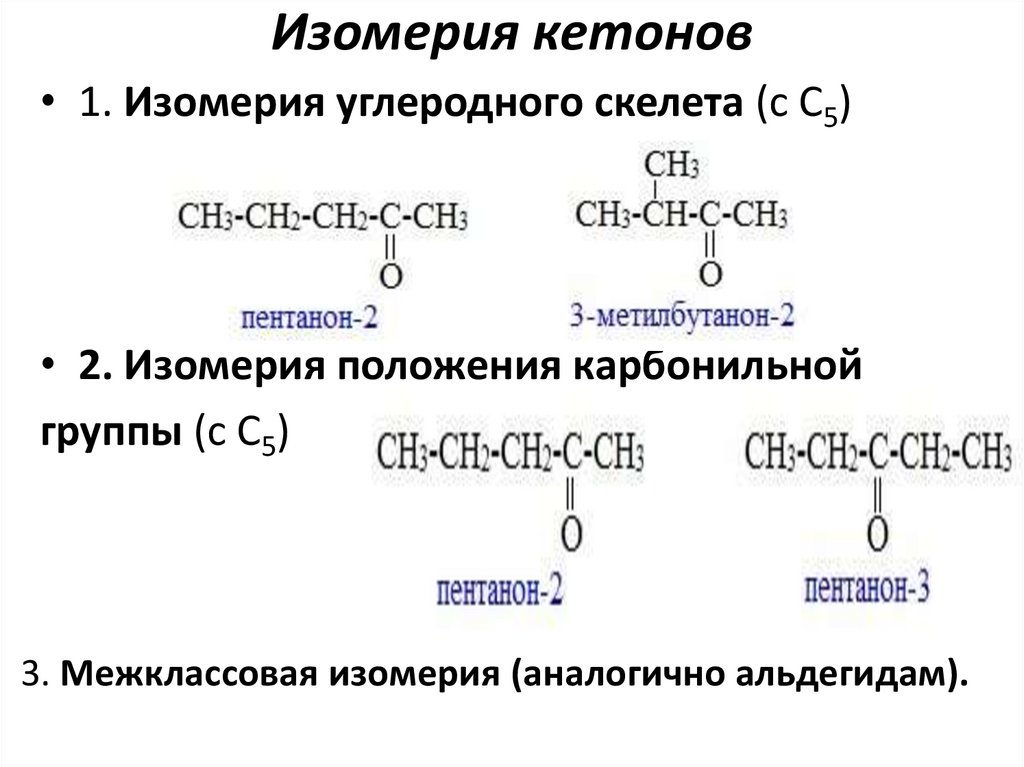
Изомерия кетонов• 1. Изомерия углеродного скелета (c C5)
• 2. Изомерия положения карбонильной
группы (c C5)
3. Межклассовая изомерия (аналогично альдегидам).
30.
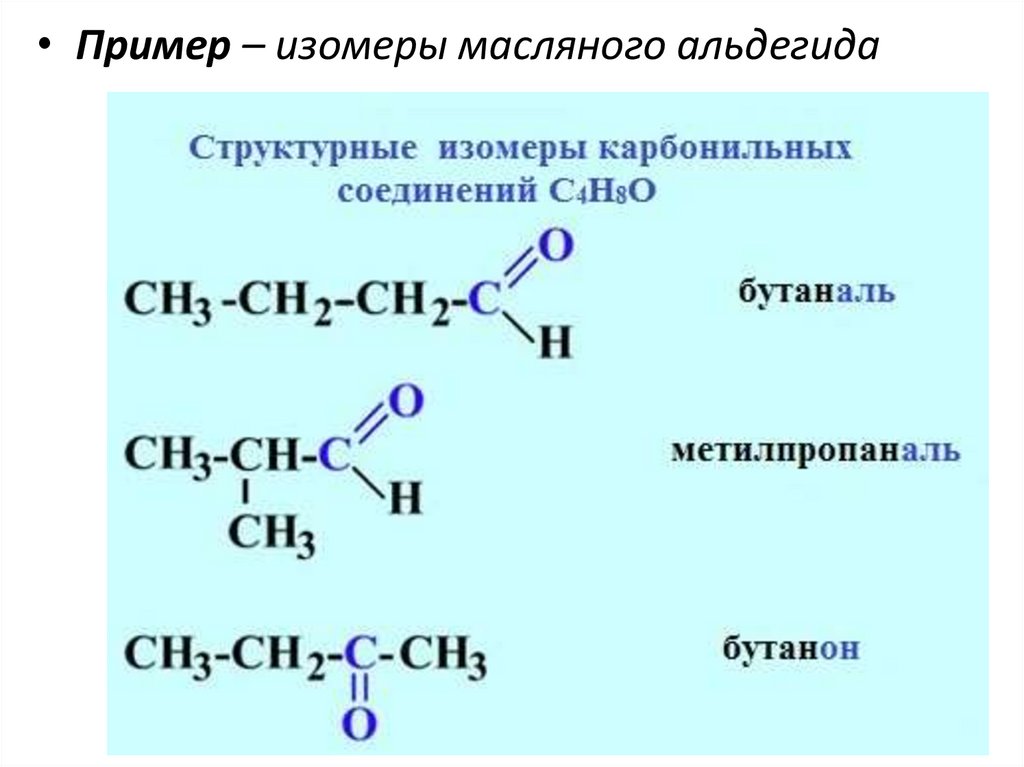
• Пример – изомеры масляного альдегида31.
32.
Строение карбонильной группы C=O• Атомы углерода и кислорода в карбонильной группе
находятся в состоянии sp2-гибридизации. Углерод своими
sp2-гибридными орбиталями образует три σ-связи (одна
из них — связь С–О), которые располагаются в одной
плоскости под углом около 120° друг к другу
Одна из трех sp2-орбиталей
кислорода участвует в σ-связи С–О,
две другие содержат неподеленные
электронные пары.
33.
• π-Связь С-О, образованная перекрываниемнегибридизированной р-орбитали атома углерода и рорбитали атома кислорода, располагается
перпендикулярно этой плоскости и легко смещается к
более электроотрицательному атому кислорода.
Атом углерода в карбонильной группе связан с
атомом кислорода двойной связью С=О (одна σ-связь
и одна π-связь).
34.
• Связь С=О сильно поляризована. Электроны кратной связи С=О,особенно более подвижные π-электроны, смещены к более
электроотрицательному атому кислорода, что приводит к
появлению на нем частичного отрицательного заряда δ—
Карбонильный углерод приобретает при этом частичный
положительный заряд (δ +).
Таким образом,
группа >C=O сильно поляризована, что
обусловливает большую реакционную
способность органических соединений,
содержащих карбонильную группу.
Углерод подвергается атаке нуклеофильными реагентами, а
кислород электрофильными, в том числе Н+. Важнейшими
реакциями альдегидов являются реакции нуклеофильного
присоединения по двойной связи карбонильной группы.
Альдегиды, как правило, более реакционноспособны, чем
кетоны.
35.
Физические свойства альдегидовС1
– газ с резким запахом
С2 – С3 – жидкости с резким запахом
С4 – С6 – жидкости с неприятным запахом
>С6 – высшие (особенно непредельные или ароматические) –
твердые, нерастворимые в воде с цветочным запахом
НСОН - формальдегид – газ с резким удушливым
запахом, хорошо растворимый в воде, t кип. - 19,3С,
ядовит. 40% раствор формальдегида называется
формалином
СН3СОН – уксусный альдегид – жидкость с запахом
зелёного яблока, растворимая в воде t кип. 21С
у этих альдегидов температуры кипения ниже, чем у соответствующих
спиртов
36.
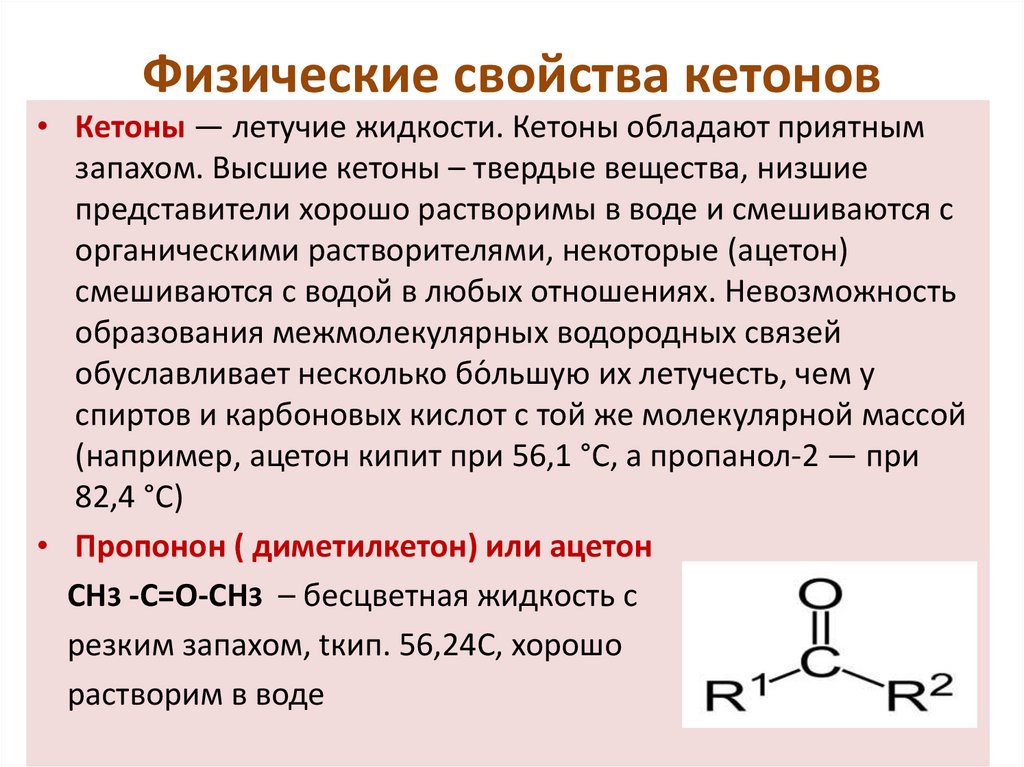
Физические свойства кетонов• Кетоны — летучие жидкости. Кетоны обладают приятным
запахом. Высшие кетоны – твердые вещества, низшие
представители хорошо растворимы в воде и смешиваются с
органическими растворителями, некоторые (ацетон)
смешиваются с водой в любых отношениях. Невозможность
образования межмолекулярных водородных связей
обуславливает несколько бо́ льшую их летучесть, чем у
спиртов и карбоновых кислот с той же молекулярной массой
(например, ацетон кипит при 56,1 °C, а пропанол-2 — при
82,4 °C)
• Пропонон ( диметилкетон) или ацетон
СН3 -С=О-СН3 – бесцветная жидкость с
резким запахом, tкип. 56,24С, хорошо
растворим в воде
37.
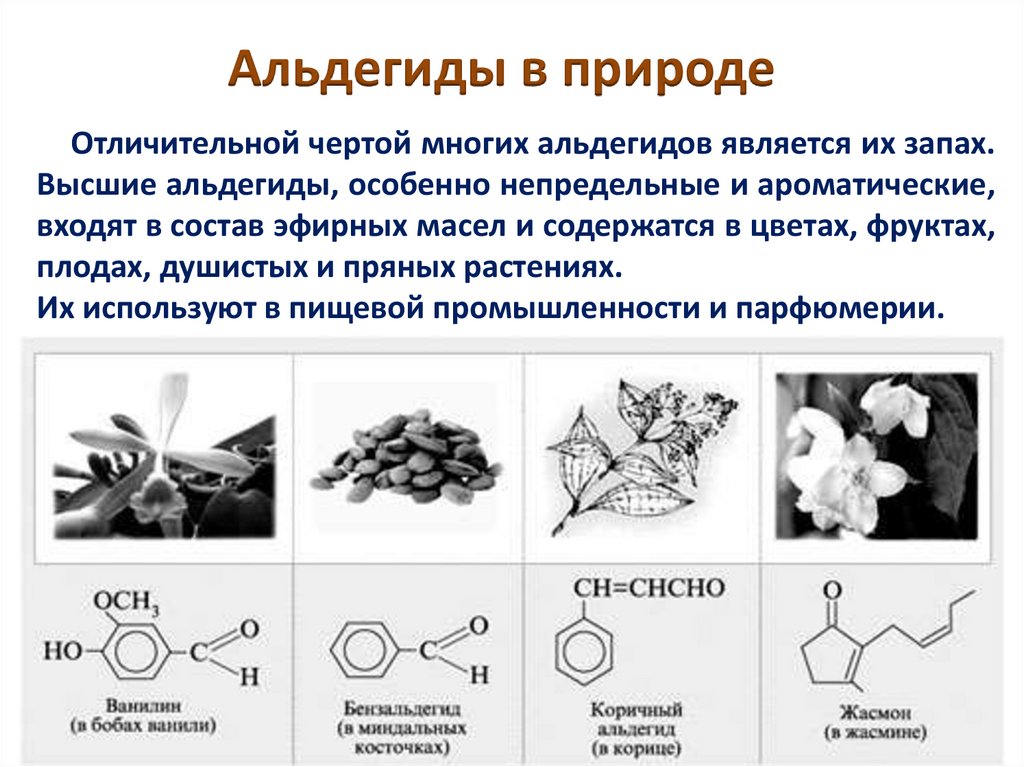
Альдегиды в природеОтличительной чертой многих альдегидов является их запах.
Высшие альдегиды, особенно непредельные и ароматические,
входят в состав эфирных масел и содержатся в цветах, фруктах,
плодах, душистых и пряных растениях.
Их используют в пищевой промышленности и парфюмерии.
38.
Альдегиды в природеВанилин
В
плодах
ванили
содержится ароматический
альдегид, который придает
им характерный запах.
Ванилин применяется в
парфюмерии, кондитерской
промышленности,
для
маскирования
запахов
некоторых продуктов
39.
Альдегиды в природеЦитраль
Запах цитрусовых обусловлен данным
диеновым альдегидом. Его применяют в
качестве отдушки средств бытовой химии,
косметических и парфюмерных веществ
40.
Альдегиды в природеКоричный альдегид
Коричный альдегид содержится в масле корицы,
его получают перегонкой коры дерева корицы .
Применяется в кулинарии в виде палочек или
порошка
41.
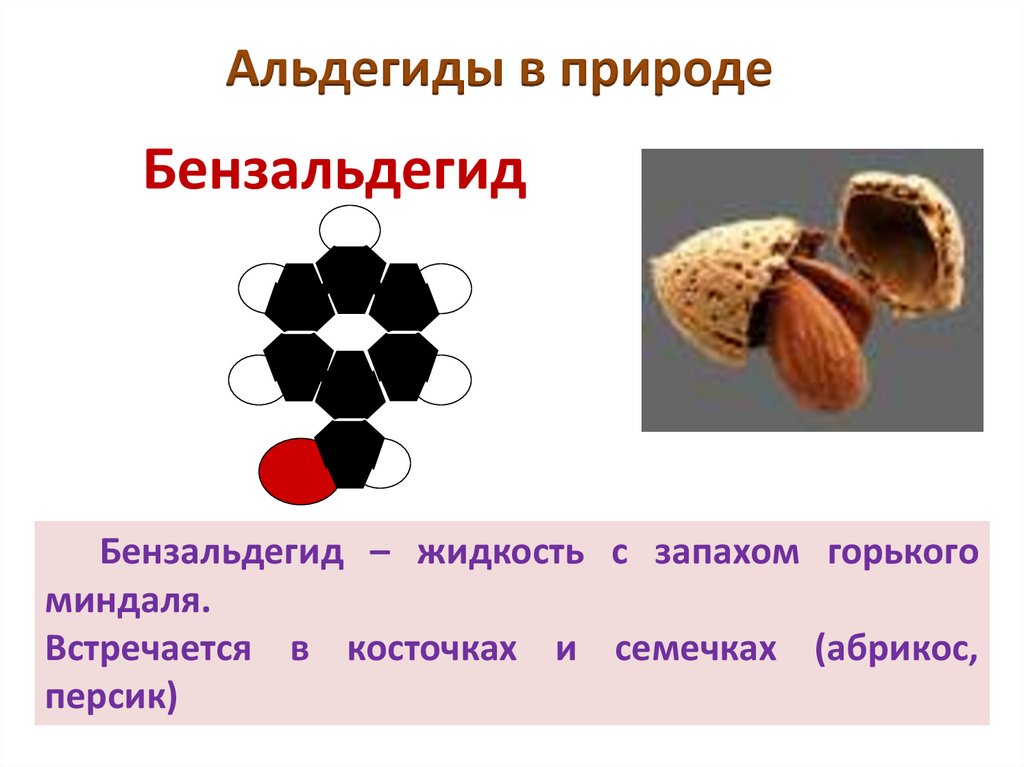
Альдегиды в природеБензальдегид
Бензальдегид – жидкость с запахом горького
миндаля.
Встречается в косточках и семечках (абрикос,
персик)
42.
Альдегиды в природеФенилэтаналь
Фенилэтаналь по сравнению с
бензальдегидом лучше соответствует
рецептору цветочного запаха.
Фенилэтаналь пахнет гиацинтом.
43.
Кетоны в природеn-Гидроксифенилбутанон-2
Этот кетон обуславливает в основном запах спелых ягод
малины.
Его включают в состав синтетических душистых
композиций
44.
Химическиесвойства
45.
• Химические свойства альдегидов и кетонов определяютсятем, что в состав их молекул входит карбонильная группа с
полярной двойной связью >C=O.
• 1. Высокая полярность связи С=О вызывает на карбонильном
атоме углерода значительный дефицит электронной
плотности (Cδ+), и по этому атому углерода возможна
нуклеофильная атака. При этом, взаимодействие с
нуклеофилами приводит к разрыву π-связи и образованию
более прочной σ-связи.
• 2. Высокая полярность связи С=О вызывает на атоме
углерода, соседнем с карбонильной группой (α-углеродном
атоме), повышенную полярность связи С-Н α-углеродного
атома. Это характеризует данные соединения как СНкислоты.
46.
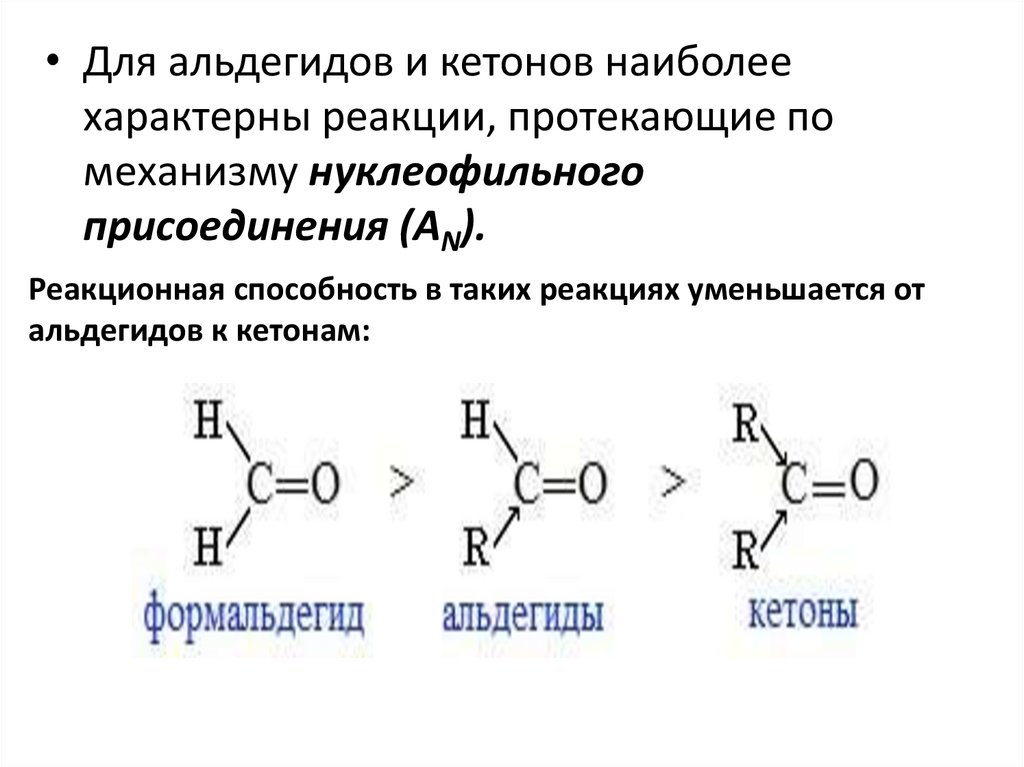
• Для альдегидов и кетонов наиболеехарактерны реакции, протекающие по
механизму нуклеофильного
присоединения (AN).
Реакционная способность в таких реакциях уменьшается от
альдегидов к кетонам:
47.
• При сравнении реакционной способностиальдегидов и кетонов необходимо учесть 2
фактора: электронный и пространственный
• Альдегиды более реакционноспособны, чем
кетоны. Кетоны реагируют обычно в более
жестких условиях, чем альдегиды, а в
некоторые реакции даже и не вступают.
• Электронный фактор связан с величиной
положительного заряда на карбонильном
атоме углерода и влиянием на него
электронодонорных эффектов
заместителей R и R'.
48.
• В молекулах кетонов на карбонильный атомуглерода действуют индуктивные эффекты
двух углеводородных радикалов R и R', а в
молекулах альдегидов одного радикала R,
поэтому в случае кетонов
величина положительного заряда на этом
атоме меньше.
взаимодействие кетонов с нуклеофилами
протекает труднее
49.
• Пространственный фактор связан с доступностьюреакционного центра (Cδ+) для нуклеофильной
атаки, а это зависит от размеров
заместителей R и R'.
• В молекулах альдегидов (содержат один
радикал R) карбонильный атом углерода
оказывается более доступен по сравнению с
кетонами, поэтому нуклеофильные реакции для
альдегидов протекают легче, чем для кетонов.
50.
• Реакционная способность карбонильных соединенийопределяется величиной частичного
положительного заряда δ+ на атоме углерода в
карбонильной группе. Чем этот заряд больше, тем
выше химическая активность карбонильного
соединения.
• Углеводородные радикалы у группы С=О увеличивают
пространственные препятствия присоединению к
карбонильному атому углерода новых атомов или
атомных групп.
• Углеводородные радикалы за счет +I-эффекта
уменьшают положительный заряд на атоме углерода
карбонильной группы, что затрудняет присоединение
нуклеофильного реагента.
51.
Для карбонильных соединений характерныреакции:
• присоединение по карбонильной группе;
• реакции замещения у α-углеродного атома;
• полимеризация;
• поликонденсация;
• окисление.
52.
Реакции присоединения• Присоединение большинства реагентов по
двойной связи С=О происходит как ионная
реакция по механизму нуклеофильного
присоединения AN.
53.
1. Гидрирование (восстановление)• Гидрирование альдегидов приводит к
образованию первичных спиртов,
гидрирование кетонов – ко вторичным.
54.
55.
• В лабораторных условиях длявосстановления альдегидов и кетонов
используется алюмогидрид лития
(тетрагидроалюминат лития) LiAlH4:
56.
2. Присоединение циановодородной(синильной) кислоты НСN
• Альдегиды и кетоны, взаимодействуя с синильной
кислотой, образуют циангидрины – органические
соединения, молекулы которых содержат две
функциональные группы: цианогруппу
и гидроксильную –ОН.
57.
• Образовавшееся соединение содержит на одинатом углерода больше, чем исходный альдегид
или кетон, поэтому подобные реакции
используют для удлинения углеродной цепи. А
также для получения α-гидроксикислот R-CH
(COOH) OH:
58.
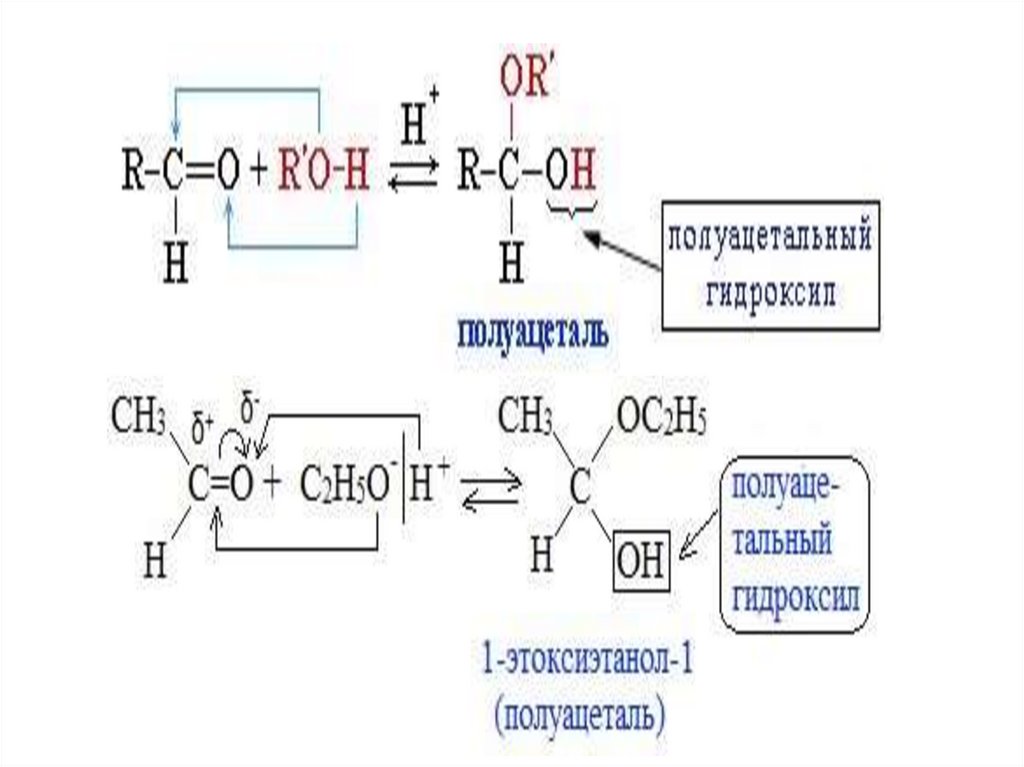
3. Взаимодействие со спиртами (в присутствии кислоты илиоснования как катализатора)
• Альдегиды могут взаимодействовать с одной или двумя
молекулами спирта, образуя соответственно полуацетали
или ацетали
• Полуацетали — соединения, содержащие при одном
атоме углерода гидроксильную и алкоксильную (ОR)
группы.
• Ацетали – это соединения, содержащие при одном атоме
углерода две алкоксильные группы.
59.
60.
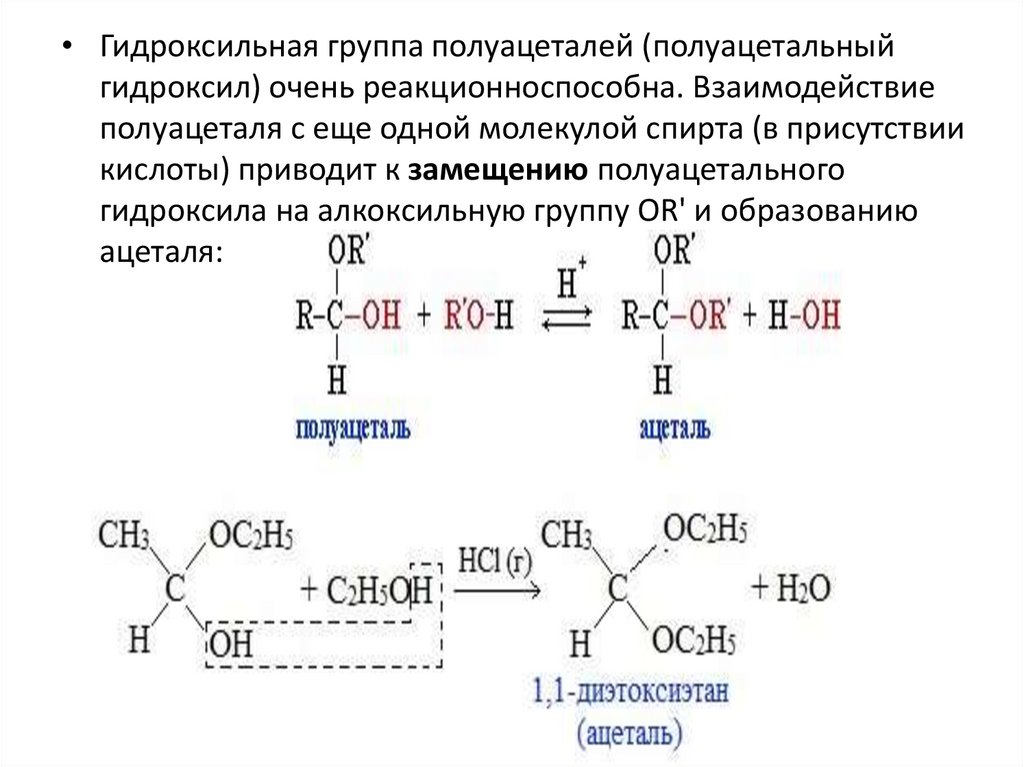
• Гидроксильная группа полуацеталей (полуацетальныйгидроксил) очень реакционноспособна. Взаимодействие
полуацеталя с еще одной молекулой спирта (в присутствии
кислоты) приводит к замещению полуацетального
гидроксила на алкоксильную группу OR' и образованию
ацеталя:
61.
4. Гидратация (присоединение воды)• Альдегиды в водных растворах существуют в виде
гидратных форм, образующихся в результате
присоединения воды к карбонильной группе:
Эта реакция возможна только для формальдегида и
уксусного альдегида
Кетоны не реагируют с водой
62.
5. Присоединение реактива Гриньяра —образование спиртов
• При добавлении раствора галогеналкана в диэтиловом
эфире к магниевой стружке легко происходит
экзотермическая реакция, магний переходит в раствор и
образуется реактив Гриньяра.
63.
• а) Взаимодействием реактива Гриньяра сформальдегидом можно получить первичный
спирт (кроме метанола). Для этого продукт
присоединения реактива Гриньяра гидролизуют с водой:
б) При использовании любых других алифатических
альдегидов могут быть получены вторичные спирты:
64.
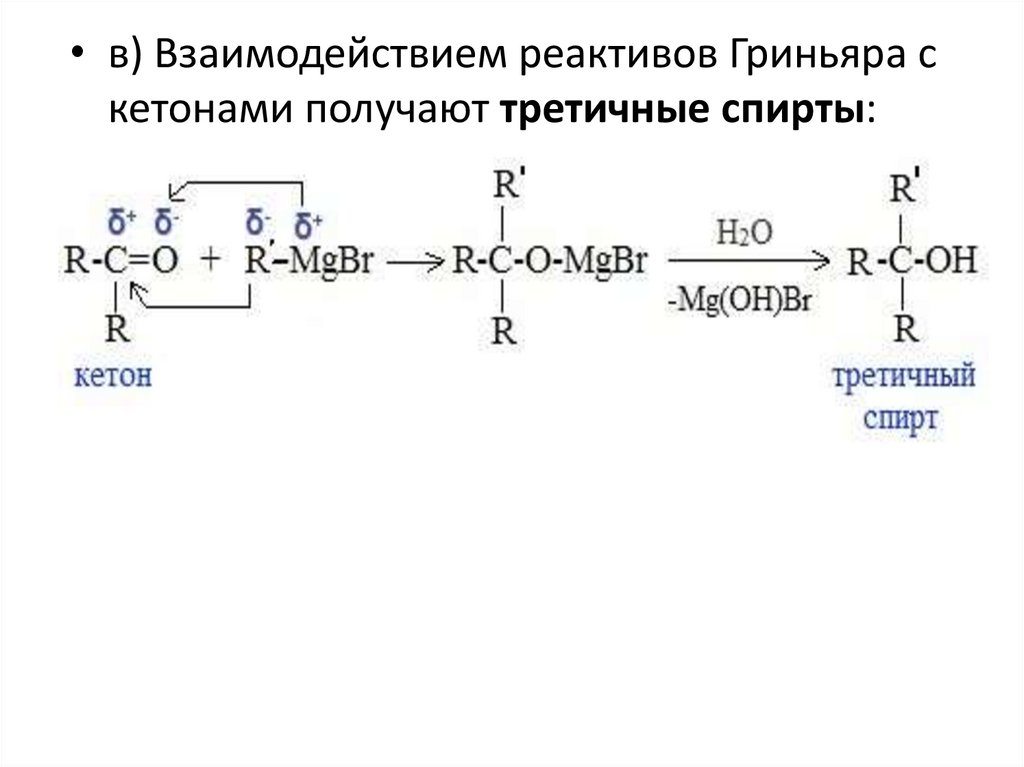
• в) Взаимодействием реактивов Гриньяра скетонами получают третичные спирты:
65.
6. Присоединение гидросульфита натрия NaHSO3 собразованием гидросульфитных производных альдегидов
• Качественная реакция на альдегидную группу!
Альдегиды при встряхивании с концентрированным раствором
гидросульфита натрия образуют кристаллические соединения:
С помощью этой реакции выделяют альдегиды из смесей с
другими веществами и для получения их в чистом виде
66.
7. Взаимодействие с аммиаком67.
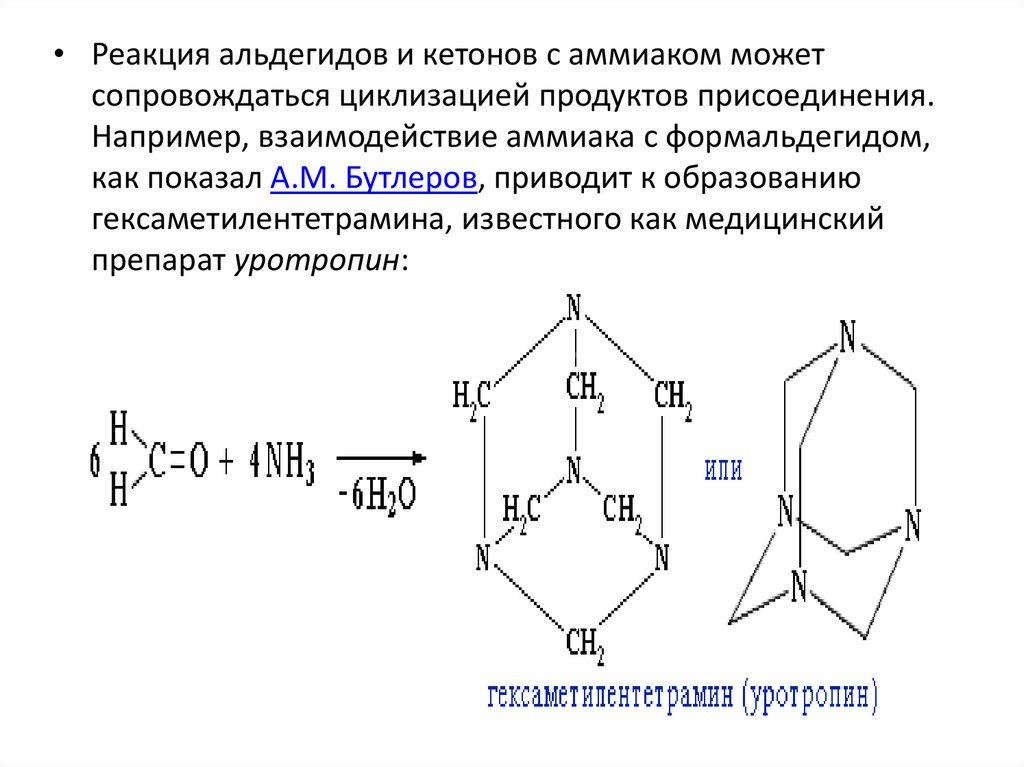
• Реакция альдегидов и кетонов с аммиаком можетсопровождаться циклизацией продуктов присоединения.
Например, взаимодействие аммиака с формальдегидом,
как показал А.М. Бутлеров, приводит к образованию
гексаметилентетрамина, известного как медицинский
препарат уротропин:
68.
Нитрование гексаметилентетрамина приводит кобразованию сильного взрывчатого вещества "гексоген":
69.
II. Реакции окисления:по связи С-Н
• [О] - KMnO4, K2Cr2O7, Cu(OH)2,
• оксиды и гидроксиды меди и
серебра (мягкие окислители)
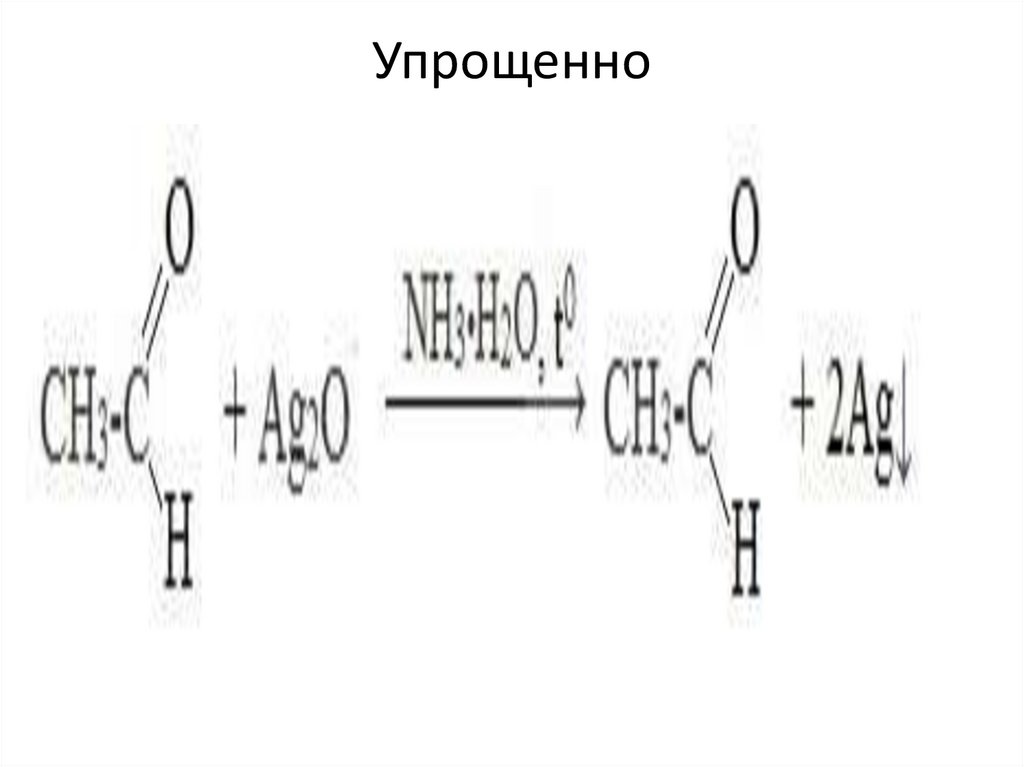
70.
1. Реакция «серебряного зеркала» - окислениеаммиачным раствором оксида серебра (реактив
Толленса)
• Качественная реакция на альдегидную группу!
71.
Упрощенно72.
2. Окисление гидроксидом меди (II)• Качественная реакция на альдегидную группу!
Для реакции используют свежеприготовленный Cu (ОН)2,
образующийся при взаимодействии растворимой соли меди
(II) со щелочью.
Голубая суспензия гидроксида меди (II) при нагревании с
альдегидом приобретает окраску оранжево-красного осадка
оксида меди (I):
73.
3. Реакция на альдегиды с фуксиносернистойкислотой (реактив Шиффа)
• Качественная реакция на альдегидную группу!
Кетоны не вступают в эту реакцию!!!!!!!
• Краситель красного цвета — фуксин, при
насыщении его раствора газообразным
сернистым ангидридом (SO2) образует
бесцветный раствор фуксиносернистой кислоты.
Этот реактив при взаимодействии с альдегидами
дает красно-фиолетовое окрашивание, что
является качественной реакцией на альдегидную
группу.
74.
75.
4. Окисление перманганатом калия• Альдегиды можно окислить подкисленным
раствором перманганат калия КMnO4 при
нагревании
76.
5. Горение (полное окисление)77.
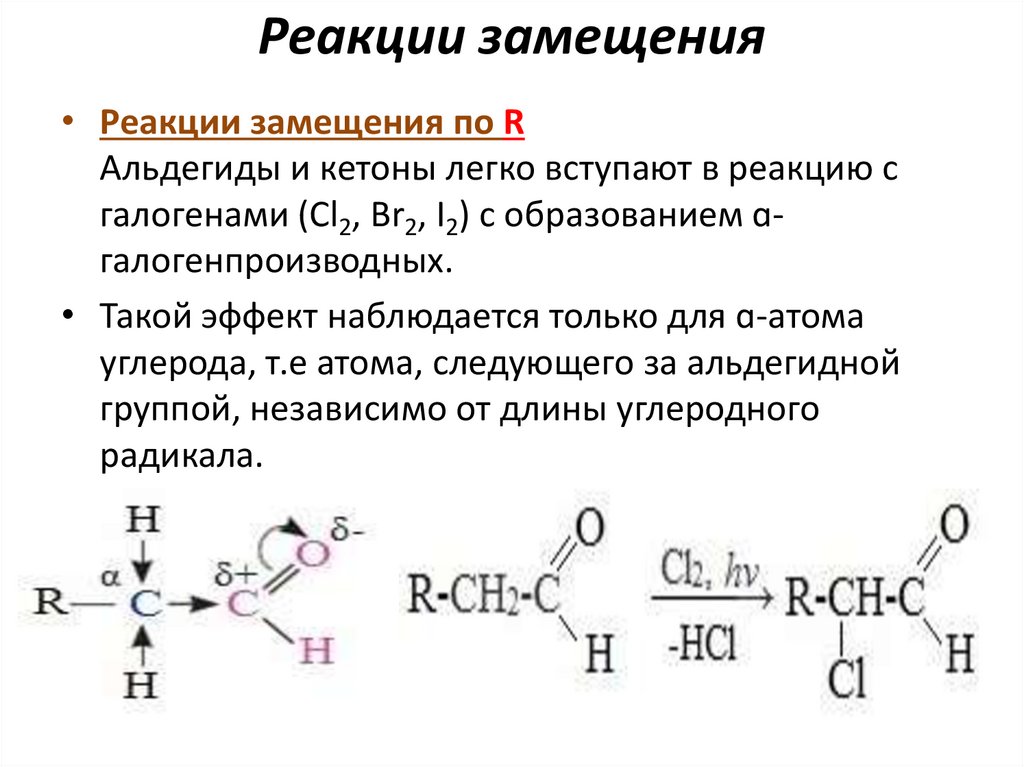
Реакции замещения• Реакции замещения по R
Альдегиды и кетоны легко вступают в реакцию с
галогенами (Cl2, Br2, I2) с образованием ɑгалогенпроизводных.
• Такой эффект наблюдается только для ɑ-атома
углерода, т.е атома, следующего за альдегидной
группой, независимо от длины углеродного
радикала.
78.
• Галогенопроизводные альдегидов и кетоновпроявляют слезоточивое действие и
называются лакриматорами.
• При избытке галогена замещению
подвергаются все атомы водорода при ɑуглеродном атоме:
Хлораль обладает снотворным действием. На основе хлораля
получают средства борьбы с насекомыми (инсектициды), в том
числе хлорофос, а также различные гербициды.
При растворении хлораля в воде образуется хлоралгидрат
ССl3CH (OH)2.
79.
2. Галоформная реакция (иодоформная реакция, или пробаЛюголя)
• Качественная реакция на метилкетоны и ацетальдегид!
• Иодоформная реакция – обработка карбонильного
соединения избытком иода в присутствии щелочи.
Выпадение желтого осадка иодоформа указывает на
наличие в исходном соединении метильной группы,
связанной с карбонилом:
Иодоформ широко используется как антисептик в медицине
и ветеринарии.
80.
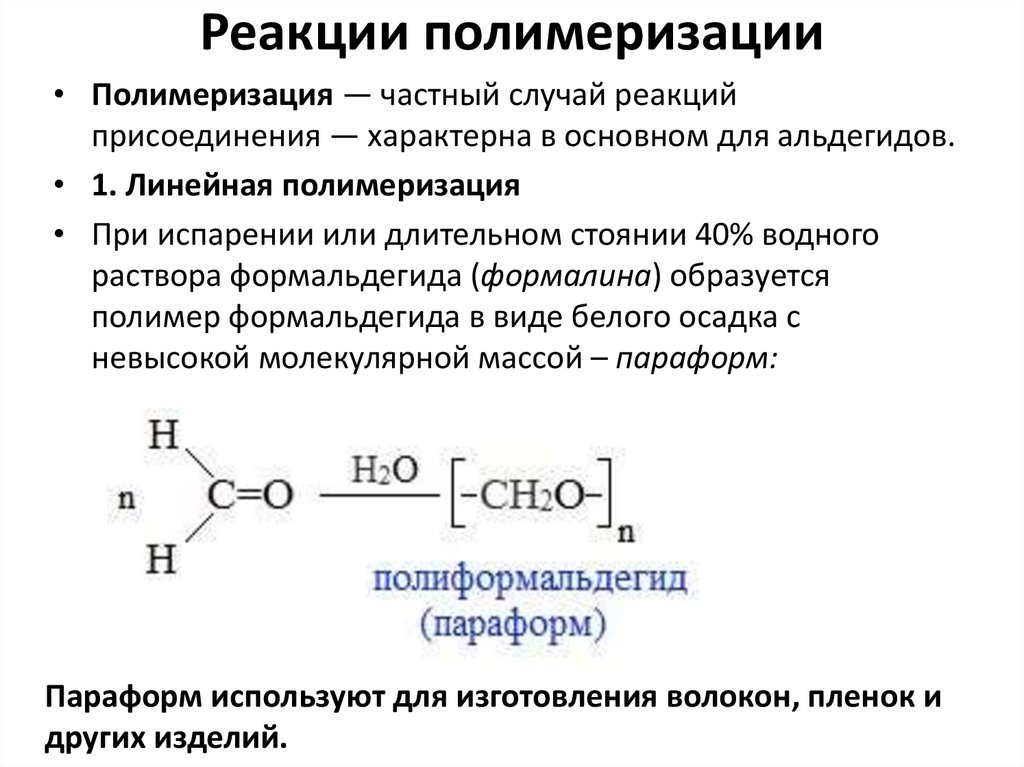
Реакции полимеризации• Полимеризация — частный случай реакций
присоединения — характерна в основном для альдегидов.
• 1. Линейная полимеризация
• При испарении или длительном стоянии 40% водного
раствора формальдегида (формалина) образуется
полимер формальдегида в виде белого осадка с
невысокой молекулярной массой – параформ:
Параформ используют для изготовления волокон, пленок и
других изделий.
81.
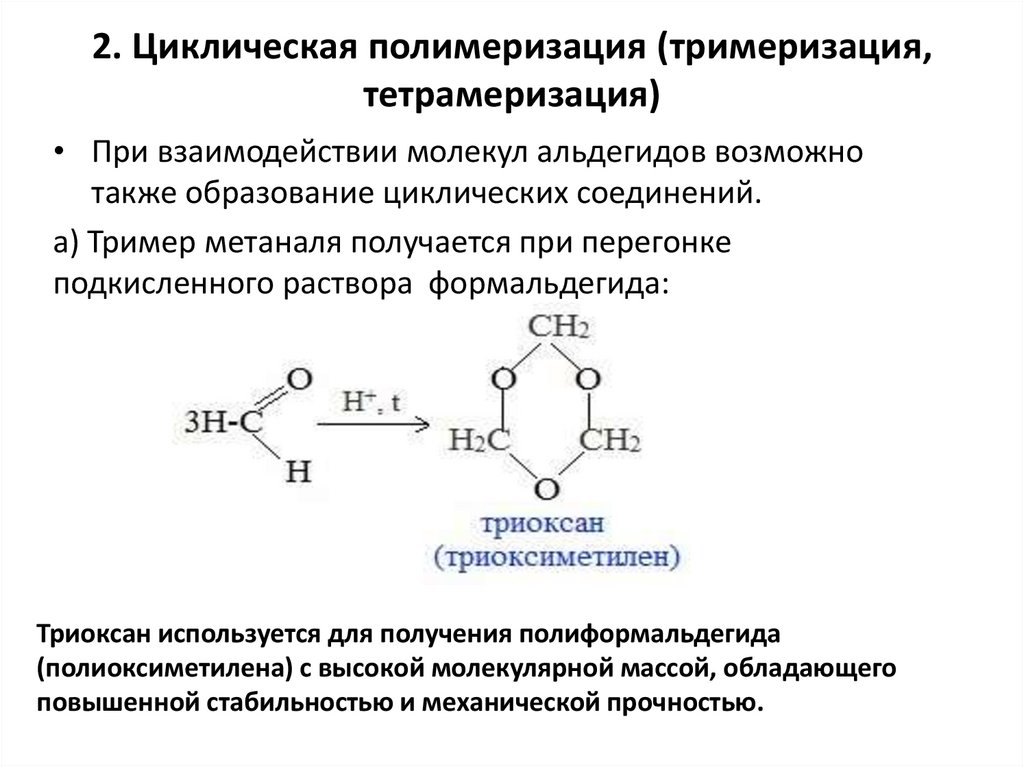
2. Циклическая полимеризация (тримеризация,тетрамеризация)
• При взаимодействии молекул альдегидов возможно
также образование циклических соединений.
а) Тример метаналя получается при перегонке
подкисленного раствора формальдегида:
Триоксан используется для получения полиформальдегида
(полиоксиметилена) с высокой молекулярной массой, обладающего
повышенной стабильностью и механической прочностью.
82.
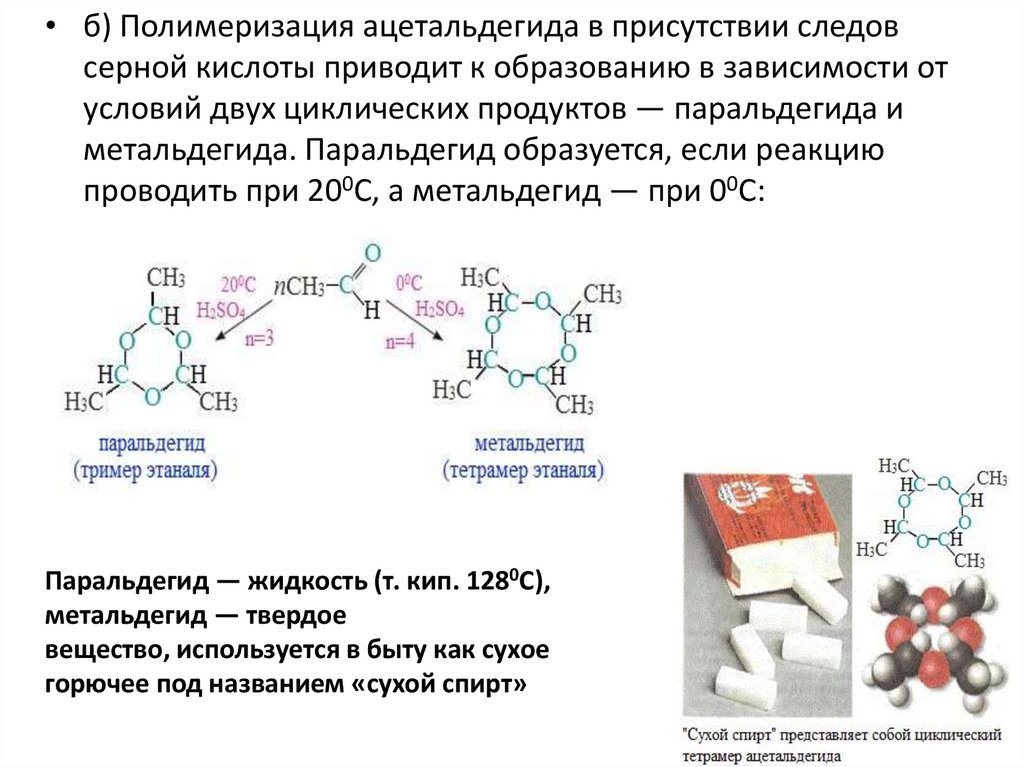
• б) Полимеризация ацетальдегида в присутствии следовсерной кислоты приводит к образованию в зависимости от
условий двух циклических продуктов — паральдегида и
метальдегида. Паральдегид образуется, если реакцию
проводить при 200С, а метальдегид — при 00С:
Паральдегид — жидкость (т. кип. 1280С),
метальдегид — твердое
вещество, используется в быту как сухое
горючее под названием «сухой спирт»
83.
Реакции поликонденсации• Конденсацией называется реакция, приводящая к
усложнению углеродного скелета и возникновению
новой углеродной связи, причем из двух или более
относительно простых молекул образуется новая,
более сложная молекула. Обычно в результате реакции
конденсации выделяется молекула воды или другого
вещества.
• Конденсация, приводящая к образованию
высокомолекулярных соединений, называется реакцией
поликонденсации.
84.
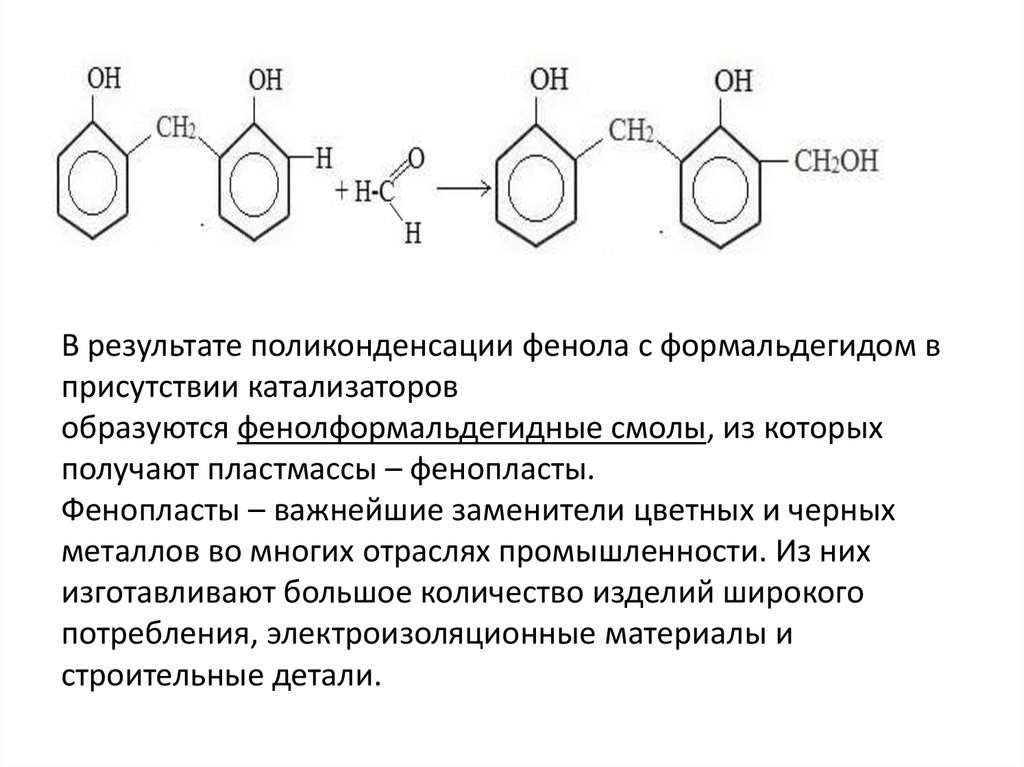
1. Конденсация с фенолами• Практическое значение имеет реакция формальдегида с
фенолом (катализаторы — кислоты или основания).
Для фенола эта реакция
электрофильного замещения
(SE), а для формальдегида –
нуклеофильного
присоединения (АN).
85.
В результате поликонденсации фенола с формальдегидом вприсутствии катализаторов
образуются фенолформальдегидные смолы, из которых
получают пластмассы – фенопласты.
Фенопласты – важнейшие заменители цветных и черных
металлов во многих отраслях промышленности. Из них
изготавливают большое количество изделий широкого
потребления, электроизоляционные материалы и
строительные детали.
86.
• 2. Конденсация альдегидов с карбамидом(мочевиной) (NH2)2C=O получение карбамидных (мочевиноформальдегидных) смол
87.
4. Альдольно-кротоновая конденсация• При альдольной конденсации происходит присоединение
одной молекулы карбонильного соединения к другой
молекуле, образуется альдегидоспирт (альдоль) или
кетоноспирт (кетол).
Например, уксусный альдегид на холоду при действии
разбавленных растворов щелочей превращается в альдоль:
Альдольная конденсация широко используется в промышленности для
получения синтетических каучуков, смол, лаков и различных душистых
веществ.
88.
• При кротоновой конденсации образуется молекуланепредельного альдегида или кетона. Химическая
реакция сопровождается выделением молекулы воды.
• Реакция проводится в более жестких условиях (при
нагревании или в присутствии кислоты) альдоль
дегидратируется с образованием кротонового альдегида:
Легкое отщепление воды от альдоля объясняется подвижностью водородного
атома в α-звене, на которое действует – I-эффекты двух групп (ОН и С=О).
Соединения, содержащие третичный углеродный атом возле карбонильной
группы не вступают в реакцию альдольной конденсации.
89.
Реакции диспропорционирования• Реакция Канниццаро
• Альдегиды, не содержащие атом водорода у αуглеродного атома, в щелочной среде способны
вступать в окислительно-восстановительную
реакцию (диспропорционирования):
90.
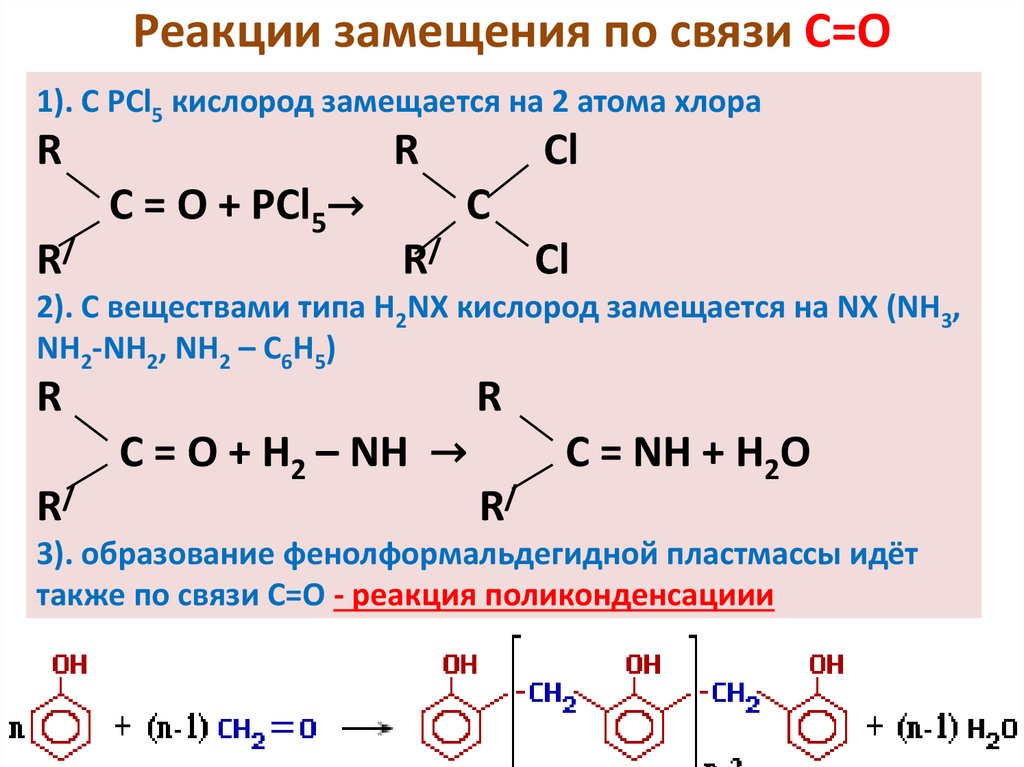
Реакции замещения по связи С=О1). С РСl5 кислород замещается на 2 атома хлора
R
R/
R
C = O + РСl5→
Cl
C
R/
Cl
2). С веществами типа Н2NХ кислород замещается на NX (NH3,
NH2-NH2, NH2 – C6H5)
R
R/
R
C = O + H2 – NH →
R/
C = NH + H2O
3). образование фенолформальдегидной пластмассы идёт
также по связи С=О - реакция поликонденсациии
91.
Получение альдегидов и кетонов• 1. Окисление спиртов
В лаборатории карбонильные соединения получают
окислением спиртов в жестких условиях в присутствии
сильных окислителей (дихромата калия К2Cr2O7 или
перманганата калия КМnО4) в серной кислоте Н2SO4. В
качестве окислителя можно использовать оксид меди (II) при
нагревании.
• При окислении первичных спиртов образуются
альдегиды:
92.
• Первичные спирты при окисленииобразуют альдегиды, которые затем легко
окисляются до карбоновых кислот:
При окислении вторичных спиртов образуются кетоны:
93.
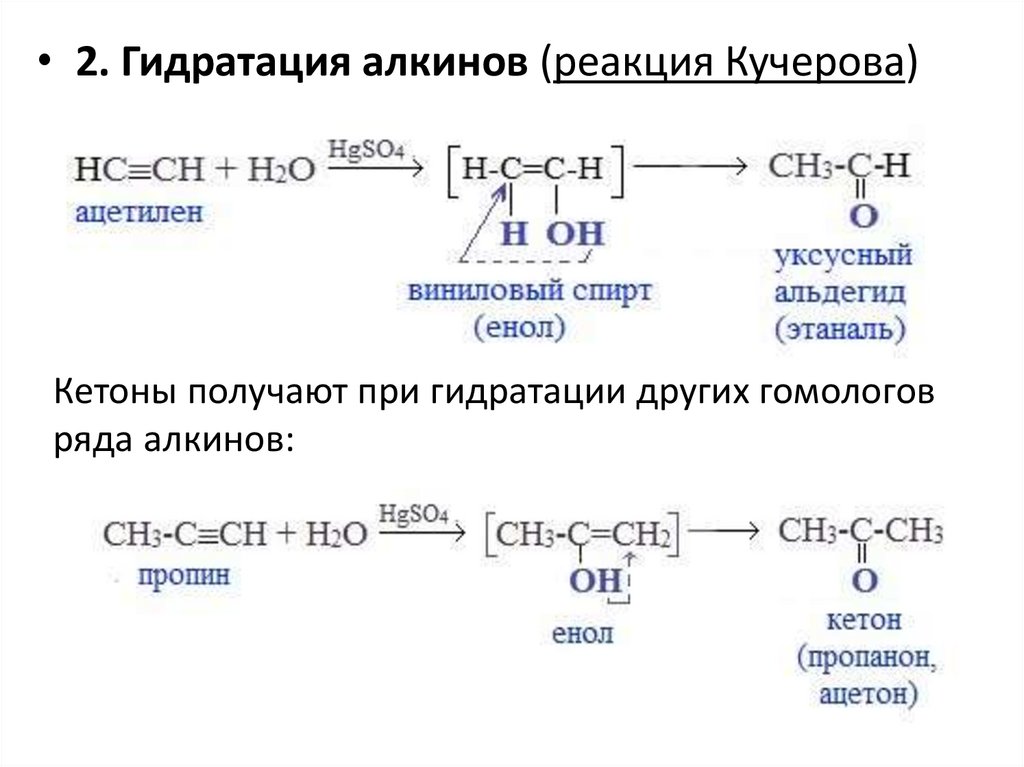
• 2. Гидратация алкинов (реакция Кучерова)Кетоны получают при гидратации других гомологов
ряда алкинов:
94.
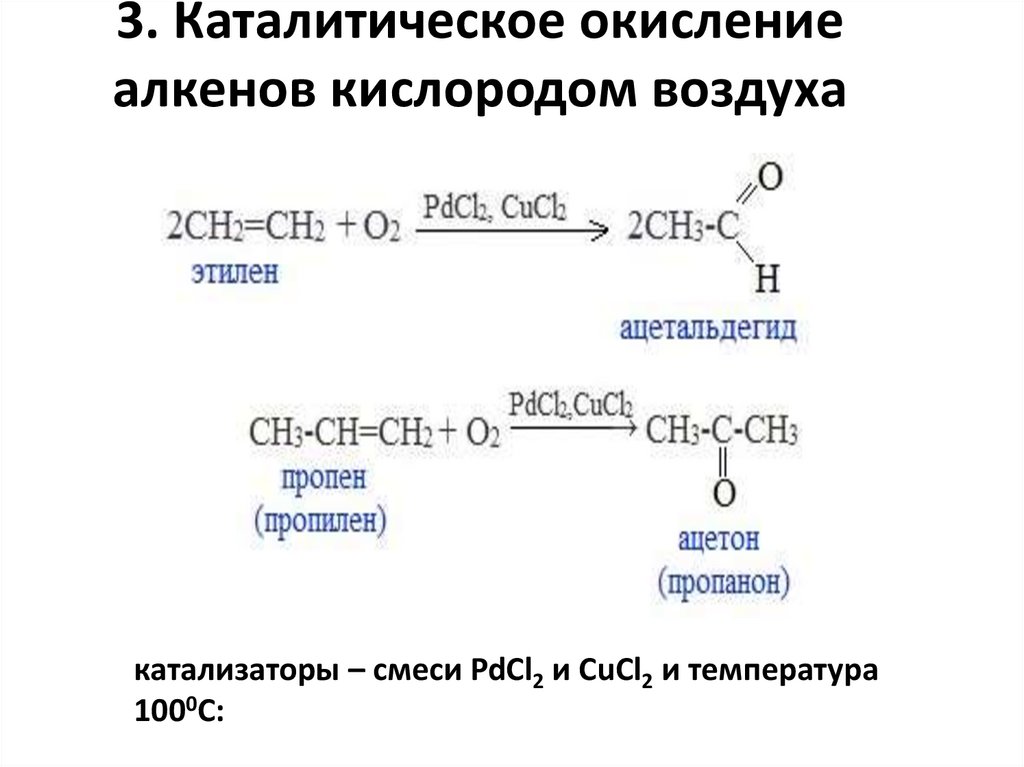
3. Каталитическое окислениеалкенов кислородом воздуха
катализаторы – смеси PdCl2 и CuCl2 и температура
1000С:
95.
4. Каталитическое дегидрирование спиртов• В промышленности альдегиды и кетоны получают
дегидрированием спиртов, пропуская пары спирта
над нагретым катализатором (Cu, соединения Ag,
Cr или Zn).
96.
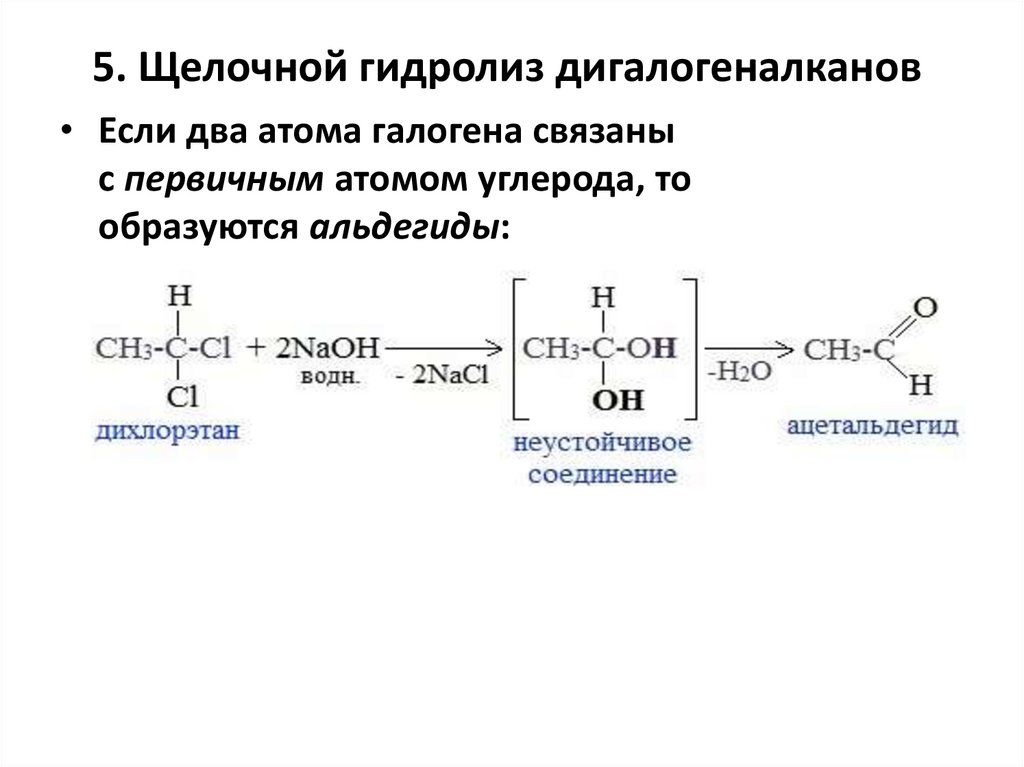
5. Щелочной гидролиз дигалогеналканов• Если два атома галогена связаны
с первичным атомом углерода, то
образуются альдегиды:
97.
• При гидролизе дигалогеналканов, содержащих атомыгалогена у вторичного атома углерода,
образуются кетоны:
Это лабораторный способ получения карбонильных соединений
98.
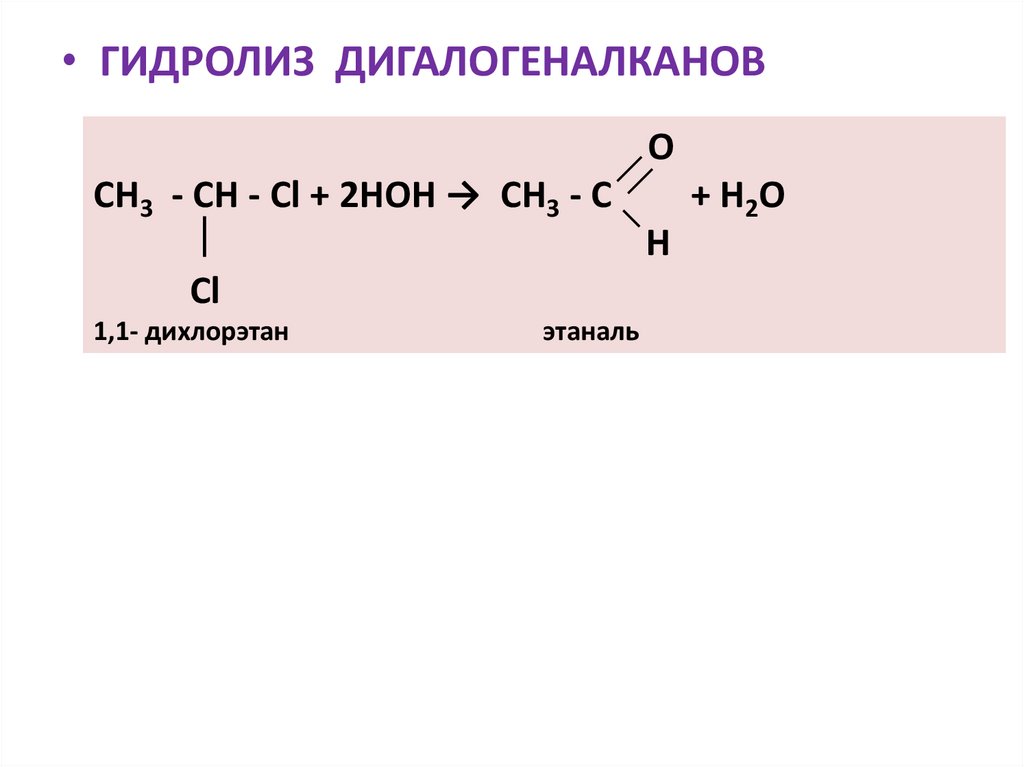
• ГИДРОЛИЗ ДИГАЛОГЕНАЛКАНОВO
СН3 - СН - Сl + 2НOH → СН3 - С
+ H2O
H
Cl
1,1- дихлорэтан
этаналь
99.
6. Пиролиз солей карбоновых кислот• При пиролизе (термическое разложение) кальциевых, бариевых
солей карбоновых кислот образуются соответствующие карбонильные
соединения. Из смешанной соли муравьиной и другой карбоновой
кислоты получают альдегиды, а в остальных случаях образуются
кетоны.
100.
Это лабораторный способ получения карбонильных соединений.101.
7. Кумольный способ получения ацетона(наряду с фенолом)
Это промышленный способ получения ацетона
102.
Получение формальдегида• 1. Окисление метана
Формальдегид в промышленности можно
получить окислением метана кислородом
воздуха при высоких температурах с
использованием катализатора:
103.
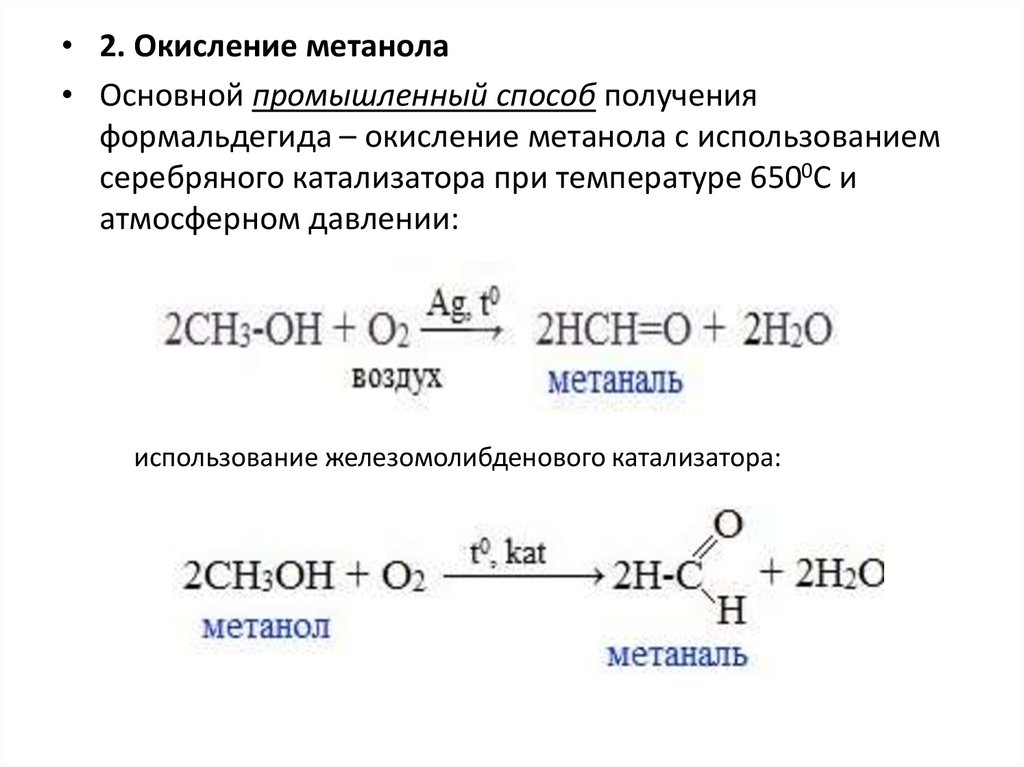
• 2. Окисление метанола• Основной промышленный способ получения
формальдегида – окисление метанола с использованием
серебряного катализатора при температуре 6500С и
атмосферном давлении:
использование железомолибденового катализатора:



































































 Химия
Химия








