Похожие презентации:
Молекулярная физика. Литература
1. Молекулярная физика
ЛитератураОсновная
1. Савельев «Курс Общей Физики», Москва, Апрель, 2002 г. т.3
2. А.А. Деталаф, В.М. В.М. Яворский «Курс Общей Физики» М., Высшая школа, 2000.
3. В.С. Волькинштейн . «Сборник задач по общему курсу физики», - С.-Петербург,
2001.
Дополнительная
1. Берклеевский Курс физики. – М., Наука, 1986.
2., Фейнмановские лекции по физике, М.: Мир, 1967.
2. Термодинамика
Молекулярная физика – раздел физики, изучающий свойствател в зависимости от характера движения и взаимодействия
частиц, образующих тело.
Термодинамика анализирует условия
соотношения превращения энергии.
и
количественные
Её первоначальная задача – изучение закономерностей
превращения тепла в работу (в тепловых машинах).
Основным
содержанием
современной
физической
термодинамики является изучение закономерностей тепловой
формы движущейся материи и связанных с ней физических
явлений.
3. Термодинамика
Совокупность тел, составляющих макроскопическую систему,называется термодинамической системой.
Система может находиться в различных состояниях. Величины,
характеризующие состояние системы называются параметрами
состояния: давление, температура, объём и так далее.
Любой параметр, имеющий определённое значение для каждого
равновесного состояния, является функцией состояния
Равновесной называется такая система, параметры состояния
которой одинаковы во всех точках системы и не изменяются
со временем (при неизменных внешних условиях).
Процесс – переход из одного равновесного состояния в другое.
Релаксация – возвращение системы в равновесное состояние
4. Термодинамика
Атомная единица массы (а.е.м.) – mед – единица массы, равная1/12 массы изотопа углерода С12.
mед = 1,66·10 27 кг
Количество
вещества, в котором содержится число молекул,
равное числу атомов в 12 г С12 (изотопа углерода) называется
молем (в 12 кг – киломолем).
Число молекул в одном моле называется числом Авагадро
NА = 6,02·1023 моль 1 = 6,02·1026 кмоль 1
Молярная масса – масса одного моля (µ)
µ = АmедNА.
При одинаковых температурах и давлениях все газы содержат в
единице объёма
одинаковое число молекул. Число молекул,
содержащихся в 1 м3 при нормальных условиях, называется числом
Лошмидта: NL = р0/kT0 = 2,68·1025 м 3.
p0 = 105 Па; Т0 =273 К; k
равная 1,38·10 23Дж/К.
Нормальные условия:
– постоянная Больцмана
5. Давление. Основное уравнение молекулярно-кинетической теории.
pdFn
dS
n – концентрация молекул в сосуде;
m0 – масса одной молекулы
в единицу времени (1/6) nυ молекул
при абсолютно-упругом ударе m0υx – ( m0υx) = 2m0υx
За время dt о стенку, площадью S успеет удариться n = Sυxdt число
молекул
1
1
Общий импульс, который получит стенка S: Fdt n 2m0 υ x υ x Sdt m0 nυ x2 Sdt.
6
3
p = dF/dS.
F 1
m0 υ x2 p,
S 3
6. Давление. Основное уравнение молекулярно-кинетической теории.
Более точно случайную величину характеризует среднеквадратичная величина.υ υ
2
кв
2
хкв
υ
2
укв
υ .
υх2кв υу2кв υz2кв .
2
zкв
2
2 m0υкв2
2
p m0 nυкв n
,
3
3
2
2 m0υкв2
2
p n
n Ek ,
3
2
3
где Ek – средняя энергия одной молекулы. Это и есть основное уравнение
молекулярно-кинетической теории газов.
Иногда за основное уравнение принимают p
= nkT.
Единицы измерения давления:
1 Па = 1 Н/м2; 1 ат. = 9,8 Н/см2 = 98066 Па 105 Па
1 мм.рт.ст. = 1 тор = 1/760 ат. = 133,3 Па
1 бар = 105 Па; 1 ат. = 0,98 бар.
7. Температура.
Чем выше температура тела тем больше кинетическая энергияего молекул!
Чтобы связать единицу энергии с градусом, Больцман ввел коэффициент
пропорциональности k который впоследствии был назван его именем:
постоянная Больцмана равная 1,38·10 23 Дж·К 1
2
m0 кв
3
kT
2
2
на одну молекулу идеального газа
m0υкв2
3
N A k TN A ,
2
2
2
υкв
2
3
RT
2
2
p nWk1 ,
3
kNA R 8,31
Дж
Дж
8,31 103
,
мольK
кмольК
R – универсальная газовая постоянная
для молярной массы и газа
3
Wk kT .
2
1
р = nkT
k
–
8. Изопроцессы идеальных газов.
Изопроцессы идеального газа – процессы, при которых один изпараметров остаётся неизменным.
Изохра
Изохорический процесс. Закон Шарля.
V = const.
Изохорическим процессом называется процесс, протекающий
при постоянном объёме.
p1 p2
T1 T2
9. Изобара
Изобарический процесс. Закон Гей – Люсака.р – const.
Изобарическим процессом называется процесс, протекающий
при постоянном давлении.
V1 V2
T1 T2
10. Изотерма
Изотермический процесс. Закон Бойля – Мариотта.T = const.
Изотермическим процессом называется процесс, протекающий
при постоянной температуре
р1V1 = р2V2.
11. Термодинамика
Адиабатическийпроцесс
–
термодинамический
происходящий без теплообмена с окружающей средой.
процесс,
Закон Авогадро. При одинаковых давлениях и одинаковых температурах,
в равных объёмах различных идеальных газов содержится одинаковое
число молекул. В одном моле различных веществ содержится NA = 6,02·1023
молекул (число Авогадро).
Закон Дальтона. Давление смеси идеальных газов равно сумме
парциальных давлений
р, входящих в неё газов р = р1 + р2 + ...
+ рn (р1 – давление, которое оказывал бы определённый газ из
смеси, если бы он занимал весь объём)
12. Объединённый газовый закон (Закон Клапейрона).
Из законов Бойля – Мариотта и Гей – Люссака можно сделатьзаключение, что для данной массы газа
p1V1 p2V2
pV
или
const.
T1
T2
T
13. Уравнение состояния идеального газа - уравнение Менделеева - Клапейрона.
Уравнение состояния идеальногогаза - уравнение Менделеева Клапейрона.
Идеальный газ - газ, молекулы которого пренебрежимо малы, по
сравнению расстояния между ними, и не взаимодействуют друг с
другом на расстоянии.
МЕНДЕЛЕЕВ объединил известные законы Бойля-Мариотта, Гей –
Люсака и Шарля с законом Авогадро.
pV
p
m
RT ,
μ
m
ρ
RT RT .
μV
μ
m RT
p1 1
;
μ1V
m – масса газа; μ – молярная масса газа; R –
универсальная газовая постоянная; V – объём газа;
m2 RT
p2
μ 2V
m1 m2
mn
pV
... RT
n
1 2
– это уравнение Менделеева – Клапейрона для смеси газов
14. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Внутренняя энергия. Работа и теплота.под внутренней энергией в термодинамике подразумевают энергию
теплового хаотического движения молекул
Тогда: внутренняя энергия U одного моля идеального газа равна
3
3
kN AT RT
2
2
механической
U N AWê
Обмен
работой
(А),
а
переданного тепла
3
RT
2
характеризуется
U
энергией
обмен
(Q).
внутренней
энергии
–
совершенной
количеством
15. Внутренняя энергия. Работа и теплота.
U=Q–АИли
Q=U+А
изменение внутренней энергии тела равно
разности сообщаемой телу теплоты и
произведённой телом работы
dQ = dU + dA.
количество теплоты, сообщаемой телу идёт на
увеличение внутренней энергии и на совершение
телом работы
Это есть первое начало термодинамики или закон
сохранения энергии в термодинамики.
2
dU U
1
2
U 1.
dU 0
Если U = 0, то согласно первому началу
термодинамики А = Q т.е. нельзя построить
периодически действующий двигатель, который
совершал бы большую работу, чем количество
сообщенной ему энергии. Иными словами вечный
двигатель первого рода невозможен. Это одна из
формулировок первого начала термодинамики.
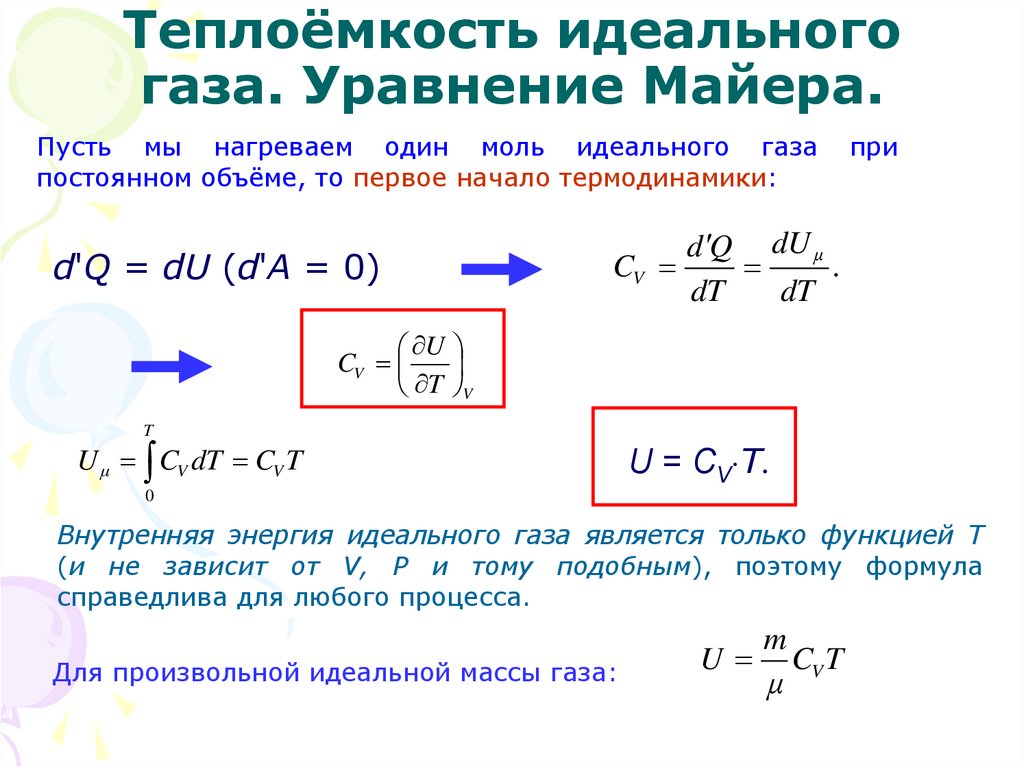
16. Теплоёмкость идеального газа. Уравнение Майера.
Теплоёмкостьтела
характеризуется
количеством
теплоты,
необходимой
для
нагревания этого тела на один градус
C
dQ
dT
Удельная теплоёмкость (Суд) – есть количество теплоты,
необходимое для нагревания единицы массы вещества на один
градус [Cуд] = Дж/К.
молярной теплоемкостью Сμ количество теплоты
необходимое для нагревания 1 кмоля газа на 1 градус
молярная масса – масса одного моля:
Μ = А mед NА
где А – атомная масса; mед атомная единица массы;
число Авогадро;
μ (моль) – количество вещества
Сμ = Суд μ
NА
17. Теплоёмкость идеального газа. Уравнение Майера.
Теплоёмкость термодинамической системы зависит от того, как изменяетсясостояние системы при нагревании.
Если газ нагревать при постоянном объёме СV, то всё подводимое тепло идёт на
нагревание газа, то есть изменение его внутренней энергии.
Если нагревать газ при постоянном давлении
(Ср) в сосуде с поршнем, то поршень поднимется на
некоторую высоту h, то есть газ совершит работу.
Следовательно проводимое тепло затрачивается и
на нагревание и на совершение работы. Ср
> CV.
18. Теплоёмкость идеального газа. Уравнение Майера.
Пусть мы нагреваем один моль идеального газапостоянном объёме, то первое начало термодинамики:
d'Q = dU (d'А = 0)
при
d Q dU μ
CV
.
dT
dT
U
CV
T V
T
U μ CV dT CV T
U = CV T.
0
Внутренняя энергия идеального газа является только функцией Т
(и не зависит от V, Р и тому подобным), поэтому формула
справедлива для любого процесса.
Для произвольной идеальной массы газа:
U
m
CV T
μ
19. Теплоёмкость идеального газа. Уравнение Майера.
При изобарическом процессе кроме увеличения внутренней энергиипроисходит совершение работы газом:
d QP = dUμ + рdVμ
из основного уравнения молекулярнокинетической теории
рVμ = RT,
при изобарическом процессе
dV
d QP dU
Cp
p
dT
dT
dT
так как
р=
СР = СV + R.
const
Это уравнение Майера для одного моля газа.
СР СV R
μ
μ μ
СРуд СVуд
R
.
μ
20. Теплоёмкости одноатомных газов
Так как энергия одной молекулы идеального газа,
3
kТ
2
то внутренняя энергия одного моля идеального газа равна
U μ NA
3
3
kT RT ,
2
2
Uμ
3
RT .
2
Внутренняя энергия произвольного количества газа:
m3
U
RT .
μ2
Её изменение:
dU
m3
RdT .
μ2
Теплоёмкости одноатомных газов СV и
dU 3
кДж
R 1,25
,
Р dT
2
кмольК
C
СV :
21. Теплоёмкости одноатомных газов
для изобарических процессов можно записать:dQP = dUμ + RdT (для одного моля).
Cp
3
R R
2
или
Cp
5
кДж
R 20,8
.
2
кмольК
R
γ 1
CV
внутренняя энергия
Учитывая:
m
pV RT
μ
CV
U
γ
С Р CV R
R
1
.
СV
CV
CV
R
.
γ 1
m
m R
CV T
T,
μ
μ γ 1
U
pV
.
γ 1
22. Уравнение адиабаты для идеального газа
P = const – изобарический процесс;V = const - изохорический процесс;
T = const – изотермический процесс.
При изотермическом процессе pV=const
(ур. изотермы).
Процесс, протекающий без обмена энергий
с внешней средой – адиабатический.
23. Уравнение адиабаты для идеального газа
Запишем первое начало термодинамики в виде:В отсутствие
m
d ' Q d CV T pdV
теплообмена с внешней
M
средой d’Q=0.
m
R
m
pV
RT .
Взяв дифференциал от
pdV CV dT .
M
M
Cv
pdV Vdp
m
RdT
M
pdV Vdp
R
m
pdV RdT
CV
M
R
1
CV
R
pdV
Cv
pdV Vdp 0
24. Уравнение адиабаты для идеального газа
pdV Vdp 0,dV dp
0.
V
p
dV
dp
0
V
p
ln V ln p ln const
ln pV const
pV const.
25. Уравнение адиабаты для идеального газа
В переменных TV имеемИз уравнения следует,
что при
адиабатическом
расширении
идеальный газ
охлаждается, а при
сжатии нагревается.
TV const.
26. Политропические процессы.
C constTV n 1 const
pV const
n
С
nCV C p
n 1
Процесс
n
C
Изобарический
0
Cp
Изотермический
1
Адиабатический
0
Изохорический
СV
27. Работа идеального газа.
A F h pS h p VЕсли давление не меняется
то
A12 p V2 V1
h
В общем случае
F pS
A
P
.
V2
pdV
V1
0
V1
V2
V
28. Работа идеального газа.
Работа А не определяется знаниемначального и конечного состояния системы.
Её значение зависит от способа («пути»)
перехода из начального в конечное
состояние.
Рассмотрим работу, совершаемую 1 молем идеального
газа при изотермическом (T=const) процессе.
Учитывая PV
= RT = const, имеем
V2
V2
V2
dV
A PdV RT
RT ln
V1
V1
V1 V
29. Работа идеального газа.
npV
p1V1 p2V2
Уравнение политропы идеального газа
n
откуда
При
p p V /V
n
1 1
n 1
Используя
n
, и работа
n
dV
A12 p V n
V
n
1 1
n 1
n 1
p
V
V
dV
1
V
1 1 A12 1 1 1 1
V1n 1 n
n 1 V2
V
n 1 V2
n 1
m
m RT1 V1
1
A12
pV
RT .
M
n
1
V2
M
Эта формула справедлива для любого
политропического процесса, кроме
процесса изотермического (n=1).
30. Работа идеального газа.
Для адиабатического процесса1
V1
p1V1
1
A12
1 V2
1
V1
m RT1
1
A12
M 1 V2
pV const.
31. СТАТИСТИЧЕСКАЯ ФИЗИКА Сведения из теории вероятности
Случайная величинаx
может иметь
значения:
В результате измерений получили:
N1 x1
Ni
N
x1 , x2 ,... xi ,... xk ,... x s
N
i
- относительная частота.
N 2 x2
...
N i xi
N
Ni Ni
Pi lim
N
N N
32. Сведения из теории вероятности
PiNi
1
N
Pi или k
Ni N k Ni N k
Pi Pk
N
N N
Теорема о сложении вероятностей:
Pi или k Pi Pk
Пусть система характеризуется x и y вероятность которых, равна:
N xi
P xi
N
и
N yi
P yi
N
- теорема об умножении вероятностей: вероятность
одновременного появления статически независимых
событий равна произведению вероятностей этих
событий
P xi , y k P xi P y k
Среднее значение
x
Nx
Px
N
i i
i i
33. Сведения из теории вероятности
Непрерывная случайная величинахарактеризуется функцией распределения
вероятности
dPx f x dx
Px ( x1 , x2 )
x
от x до x dx
x2
f x dx
x1 x
f x dx dP
x
x0
1
x0
x
x xdPx
x0
x
x x dPx
x0
f x
34. Характер теплового движения
В равновесии в газе молекулы движутся хаотически.Изменение скоростей при столкновениях происходит случайным образом.
Скорость молекул газа не может быть больше некоторойvMAX
2 mv 2
2
p n
n Ek
Давление газа на стенку
3
2
3
m - масса
- число молекул в единице
N
n
молекулы
объёма,
V
‹v›- средняя скорость молекул
‹Ek› - средняя кинетическая энергия поступательного движения молекул
2 mv2
2
p n
n Ek
3
2
3
p nkT
3
Ek kT
2
Средняя энергия молекул
35. Характер теплового движения
mv 2m 2
Ek
v
2
2
Так как
v 2 vx
2
vy
vx2
2
vz
2
vx
v
2
vy
2
3kT
m
2
vz
2
1 2
kT
v
3
m
Здесь учтена только энергия поступательного движения. Наряду
с поступательным движением возможны также вращение
молекулы и колебание атомов, входящих в состав молекулы.
Числом степеней свободы механической системы
называется число независимых величин, с помощью
которых может быть задано положение системы.
36. Характер теплового движения
Материальная точка задаётся 3-мя координатами;Твердое тело - 3-мя координатами и 2-мя углами
и т.д.
Закон равнораспределения – на каждую
степень свободы молекулы приходится в
среднем одинаковая кинетическая энергия,
равная
1
E
i
E kT
2
2
kT
i nПОСТ nВР nКОЛ
37. Характер теплового движения
Для идеального газаUM NA E
i
i
N AkT RT
2
2
U M CV T .
i
СV R
2
i 2
СP
R
2
C P CV R
CP i 2
CV
i
38. Распределение Максвелла
Распределение Максвелла описывает распределениемолекул по скоростям:
3
2
mv 2 2
m
v
f v 4
exp
2 kT
2kT
39. Распределение Максвелла
Средняя скоростьмолекул будет равна:
v vf (v)dv
8kT
v
m
0
Средний квадрат скорости v 2 v 2 f (v)dv
v
0
vср.кв
v2
3kT
m
2
3kT
m
средняя квадратичная скорость
Скорость, отвечающая максимуму f v
, называется наиболее вероятной.
vвер
2kT
m
vвер : v : vср.кв 2 : 8 : 3 1 : 1.13 : 1.22
40. Распределение Максвелла
4m
f vвер
~ m
T
e 2 kT
Для некоторых приложений
удобно записать распределение
Максвелла как функцию
U v
vвер
4
U 2
2
f (U )
e U
Это
уравнение
универсальное. В таком
виде
функция
распределения
не
зависит ни от рода газа,
ни от температуры.
41. Распределение Максвелла
Используя очевидное соотношениеf (v)dv f ( E)dE
f ( E ) A·exp(
E
) E
kT
A
2
kT 3 2
Таким образом распределение Максвелла – это
распределение молекул по кинетической энергии.
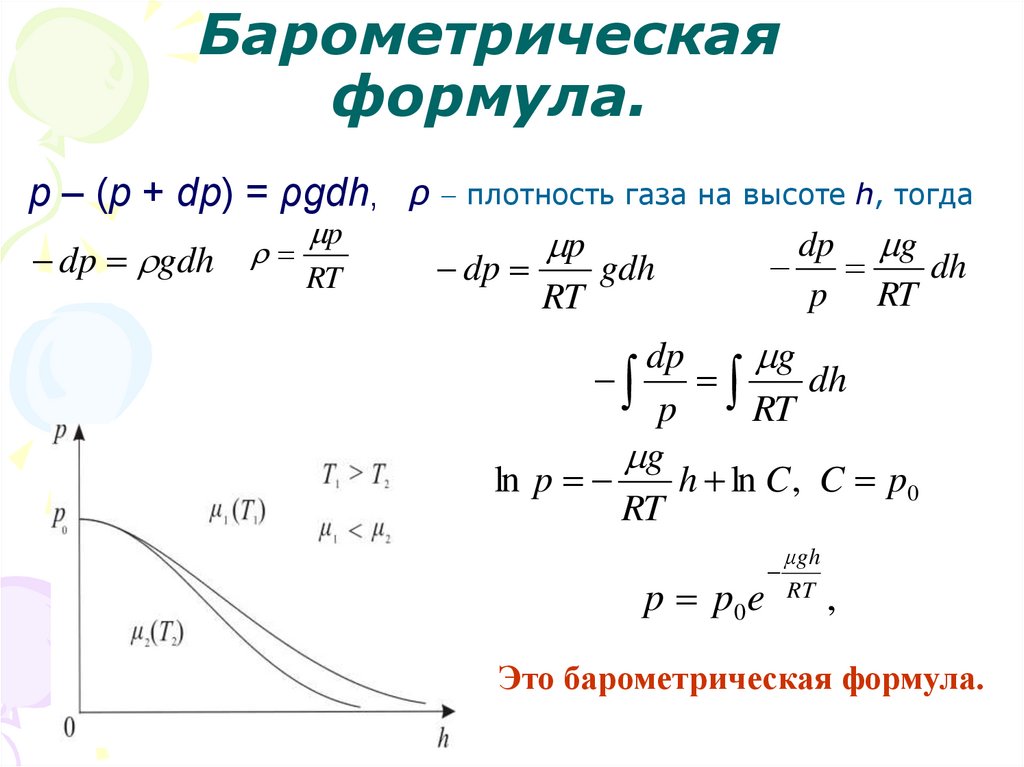
42. Барометрическая формула.
Атмосферноедавление
на
высоте h обусловлено весом
выше лежащих слоёв газа.
Пусть
p
– давление на высоте
h, p + dp – на высоте h + dh .
Причём dh > 0, dр < 0 так как
на большой высоте давление
меньше. Разность давления p –
(p + dp) равна весу газа,
заключённого
в
объёме
цилиндра
с
площадью
основания равного единице и
высотой dh, p = ρgh,
медленно убывает с высотой.
43. Барометрическая формула.
p – (p + dp) = ρgdh, ρ плотность газа на высоте h, тогдаp
dp g
p
dp gdh
RT
dp
RT
gdh
p
RT
dh
dp
g
dh
p
RT
g
ln p
h ln C , C p0
RT
p p0 e
μgh
RT
,
Это барометрическая формула.
44. РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА .
f (r ) A eU (r )
kT
f (r )dV 1
0
В гравитационном поле Земли n n0
Плотность
равна
частиц
n N · f (r )
mgh
e kT
p p0 e
mgh
kT
n0 – плотность молекул на уровне моря,
p0 – давление уровне моря, h - высота.
В центрифуге
n n0e
p p0
m 2 r 2
2 kT
m 2r 2
e 2 kT
n0 и p0 плотность частиц и
давление в центре центрифуги,
r – расстояние от центра
45. РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА .
Таким образом, молекулы располагаются с большейплотностью там, где меньше их потенциальная энергия
n1
U1 U 2
exp
n2
kT
Распределение Максвелла и Больцмана можно объединить в
один закон Максвелла – Больцмана
U mv2 2
dN A exp(
)dvdr
kT
A N 0 (m 2πkT ) 3 2
A – нормировочная константа, U – потенциальная mv2/2
– кинетическая, E = U + mv2/2 – полная энергия.
U r U r dr
N0 –полное число молекул
T v T v dv
mv2 m v dv 2
2
2
dN
A
U mv2 2
exp(
)dvdr
N0 N0
kT
46. Распределение Бозе – Эйнштейна, Ферми – Дирака.
Если у нас имеется термодинамическая система состояния изN частиц, энергии которых могут принимать дискретные
значения (W1, W2 ... Wn), то говорят о системе квантовых
чисел.
Распределение Бозе – Эйнштейна:
1
Ni
e
(Wi μ )
kT
1
квантовые частицы с целым спином (собственный
момент движения) -
бозоны (например фотоны)
Распределение Ферми – Дирака:
1
Ni
e
квантовые частицы с полуцелым спином - фермионы,
например: электроны, протоны, нейтроны
(Wi μ )
kT
1
47. Круговые процессы. Тепловые машины.
Круговым процессом, или циклом,называется такой процесс, в
результате которого
термодинамическое тело
возвращается в исходное
состояние.
Цикл, совершаемый идеальным
газом, можно разбить на
процессы расширения (1 – 2) и
сжатия (2 – 1) газа.
Работа расширения (определяется площадью фигуры
1a2V2V11) положительна (dV > 0)
Работа сжатия (определяется площадью фигуры 2b1V1V22)
отрицательна (dV < 0)
Следовательно, работа, совершаемая за цикл, определяется
площадью, охватываемой кривой.
48. Круговые процессы. Тепловые машины.
Если за цикл совершается положительная работато он называется прямым
A pdV 0
Если за цикл совершается
отрицательная работа
A pdV 0
он называется обратным
49. Круговые процессы. Тепловые машины.
В результате кругового процесса система возвращается висходное состояние, полное изменение внутренней энергии газа
равно нулю. Первое начало термодинамики для кругового
процесса
Q = U + A = A
работа, совершаемая за цикл, равна количеству полученной
извне теплоты
система может теплоту как получать, так и
отдавать
Q = Q1 – Q2
коэффициент полезного действия
Q2
A Q1 Q2
η
1
.
Q1
Q1
Q1
50. Круговые процессы. Тепловые машины.
Процесс называют обратимым, если он протекает такимобразом, что после окончания процесса он может быть
проведен в обратном направлении через все те же
промежуточные состояния, что в прямом процесс.
никаких изменений в среде, окружающей систему, не произойдет
Процесс называется необратимым, если он протекает
так, что после его окончания систему нельзя вернуть в
начальное состояние через прежние промежуточные
состояния
Нельзя осуществить необратимый круговой процесс, чтобы
нигде в окружающей среде не осталось никаких
изменений.
Максимальным КПД обладают машины у
которых только обратимые процессы.
51. Тепловые машины.
Тепловой машиной называется периодическийдействующий двигатель, совершающий работу за счет
получаемого извне тепла
Прямой цикл используется в тепловом двигателе. От термостата с
более высокой температурой Т1 (нагреватель), за цикл отнимается
количество теплоты Q1, а термостату с более низкой температурой
Т2, (холодильник), за цикл передается количество теплоты Q2 и
совершается работа A:
A = Q1 – Q2
52. Тепловые машины.
Обратный цикл используется в холодильных машинах –периодически действующих установках, в которых за счет
работы внешних сил теплота переносится к телу с более
высокой температурой. Системой за цикл поглощается при низкой
температуре Т2 количество теплоты Q2 и отдается при боле высокой
температуре Т1 количество теплоты Q1.
53. Тепловые машины.
Цикл Карноиз всех периодически действующих тепловых машин, имеющих
одинаковые температуры нагревателей и холодильников,
наибольшим КПД обладают обратимые машины. КПД
обратимых машин, работающих при одинаковых температурах
нагревателей и холодильников, равны друг другу и не
зависят от конструкции машины.
Цикл Карно- самым
экономичным,
состоит из двух
изотерм и двух
адиабат
54. Тепловые машины.
Работа и КПД цикла КарноПроцесс
А-В.
Положительная
работа,
совершенная
газом
при
изотермическом
расширении одного моля газа от V0 до V1.
Тепло,
полученное
от
нагревателя
Q1,
изотермически расширяется совершая при этом
работу А1:
Процесс
В-С
–
адиабатическое
расширение. Работа расширения А2
совершается
за
счет
изменения
внутренней энергии. Уравнение адиабаты:
Полученная работа на этой стадии
V1
A1 RT1ln
Q1 ,
V2
γ 1
T1 V2
,
T2 V1
γ
A2
Cp
CV
i 2
.
i
R
(T1 T2 )
γ 1
55. Тепловые машины.
Работа и КПД цикла КарноПроцесс С-D – изотермическое
сжатие. На третьем этапе газ
изотермический сжимается V2 до
V3. Теплота Q2, отданная газом
холодильнику при изотермическом
сжатии, равна работе сжатия А3 – это
работа совершаемая над газом:
работа сжатия на последнем этапе:
A3 RT2ln
V2
Q2
V3
Q2 – тепло, отданное
холодильнику
R
A4
(T1 T2 )
γ 1
56. Тепловые машины.
Работа и КПД цикла КарноV1 R(T1 T2 )
V2 R(T1 T2 )
A RT1 ln
RT2 ln
V0
1
V3
1
V2
V1
A Q1 Q2 R(T1 T2 )lnβ 0
ln ln
ln
V3
V0
Значит работа совершаемая газом больше работы внешних сил:
Работа равна площади ограниченной кривой АВСDА.
Из равенств следует:
полезная работа
КПД η равен:
Q1
T1
Q2 T2
А = Q1 Q2.
Q2
T2
A Q1 Q2
η
1
1
Q1
Q1
Q1
T1
57. Тепловые машины.
Необратимый цикл. Холодильная машина.Предположим, что необратимость цикла обусловлена тем,
что теплообмен между рабочим телом и источником теплоты
(холодильник
“источник”,
отрицательной
температуры) происходит при конечных разностях
температур, т.е. нагреватель, отдавая тепло, охлаждается на
∆T, а холодильник нагревается на ΔТ.
Для необратимого цикла
ηнеобр
Т 2 ΔТ
Т2
1
1 .
Т 1 ΔТ
Т1
ηобр > ηнеобр
58. Тепловые машины.
Холодильная машина.А = (Q1 + Q2) < 0.
Обратный цикл Карно. При
изотермическом сжатии В – А
от газа отводится количество
теплоты Q1 при Т1. В процессе
D – С – изотермического
расширения к газу подводится
количество теплоты Q2.
В этом цикле Q1 < 0, Q2 > 0 и
работа совершаемая над газом –
отрицательна
Q2
T2
А Q1 Q2
Для холодильных машин Карно η Q1 Q1 1 Q1 1 T1
59. ЭНТРОПИЯ. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
Из цикла Карно видно, что равны между собойотношения теплот к температурам, при которых они были
получены или отданы:
в изотермическом процессе
Q1
T1
Q2
T2
Q
Q*
T
2
Отношение теплоты Q1, в изометрическом
процессе,
к
температуре,
при
которой
d Q
происходила передача теплоты, называется
Q *1 2
приведенной теплотой Q*.
T
1
в обратном цикле Карно имеем:
Этот
результат
B
C
D
A
d Q
d Q
d Q
d Q
справедлив для любого
Q *Карно
обратимого процесса.
T
T
T
T
A
Q *Карно
1
B
C
2
D
B
D
Q1 Q2
1
1
d Q d Q
0
TA
T2 C
T1 T2
d Qобр
T
0.
60. ЭНТРОПИЯ. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
dQT
Из равенства нулю интеграла взятого по замкнутому контуру,
следует, что
полный дифференциал некоторой функции,
которая определяется только состоянием системы
и зависит от пути, каким система пришла в это
состояние.
Функция
которой
состояния,
дифференциал
dQ
dS
T
dQ
T
называется
–
энтропией.
Энтропия обозначается S – это отношение полученной или
,
отданной теплоты к температуре при которой произошла эта
отдача.
Для обратимых процессов изменение энтропии
равенство Клаузиуса
ΔS обр 0 т к.
dQобр
T
0
61. ЭНТРОПИЯ. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
Если система совершает равновесный переход из состояния 1 всостояние 2, то изменение энтропии:
dQ
dU dA
S 2 S1
,
T
T
1
1
2
S1 2
2
Последняя формула определяет энтропию лишь с точностью до
аддитивной постоянной, т.е. начало энтропии произвольно.
62. ЭНТРОПИЯ. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
найдем изменения энтропии в процессах идеального газаиспользуя
2
2
dQ
dU dA
,
T
T
1
1
S1 2 S 2 S1
m
dU CV dT ,
μ
m RT
dA pdV
dV ,
V
2
2
dU m
dT m
T2
1 T CV 1 T CV ln T1 ,
2
dA
m RT
1 T pdV T
T2 m
V2
m
ΔS Cv ln R ln
μ
T1 μ
V1
2
dV m
V2
1 V R ln V2 ,
63. ЭНТРОПИЯ. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
изменение энтропии S1 2 идеального газа при переходеего из состояния 1 в состояние 2 зависит от вида перехода
1 2.
V1 V2
изохорического процесса:
T2
m
ΔS CV ln ,
μ
T1
изобарического процесса:
T
m 2 dT2 m
ΔS C p
C p ln 2 ,
μ T1
T1
μ
T1
T
изотермического процесса:
адиабатного процесса:
V2
ΔS mR ln ,
V1
dQ 0, то
p1 = p2
Т1 = Т2
ΔS 0,
S = const, адиабатный процесс по другому называют –
изоэнтропийным процессом
64. Изменения энтропии при обратимых и необратимых процессах .
Энтропия (S) – величина аддитивная, т.е. S Sона равна сумме всех тел входящих в систему.
Обратимый цикл Карно.
d Qобр так как газ возвращается в исходное состояние
ΔS газа 0,
S
T
ΔS нагр
Q1
T1
ΔS ц.K. ΔS H ΔS x
ΔS хол
Q2
,
T2
Q1 Q2
0
T1
T2
так как
dQобр
T
Q1 Q2
T1
T2
0,
65. Изменения энтропии при обратимых и необратимых процессах .
Необратимый цикл.ηобр > ηнеобр, т.е.
ΔS необр ΔS необр ΔS хол
При любом
1
Q2
T
1 2
Q1
T1
Q1 Q2
0
T1
T2
Q2 Q1
,
T2
T1
S необр 0
необратимом процессе в замкнутой
системе энтропия возрастает
dS
образом для произвольного процесса
> 0.
Таким
где «=» – для обратимого; «>» для необратимого, и
для замкнутой системы
Q
S
T
dS 0
66. Изменения энтропии при обратимых и необратимых процессах . ЭНТРОПИЯ. Второе начало термодинамики.
Второе начало термодинамики.Работа теплового двигателя. A = Q1 – Q2.
Чтобы кпд теплового двигателя был = 1, должно быть
выполнено условиевечный
Q2 = 0двигатель Второго рода
М. Карно доказал, что для работы теплового двигателя необходимо не
менее двух источников теплоты с различными температурами.
Невозможно создание вечного двигателя Второго
рода подтверждается вторым началом
термодинамики:
67. Изменения энтропии при обратимых и необратимых процессах .
Второе начало термодинамики.1. Невозможен процесс, единственным результатом которого
является превращение всей теплоты, полученной от нагревателя
в эквивалентной ей работе (формулировка Кельвина).
2. Невозможен двигатель Второго рода (Томсон-Планк).
3. Невозможен процесс, единственным результатом которого
является передача энергии в форме теплоты от холодного тела к
горячему (Клаузиус).
dS 0
68. Изменения энтропии при обратимых и необратимых процессах .
Второе начало термодинамики.При обратном процессе
dQ TdS
Клаузиус доказал, что при необратимом процессе dS > dQ
изменение энтропии больше приведенной теплоты, тогда
< TdS можно объединить, тогда d Q TdS
тогда
первое
и
второе
начала
объединенной форме будут иметь вид:
термодинамики
TdS dU d A
в
dQ
69. Изменения энтропии при обратимых и необратимых процессах .
Свободная и связанная энергииd A (dU TdS )
в обратимом процессе:
d A d (U TS ) SdT
U TS F
d A dF SdT
F
– разность двух функций состояния, а поэтому и сама является
функцией состояния. Ее назвали свободной энергией.
Если тело совершает обратный изометрический процесс, то
dT
2
d A dF dF F2 F1 F2 F1 ,
1
= 0,
70. Изменения энтропии при обратимых и необратимых процессах .
Свободная и связанная энергииАизот = F1 – F2 - свободная энергия есть работа, которая могло бы
совершить тело в обратном изотермическом процессе или,
свободная энергия – есть максимальная возможная
работа, которую может совершить система, запасом внутренней
энергии:
U = F + TS
Внутренняя энергия системы равна сумме свободной
(F)
и связанной
энергии (TS).
Связанная энергия – часть внутренней энергии, которая не
может быть превращена в работу
71. Изменения энтропии при обратимых и необратимых процессах .
Свободная и связанная энергииПри одной и той же температуре, связанная энергия тем больше,
чем больше энтропия.
При необратимом процессе энтропия увеличивается, до того пока не
прекратятся какие-либо процессы (F = 0). Это произойдет, при
достижении замкнутой системы равновесного состояния. Вывести
систему из этого равновесного состояния можно затратив
энергию из вне.
В термодинамике есть еще понятие
T
min
ΔS ,
– энергетическая потеря в изолированной системе
Tmin температура окружающей среды.
72. Статистический смысл энтропии.
Макросостояние–
это
состояние
вещества
характеризующее его термодинамические параметры.
Состояние же системы, характеризуемое состоянием
каждой входящей в систему молекулы называют –
микросостояниями.
Термодинамической
вероятностью
или
статистическим весом макросостояния W называется
число микросостояний, которым она
может быть
осуществлена
Термодинамическая вероятность W максимальна,
когда система находится в равновесном состоянии.
В состоянии равновесия энтропия максимальна
73. Статистический смысл энтропии.
S – аддитивная величина. S Sгде S энтропия системы;
S
сумма энтропий тел, входящих в систему.
Вероятность сложного события
W W1W2
где W1 – первое состояние; W2 – второе состояние.
Поэтому аддитивной величиной является логарифм W:
LnW ln W1 ln W2
Поэтому Больцман предложил
S k ln W ,
74. Статистический смысл энтропии.
Связь между S и Wпозволяет несколько иначе
сформулировать второе начало термодинамики:
Наиболее вероятным изменением энтропии является ее возрастан
Энтропия – вероятностная статистическая величина.
Энтропия системы – максимальна, при достижении
системы (замкнутой) равновесного состояния.
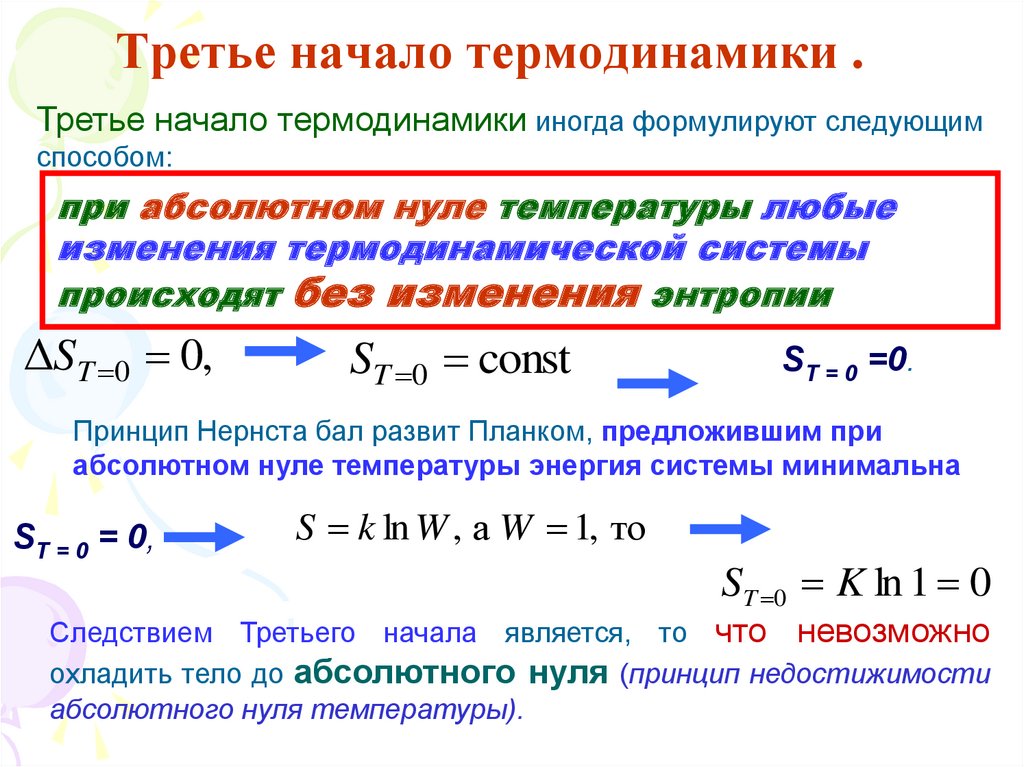
75. Третье начало термодинамики .
теорема НернстаЭнтропия любой равновесной системы при
абсолютном нуле температуры равна нулю.
T
Отсюда следует, что при T 0
сходится на нижнем пределе S(0)
dQ
T T
0
= const или S(0) = 0,
равенство нулю рассматривается как наиболее вероятное
76. Третье начало термодинамики .
Третье начало термодинамики иногда формулируют следующимспособом:
при абсолютном нуле температуры любые
изменения термодинамической системы
происходят без изменения энтропии
ΔST 0 0,
ST 0 const
ST = 0 =0.
Принцип Нернста бал развит Планком, предложившим при
абсолютном нуле температуры энергия системы минимальна
ST = 0 = 0,
S k ln W , а W 1, то
ST 0 K ln 1 0
Следствием Третьего начала является, то что невозможно
охладить тело до абсолютного нуля (принцип недостижимости
абсолютного нуля температуры).
77. Термодинамические потенциалы.
Термодинамические потенциалы – функции состояния.Внутренняя энергия
Свободная
энергия:
U
T
S V
F U TS
U
p
V V
F
S
T V
F
p
V T
,
Энтальпия:
H U pV
H
T
S
p
H
V
p
S
Термодинамический потенциал Гиббса:
G H TS pV TS
G
V
p
T
G
S
T p










































































 Физика
Физика








