Похожие презентации:
Биохимия нервной, мышечной и соединительной ткани
1. ЛЕКЦИЯ: Биохимия нервной, мышечной и соединительной ткани
2. План лекции
1. Нервная ткань: определение понятия, классификация по функциями клеточному составу.
2. Нейрон – как основная морфо-функциональная единица нервной
системы: особенности структуры, состава органелл, функции.
Нейрональная теория функционирования
высшей нервной
системы.
3. Головной мозг: химический состав сухого остатка, белого и серого
вещества, нейронов, синапсов, нервных волокон. Особенности
обмена – энергетического, углеводного, липидного, нуклеотидного
и нуклеиновых кислот, белкового и аминокислот. Биохимические
причины и механизмы развития патологических состояний.
4. Биохимические основы нервной деятельности. Виды синапсов и
рецепторов, обмен нейромедиаторов и механизмы передачи
нервного импульса через синапсы. Основные ингибиторы
механизмов передачи нервного импульса в различных видах
синапсов.
5. Биохимические показатели крови, мочи, спинномозговой жидкости,
отражающие функциональное состояния нервной ткани.
3. Функции нервной системы:
1. координирует взаимодействие организма с внешнейсредой,
2. координирует функции различных органов и тканей
3. осуществляет интеграцию частей организма в единое
целое,
4. является
центральным
органом
поддержания
гомеостаза.
Принципы действия нервной системы
• воспринимает информацию из внешней и внутренней
среды;
• перерабатывает полученную информацию;
• хранит информацию;
• генерирует сигналы, обеспечивающие ответные
реакции, адекватные действующим раздражителям.
4. Классификация нервной системы
АнатомическиФизиологически
ЦНС
головной
и спинной мозг
ПНС
периферические
нервные узлы,
нервы и
нервные окончания
Автономная
Симпатическая
Соматическая
функции
произвольного
движения
Парасимпатическая
регулирует деятельность внутренних органов, сосудов и желез
5.
Функциональной тканью нервной системы являетсянервная.
Нервная ткань – это высокоспециализированная
ткань, обладающая возбудимостью и проводимостью,
она состоит из:
1. Нейронов
2. Нейроглии
• Макролия (астроциты, эпендимоциты,
олигодендроциты)
• Микроглия (тканевые макрофаги)
6.
Нейрон7.
Нейроглия (от греческого glia – клей) это клетки нервнойсистемы, которые не проводят нервные импульсы.
Глиальные клетки занимают 50% объема ЦНС и более
90% от количества всех ее клеток.
Глиальные клетки обеспечивают деятельность нейронов,
играя вспомогательную роль:
1. опорную,
2. трофическую,
3. Барьерную
4. Защитную
5. Секреторную (некоторые)
8.
Макроглия1. Астроцитарная глия
1. обеспечивает
микроокружение
нейронов,
2. выполняет опорную и
трофическую
функции в сером и
белов веществе,
3. участвует в
метаболизме
нейромедиаторов,
4. входят в состав
гематоэнцефалическ
ого барьера.
Астроциты
9.
2. Эпендимная глия1. образует
выстилку
желудочков головного
мозга
2. входит
в
состав
гематоликворного
барьера.
На снимке - просвет одного из
желудочков мозга (1).
Он заполнен жидкостью и
выстлан эпендимой (2).
Под эпендимой - белое
вещество (3) мозга.
эпиндимоциты
10.
3. Олигодендроглия1. встречается в сером
и белом веществе;
2. обеспечивает
барьерную
функцию,
3. участвует в
формировании
миелиновых
оболочек нервных
волокон,
4. регулирует
метаболизм
нейронов,
5. захватывает
нейромедиаторы.
1. часть тела псевдоуниполярного нейрона
2. олигодендроглия (клетки-сателлиты)
11.
Микроглия• Микроглия – специализированные макрофаги ЦНС.
• Способны к амёбоидным движениям и фагоцитозу
• Активизируются при воспалительных и
дегенеративных заболеваниях.
• Выполняют в ЦНС роль антиген-представляющих
дендритных клеток
микроглиоциты
12.
По клеточному составу нервную ткань делят на:1. Серое вещество образовано скоплением нейронов,
тонких немиелинизированных нервных волокон и
нейроглии (астроциты, олигодендроциты)
в ЦНС называется ядром, в ПНС – ганглием (узлом).
2. Белое вещество представлено совокупностью
аксонов, покрытых миелиновой оболочкой и глиальных
клеток (астроцитов).
в ЦНС носят название трактов, в ПНС образуют
нервы.
13. Химический состав нервной ткани
Химический состав серого и белого вещества головного мозга человека84
70
90
80
70
60
% содержания
50
40
17
30
8
9
5
20
1
10
0
Вода
Белки
Липиды
Вещество
Серое вещество, %
Белое вещество,%
Минеральные
вещества
2
14. Белки нервной ткани
В головном мозге на белки приходиться 40% сухой массы.В настоящее время выделено более 100 белковых
фракций нервной ткани
Белки нервной ткани
Простые :Нейроальбумины – основные
растворимые белки (80%)
Нейроглобулины - 5%.
Катионные белки - основные белки (рН 10 –
12) - гистоновые.
Нейросклеропротеины (нейроколлагены,
нейроэлластины)– 10% - структурноопорная функция
сложные
15. Сложные белки
• Гликопротеины –нейрорецепция• Протеолипиды – структурная ф -я
Нейроспецифические белки
• Нейроспецифическая енолаза (Белок 14-3-2) кислый белок в нейронах ЦНС
• Белок Р-400 - в мозжечке - двигательный контроль
• Нейротубулин, нейростенин, актиноподобные белки
- подвижность цитоскелета, активный транспорт
веществ.
• Гликопротеины гипоталамуса,
• нейрофизины - гуморальная регуляция
• Нейроспецифические поверхностные антигены
(NS1, NS2, L1)
• Факторы адгезии клеток (N-САМ) - на мембране
нейронов
16.
• Белок S100 - гетерогенный кислый Сa-связывающий белок,локализуется в нейроглии (в астроцитах) и интенсивно
нарабатывается в клетках гиппокампа при обучении,
тренировках, формировании условных рефлексов.
• Белок В-50 - один из основных фосфорилируемых белков
плазматических мембран нейронов. Локализован в синапсах и
является эндогенным субстратом диацил-глицерол-зависимой
и Са-зависимой протеинкиназы С.
НЕЙРОПЕПТИДЫ - эндогенные регуляторы функций ЦНС
Осуществляют контроль:
- за экспрессией вторичных клеточных мессенджеров,цитокинов
и других сигнальных молекул,
- за запуском генетических программ апоптоза, антиапоптозной
защиты,
- усилением нейротрофического обеспечения
17.
Опиоидные нейропептидыПрирода
метЭнкефалин
Действие
5 остатков
аминокислот
Кратковременное обезболивающее
действие
β-эндорфин
30 остатков АК
1.Морфиноподобные эффекты:
oобезболивание,
oвозникновения чувства
удовлетворения.
oснижение других эмоций.
2.Важный периферический эффект:
oмощная стимуляция NK-клеток
γ-эндорфины
Первые 17
остатков βэндорфина
Нейролептическое действие
(торможение эмоциональной сферы).
Обезболивающий эффект выражен
слабо.
α-эндорфин
Первые 16
остатков βэндорфина
Психостимулирующее:
стимуляция эмоций,
увеличение моторной активности
18.
нейропептидыПрирода
Действие
Вазопрессин
Циклические
нонапептиды
Способствует формированию
долгосрочной памяти
Окситоцин
Циклические
нонапептиды
Умеренно препятствует формированию
долгосрочной памяти
Холецистокинин-8
Декапептид
Очень мощный ингибитор
пищедобывательного поведения
13 остатков АК
Подобно анальгину, вызывает эффекты:
обезболивающий (не через опиатные
рецепторы),гипотермический и
гипотензивный
Эндозепин-6
Гексапептид
Ингибирует ГАМК-рецепторы. Вызывает
беспокойство и проконфликтное
поведение
Пептид дельта
сна
Не входит ни в
одно из 18
семейств
Сильный снотворный эффект,облегчен
Нейротензин
19. Нейротрофические факторы:
Фактор роста нейронов (NGF)
•Нейротрофический
фактор головного
мозга (BDNF)
•Трансформирующий
фактор роста b 1-3
(TGFb 1, TGFb 2, TGFb 3)
•Нейротрофический
фактор глиальных
клеток (GDNF)
•Нейротрофин
3 (NT3)
•Нейротурин
•Нейротрофин
4/5 (NT4/5)
•Персефин
(NTN)
(PSP)
Нейропоэтины
Факторы роста фибробластов
•Цилиарный нейротрофический фактор •Кислый фактор роста фибробластов (FGF(CNTF)
1)
•Фактор,
ингибирующий лейкоз (LIF)
•Основной
фактор роста фибробластов
(FGF-2)
Инсулиноподобные факторы роста 1-2
(IGF-1, IGF-2)
•Фактор
Трансформирующие факторы роста
Другие факторы
•Трансформирующий
•Фактор
роста тромбоцитов (PDGF)
•Фактор
роста стволовых клеток (SCF)
фактор роста a
роста фибробластов-5 (FGF-5)
(TGFa )
20. Ферменты
Нейроспецифическая енолаза
ЛДГ (ЛДГ1, ЛДГ2 в нейронах, ЛДГ5 - в глии),
АСТ,
альдолаза,
креатинкиназа (ВВ),
гексокиназа,
глутамат-дегидрогеназа,
Малат-дегидрогеназа
холинэстераза,
Кислая фосфатаза,
Моноаминоксидазы.
21.
АминокислотыАминокислот в мозге в среднем 34 ммоль на 1г ткани, что значительно
превышает их содержание, как в плазме крови, так и в СМЖ.
Высокая концентрация АК в нервной ткани достигается путем их
многоступенчатого активного и пассивного транспорта из плазмы крови.
Содержание (мкмоль/г) свободных аминокислот в мозге, плазме и
СМЖ
мозг
Плазма крови
СМЖ
Аминокислота
Глутаминовая
10,6
Nацетиласпарагиновая
5,7
-
-
Глутамин
4,3
0,70
0,030
ГАМК
2,3
-
-
Аспарагиновая
2,2
0,01
0,007
75%
0,05
23%
0,225
60%
22. Липиды нервной ткани
Нервная ткань отличается высоким содержанием и разнообразиемлипидов, которые придают ей специфические особенности.
• фосфоглицериды в сером веществе составляют более
60% от всех липидов, а в белом – около 40%.
• Холестерин - 25% от общего содержания липидов
(повышает электроизоляционные свойства клеточных
мембран, защищает их от ПОЛ, защищает от
повреждения).
• Сфинголипиды (ганглиозиды и цереброзиды),
участвуют в процессах коммуникации нервной клетки с
окружающей ее средой, в передаче сигналов с наружной
поверхности клетки внутрь.
• ХС, сфингомиелинов, сульфатидов и особенно
цереброзидов содержится больше в белом веществе,
чем в сером.
• Много этерефицированных жирных кислот
(пальмитиновой, стеариновой, олеиновой и
арахидоновой).
23.
• Ганглиозиды - в сером веществе - Gм1, GD1a, GD1b,GT1. Синтез ганглиозидов связан с дифференциацией
нейронов.
• Функции ганглиозидов: 1). являются рецепторами
внешних сигналов; 2). с гликопротеинами отвечают за
специфичность клеточной поверхности, распознавание
клеток и их адгезию; 3). участвуют в развитии нервной
системы при образовании «правильных» межклеточных
связей; 4). участвуют в коммуникации между
мембранами аксонов и окружающими их
олигодендроглиальными клетками; 5). участвуют в
функциональной адаптации зрелой нервной системы.
• Фосфатидилинозитолы - 2% от об. липидов - в
мембранах, миелине. Участвуют в
инозитолтрифосфатной системе передаче сигнала.
24. Углеводы нервной ткани
1. много олигосахаров (составляют 2-10%массы плазматической мембраны) придают ей
индивидуальность и специфичность.
2. мало глюкозы (0,05%) и гликогена
25. Нуклеотиды нервной ткани
Клетки Пуркинье мозжечка содержат избыточное
количество ДНК.
Необычно короткие нуклеосомные единицы,
наличие редких вариантов гистонов, большое
разнообразие негистоновых белков и высокая
матричная активность.
Содержание РНК в нейронах велико, что связано с
активным синтезом белка. Среднее отношение
РНК/ДНК может достигать 50
Содержание цАМФ и цГМФ в головном мозге
значительно выше, чем во многих других тканях.
26. Макроэргические соединения нервной ткани
Содержание креатина икреатинфосфата более, чем в
2 раза превышает количество
адениновых нуклеотидов –
АТФ.
27. Минеральные вещества нервной ткани
•Na+, K+, Cu2+, Fe2+, Ca2+, Mg2+ и Mn2+распределены в головном мозге относительно
равномерно между серым и белым веществом.
•Содержание фосфора в белом веществе выше, чем
в сером.
•В мозговой ткани существует дефицит анионов,
который покрывается за счет белков и липидов (у
липидов нервной ткани важная роль в ионном
балансе).
28. Строение нервного волокна. Миелиновая оболочка
Белки миелина ЦНС:•Протеолипид
•Основной белок миелина А1 (МВР)
•Белки Вольфграма
3
2
Белки миелина ПНС:
•белками А1 (немного)
• Р0 и Р2.
1
1-аксон; 2-миелин; 3-ось волокна; 4-белок (наружные слои)
5-липиды; 6-белок (внутренний слой); 7-холестерин;
8-цереброзид; 9- сфингомиелин; 10-фосфатидилсерин.
В миелине активны ферменты:
1. холестеролэстеразы;
2. фосфодиэстеразы, гидролизирующей цAMФ;
3. протеинкиназы А, фосфорилирующей основной белок;
4. сфингомиелиназы;
5. карбоангидразы.
29.
Гематоэнцефалический барьер (ГЭБ) – самый труднопроницаемый, непроницаем для катехоламинов, АХ,
серотонина, ГАМК.
Образован:
клетками эндотелия капилляров
плотной базальной мембраной, не имеющей пор.
Астроглией,
выстилающие
наружную
поверхность
эндотелия.
1 Путем диффузии (О2, СО2)
Р-ГП
- (Межклеточных щелей нет)
- («Окон» нет)
+ (Пиноцитоз отсутствует
или незначителен)
5 Путем активного
транспорта (АК, глюкоза,
кетоновые тела)
30. Особенности метаболизма нервной ткани
Энергетический обмен нервной ткани• Для мозга характерна высокая интенсивность
энергетического обмена с преобладанием аэробных
процессов.
• Головной мозг составляет 2-2,5% веса тела, а
потребляет 10-20% О2, поглощаемого организмом.
Газообмен в мозге превышает газообмен в
мышечной ткани в 20 раз.
• у детей в возрасте 4 лет к окончанию миелинизации
и завершения процессов дифференцировки нервная
ткань потребляет около 50% всего О2 поступающего
в организм.
31. Основной энергетический субстрат для нервной ткани - глюкоза
• За 1 минуту 100 г ткани мозга потребляют 5 мгглюкозы (до 70% свободной глюкозы, выделяемой из
печени в кровь)
• 85% глюкозы расходуется в аэробном гликолизе,
• 12% - в анаэробном гликолизе (до лактата)
• 3% - в ПФП, образуя НАДФН2 и рибозу
В экстремальных состояниях нервная ткань
переключается на кетоновые тела (до 50% всей
энергии).
32. Обмен белков и аминокислот нервной ткани
Нервная ткань характеризуется высоким обменомаминокислот и белков. Максимальная скорость в сером
веществе, минимальная в белом.
Аминокислоты используются :
для синтеза белков, пептидов, некоторых липидов, гормонов,
биогенных аминов и др. В сером веществе преобладает синтез БАВ,
в белом – белков миелиновой оболочки.
как нейротрансмиттеры и нейромодуляторы. АК и их производные
участвуют в синаптической передаче (глу), в осуществлении
межнейрональных связей.
Источник энергии. в ЦТК окисляются АК глутаминовой группы и с
разветвленной боковой цепью (лейцин, изолейцин, валин).
Для выведения азота. При возбуждение нервной системы
возрастает образование аммиака (в первую очередь за счет
дезаминирования АМФ), который связывается с глутаминовой
кислотой с образованием глутамина.
33. Обмен азота нервной ткани
Источником аммиака в головном мозге служит непрямое дезаминированиеаминокислот с участием глутаматдегидрогеназы, а так же дезаминирование с
участием АМФ–ИМФ цикла.
АК
а-КГ
аминотрасфераза
АСТ
кетокислота
глутамат
АК
НАДН2 + NH3
а-КГ
аминотрасфераза
глу-ДГ
кетокислота
глутамат
HOOC
C
H2
COOH
а-кетоглутарат
HOOC
C
H2
глутамат
COOH
HOOC
C
H2
NH 2
H2
C C COOH
H
глутамат
НАД+ НАДН2
Глутаматдегидрогеназа
NH3
NH 2
H2
C C
H
НАД+ + H2O
NH3
O
H2
C C
аспартат
аденилосукцинатсинтетаза
аденилосукцинатлиаза
малат
фумарат
ЩУК
Mg2+
H2NOC
C
H2
NH 2
H2
C CH COOH
кишечник,
почки
глутамин
АТФ
АДФ + Фн
Глутаминсинтаза
АМФ, глюкозо-6ф, гли, ала и гис
ИМФ
NH3
H2O
АМФ
АМФ-дезаминаза
34. Липидный обмен нервной ткани
Особенность: липиды не используются в качествеэнергетического материала, а в основном идут на
строительные нужды.
В нейронах серого вещества из фосфоглицеридов
наиболее интенсивно обновляются
фосфотидилхолины и особенно фосфотидилинозитол,
который является предшественником внутриклеточного
посредника ИТФ.
В миелиновых оболочках обмен липидов протекает
медленно, очень медленно обновляются холестерин,
цереброзиды и сфингомиелины
35. Механизмы передачи нервного импульса
36.
Механизмы передачи нервного импульсапо нервному волокну
1. Потенциал покоя (-70 мВ)
Na-канал
б)Стадия деполяризации (0 мВ - +50 мВ)
К-канал
2. Потенциал действия
а)Локальный ответ (-50 мВ)
в)Стадия реполяризации (-70 мВ)
Na
К
37.
Механизмы передачи нервного импульсачерез химический синапс
Синтез
медиатора
Слияние
везикул
Загрузка в
везикулу
Са
Обратное
Открытие
поглощение
Na канала
Проведение
импульса
Открытие
Сa канала
Na
K
Деградация
медиатора
Специфические
рецепторы
38. Аминокислотные медиаторы
Нейромедиаторэто
сигнальная
молекула,
синтезируется и запасается в нейроне, высвобождается
при проведении нервного импульса и специфически
связывается постсинаптической мембраной, где оно
активирует или ингибирует постсинаптическую клетку
посредством деполяризации и гиперполяризации.
Аминокислотные медиаторы
возбуждающие кислые
(глутамат и аспартат)
ингибиторные нейтральные
(ГАМК, глицин, β-аланин и таурин).
Глицин
• открывает хлорные каналы
• вызывает гиперполяризацию
• тормозит возбудимость
постсинаптической мембраны
39.
ГАМКАцетил-КоА
ГАМК аминотрансфераза
Глутамат
Глутамат декарбоксилаза
а-КГ
ЦТК
Янтарный
полуальдегид
Дегидрогеназа
Сукцинат
ГАМК
СО2
• открывает хлорные каналы
• вызывает гиперполяризацию
• тормозит возбудимость постсинаптической мембраны
40. Синтез холина
ПеченьОН
CO2
ОН
CH 2
CH NH 2
CООН
Серин
CH 2
CH 2
3SAM 3SAГ
ОН
CH 2
CH
2
Этаноламин+
+
N
(CH
)
3
3
метилтрансфераза
NH 2
Холин
Этаноламин
сериндекарбоксилаза
Нейроны
41.
Синтез и распад медиатора на примере ацетилхолинаПЕЧЕНЬ
(CH3)3N-CH2-CH2-OH
Нейрон
CH3-CO-S-KoA
HS-KoA холинацетилтрансфераза
(CH3)3N-CH2-CH2-O-CO-CH3
H2O
ацетилхолинэстераза
CH3COOH
(CH3)3N-CH2-CH2OH
42. Рецепторы
Рецепторы - это белки, встроенные в клеточную мембрану илинаходящиеся внутри клетки, которые, взаимодействуя с
сигнальными молекулами, меняют активность регуляторных белков.
По механизму передачи сигнала рецепторы делятся на 4 типа:
1). Рецепторы, связанные с ионными каналами (холинэргические,
ГАМК)
2). Рецепторы, с ферментативной активностью.
Бывают 3 видов:
а). Рецепторы, с тирозинкиназной активностью (тирозиновые
протеинкиназы).
б). Рецепторы, с фосфатазной активностью (тирозиновые
протеинфосфотазы) (например, ФПФ).
в). Рецепторы с гуанилатциклазной активностью (ГЦ).
3). Рецепторы, сопряженные с G-белками по строению их еще
называют серпантинными (к норадреналину).
4). Ядерные и цитоплазматические рецепторы.
43. Биохимические синдромы в психиатрии
1.2.
3.
4.
5.
6.
7.
Интоксикации (аминокислоты, кетокислоты,
аммиак, мочевина)
Нарушения окислительно-восстановительных
процессов (гипоксия, накопление молочной к-ты,
энергодефицит)
Гипоэргизма-гиперэргизма (гипогликемиягипергликемия)
Алиментарной недостаточности (аминокислоты,
витамины)
Нарушения эндокринной и вегетативной регуляции
(медиаторы -+)
Аутоиммунные (гамма-глобулины +)
Наследственные (дефекты ферментов)
44. Патобиохимия нервной системы
1) Миастения - уменьшение числа холинорецепторов2) Шизофрения - из-за гиперреактивности дофаминовых рецепторов в нейронах.
3) болезнь Паркинсона - дегенерация дофамин содержащих нейронов нитростриарного проводящего пути
4) Депрессия - из-за истощения запасов моноаминовых нейромедиаторов в нейронах.
45. Нейроспецифические белки- МАРКЕРЫ НЕЙРОДЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ
Нейроспецифические белкиМАРКЕРЫ НЕЙРОДЕГЕНЕРАТИВНЫХ ПРОЦЕССОВАстроциты
Нейроны
Олигодендроциты
и миелин
НЕЙРОСПЕЦИФИЧЕСКИЕ БЕЛКИ
Нейрон
специфическая
енолаза (NSE)
белок S100
MBP
(его фрагмент –
энцефалитогенный
протеин - ЭП)
Определ Аt к ЭП
46. Нейронспецифическая енолаза (NSE)
• Нейроспецифическая енолаза (антиген 14-3-2) NSE– это гликолитический фермент, катализирующий
превращение 2-фосфоглицерата в 2фосфоенолпируват.
2H2O
COOH
2H
C
OPO32-
CH 2OH
2-ФГК
COOH
Mg2+
2 H
Енолаза
C
OPO32-
CH 2
ФЕП
• Состоит из двух типов мономеров (α и γ),
формирующих три изофермента: αα, αγ и γγ
• γγ-NSE много содержится в цитоплазме и дендритах нейронов
• αγ-NSE содержится астроцитах, олигодендроглиоцитах и
эндотелиальных клетках
47. Белок S100
• S-100 - кальций-связывающий протеин.• Локализация мембраны, цитоплазма.
• участвует в фосфорилировании белка, обеспечивает
работу цитоскелета астроцитов, их движение, рост и
дифференцировку.
• Семейство S-100 состоит из 20 тканеспецифичных
мономеров, два из которых: α (10,4 кДа) и β (10,5 кДа)
образуют гомо- и гетеродимеры, присутствующие в
высокой концентрации в клетках нервной системы.
• Гомодимер ββ присутствует в высоких концентрациях в
глиальных и шванновских клетках, гетеродимер αβ
находится в глиальных клетках.
48.
• антитела к S100β являются специфичнымимаркерами повреждения астроцитарной глии.
• Ген S100 находиться в длинном плече 21-й
хромосомы в области 22.2-22.3, которая отвечает за
фенотипические проявления синдрома Дауна.
• При синдроме Дауна концентрация S100 в крови
плода резко возрастает. Однако S100 не проходит
плацентарный барьер, что не позволяет его
использовать в качестве маркера синдрома Дауна.
• В норме белок S100 не присутствует в сыворотке
крови.
• Увеличение концентрации S-100 (αβ) и S-100 (ββ) в
спинномозговой жидкости и плазме свидетельствует
о нарушении гематоэнцефалического барьера и
гибели астроцитов.
49. Основной белок миелина (MBP)
• MBP - щелочной белок, с высоким содержанием (25%)основных аминокислот (аргинина, лизина, гистидина).
• Ген в 18 хромосоме.
• Миелин содержит 3 изоформы MBP с массами: 21,5;
18,5 и 17,2 кДа.
• MBP составляет 25-30% массы сухого вещества
миелина
• В ЦНС на долю MBP 35% всех белков миелина,в
периферических нервах 18% всех белков.
• функции: питание аксона, изоляция и ускорение
проведения нервного импульса, опорная и барьерная
функции, иммуногенез и энцефалитогенез
• в молекуле МВР выявлено 27 антигенных
детерминант, часть из них являются
энцефалитогенными
• эпитоп 85-96 имеет собственное название –
энцефалитогенный протеин (ЭП).
50. NSE, S100 и MBP – маркеры повреждения мозговой ткани
• Нейроспецифические белки в нормальныхусловиях обнаруживаются в крови в
следовых концентрациях, не приводящих к
образованию аутоантител.
• при повреждении нервной ткани повышается
сначала их концентрация в СМЖ, а затем
происходит их выход в кровоток.
• К НСБ отсутствует иммунологическая
толерантность, поэтому появление их в крови
запускает аутоиммунную агрессию на эти
антигены.
51.
• NSE является высокоспецифичным маркероммелкоклеточного рака легкого и нейробластомы, а
также других опухолей нейроэктодермального или
нейроэндокринного происхождения.
• S100 (αβ- и ββ-димеры) служит диагностическим и
прогностическим маркером злокачественной
меланомы, глиальных опухолей ЦНС.
• MBP также может определяться у больных с
различными видами опухолей ЦНС, включая
злокачественные. MBP отражает тяжесть рецидива в
период обострения рассеянного склероза
• НСБ являются маркерами деструктивных процессов
вещества мозга (эпилепсия, нейродегенеративные
заболевания, гидроцефалия, экстапирамидные
расстройства, психические заболевания,
шизофрения, психозы)
• чем выше концентрация НСБ в сыворотке крови и
СМЖ, тем выше вероятность летального исхода.
52.
• концентрация белка НСБувеличивается с возрастом, у мужчин в
большей степени, чем у женщин
• NSE, S100 и MBP включены в панель
биохимических тестов в остром
периоде инсульта
53.
Дофамин – нейромедиатор центральной нервной системы, а также медиаторпаракринной регуляции в ряде периферических органов ( слизистой желудочнокишечного тракта, почках), предшественник норадреналина и адреналина в ходе
их синтеза.
Дофамин вырабатывается:
мозговым веществом надпочечников (3)
областью среднего мозга, называемой "Substantia nigra".
Биосинтез дофамина: происходит в нейронах промежуточного и
среднего мозга.
Предшественником дофамина является L-тирозин (он синтезируется из
фенилаланина), который гидроксилируется (присоединяет OH-группу)
ферментом тирозингидроксилазой с образованием L-DOPA, которая, в свою
очередь, теряет COOH-группу с помощью фермента L-DOPA-декарбоксилазы, и
превращается в дофамин. Этот процесс происходит в цитоплазме нейрона.
Рецепторы дофамина: трансмембранные метаботропные G-белки, впервые были выделены в 1979 году. По своим
структурным, биохимическим и фармакологическим характеристикам подразделяемые на:
D1-подобные (D1, D5) - D1-подобные рецепторы активируют аденилатциклазу
D2-подобные (D2, D3, D4) - D2 ингибируют аденилатциклазу.
Классификация предложенная в 1983 году подразделяет рецепторы дофамина по их эффектам:
Активация группы D1-подобных рецепторов вызывает релаксацию мышц и расширение сосудов, для этих
рецепторов (R)-сульпирид, является сильным антагонистом, апоморфин — слабым агонистом, а домперидон на них
не действует.
Активация группы D2-подобных рецепторов ингибирует действие норадреналина, апоморфин — их сильный
агонист, а сильные антагонисты — (S)-сульпирид и домперидон.
54.
Катаболизм дофамина:Синтезированный нейроном дофамин
накапливается в дофаминовых везикулах
(«синаптическом пузырьке»). В везикулу с
помощью протон-зависимой АТФазы
закачиваются ионы H+. При выходе
протонов по градиенту в везикулу
поступают молекулы дофамина.
Далее дофамин выводится в синаптическую
щель. Часть его участвует в передаче
нервного импульса, воздействуя на
клеточные D-рецепторы постсинаптической
мембраны, а часть возвращается в
пресинаптический нейрон с помощью
обратного захвата.
Ауторегуляция выхода дофамина
обеспечивается D2 и D3 рецепторами на
мембране пресинаптического нейрона.
Обратный захват производится
транспортером дофамина. Вернувшийся в
клетку медиатор расщепляется с помощью
моноаминооксидазы (МАО) и, далее,
альдегиддегидрогеназы и катехол-О-метилтрансферазы до гомованилиновой кислоты.
55.
ДОФАМИНЕРГИЧЕСКАЯ СИСТЕМА ГОЛОВНОГО МОЗГАРазличают семь отдельных подсистем (первые три являются основными):
1. Нигростриатная
2. Мезокортикальная
3. Мезолимбическая
4. Тубероинфундибулярная
5. Инцертогипоталамическая
6. Диенцефалоспинальная
7. Ретинальная
Нигростриатная система. Аксонами нейронов нигростриарного тракта
выделяется около 80 % мозгового дофамина.
Тела дофаминовых нейронов, находятся:
в компактной части черной субстанции - через аксоны дают проекции в
дорсальный стриатум (полосатое тело)
в латеральном отделе вентрального поля покрышки среднего мозга –
через аксоны дают проекции в вентральный стриатум.
Мезолимбическая система. Тела нейронов этой системы, расположены в
вентральном поле покрышки среднего мозга и частично в компактной
части черной субстанции. Отростки идут в: поясную извилину,
энториальную кору, миндалину, обонятельный бугорок, аккумбентное
ядро, гиппокамп, парагиппокампальную извилину, перегородку и др.
Тубероинфундибулярный тракт. Данный тракт образован аксонами
нейронов, расположенных в аркуатном ядре гипоталамуса. Отростки
таких нейронов достигают наружного слоя срединного возвышения.
Инцертогипоталамический тракт. Инцертогипоталамический тракт
начинается от zona incerta и оканчивается в дорсальном и переднем
отделах медиального таламуса, а также в перивентрикулярной области.
Он принимает участие в нейроэндокринной регуляции.
Диенцефалоспинальный тракт. Источником проекций
диенцефалоспинального тракта являются нейроны заднего гипоталамуса,
отростки которых достигают задних рогов спинного мозга.
Ретинальный тракт. Ретинальный тракт расположен в пределах сетчатки
глаза. Особенности этого тракта делают его среди других
дофаминергических трактов достаточно автономным.
56.
Пути Дофамина:Патология:
Патология
Патология
57. Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга. Снижена активность тирозингидроксилазы,
Патология Дофамина. Болезнь Паркинсона.Функциональная организация экстрапирамидальной системы В НОРМЕ.
АКТИВИРУЮЩЕЕ ВЛИЯНИЕ
ТОРМОЗЯЩЕЕ ВЛИЯНИЕ
(ГЛУТАМАТЕРГИЧЕСКИЕ)
(ДОФАМИНЕРГИЕЧЕСКИЕ И ГАМКергические)
ЛОБНАЯ КОРА
ТАЛАМУС
D2
СКОРЛУПА D1
НЕПРЯМОЙ
ПУТЬ
ПРЯМОЙ
ПУТЬ
ЧЕРНАЯ
СУБСТАНЦИЯ
НАРУЖНЫЙ СЕГМЕНТ
БЛЕДНОГО ШАРА
ВНУТРЕННИЙ СЕГМЕНТ
БЛЕДНОГО ШАРА
СУБТАЛАМИЧЕСКОЕ ЯДРО
ППЯ
СТВОЛ МОЗГА И СПИННОЙ МОЗГ
Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга.
Снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы.
58. Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга. Снижена активность тирозингидроксилазы,
Патология Дофамина. Болезнь Паркинсона.Функциональная организация экстрапирамидальной системы ПРИ БОЛЕЗНИ ПАРКИНСОНА.
АКТИВИРУЮЩЕЕ ВЛИЯНИЕ
ТОРМОЗЯЩЕЕ ВЛИЯНИЕ
(ГЛУТАМАТЕРГИЧЕСКИЕ)
(ДОФАМИНЕРГИЕЧЕСКИЕ И ГАМКергические)
ЛОБНАЯ КОРА
ТАЛАМУС
D2
СКОРЛУПА D1
НЕПРЯМОЙ
ПУТЬ
ПРЯМОЙ
ПУТЬ
ЧЕРНАЯ
СУБСТАНЦИЯ
НАРУЖНЫЙ СЕГМЕНТ
БЛЕДНОГО ШАРА
ВНУТРЕННИЙ СЕГМЕНТ
БЛЕДНОГО ШАРА
СУБТАЛАМИЧЕСКОЕ ЯДРО
ППЯ
СТВОЛ МОЗГА И СПИННОЙ МОЗГ
Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга.
Снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы
59. План лекции
Функции мышцКлассификация мышечных волокон
Химический состав мышц
Особенности обмена веществ и
энергии в мышцах
5. Строение миофибриллы
6. Механизм мышечного сокращения
7. Патология мышечной ткани
1.
2.
3.
4.
60. Мышечное волокно
• Функциональной единицеймышечной ткани является
мышечное волокно
• Мышечное волокно
поперечнополосатой
мышцы- это многоядерная
клетка.
• По форме напоминает
веретено, которое может
быть вытянуто на всю
длину мышцы.
• Снаружи мышечное волокно окружено электровозбудимой
мембраной – сарколеммой
• Внутри находиться внутриклеточная жидкость - саркоплазма.
• Центральная часть саркоплазмы заполнена миофибриллами
• На периферии, вдоль сарколеммы - ядра и митохондрии.
61.
• Двигательная единица – это совокупностьобразований – нейрон и все мышечные волокна
(обычно 10-1000), которые этот нейрон через
свои аксоны иннервирует.
62. ХИМИЧЕСКИЙ СОСТАВ МЫШЕЧНОЙ ТКАНИ
Вода............................................72—80Сухой остаток …........................20—28
В том числе:
Белки...........................................16,5—20,9
Гликоген......................................0,3—3,0
Фосфатиды.................................0,4—1,0
Холестерин.................................0,06—0,2
Креатин + креатинфосфат........0,2—0,55
Креатинин....................................0,003—0,005
АТФ...............................................0,25—0,4
Карнозин......................................0,2—0,3
Карнитин......................................0,02—0,05
Анзерин........................................0,09—0,15
Свободные аминокислоты........0,1—0,7
Молочная кислота......................0,01—0,02
Зола...............................................1,0—1,5
63. МЫШЕЧНЫЕ БЕЛКИ
1. Сократительные (миофибриллярные) белки• миозин 55%
• актин 25%
• тропомиозин (во всех мышцах)
• тропонины Т, I и С (только в поперечнополосатых).
• α- и β-актинин, десмин, коннектин (титин) и виментин.
2. Саркоплазматические белки
• глобулины X, миогены, миоглобин, нуклеопротеиды
• Ферменты:
a) в миокарде АСТ, АЛТ, ЛДГ1,2, КФК МВ.
b) в скелетной мышце ЛДГ3,4, КФК ММ.
3. Белки стромы
• коллаген
• эластин
64.
Углеводы мышечной ткани• Гликоген: 0,3-3,0%
• ГАГ
• моносахариды глюкоза, фруктоза
Липиды мышечной ткани
Фосфолипиды (в миокарде больше)
Холестерин
Небелковые азотистые вещества
креатинфосфат и креатин до 60%,
креатинин (мало);
Много адениновых нуклеотидов АТФ, АДФ и АМФ
(АТФ 4,43 мкмоль/г, АДФ 0,81 мкмоль/г, АМФ 0,93 мкмоль/г);
• Мало нуклеотидов неаденинового ряда (ГТФ, УТФ, ЦТФ и др.)
• имидазолсодержащие дипептиды (карнозин и ансерин).
• свободные аминокислоты (много глутамина, аланина) и др.
Неорганические вещества: макро- и
микроэлементы
• соли К, Na, Ca, Mg.
65. ОСОБЕННОСТИ ОБМЕНА ВЕЩЕСТВ В МЫШЕЧНОЙ ТКАНИ
Обмен белков и аминокислот1. Мышцы характеризуются высоким обменом белков и
АК. Белки и АК в мышцах активно синтезируются и
распадаются.
2. Белки скелетных мышц являются важным источником
АК. При голодании и энергодефиците белки мышц
разрушаются, а образовавшиеся АК используются в
качестве источника энергии.
3. У млекопитающих мышцы являются главным местом
катаболизма АК с разветвленной цепью (Валин,
Лейцин, Изолейцин). Аминокислоты дезаминируются,
а образовавшиеся кетокислоты используются как
субстраты ЦТК.
66.
4. Мышцы также синтезируют и выделяют много аланина иглутамина. В реакций трансаминирования вступают
ПВК (гликолиз), α-КГ (ЦТК), и аминогруппы других АК.
Мышца
глюкоза
2АТФ
2НАДН2
белки
АТФ
АК
ПВК
КК
аланин
Печень
глюкоза
Кровь
аланин
глюкоза
2НАДН2
6АТФ
ПВК
Мочевина
аланин
67.
5. При интенсивной работе для нейтрализации лактатамышцы выделяют аммиак. В мышцах низкая активность
глу-ДГ, поэтому непрямое дезаминирование идет с
участием ИМФ-АМФ цикла.
Печень
Мышца
Глюкоза
Белки
Аминокислоты
белки
ИМФ
Глюкоза
Лактат
Лактат
АТФ
КК
Кровь
Мочевина
АМФ
NH3
NH3
68.
Липидный обмен• преобладает катаболизм липидов.
• Жирные кислоты, кетоновые тела в
аэробных условиях окисляются в
мышцах для получения энергии.
• В мышцах синтезируется немного
холестерина.
69.
Углеводный обмен
преобладает катаболизм углеводов.
глюкоза окисляется в аэробных или
анаэробных условиях для синтеза АТФ.
Из глюкозы в мышцах образуется аланин.
Глюкоза запасается в мышцах в форме
гликогена (до 1%).
Адреналин и Ca2+ в мышцах стимулируют
гликогенолиз, а также образование АТФ и
мышечное сокращение.
70. Энергетический обмен
• Энергетический обмен в состоянии покоя оченьнизкий, при интенсивной физической нагрузке
значительно возрастает.
• В белых (быстрых) волокнах преобладает
анаэробный гликолиз (субстрат глюкоза).
• В красных (медленных) мышцах преобладает
аэробное окисление жирных кислот, кетоновых
тел и глюкозы.
• Миокард в норме в качестве субстратов для
синтеза АТФ использует жирные кислоты (65 —
70%), глюкозу (15 — 20%) и молочную кислоту
(10 — 15%).
71.
Мышцы,которые
могут
длительно находиться в
состоянии
сокращения,
способны резервировать
кислород в миоглобине.
За счет миоглобина, мышцы
окрашены в красный цвет
в отличие от белых
скелетных мышц.
• S - медленно
сокращающееся
волокно (красное
волокно)
• F - быстро
сокращающееся
волокно (белое
волокно)
72.
• Основной потребитель АТФ - процессмышечного сокращения. Запасы АТФ
быстро истощаются.
Источники АТФ:
1) классический путь в реакциях
субстратного и окислительного
фосфорилирования.
2) при участии миоаденилаткиназы:
АДФ + АДФ → АТФ + АМФ
3) креатинфосфатный челнок.
73.
Креатинфосфатный челнокматрикс
АТФ (Окислительное фосфорилирование)
ВНУТРЕННЯЯ
МЕМБРАНА
МИТОХОНДРИЙ
МЕЖМЕМБРАННОЕ
ПРОСТРАНСТВО
АДФ-АТФтранслоказа
(ААТ)
АТФ
КРЕАТИН
креатинкиназа
АДФ
КРЕАТИН ФОСФАТ
САРКОЛЕММА
АДФ
МИОФИБРИЛЛА
КРЕАТИН ФОСФАТ
креатинкиназа
АТФ
КРЕАТИН
74.
Креатинфосфатный челнокпредотвращает быстрое истощение
запасов АТФ в мышце за счет:
1) запаса макроэргических связей в
креатинфосфате
2) креатинфосфат меньше АТФ, поэтому
быстрее чем АТФ доставляет энергию от
митохондрий к работающей миофибрилле.
Кф-путь возникает в миокарде только после
рождения, когда резко возрастает нагрузка на
сердце.
75. Характеристика быстрых и медленных скелетных мышц
ПоказателиЦвет
Активность
миозиновой
АТФазы
Утилизация энергии
Миоглобин
Частота сокращений
Длительность сокращений
Быстрая
скелетная
мышца
Медленная
скелетная
мышца
Белый
Высокая
Красный
Низкая
Высокая
Нет
Высокая
Малая
Низкая
Есть
Низкая
Большая
76. Миофибрилла
77.
МИОФИБРИЛЛАМиофибрилла — это
цилиндрическое
образование толщиной 1-2
мкм, простирающиеся на
всю длину мышечного
волокна.
Миофибрилла состоит из
одинаковых повторяющихся
элементов - саркомеров.
• Саркомер - функциональная
единица миофибриллы, от
1500 до 2300 нм.
Строение миофибриллы:
1. Тонкие филаменты
2. Толстые филаменты
3. Z-диски
78. 1. Тонкие филаменты
• Тонкие филаменты у гладких мышцобразованы F-актином и тропомиозином,
• У поперечнополосатых - F-актином,
тропомиозином и тропонинами I, Т и С.
«тонкие» филаменты ( 6 нм) присоединяются
к Z-дискам
79. Актин
• G-актин - мономерный (глобулярный) белок с массой43кДа.
• F-актин. При физиологической величине рН и в
присутствии магния G-актин нековалентно
полимеризуется с образованием F-актина нерастворимого двойного спирального филамента,
толщиной в 6—7 нм.
• G- и F-актин не обладают каталитической активностью.
• На поверхности F-актина через каждые 35,5 нм
располагаются минорные белки: тропомиозин и
тропонины I, Т и С.
80.
ТропонинТропомиозин
Тропомиозин - есть во всех мышцах: белок, состоящий из
а и р цепей, располагается в щели между двумя
полимерами F-актина.
Тропонины - есть только в поперечнополосатых мышцах:
1) Тропонин I (TпI) ингибирует взаимодействие между Fактином и миозином и также связывается с другими
компонентами тропонина.
2) Тропонин С (ТпС) — кальций-связывающий белок с
массой 17кДа, может связывать 4 Са2+, строение и
свойства аналогичны кальмодулину.
3) Тропонин Т (ТпТ) -связывается с тропомиозином.
81. 2. Толстые филаменты
• образованы миозином, размер 16нм.• располагаются в центре саркомера, между
«тонкими» филаментами.
• На поверхности с промежутками в 14 нм
располагаются головки миозина, с помощью
которых «толстые» филаменты
взаимодействуют с актином «тонких»
филаментов.
82.
МиозинАсимметричный гексамер с мол. массой
460кДа, состоит из 2 тяжелых (Н) и 4 легких
(L) цепей.
Части:
1) Фибриллярная часть -двойная αсуперспираль тяжелых цепей (Н), длина 150
нм. Ее свободный конец за счет COOHгрупп заряжен «-».
2) Глобулярная часть - 2 глобулярные
«головки» (G), каждая содержит 2 легкие
цепи (L) и глобулярную часть 1 тяжелой
цепи.
Глобулярные «головки», за счет -NH3+,
имеют «+» заряд. У скелетных мышц они
обладают АТФ-гидролизующей (АТФ-азной)
активностью.
(+)
(-)
83. 3. Z-диски
• Саркомер ограничен с двух сторон Z-дисками (αактинин).• К Z-дискам присоединены «тонкие» филаменты
Z-ДИСК
(α-АКТИНИН)
84.
Строение саркомера• Диск А (анизотропная зона)= темный участок –
образован «толстыми» нитями миозина.
• Зона Н - центральная область диска А, менее
плотная, чем остальная его часть, т к не имеет
«тонких» нитей актина. Размер зоны Н
уменьшается при сокращении мышцы.
• Более темная часть А диска образована и
«толстыми» и «тонкими» нитями.
85.
• Полоса М - пересекает центральную областьдиска А, образована толстыми нитями, в которых
миозин не имеет головок. Длина 150 нм. В нее
заходят «тонкие» нити актина.
• Диск I (изотропная зона) - светлый участок образован «тонкими» нитями актина. Размер диска
I уменьшается при сокращении мышцы.
• Диск I делит пополам очень плотная и узкая линия
Z, которая образована Z-дисками α-актинина.
86.
• Вследствие движения уменьшается длинакаждого саркомера (укорачиваются Н-зона
и I-диски) и всей мышцы в целом.
• При этом длина филаментов не
изменяется.
87.
• В скелетноймышечной ткани
саркомеры
миофибрилл
располагаются
параллельно.
• За счет этого на
срезах скелетные
мышцы выглядят
поперечнополосаты
ми
88.
Мышечное сокращениеАТФ
АДФ
1. Миозиновая головка может спонтанно
гидролизовать АТФ до АДФ и Фн, которые
при этом остаются в составе головки.
Миозиновая головка, содержащая АТФ или
АДФ и Фн, свободно вращается под
большими углами.
89.
2. При достижениинужного положения
миозиновая головка с
АТФ или АДФ и Фн
может связываться с Fактином, образуя актинмиозиновый комплекс, в
котором головка
миозина располагается
к оси фибриллы под
углом 90°. Актин
значительно ускоряется
АТФ-азную активность
миозина, в результате
весь АТФ гидролизует
до АДФ и Фн.
АДФ
АДФ
90.
3. У АДФ и Фн низкое сродство к актинмиозиновому комплексу, поэтому они отнего отделяются. При этом головка миозина
изменяет свой угол к оси фибриллы с 90° на
примерно 45°, продвигая актин (на 10—15
нм) в направлении центра саркомера.
АДФ
АДФ
91.
4. Новая молекула АТФприсоединяется к актинмиозиновому комплексу.
5. Комплекс актин-миозинАТФ обладает низким
сродством к актину,
поэтому миозиновая
головка с АТФ
отделяется от F-актина.
При этом наступает
расслабление.
Далее цикл повторяется
92. Механизм мышечного сокращения
93. Регуляция сокращения и расслабления мышц
• Любое мышечное сокращениеопосредуется Са2+.
• Кальциевые насосы постоянно
перекачивают Са2+ из саркоплазмы в
саркоплазматический ретикулюм (у
скелетных мышц) или межклеточный
матрикс (миокард) (при участии Сасвязывающего белка - кальсеквестрина).
• В результате в саркоплазме покоящейся
мышцы концентрация Са2+ =10-7-10-8
моль/л.
94. Са-регуляция
Ca2+Ca2+
• При действии
ацетилхолина на
ацетилхолиновые
рецепторы происходит
возникновение
потенциала действия.
• Он через Т-систему
достигает кальциевых
каналов
саркоплазматического
ретикулума
(рианодиновые
рецепторы).
• Кальциевые каналы
открываются, выпуская
Са2+ из
саркоплазматического
ретикулума в
саркоплазму, его
концентрация в ней
возрастает до 10-5
моль/л.
95. Актиновая регуляция
• Характерна дляпоперечнополосатых мышц.
• Мышечное сокращение
ингибирует тропомиозиновая
система на 2 стадии
сокращения: TпI мешает
присоединение миозиновой
головки к F-актину (изменяет
конформацию F-актина или
перемещает тропомиозин в то
положение, в котором он
блокирует сайты связывания
миозиновых головок на F-актине).
96.
• Поступающий в саркоплазмуСа2+ присоединяется к
тропонину ТnС.
• Комплекс ТnС•Са2+ реагирует
с TnI и ТnТ, влияя на их
взаимодействие с
тропомиозином.
• Тропомиозин при этом либо
отсоединяется, либо изменяет
конформацию F-актина и
появляется возможность
присоединения к нему
миозиновой головки тяжелой
цепи.
• Начинается сократительный
цикл.
97.
Расслабление происходит, когда:1) При перекачке Са2+ в ЭПР его
содержание в саркоплазме падает ниже
10-7 моль/л.
2) комплекс ТnС•Са2+ отдает Са2+
3) тропонин, реагируя с тропомиозином,
ингибирует дальнейшее взаимодействие
миозиновой головки с F-актином
4) миозиновые головки в присутствии АТФ
отделяются от F-актина, вызывая
расслабление
98. Миозиновая регуляция
Характерна для гладких мышц.• нет тропониновой системы,
• легкая цепь (р-цепь) миозина подавляет
его АТФ-азную активность и
препятствует присоединению миозина к
F-актину.
• В саркоплазме присутствует киназа
легких цепей миозина, зависимая от
Са2+. При повышении в саркоплазме
Са2+, он присоединяется к
кальмодулину. Комплекс кальмодулин4Са2+ активирует киназу легких цепей
миозина.
• Активная киназа легких цепей миозина
фосфорилирует легкую цепь р, которая
перестает ингибировать АТФ-азную
активность миозина и препятствовать
взаимодействию миозина с F-актином.
• В результате начинается
сократительный цикл
99.
Расслабление гладких мышц происходит, когда:1) содержание ионов Са2+ в саркоплазме падает ниже 107 моль/л
2) Са2+ отсоединяется от кальмодулина, который
отделяется от киназы легкой цепи миозина, вызывая ее
инактивацию
3) нового фосфорилирования легкой цепи р не
происходит, и протеинфосфатаза отщепляет от легкой
цепи ранее присоединившиеся к ней фосфаты
4) дефосфорилированная легкая цепь р миозина
ингибирует связывание миозиновых головок с Fактином и подавляет активность АТФ-азы
5) миозиновые головки в присутствии ATФ отделяются от
F-актина, а повторное их связывание произойти не
может из-за присутствия в системе
дефосфорилированной легкой цепи р.
100. Биохимические показатели крови и мочи, отражающие функциональное состояние мышечной ткани
• Аминотрансферазы -диагностика патологии печении миокарда. При инфаркте миокарда активность
АСТ повышена.
• Лактатдегидрогеназа- при инфаркте миокарда в
плазме крови повышена активность ЛДГ1, ЛДГ2.
• Креатинкиназа -КФК-ММ повышается в крови при
патологии скелетных мышц, КФК-МВ – при инфаркте
миокарда
• Альдолаза - активность увеличивается при глубоких
дистрофических процессах в мышечной системе.
Гиперальдолаземия -у больных с инфарктом
миокарда.
101.
• Тропонин Т -маркер инфаркта миокардав острой и подострой фазе.
• Миоглобин -маркер деструктивных
изменений в мышечной системе.
• С-реактивный белок (СРБ)увеличивается при инфаркте миокарда,
злокачественных опухолях, нефрите,
отдельных формах коллагенозов.
• Креатин -креатинурия при миопатии или
прогрессирующей мышечной дистрофии.
102. Миопатии
(греч. mys, myos мышца + pathos страдание,
болезнь) - нервно-мышечные заболевания,
характеризующиеся развитием первичного
дистрофического или вторичного
(денервационного) атрофического процесса
в скелетной мускулатуре.
Признаки:
мышечная слабость
двигательные нарушения
снижение сухожильных рефлексов
деформация костей и суставов
103.
МиопатииПрогрессирующие
мышечные дистрофии:
Невральные амиотрофии:
1) Нарушение обмена веществ,
расстройства микроциркуляции
1) Поражение:
2) Дистрофия мышечных
волокон
А) сегментоядерных
мотонейронов спинного мозга
3) Замещение соединительной
и жировой тканью
Б) периферических
нервных волокон
2) Нарушение иннервации
мышц
104. БИОХИМИЧЕСКИЕ ИЗМЕНЕНИЯ В МЫШЦАХ ПРИ ПАТОЛОГИИ:
• снижение содержания миофибриллярных белков• возрастание концентрации белков стромы и
некоторых саркоплазматических белков
(миоальбумина)
• снижение уровня АТФ и креатинфосфата
• снижение АТФазной активности контрактильных
белков (миозина)
• уменьшение количества имидазолсодержащих
дипептидов
• снижается уровень фосфатидилхолина и
фосфатидилэтаноламина
• повышается концентрация сфингомиелина и
лизофосфатидилхолина
105.
• нарушение метаболизма креатина и его усиленноевыделение с мочой (креатинурия).
• креатинурия является результатом нарушения в
скелетной мускулатуре процессов фиксации
(удержания) креатина и его фосфорилирования.
• если нарушен процесс синтеза креатинфосфата, то не
образуется и креатинин - его содержание в моче резко
снижается.
• в результате креатинурии и нарушения синтеза
креатинина резко повышается креатиновый показатель
(креатин/креатинин) мочи:
106.
Изменение активности ферментов в мышцах:
уменьшается активность ферментов,
локализованных в саркоплазме
изменяется активность ферментов, связанных
с митохондриями
возрастает активность лизосомальных
ферментов
снижается содержание цАМФ в мышечной
ткани
повышается активность фосфодиэстеразы
нарушается способность аденилатциклазы
активироваться под влиянием адреналина и
фторида натрия.
107. Ишемическая болезнь сердца
• ИБС - патологическое состояние,характеризующееся абсолютным
или относительным нарушением
кровоснабжения миокарда.
Причины:
• обменные заболевания
(атеросклероз, 97-98%).
• Воспалительные заболевания
(васкулиты, большие коллагенозы,
инфекционные поражения,
например сифилис)
• нарушение нервной регуляции
артерий, приводящее к их спазму.
• Наследственные заболевания
(дефекты сосудов)
108.
Классификацияишемической болезни
сердца:
1) первичная остановка
кровообращения;
2) стенокардия;
3) инфаркт миокарда;
4) сердечная
недостаточность;
5) аритмии.
инфаркт миокарда самая тяжелая и
распространенная острая
форма ишемической
болезни сердца.
109. Причины инфаркта миокарда
Инфаркт миокардаИнфаркт миокарда –ограниченный некроз
сердечной мышцы вследствие острого
несоответствия коронарного кровотока
потребностям миокарда.
Причины инфаркта миокарда
1. Атеросклероз коронарных артерий
2. Эмболы, тромбы коронарной артерии
3. Спазм коронарных артерий и резко повышение
потребности миокарда в кислороде при стрессе;
4. Эндокринных нарушениях, нарушающих
электролитный баланс.
5. Дистрофические изменения в миокарде
110. Биохимические изменения при ИБС
• гипоксия• Снижение: активности ферментов
аэробного дыхания, синтеза
клеточных структур, транспорта
субстратов, обмена веществ и
катионов.
• перестройка изоферментного
спектра
• изменение ионного равновесия
• накопление лактата, неокисленных
жирных кислот
• ацидоз
• снижение количества гликогена и
глюкозы
• активация СРО и накопление
токсичных продуктов ПОЛ
• Повреждение клеточных структур,
некроз
111.
Неблагоприятные факторы:• ↓АТФ
норма
• ↑ ПОЛ
• Ацидоз
• Дисбаланс электролитов
Некроз через 2 часа
• Ангиозные боли
• ↓ сократительной
активности миокарда Последствия
• ↓ АД
Нарушение
кровоснабжения
органов и тканей
Кардиогенный шок
Некроз через 18 часов
112. Диагностика ЭКГ
113.
Биохимическая диагностикаинфаркта миокарда
Аспартатаминотрансфераза (АСТ)
Аланинаминотрансфераза (АЛТ)
Креатинфосфокиназа (КФК, КФК-МВ)
Лактатдегидрогеназа (ЛДГ1,2)
Тропонины
Коэффициент Де-Ритиса (АСТ/АЛТ)
• При гипоксии миокард поглощает ТГ из
липопротеинов, которые не используются, а
накапливаются, приводя к ожирению миокарда.
• В условиях ИБС назначают безжировую диету,
повышают уровень ЛПВП в крови.
114. Терапия
СимптомТерапия
Лечение
сердечные гликозиды (строфантин),
вазопрессорные средства (норадреналин,
Нарушение гемодинамики мезатон)
альфа-адреноблокаторы (фентоламин,
Спазм артериол и ишемия аминазин в небольших дозах),
тканей
нитроглицерин
антикоагулянты (гепарин) и
Тромбообразование
антиагреганты
опиоидные анальгетики (фентанил,
морфин, промедол) и средство для наркоза Болевой синдром
азота закись
противоаритмические средства (например,
Аритмии
лидокаин)
115. План лекции
Биохимия межклеточного матриксагетерополисахариды
структурные и адгезивные белки
Минерализованная соединительная
ткань. Ремоделирование костной
ткани.
115
116. Межклеточный матрикс
Гетерополисахариды ипротеогликаны
Гликозамингликаны
гиалуроновая кислота
хондроитинсульфат
дерматансульфат
гепарансульфат
гепарин
кератансульфат
Протеогликаны
Белки
Структурные
коллаген
эластин
Адгезивные
фибронектин
ламинин
нидоген
(гликозамингликаны + белки)
116
117. Гликозамингликаны, или мукополисахариды (ГАГ)
• Линейные отрицательно заряженные гетерополисахариды,состоящие из повторяющихся дисахаридных звеньев (см. след.
слайд):
гексуроновая кислота (глюкуроновая или идуроновая)
ацетилпроизводное аминосахара (глюкоз- или галактозамина)
• Ацетилирование NH2 группы аминосахаров приводит к
исчезновению положительного заряда
• Карбоксильные группы кислот и сульфатные группы
ацетилпроизводных аминосахаров придают большой
отрицательный заряд – полианионные свойства, поэтому ГАГ:
связывают Na+, К+, Ca 2+, воду (молекула гиалуроновой кислоты
связывает 200 – 500 молекул воды, поэтому межклеточное
вещество приобретает характер желеобразного матрикса)
препятствуют прохождению отрицательно заряженных молекул,
клеток (например, белков и эритроцитов через базальную
мембрану клубочков почек)
117
118.
Дисахаридная единицагиалуроновой кислоты
(всего несколько тыс.
дисахаридных единиц)
Дисахаридная единица
дерматансульфата
Структуру других ГАГ для
ознакомления см. в
учебнике
118
119. Особенности строения отдельных ГАГ
• Кератансульфаты вместо гексуроновойкислоты содержат галактозу и кроме
дисахаридных единиц –фукозу,
маннозу, сиаловую кислоту
• Гепарин имеет большее количество
сульфатных групп за счет
сульфатированной глюкуроновой
кислоты
119
120. Функции гликозамингликанов и протеогликанов
Структурный компонент межклеточного матрикса
Формируют тургор тканей (гиалуроновая кислота)
«Смазка» в суставах (гиалуроновая кислота)
Фильтрационный барьер в почках (гепарансульфаты)
«Молекулярное сито»: препятствуют распространению
патогенных микроорганизмов
• Рессоры в суставных хрящах
• Прозрачность роговицы (кератан-, дерматансульфаты)
• Антикоагуляция (гепарин)
• Межклеточные взаимодействия, клеточная адгезия
(гепарансульфаты)
Самые распространенные ГАГ
- хондроитинсульфаты
(Х-4-сульфат, Х-6-сульфат): хрящи, кожа, связки, сухожилия,
артерии, роговица глаза
120
121. Протеогликаны – основное вещество межклеточного матрикса
Состав протеогликанов:• Гликозамингликаны (кроме гиалуроновой кислоты) –
90-95%
• Белковая часть – 5-10%
Примеры протеогликанов: агрекан, версикан (крупные),
декорин, бигликан, перлекан, люмикан, фибромодулин
(малые)
Связь гликозамингликана с белком осуществляется
через связывающий трисахарид: ксилоза – галактоза –
галактоза
Связывание осуществляется через ОН-группу серина,
треонина или NH2-группу аспарагина в молекуле белка
121
122. Протеогликаны: связь гликозамингликана с белком
А и Б – дисахариднаяединица гликозамингликана
122
123. Синтез протеогликанов
1. Синтез белковой части2. Образование линкерного трисахарида
3. Рост цепи гликозамингликана
Реакции 2 и 3 этапов осуществляют гликозилтрансферазы,
использующие в качестве субстрата активные формы сахаров
(связанные с УДФ).
• Все сахара синтезируются из глюкозы
• Источник NH2 – глутамин, ацетильной группы – ацетил-КоА,
сульфатной группы - фосфоаденозил-фосфосульфат (ФАФС)
Активация сахара: присоединение УДФ к С1фосфорилированному моносахариду при участии трансфераз:
Галактоза-1-фосфат + УТФ → УДФ-галактоза + Н4Р2О7
Нарушений синтеза протеогликанов не описано
123
124.
124Синтез хондроитинсульфата
125. Катаболизм гликозамингликанов и протеогликанов
• Полупериод жизни: 3 – 10 дней (кератансульфат 120дней)
• Осуществляют лизосомные протеазы, гликозидазы,
сульфатазы
• Отсутствие или снижение активности ферментов
приводит к нарушению катаболизма – лизосомные
болезни – мукополисахаридозы (МПС)
• Типология МПС основана на виде фермента,
недостаточность которого имеет место
Например, МПС 1 типа (синдром Гурлера) обусловлен недостаточностью идуронидазы.
Накапливаются дерматансульфат, гепарансульфат и в повышенных количествах выводятся с
мочой
Клиническая картина: помутнение роговицы, гепатоспленомегалия, тугоподвижность суставов,
дисплазия костей, грубые черты лица, ССЗ, отставание психического развития, смерть в
первые 10 лет жизни
125
126. Структурные белки соединительной ткани: Коллаген
• Коллагены – семейство полиморфных фибриллярныхбелков (19 типов коллагена), имеющих трехспиральную
структуру, сформированную скручиванием 3-х
полипептидных α-цепей
• Идентифицировано более 20 различных α-цепей, каждая из
которых кодируется отдельным геном. В разных тканях
экспрессируются различные комбинации генов
• Наиболее распространенные типы коллагенов: I, II, III, IV
• Коллагены I (кости, роговица, сухожилия), II (хрящи,
стекловидное тело), III (почки, печень, сосуды), IV
(базальная мембрана)
• Пример обозначения вида коллагена: [α1 (IV)]2 α2 (IV) –
коллаген IV типа, состоящий из 2-х альфа-цепей варианта 1
и одной альфа-цепи варианта 2
126
127. Коллаген: особенности строения
• Пептидная левозакрученная α-спираль коллагена содержит600 – 3000 АК (в отличие от α-спирали глобулярных белков
она более развернута: на одни виток приходится 3 АК)
• Гли-Про-ГидПро – Гли-Ала-ГидПро-Гли-Лей-ГидПро (в
спиральной цепи глицин всегда находится над глицином)
• Присутствие глицина в каждом триплете обеспечивает
плотность укладки 3-х цепей
• Модифицированные АК: гидроксипролин и гидроксилизин
• Коллаген – неполноценный белок. Отсутствуют цистеин,
триптофан, мало метионина, гистидина и тирозина
• Из 3-х α-цепей коллагена образуется правозакрученная
суперспираль (глицин расположен по центральной оси, что
способствует образованию линейной молекулы
тропоколлагена и включению ее в волокно)
127
128. Синтез и созревание коллагена
1. Внутриклеточный этап (фибробласты, хондробласты,остеобласты):
образование пре-про-α-цепи, содержащей сигнальный пептид,
облегчающий перемещение белка в ЭР
образование про-α-цепи
гидроксилирование пролина и лизина
гликозилирование ГидЛиз
образование дисульфидных связей в области N- и C-концевых
пептидов (внутри- и межцепочечных) для формирования тройной
спирали
образование проколлагена из 3-х про-α-цепей
2. Внеклеточный этап
частичный протеолиз N- и C-концевых неспирализованных
пептидов, образование тропоколлагена
дезаминирование лизина и гидроксилизина
образование фибрилл коллагена
128
129.
129130.
Гидроксилированиепролина
и
лизина
осуществляют
монооксигеназы (гидроксилазы). Кофактор – Fe2+ . Для поддержания
восстановленной формы железа необходимо присутствие витамина С.
Дефицит витамина С приводит к ломкости сосудов.
Образование ОН-групп необходимо для последующего образования
водородных связей между цепями, стабилизирующими структуру
130
тропоколлагена
131.
Гликозилирование ГидЛиз путем присоединенияостатков
глюкозы
и
галактозы
осуществляют
гликозилтрансферазы,
использующие
в
качестве
субстратов активные формы моносахаров. Роль
углеводных групп неясна, однако при синдроме ЭлерсаДанло-Русакова
(дефицит
лизилгидроксилазы
и
снижение
количества
углеводных
компонентов)
отмечается ухудшение механических свойств кожи и
131
связок
132.
132133.
Дезаминирование лизина игидроксилизина с образованием
реакционноспособного альдегида –
аллизина и гидроксиаллизина для
формирования ковалентных сшивок
(альдольной связи) между молекулами
аллизина тропоколлагена в процессе
фибрилогенеза
Количество «сшивок» между молекулами
тропоколлагена зависит от функции ткани и
133
возраста
134. Макрофибрилла коллагена
134135.
Зрелое коллагеновое волокно толщинойв 1 мм выдерживает нагрузку до 10 кг
135
136. Катаболизм коллагена
Коллаген – медленно обменивающийся белок (время полужизни –
недели, месяцы). Обмен более активен у молодых людей до 20
лет. Синтез коллагена увеличивается, например, при заживлении
ран.
О скорости обмена коллагена судят по содержанию
гидроксипролина в крови и моче (норма15-50 мг/сут у взрослых
после 20 лет).
Протеолиз осуществляет коллагеназа – Са2+, Zn2+ -зависимая
матриксная металлопротеиназа (ММР-1) – расщепляет молекулу
на 2 фрагмента (1/4 и ¾). Дальнейший протеолиз осуществляют
лизосомальные протеазы.
Коллагеназа – индуцируемый фермент (синтез в фибробластах и
макрофагах под влиянием цитокинов, эстрогенов и др.), механизм
активации – частичный протеолиз. Небольшое количество ММР
присутствует в матриксе в неактивной форме, ингибированные
специфическим ингибитором TIMP
Изменение активности ММР играет важную роль в патогенез ряда
заболеваний (деструкция хряща при ревматоидном артрите, развитие
сердечно-сосудистых патологий и др.). Например, снижение
активности ММР при сахарном диабете наряду с гликозилированием
коллагена способствует развитию микро- и макроангиопатий
136
137. Регуляция обмена коллагена
• Аскорбиновая кислота стимулирует синтезаколлагена, протеогликанов и пролиферацию
фибробластов
• Половые гормоны регулируют синтез коллагена
• Коллаген и N-концевые пептиды после
отщепления тормозят трансляцию коллагена
(отрицательная обратная связь)
• Кортизол снижает экспрессию генов коллагена,
ингибирует активность пролил- и
лизилгидроксилазы
137
138.
При старении• увеличивается количество поперечных сшивок
между молекулами тропоколлагена,
затрудняющих действие коллагеназы
• уменьшается соотношение гликозамингликаны
/ коллаген
• уменьшается количество связанной воды
• увеличивается сухость кожи
• изменяются свойства хряща и сухожилий
• снижается прозрачность роговицы глаза
«Человек стар в той степени, в какой постарела
138
его соединительная ткань» (Слуцкий Л.И., 1969)
139. Метаболизм коллагена
При патологии
Нарушение катаболизма приводит к фиброзу органов
Усиление распада происходит при аутоиммунных
заболеваниях
Нарушение синтеза. Основная причина – мутации в генах
коллагена (гены очень большие, что увеличивает
вероятность мутаций). Примеры таких патологий (известно
более 250 синдромов):
несовершенный остеогенез (повышенная ломкость костей,
аномалии зубов, гиперподвижность суставов)
хондродисплазии
синдром Стиклера и Вагнера – нарушение синтеза коллагена
в стекловидном теле с отслойкой сетчатки
семейная аневризма аорты
прогрессирующая миопия
139
140. Структурные белки соединительной ткани: Эластин
• Основной компонент волокон тканей, обладающих значительнойэластичностью (сосуды, связки, легкие)
• 70 кДа, структура кодируется 1 геном
• 800 АК: глицин, валин, аланин, пролин (70%), ГидПро мало,
отсутствуют ГидЛиз, цис, мет, три
• Нет строго определенной конформации
• Этапы синтеза эластина:
образование мономерной формы – тропоэластина
гидроксилирование пролина
образование аллизина (лизилоксидазная реакция)
взаимодействие аллизина разных цепей тропоэластина с
образованием десмозина (пиридинолина), который связывает между
собой 2, 3, 4 молекулы эластина
Наличие поперечных сшивок (структура десмозина) и гибкой случайной
140
конформации – основа «резиноподобных» свойств эластина
141. Эластин
• Время полураспада – 75 лет• Протеолиз под действием эластазы
(нейтрофилы)
• Нарушения образования эластина (в
частности десмозина) проявляются
патологиями сердца, легких, сосудов
(дефект сердечных клапанов,
аневризмы аорты, варикоз, эмфизема
легких)
141
142. Адгезивные белки соединительной ткани: фибронектин
• Димер (2 цепи сходны, но не идентичны, соединеныдисульфидными мостиками), гликопротеин, 2500 АК, 1 ген
• Альтернативный сплайсинг является причиной образования
различных по структуре и функциональной активности молекул
фибронектина в разных клетках
• Имеет домены для связывания с клетками, с биомолекулами
соединительной ткани, обеспечивая их ориентацию,
интеграцию, адгезию клеток
• Взаимодействие с биомолекулами происходит за счет
ковалентной связи между остатками лизина и глутамина под
действием трансглутаминазы, которая также связана с
фибронектином в одном из его доменов
• В опухолевой ткани снижено количество фибронектина, что
является одной из причин метастазирования
142
143.
Структура фибронектина143
144. Адгезивные белки соединительной ткани: ламинин
• Основной гликопротеинбазальных мембран
• 3 полипептидные цепи,
имеющие доменное
строение для связывания со
всеми структурными
компонентами базальных
мембран (коллаген IV,
протеогликаны, содержащие
гепарансульфат)
• N-концевые домены,
связывая Са 2+, образуют
сетевидные структуры
базальной мембраны
144
145. Адгезивные белки соединительной ткани: нидоген
• Сульфатированный гликопротеинбазальных мембран
• Одна полипептидная цепь
• Три глобулярных домена:
центр связывания ламинина
центр связывания коллагена IV типа
центр связывания гепарансульфата
145
146. Кость – минерализованная соединительная ткань
Функции: размер и форма тела, защита внутреннихорганов, минеральный гомеостаз, кроветворение
Основные клетки
остеобласты (синтезируют органический компонент)
остеоциты (участвуют в ремоделировании кости)
остеокласты (секретируют ферменты, разрушающие
органический компонент костного матрикса при
ремоделировании)
Твердый (минерализованный) межклеточный матрикс
неорганический компонент (65%): гидроксиапатиты
кальция Са10(РО4)6(ОН)2
органические соединения: коллаген I типа,
неколлагеновые белки, гликозамингликаны,
протеогликаны, фосфолипиды, цитрат – матрица для
146
формирования гидроксиапатитов
147. Костный обмен
Костный обмен (ремоделирование)включает:
резорбцию (разрушение) костной ткани
костеобразование (обновление,
реорганизация органической матрицы и
ее минерализация)
Ремоделирование костной ткани ускоряется при изменении
физической нагрузки на ткань (снижение массы тела при
похудании), при локальных воспалительных процессах
(ревматоидный артрит), гормональных изменениях (дефицит
эстрогенов, гиперпаратиреоз)
147
148. Минеральный состав и строение апатитов
Гидроксиапатит кальцияпридает костям прочность,
твердость;
хранилище кальция (99%) и
фосфора (85%).
Ионы занимают положение в
соответствии с их размерами,
величиной заряда и
удерживаются за счет
электростатических
взаимодействий: прочность
связи прямо пропорциональна
величине заряда и обратно
пропорциональна квадрату
расстояния между ними
Ячейка гидроксиапатита
Кристалл гидроксиапатита состоит из 2000 ячеек
148
149. Строение апатитов
Оптимальное расстояние между ионами Са2+ иРО43- задается органической матрицей.
Изменение строения компонента матрицы
приводит к нарушению минерализации или
образованию кристаллов неправильной
структуры, снижению прочности кости
Апатиты легко обмениваются ионами с
молекулами окружающей среды (изоморфные
замещения), изменяется коэффициент Са/Р (в
норме 1,33 – 2,0).
• Примеры изоморфных замещений:
при недостатке кальция в пище его место
занимает стронций (стронциевый апатит хрупкий)
при ацидозе (сахарный диабет, голодание) Са2+
замещается Н+ (кристаллы разрушаются)
149
150. Органические вещества кости: коллаген
Особенности строения коллагена I типа (остеоколлагена):Больше гидроксипролина, но меньше гидроксилизина
Менее гликозилирован, при гликозилировании
присоединяется галактоза (а не галактоза-глюкоза)
Содержит меньше межцепочечных ковалентных связей
(альдольных сшивок)
Содержит фосфорилированные остатки серина (для
связывания кальция)
Имеет специфические структуры – пиридинолин
(десмозин) и дезоксипиридинолин (изодесмозин) (см.
структуру эластина). Определение уровня данных
структур в моче используется в диагностике остеопороза
150
151. Органические вещества кости: неколлагеновые белки
• Большинство неколлагеновых белков – гликопротеиныили гликофосфопротеины; присутствуют и в других
тканях (например, эпителиальной)
• Остеонектин - связывает кальций, коллаген,
гидроксиапатиты, формирует центры кристаллизации и
инициирует процесс минерализации
• Остеокальцин (содержит карбоксиглутаминовую кислоту,
образованную при участии витамина К) – участвует в
Са2+-зависимом взаимодействии с фосфолипидами
мембран клеток, активирует остеокласты, уменьшает
связывание кальция с остеонектином, замедляет
образование центров кристализации; экспрессия гена
регулируется кальцитриолом; концентрация в крови
отражает активность остеобластов
151
• Gla (γ-глу)- протеин – активирует остеокласты
152. Органические вещества кости: неколлагеновые белки
Неколлагеновые белки, содержащие RGDпоследовательность: -Арг-Глу-Асп(комплементарна рецепторам остеокластов):• Сиалопротеин, остеопонтин – стимулируют
прикрепление остеокластов к кости; экспрессию
гена остеопонтина регулирует кальцитриол
Активированные остеокласты секретируют кислую
фосфатазу, которая дефосфорилирует сиалопротеин
и остеопонтин, вызывая потерю сродства к
рецепторам остеокластов; происходит снижение
активности остеокласта
152
• Тромбоспондин – адгезивный белок
153. Другие органические вещества кости
• Факторы роста и дифференцировки (IGF-1, TGF-β, PDGF)• Протеогликаны (ГАГ: хондроитин-, дерматан-, кератансульфаты)
– в гидратированном состоянии занимают большое по объему
пространство в межклеточном матриксе, которое в дальнейшем
должно стать костью; связывают кальций и являются его
источником в процессе минерализации
• Липиды: фосфатидилсерин играет ведущую роль в связывании
кальция на начальных этапах минерализации, обеспечении
кальцием растущих кристаллов гидроксиапатитов, образовании их
связи с белками
• Цитрат (активность цитратсинтазы высокая) – участвует в обмене
кальция, образуя нерастворимые и растворимые соли
Например, воздействие паратгормона на остеобласты способствует
активации остеокластов, снижению рН, разрушению кости, приводит
к увеличению содержания цитрата, образованию его солей с
кальцием и повышению кальция в крови
153
• Ферменты: кислая фосфатаза и щелочная фосфатаза (ЩФ)
154.
Прикрепление ЩФ кмембране остеобластов с
помощью
инозитолфосфатного якоря
154
155. Роль щелочной фосфатазы в костной ткани
• Проявляет активность на стадии минерализации (рН 9,6)• Катализирует реакцию дефосфорилирования
фосфорорганических соединений матрикса кости
• Повышая концентрацию РО43- , способствует
образованию центров кристаллизации и формированию
гидроксиапатитов
• Может переносить фосфатные остатки на органические
соединения (трансферазная активность), что приводит к
изменению активности фосфопротеинов, участвующих в
регуляции минерализации
• Отделившись от мембраны под действием фосфолипазы
С, может высвобождаться в кровоток (активность ЩФ
155
высокая у детей в период роста)
156. Ремоделирование костной ткани
• Каждые 10 лет костная ткань заменяется новой (ежегоднообновляется 5-10% скелета)
• Интенсивность обмена определяется соотношением
скоростей резорбции и костеобразования:
до 18 лет образование новой костной ткани идет быстрее,
чем резорбция
18 – 40 лет – равновесие процессов
после 40 лет скорость костеобразования снижается по
сравнению с резорбцией, развивается остеопороз
Ремоделирование = Резорбция (2-3 нед) + костеобразование
(2-3 мес)
156
157. Этапы цикла ремоделирования костной ткани
1. Активация: остеобласты под влияниемстимулирующих факторов секретируют
фактор RANKL (receptor activator of nuclear
factor KB ligand), стимулирующий
образование колоний моноцитов,
формирующих остеокласты
коллагеназу, которая гидролизует коллаген
остеоида (для связывания остеокласта с
костью)
остеокальцин, сиалопротеин, остеопонтин,
Gla-протеин, которые участвуют в
прикреплении остеокласта к кости
157
158. Этапы цикла ремоделирования костной ткани
2. Резорбция: «работа» остеокластовПрикрепление остеокласта к кости
Карбоангидразная реакция и диссоциация угольной
кислоты с образованием Н+
Перекачивание протонов из остеокласта в зону
резорбции при помощи Н+ -АТФ-азы, Н+,К+ - АТФ-азы,
переносчиков Сl- / Н+ и образование «щеточной» каемки
(рН 3,5 – 4)
Секреция лизосомальных ферментов – гидролаз
Гидролиз коллагена и разрушение органической матрицы
Вымывание кальция из апатитов
Образование в кислой среде растворимых солей цитрата
кальция и их поступление в кровь
158
159.
159Активация остеокластов в процессе костной резорбции
160. Этапы цикла ремоделирования костной ткани
3. РеверсияДействие локальных ростовых факторов на остеобласты
приводит к синтезу белков матрикса, секреции
остеопротегерина, который связывает RANKL и снижает
активность остеокластов
Секреция кислой фосфатазы остеокластами приводит к
дефосфорилированию остеопонтина, сиалопротеина
(белки-активаторы остеокластов), снижению активности
остеокластов и к переходу к следующей стадии
ремоделирования – костеобразованию
4. Костеобразование (минерализация): усиление
оксигенации, синтез белков, протеогликанов,
фосфорилирование белков матрикса (условие для
формирования центров кристаллизации), формирование
центров кристаллизации, рост кристаллов. По
завершении процесса остеобласты теряют активность и
превращаются в остеоциты.
160
161. Регуляция ремоделирования
• Паракринно-аутокринная (местная)регуляция: цитокины, фаторы роста,
простагландины костной ткани
• Системная регуляция
Основные регуляторы:
Паратгормон
Кальцитриол
Кальцитонин
Половые гормоны
161
162. Регуляция ремоделирования
162163. Регуляция ремоделирования
163164. Регуляция ремоделирования
ПК А фосфорилирует белокпереносчик Са2+, чтоприводит к поступлению Са2+
в цитозоль остеокласта из
зоны резорбции;
это вызывает деполяризацию
мембраны и инактивацию
остеокласта
Кальцитонин оказывает большее влияние на растущие кости, поэтому
образование костной ткани у детей и подростков происходит быстрее
164
165. Регуляция ремоделирования
• Кортизол замедляет костеобразование: подавляетпролиферацию остеобластов, синтез остеоколлагена,
остеонектина, протеогликанов
• Кортизол стимулирует костную резорбцию: индуцирует
синтез рецепторов к паратгормону
• Андрогены стимулируют в остеобластах синтез фактора,
ингибирующего дифференцировку преостеокластов
(наступление половой зрелости тормозит рост скелета в
длину). Анаболический эффект гормонов наиболее
активно проявляется в присутствии гормона роста
• Гормоны щитовидной железы. При гипертиреозе
увеличивается скорость обмена кости, повышается
экскреция кальция с мочой, костеобразование начинает
отставать от резорбции. При гипотиреозе замедляется
образование и минерализация кости
165
166. Регуляция ремоделирования
• Гормон роста повышает активностьостеобластов, которые стимулируют
остеокласты, поэтому происходит
очаговая деминерализация, затем
увеличение объема органической
основы кости и ее минерализация
• Инсулин активирует метаболизм
остеобластов, стимулирует синтез
костного матрикса, обеспечивает
минерализацию костной ткани.
166
167. Регуляция ремоделирования
В остеобластахэстрогены стимулируют
синтез остеоколлагена,
остеонектина, ЩФ.
Вызывают раннюю
минерализацию,
поэтому в период
полового созревания
происходит остановка
роста скелета
Эстрогены
стимулируют
синтез 1-αгидроксилазы
в почках
(синтез
кальцитриола)
и рецепторов к
кальцитриолу
в энтероцитах
167
168. Маркеры метаболизма костной ткани
• Для большинства патологических состояний характерноускорение ремоделирования кости с усилением процесса
резорбции
Маркеры резорбции костной ткани:
пиридинолин, дезоксипиридинолин (продукты деградации
остеоколлагена)
остеопротегерин (остеокласт-ингибирующий фактор) /
RANKL (стимулятор образования остеокластов)
Маркеры формирования костной ткани:
остеокальцин (активатор остеокластов) – снижение
содержания – усиление минерализации
щелочная фосфатаза
специфические пептиды проколлагена I типа
168






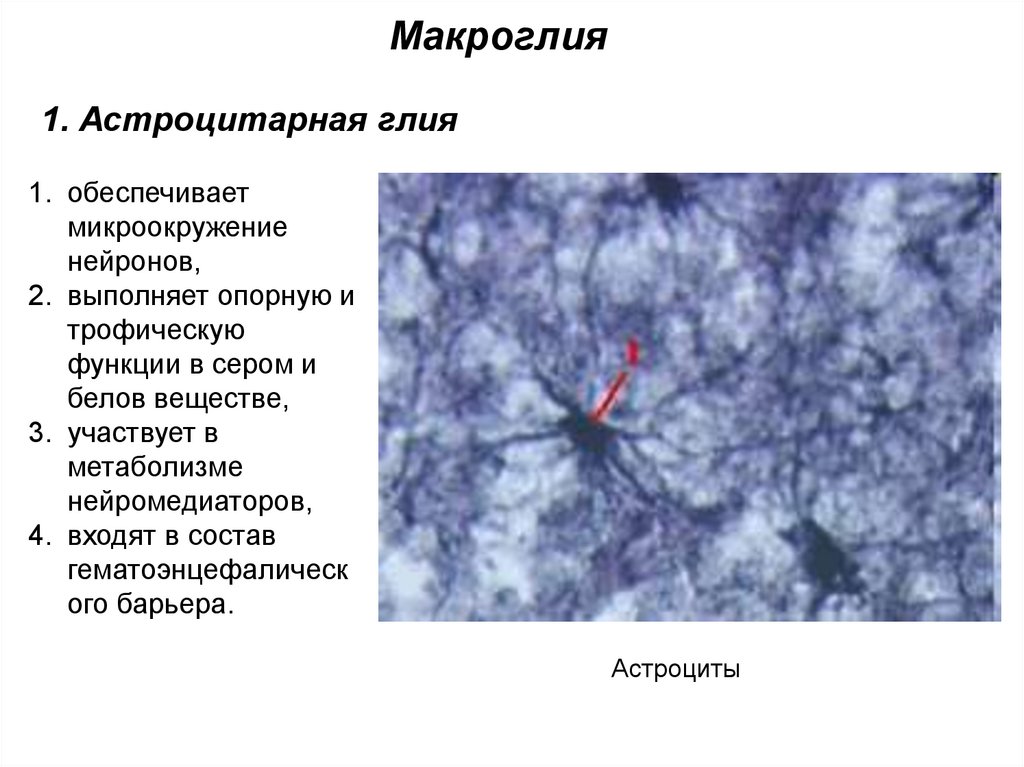
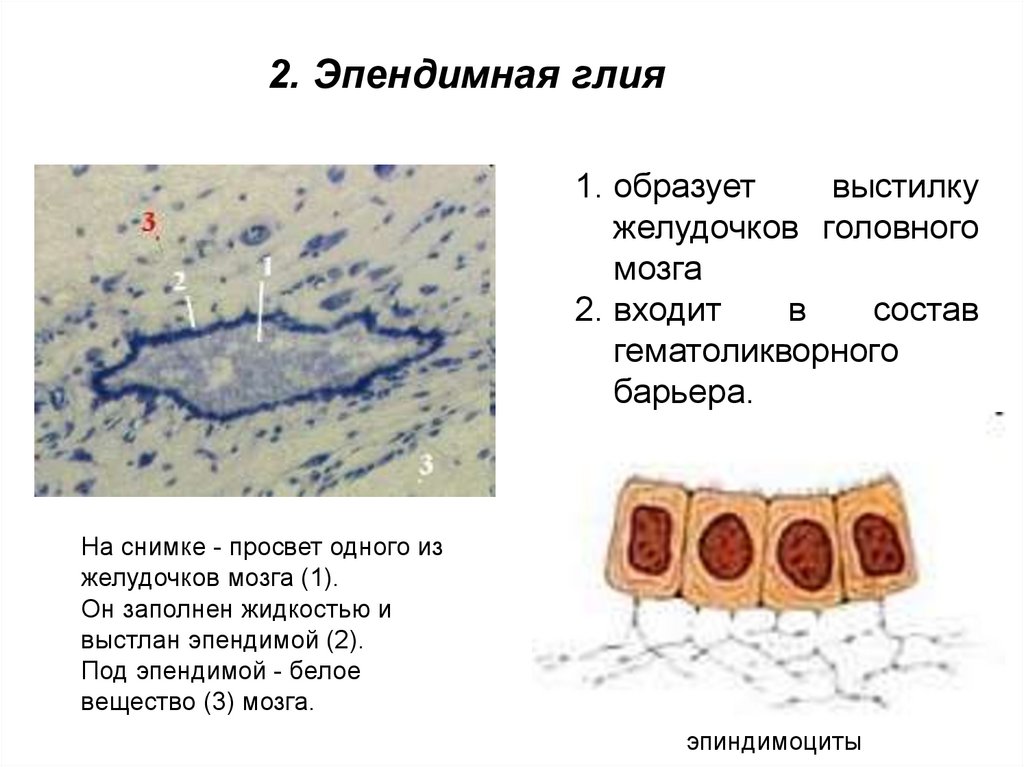
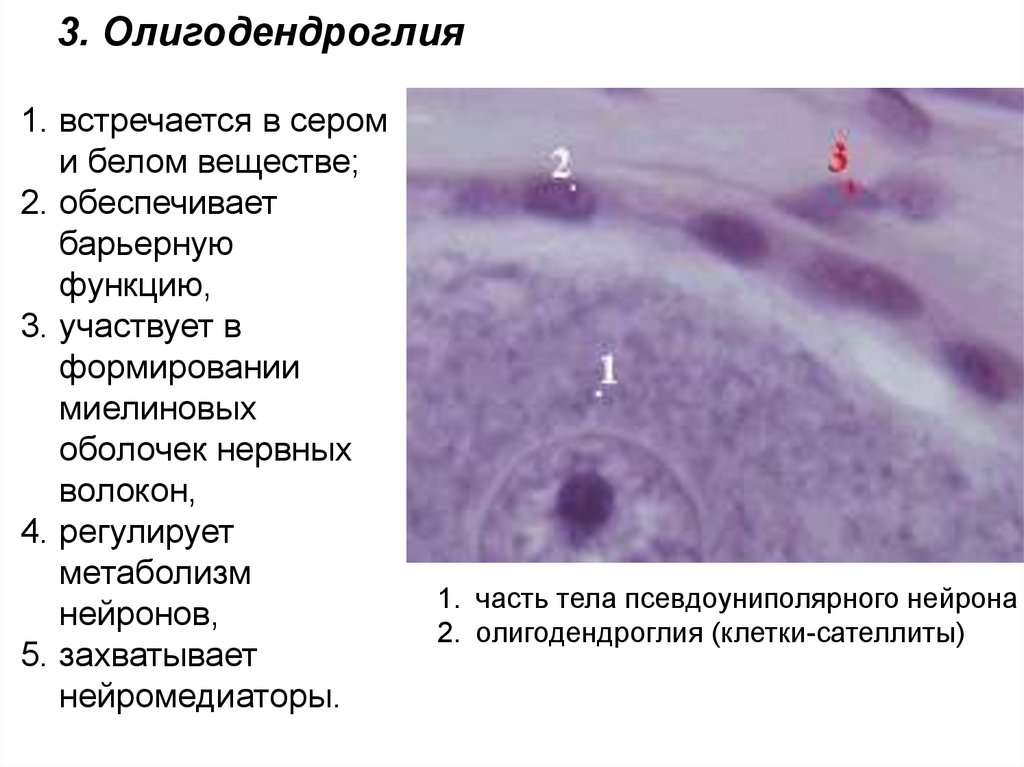


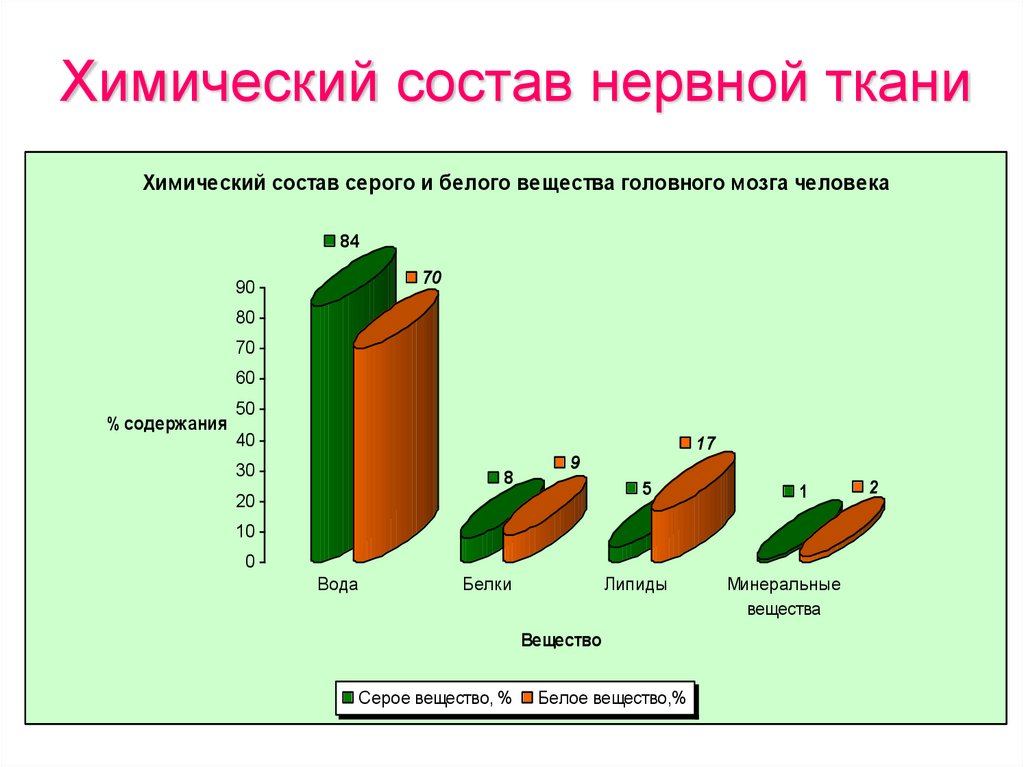



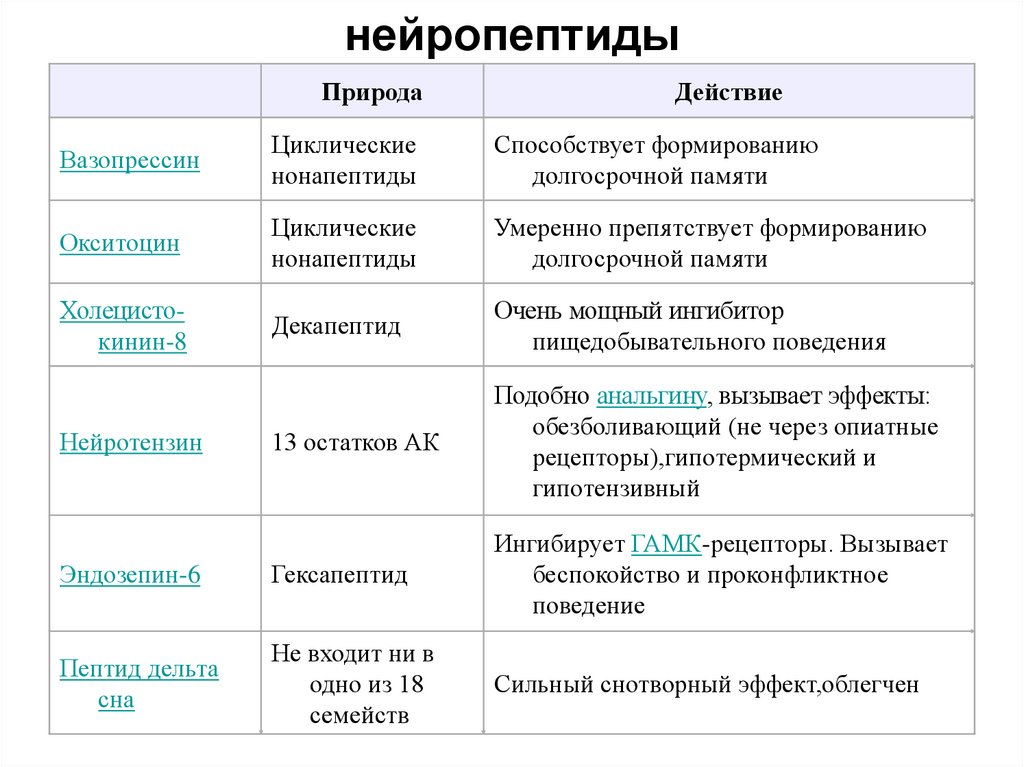
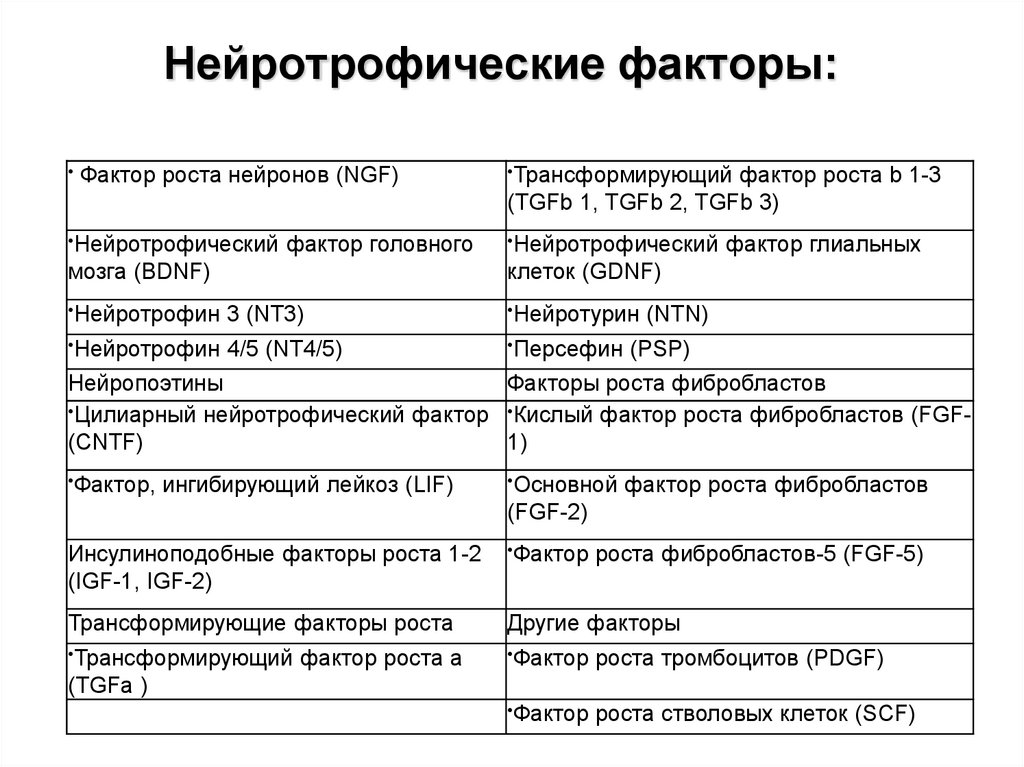













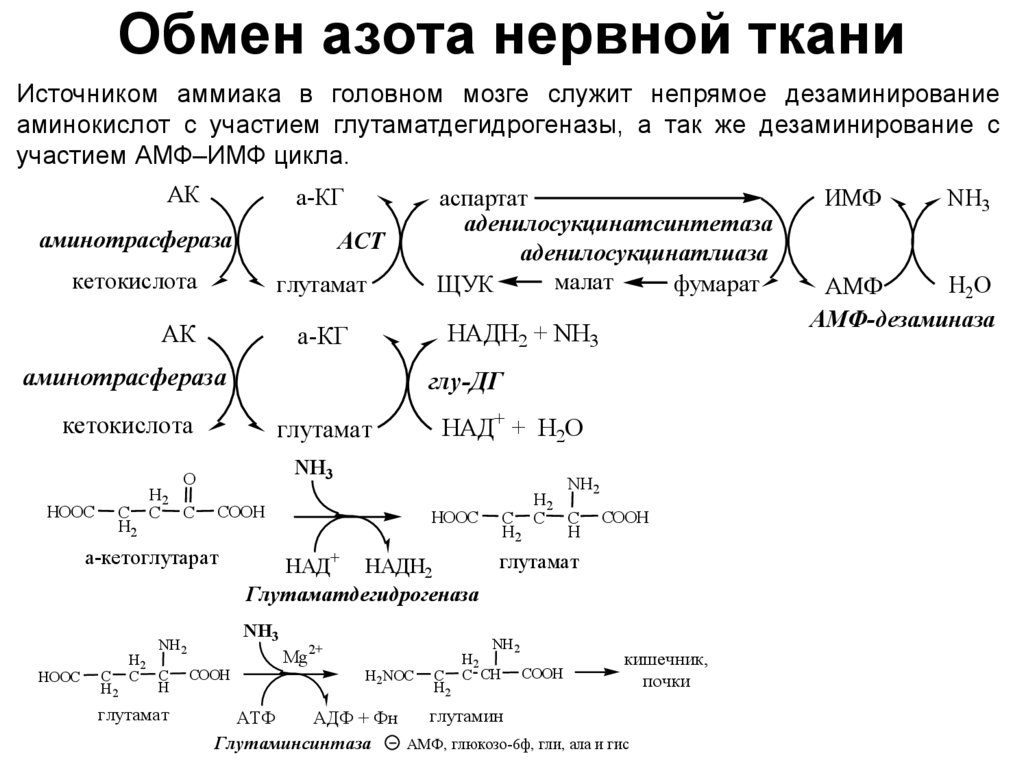



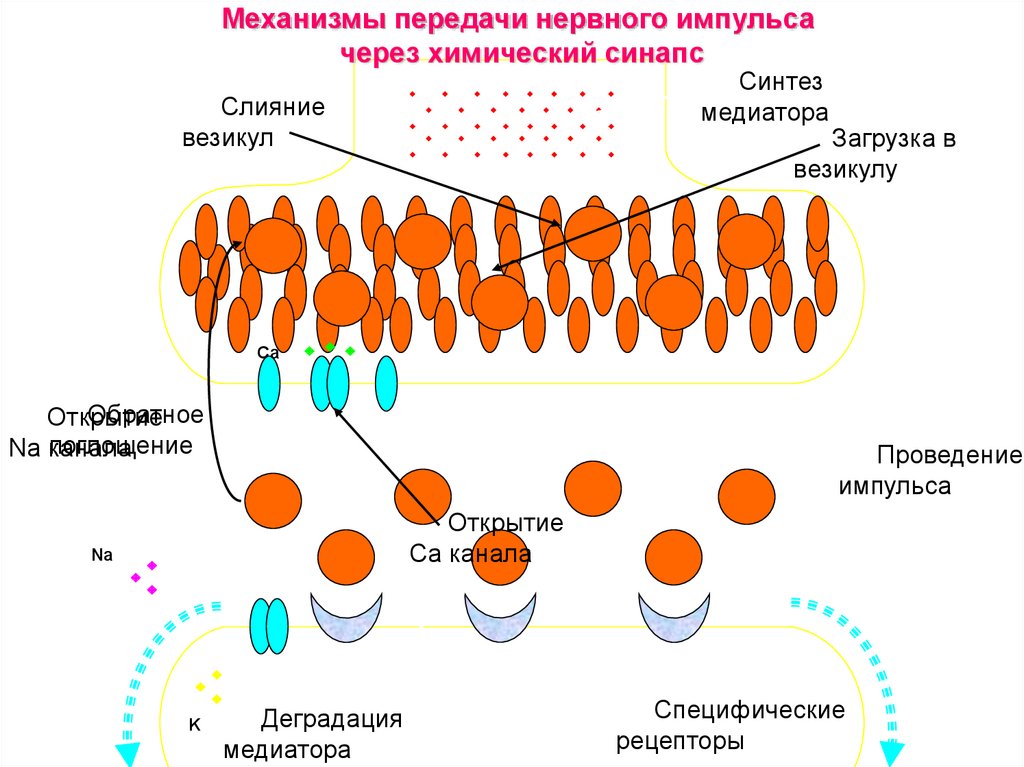
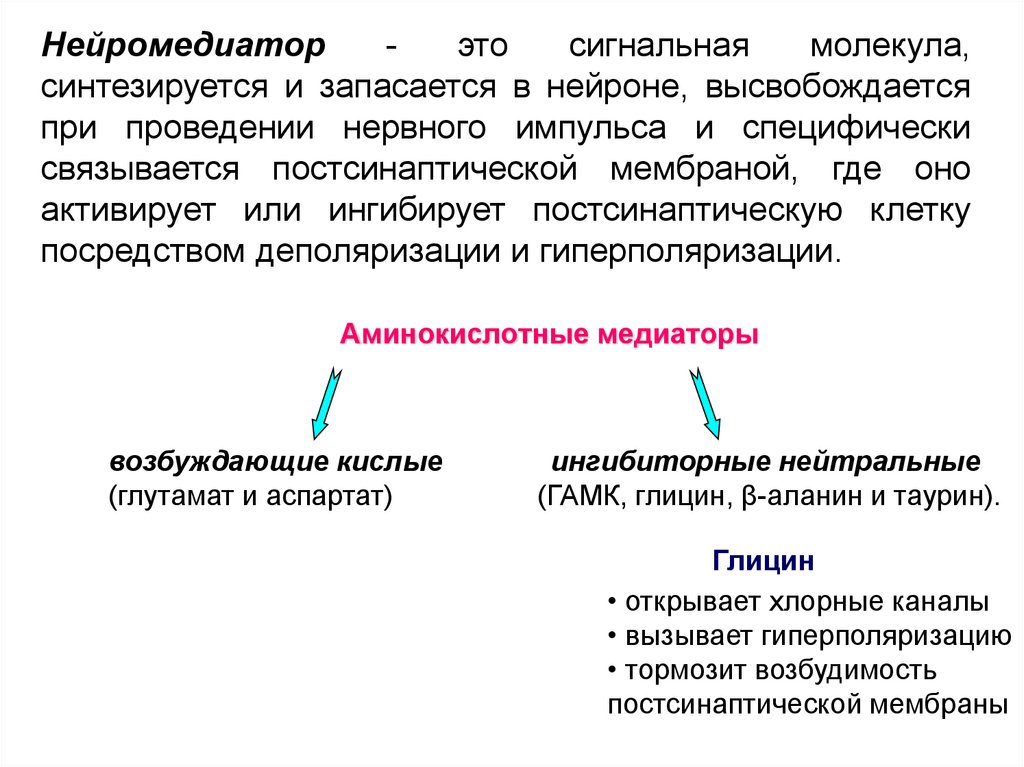
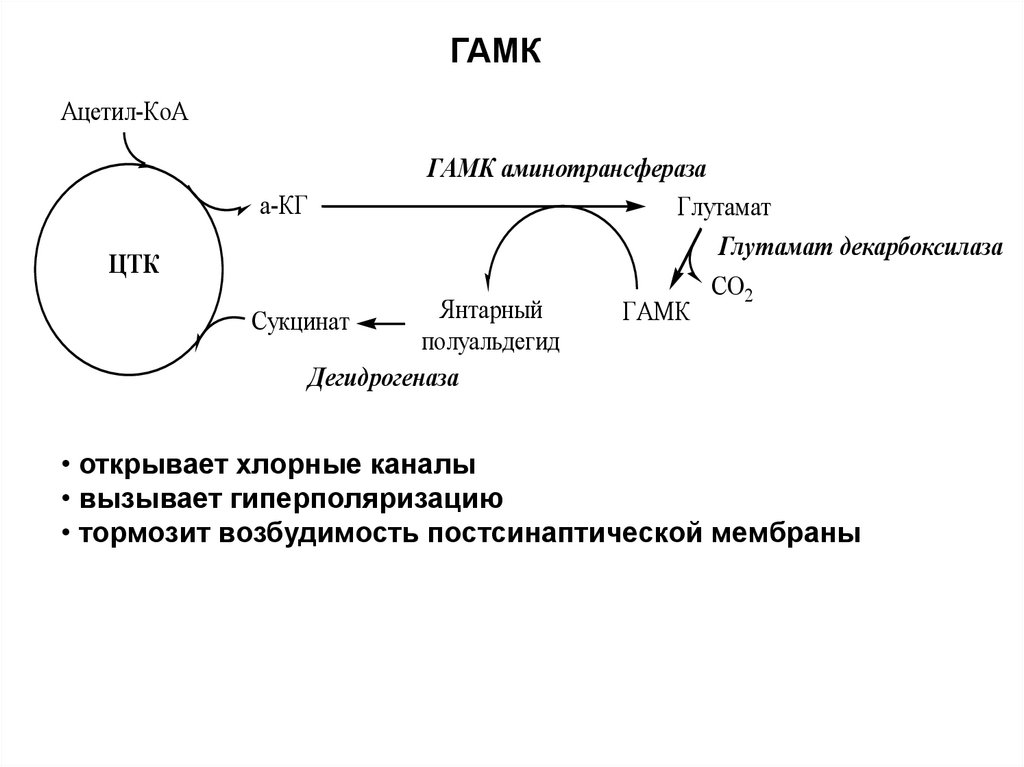
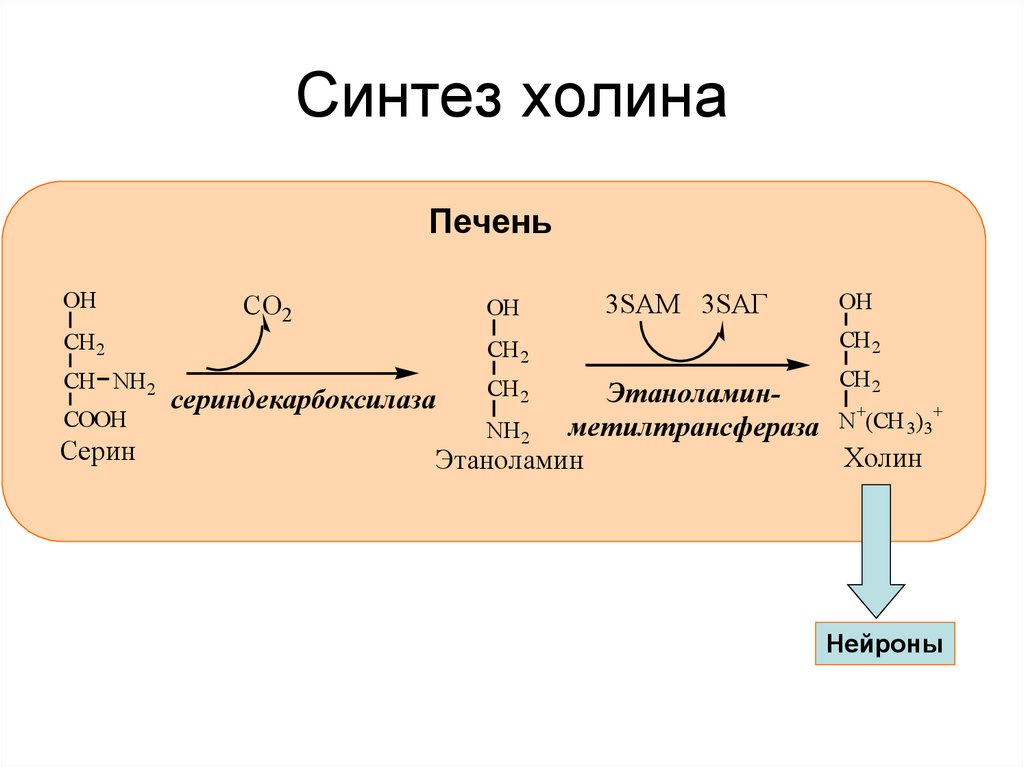
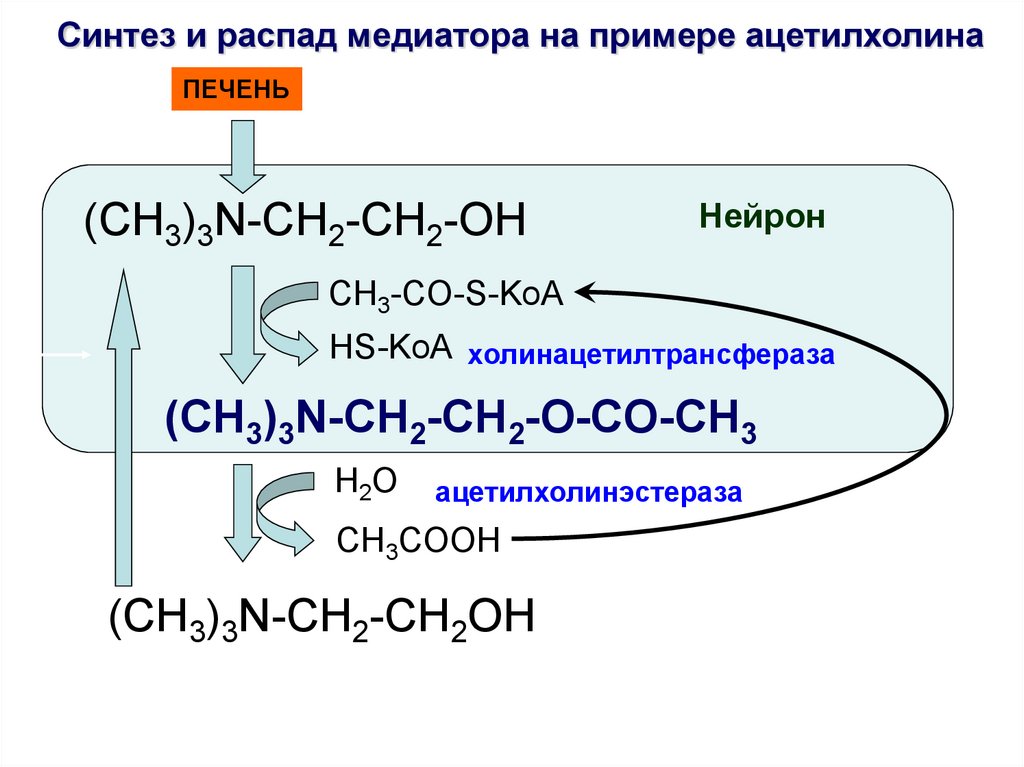



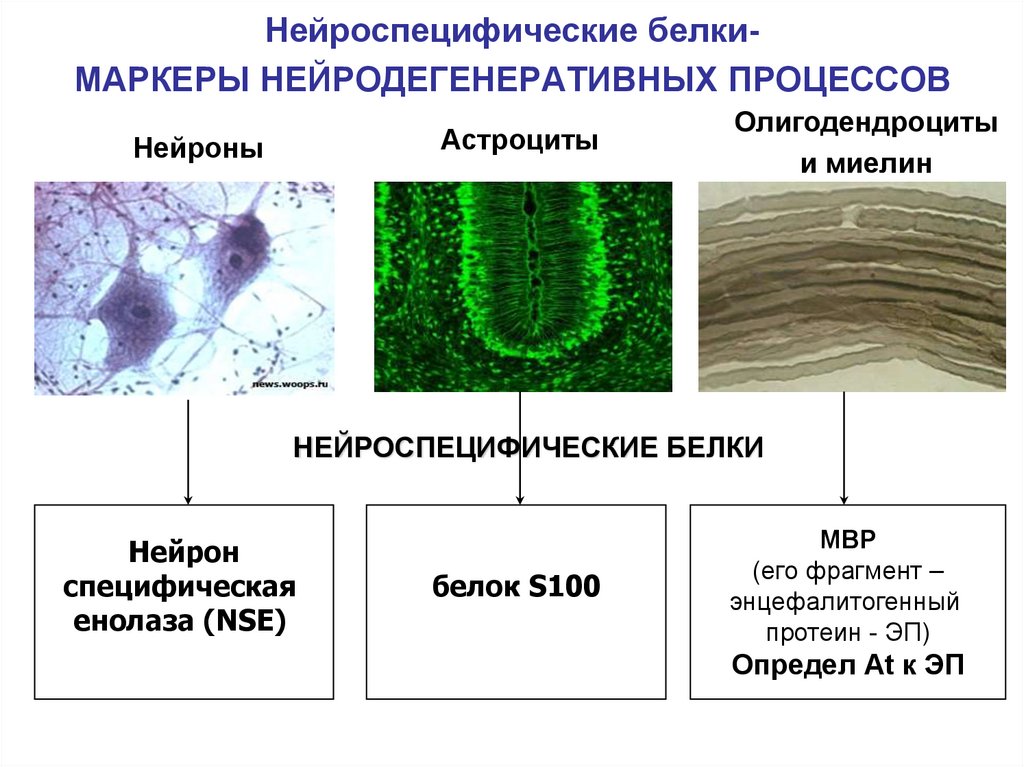
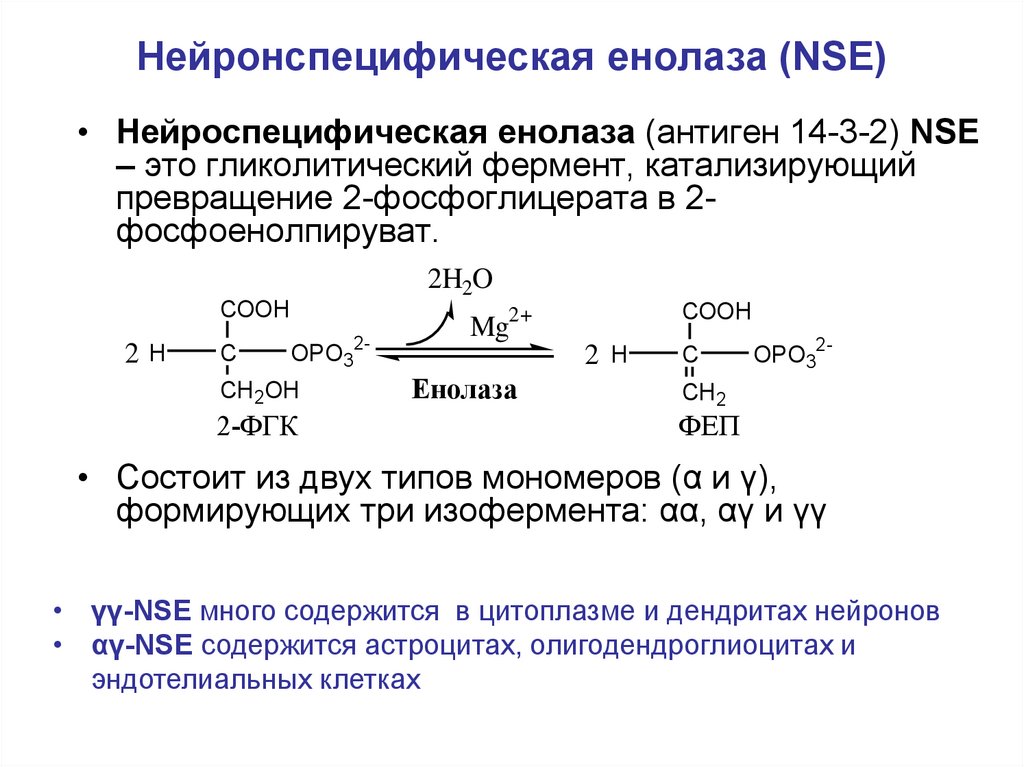






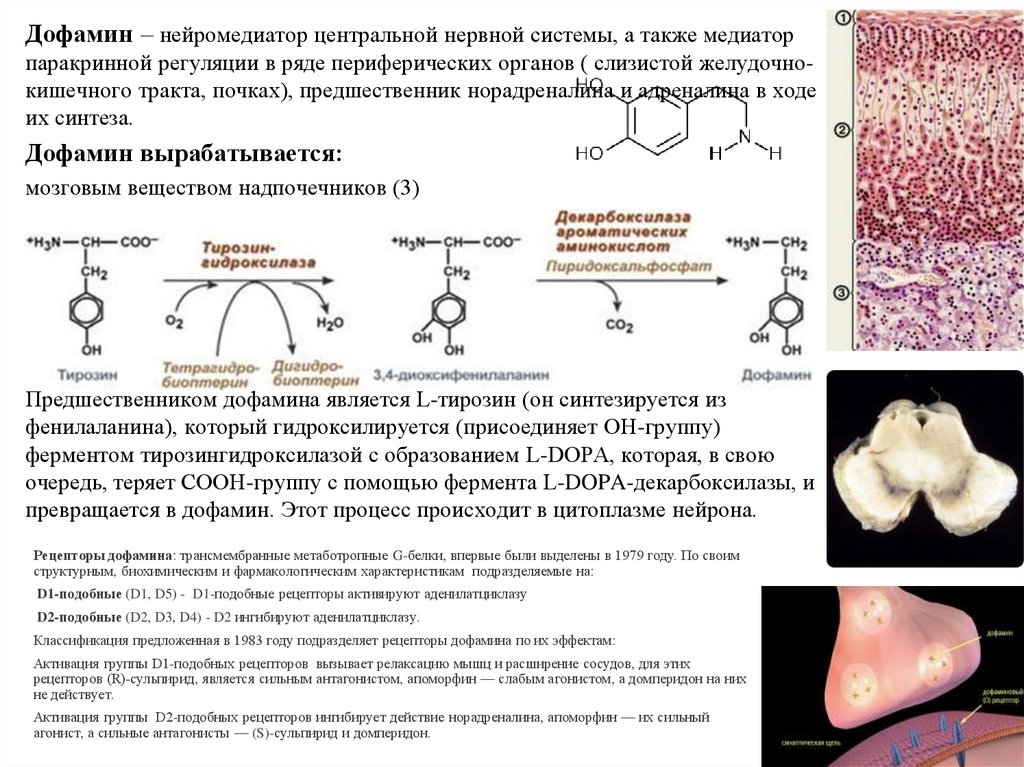
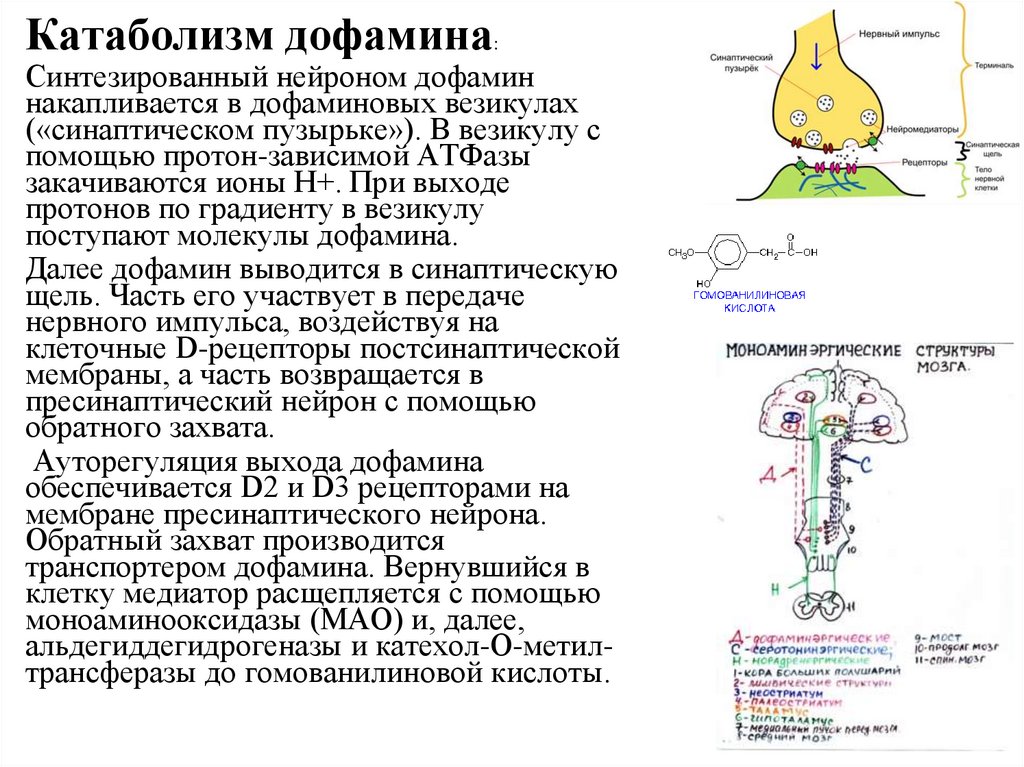

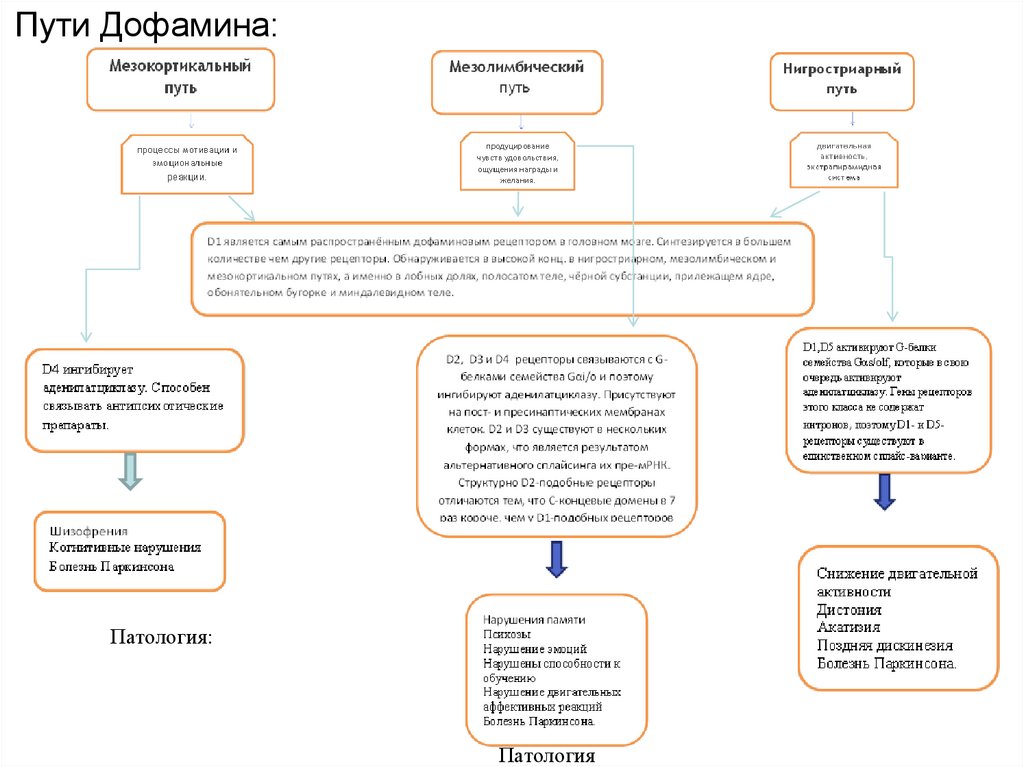
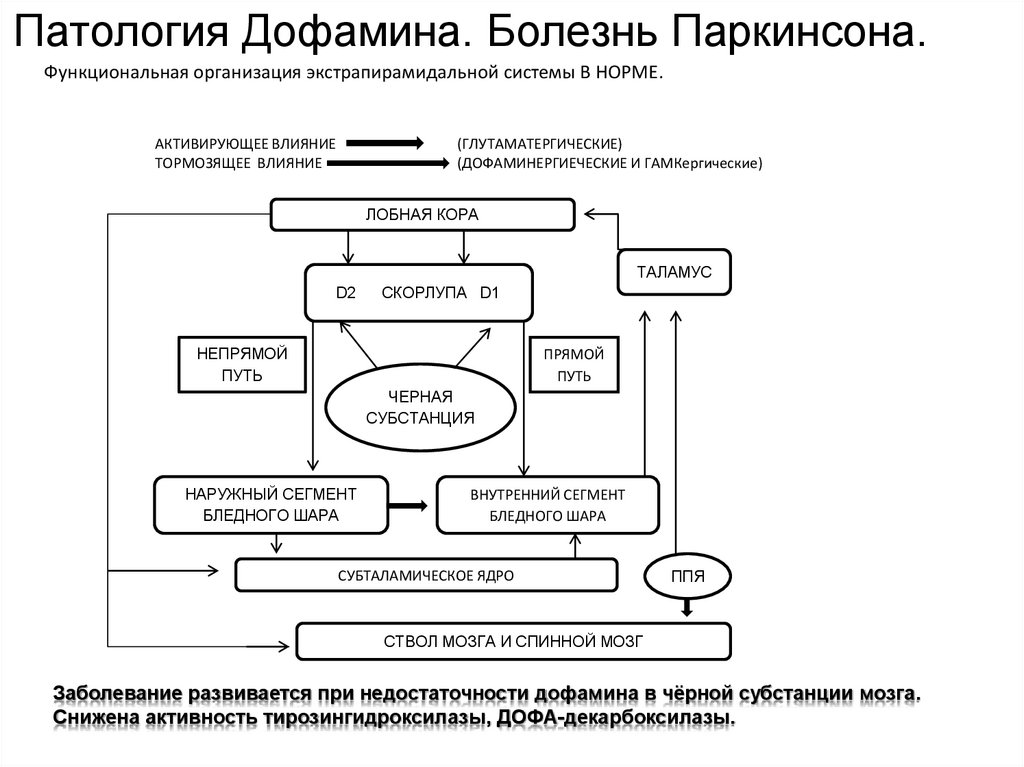
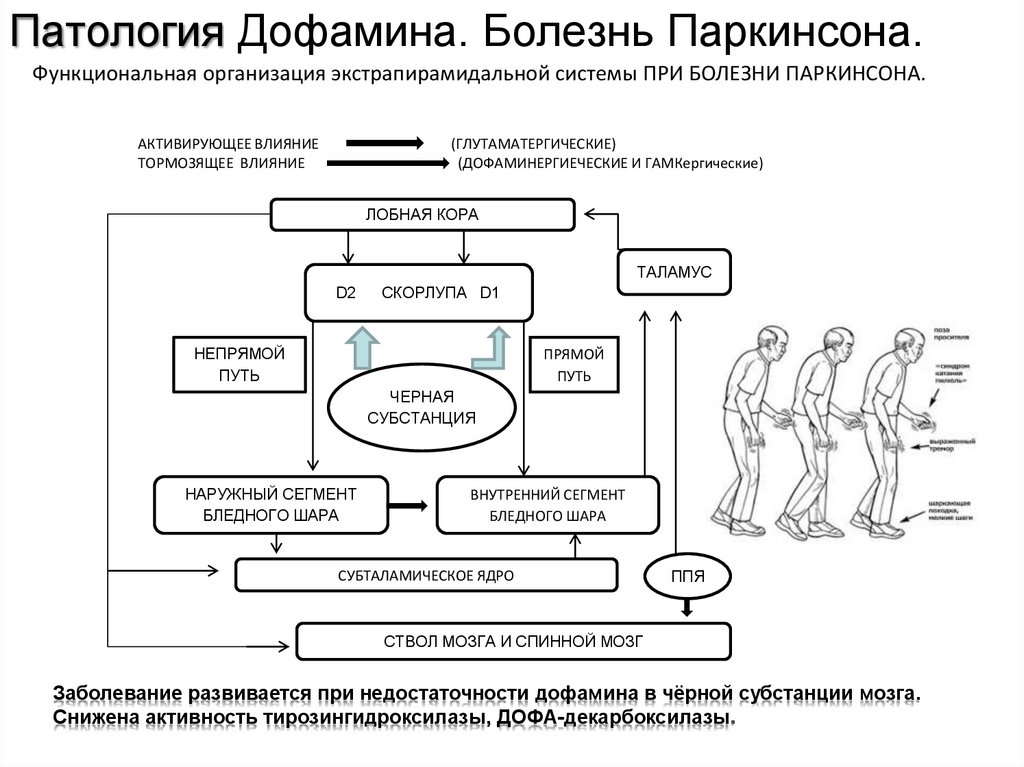

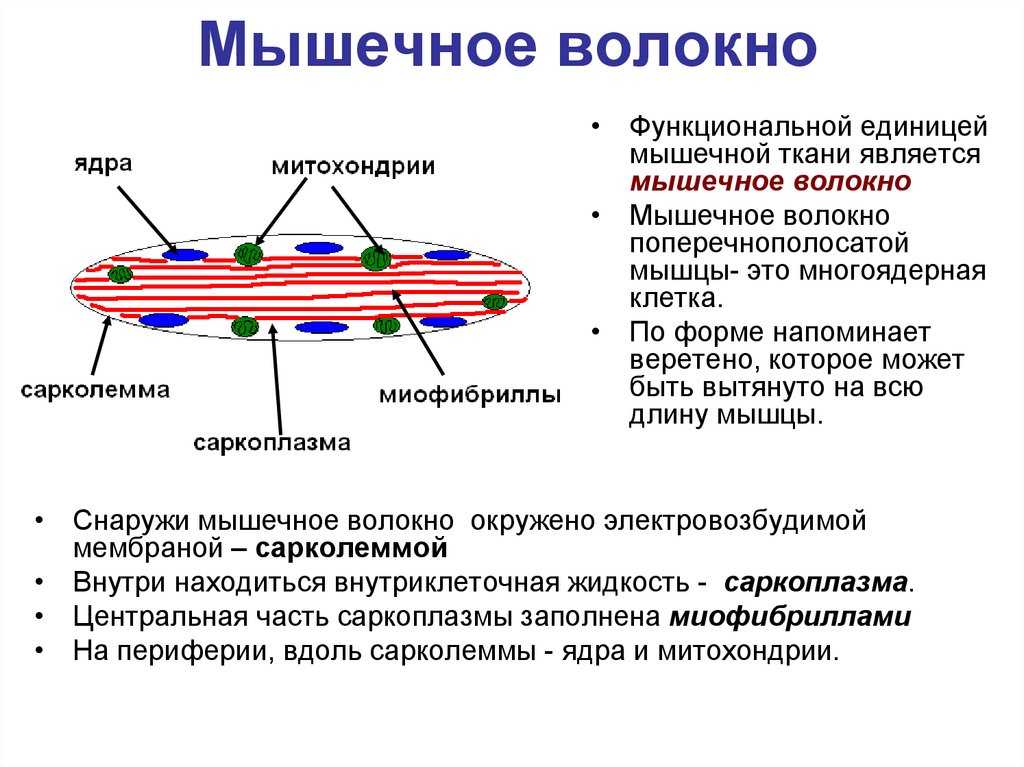
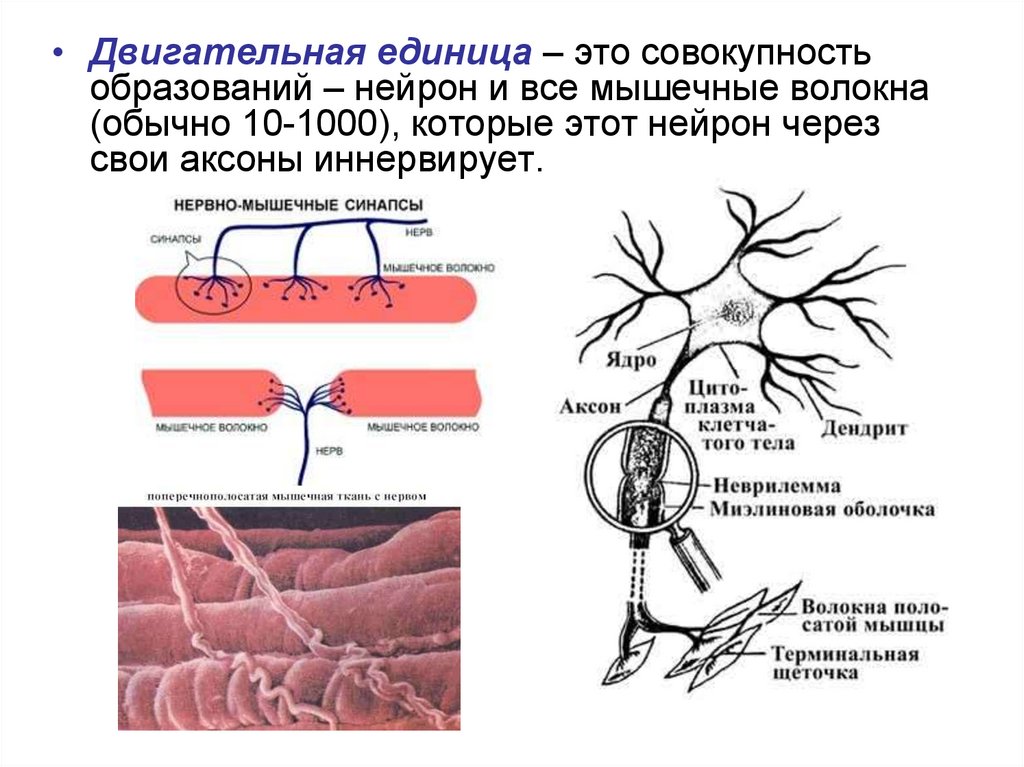
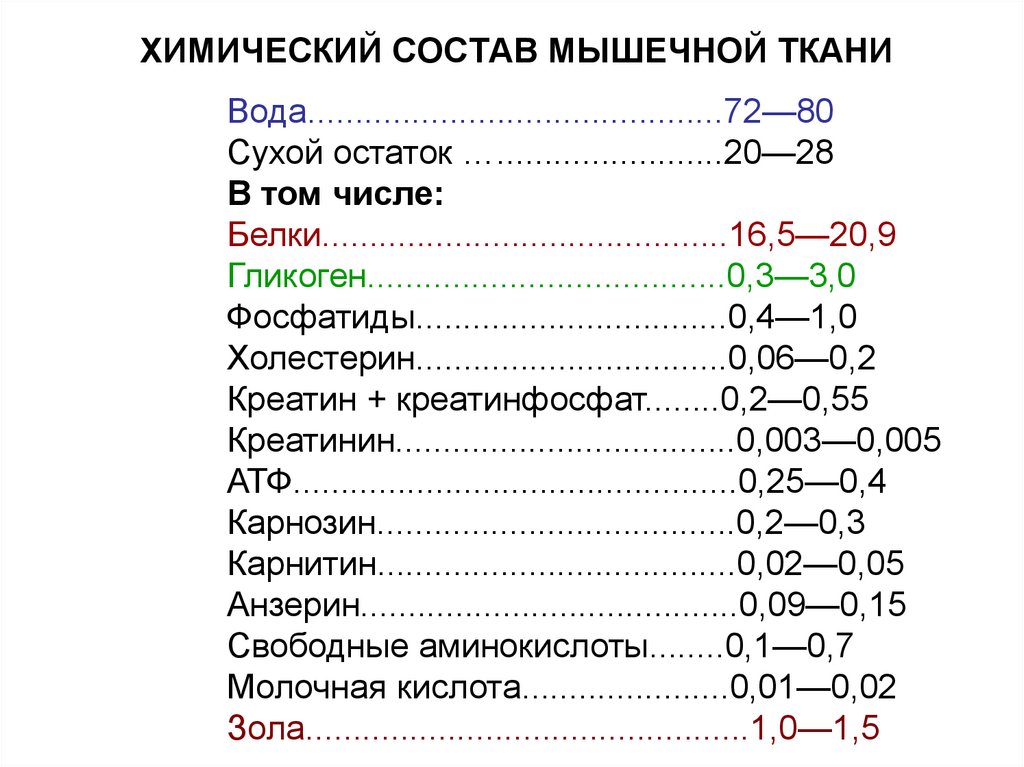



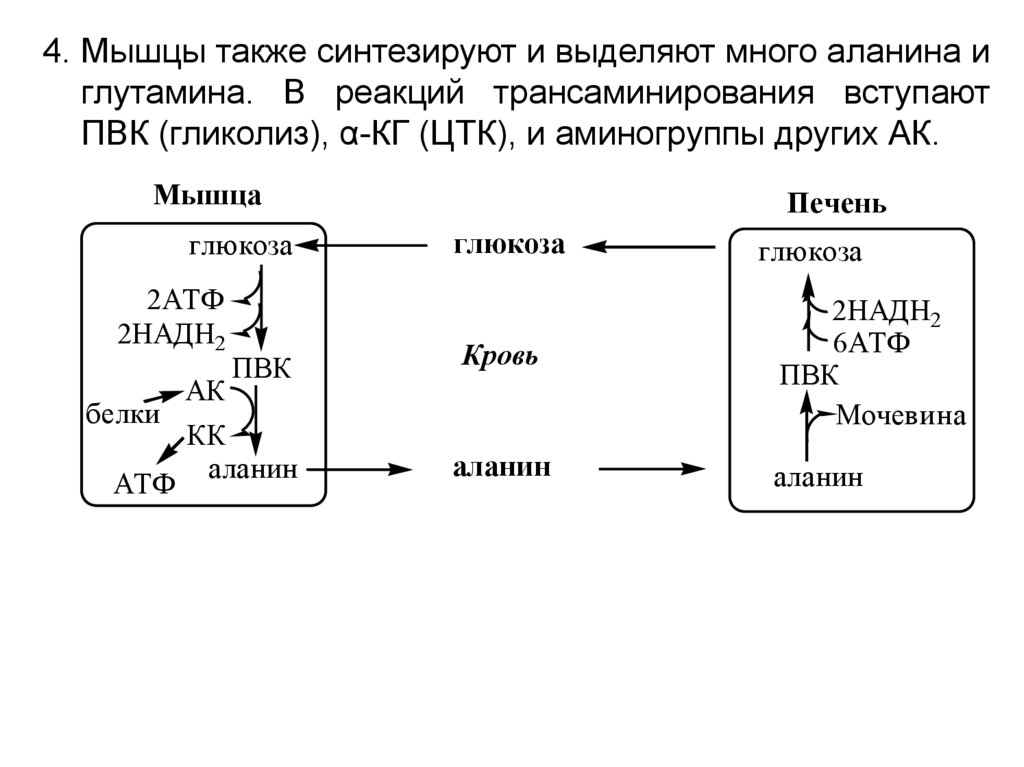
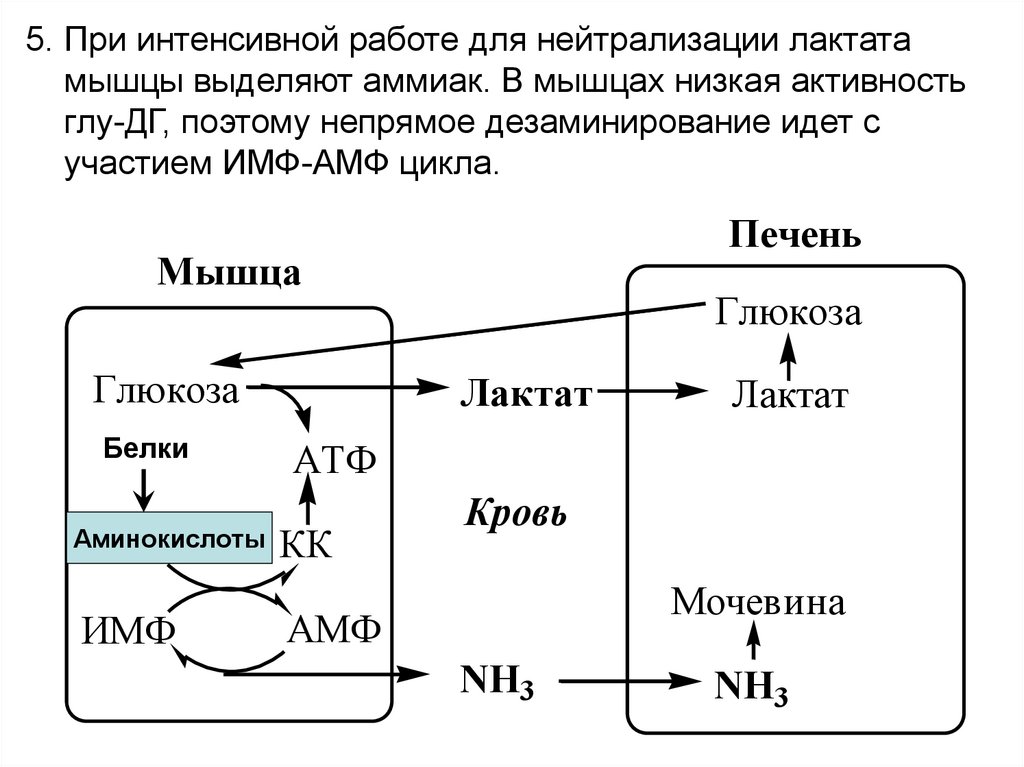





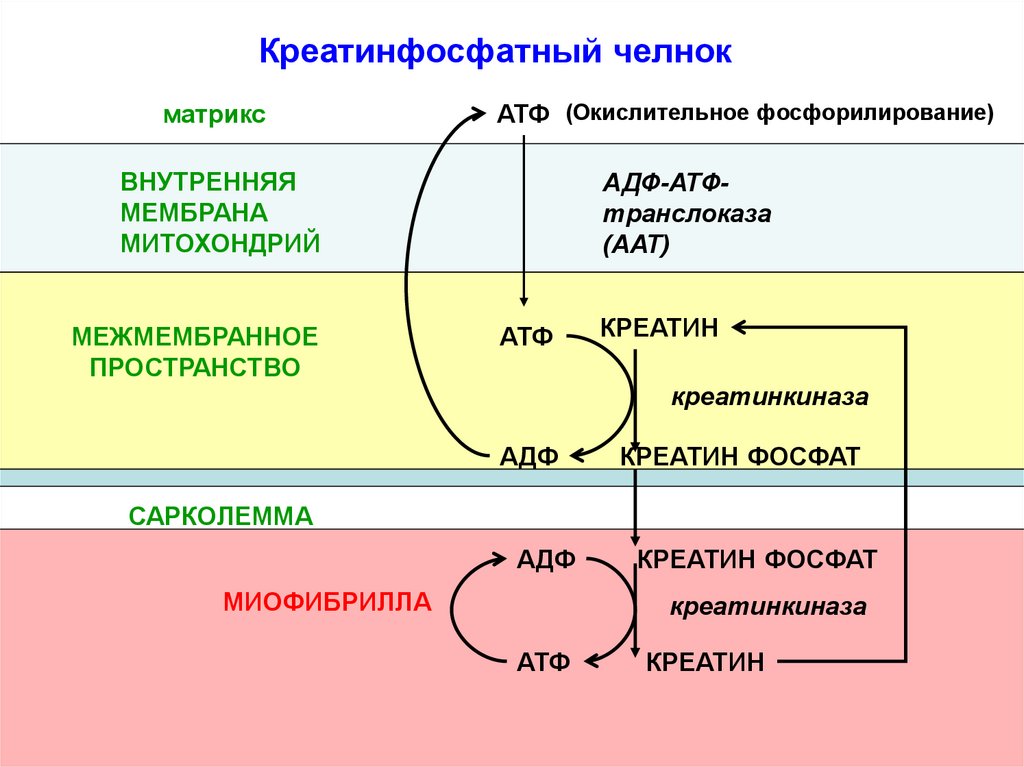


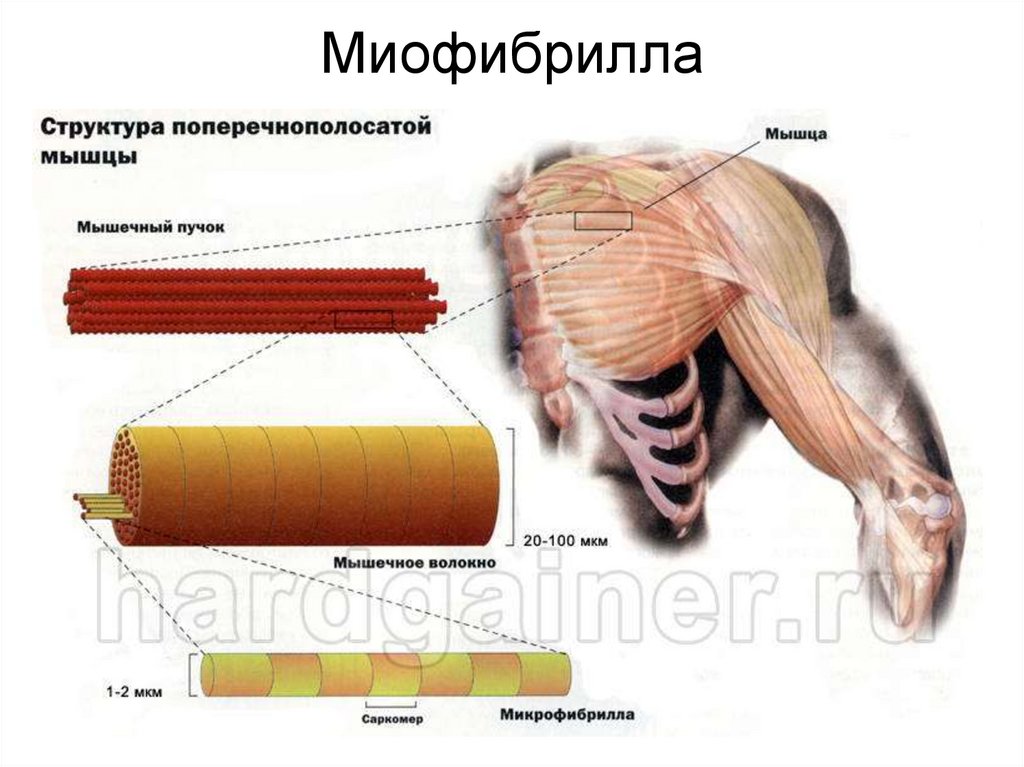
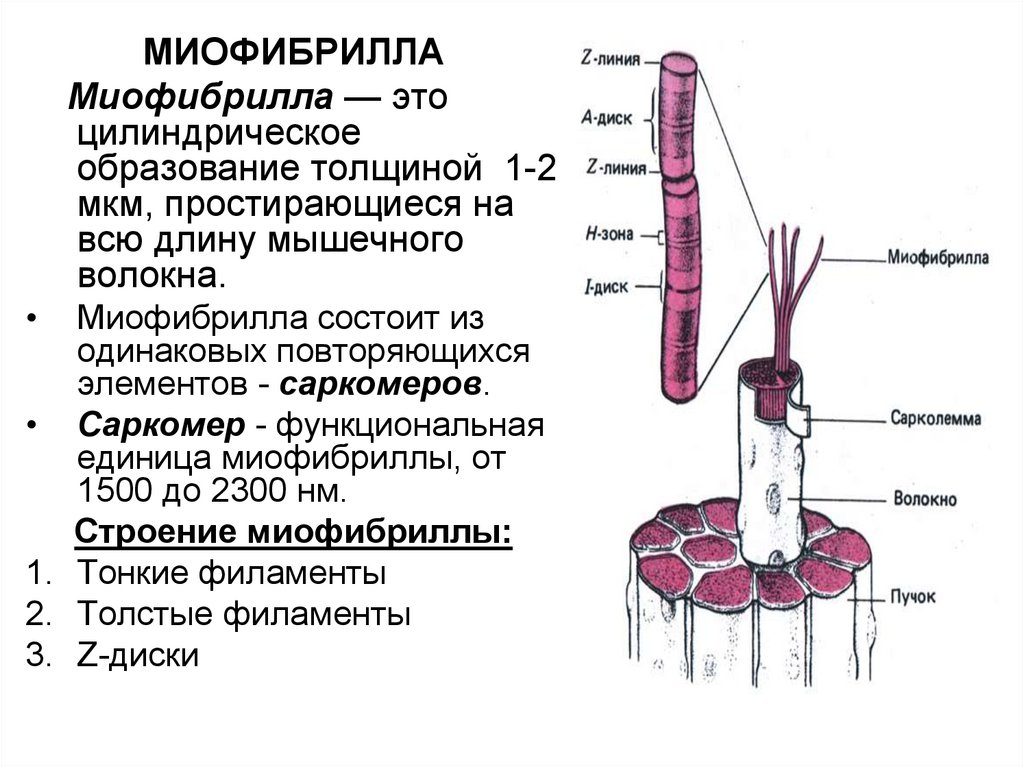
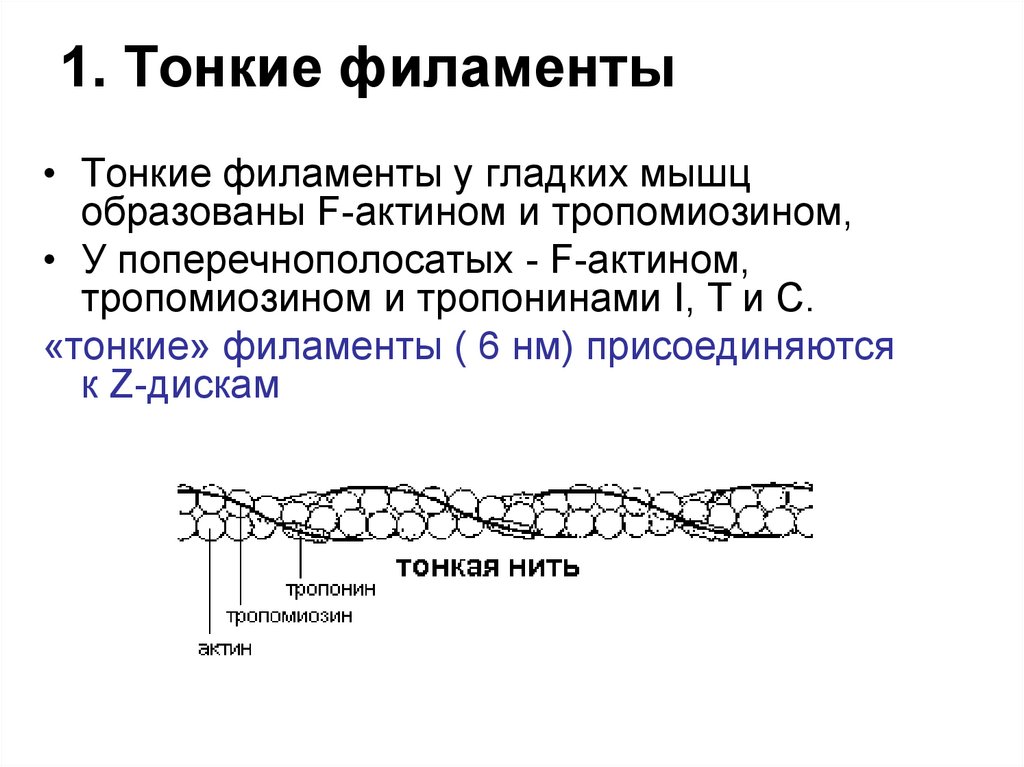


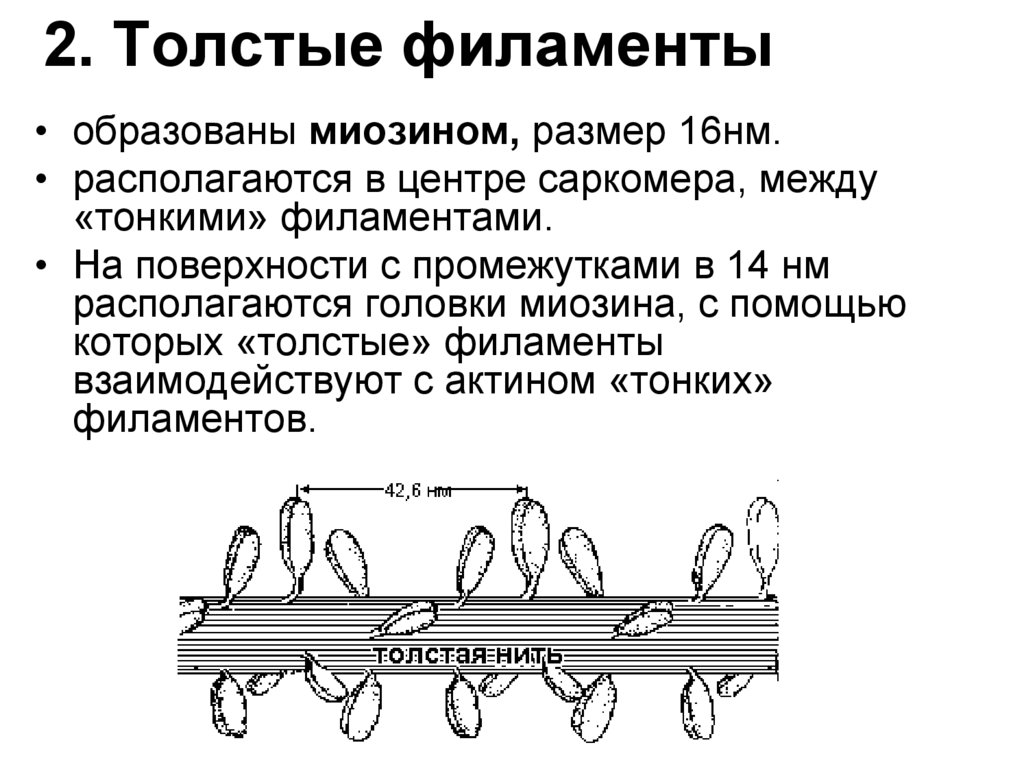
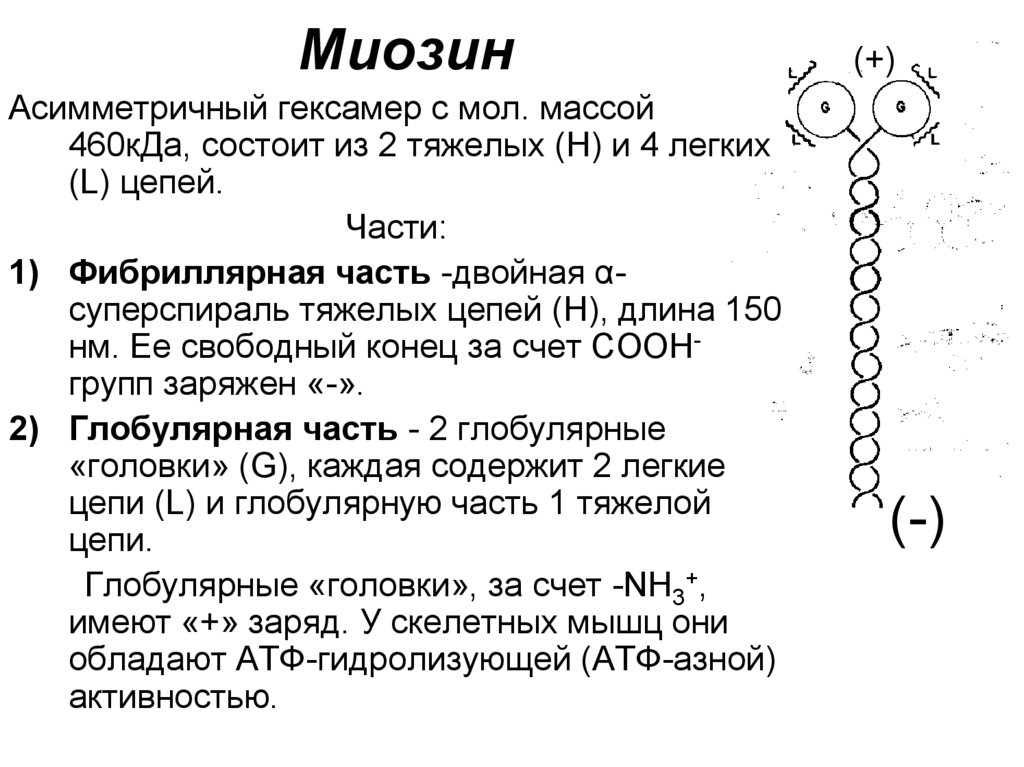
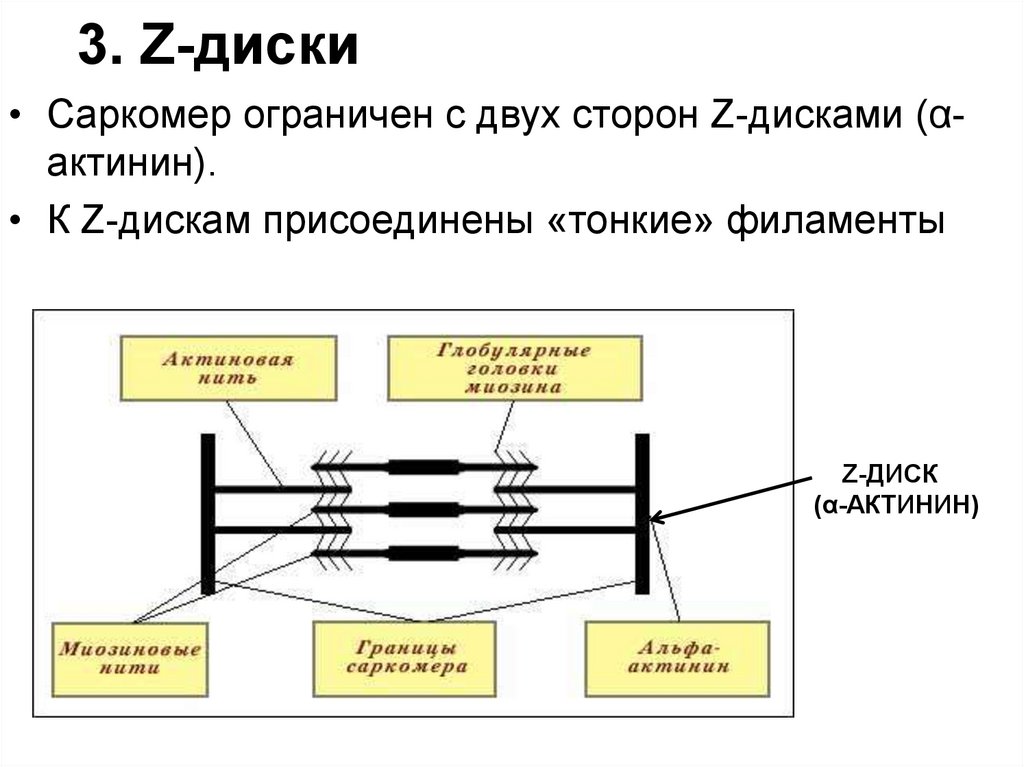
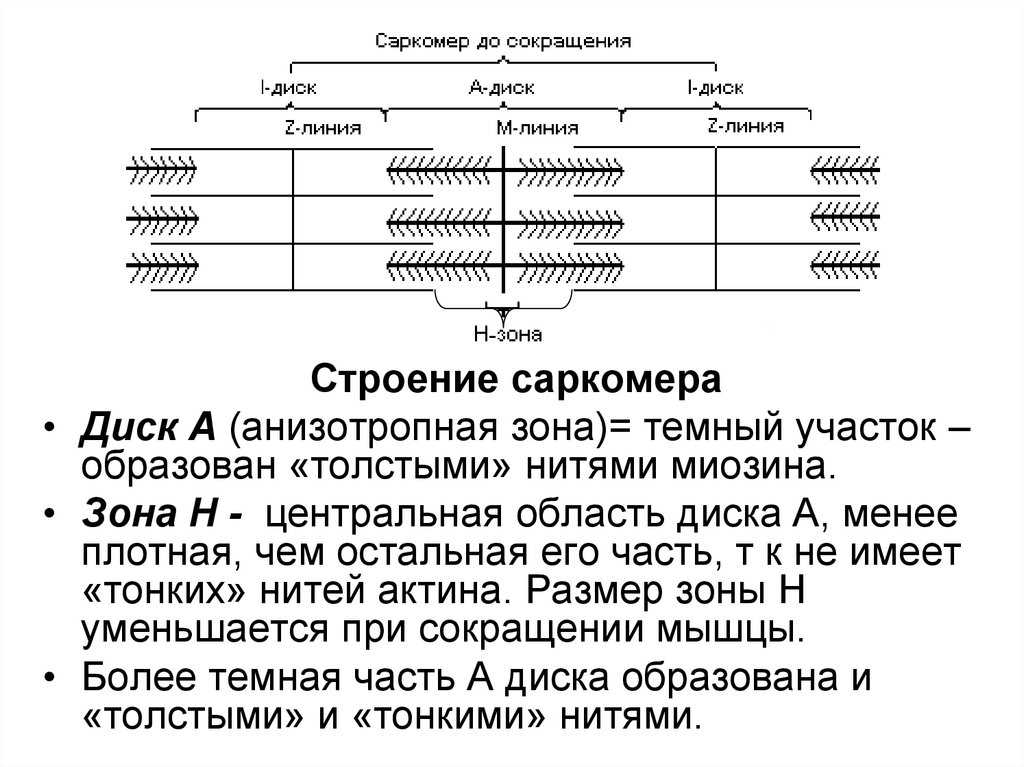
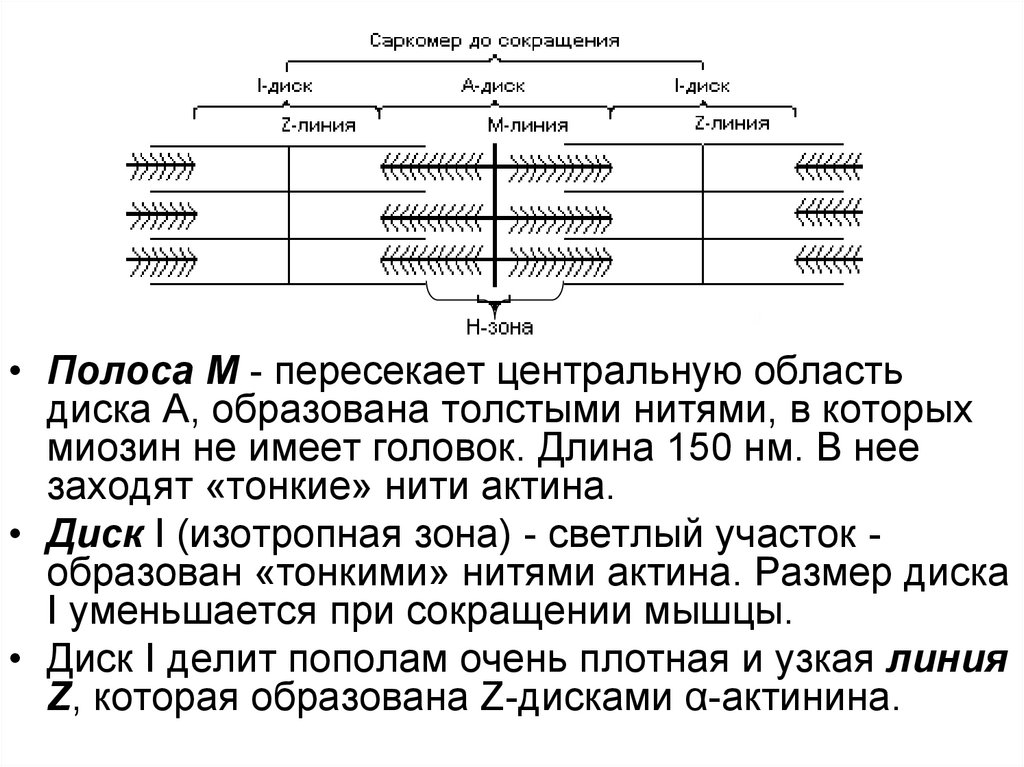
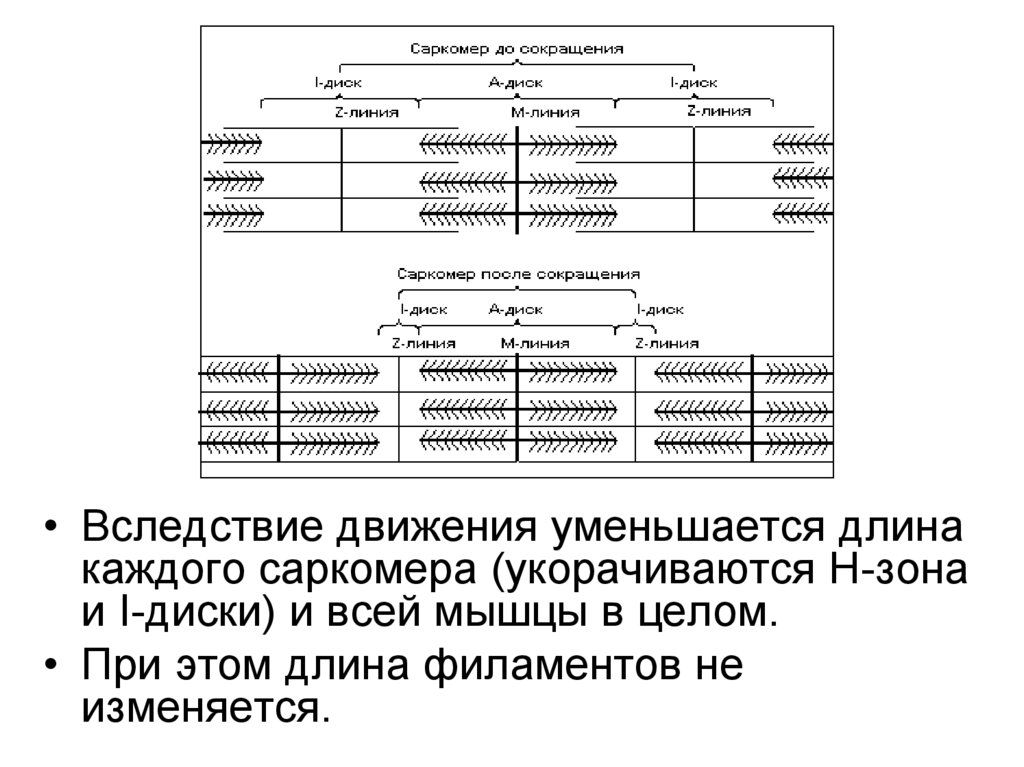

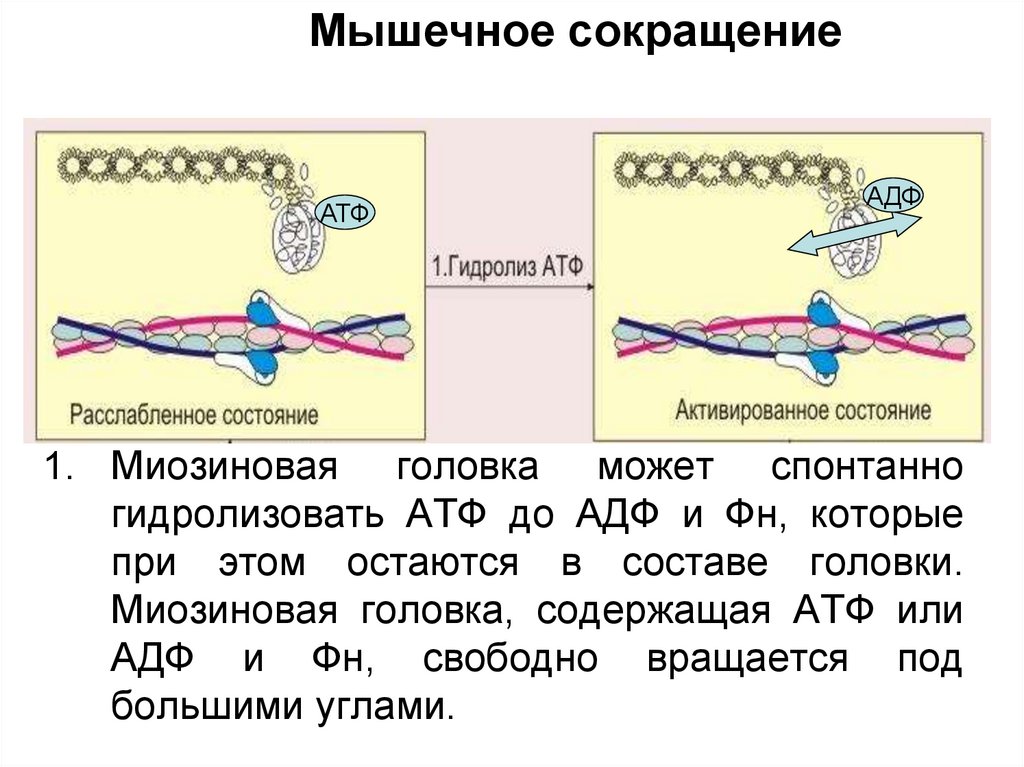
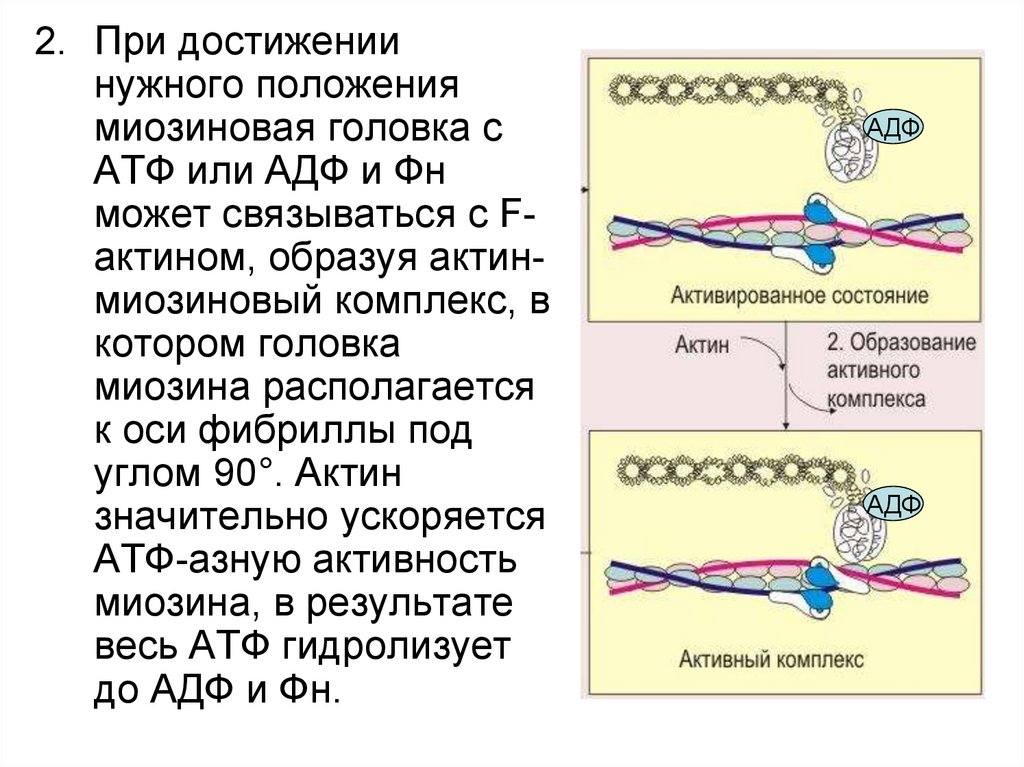
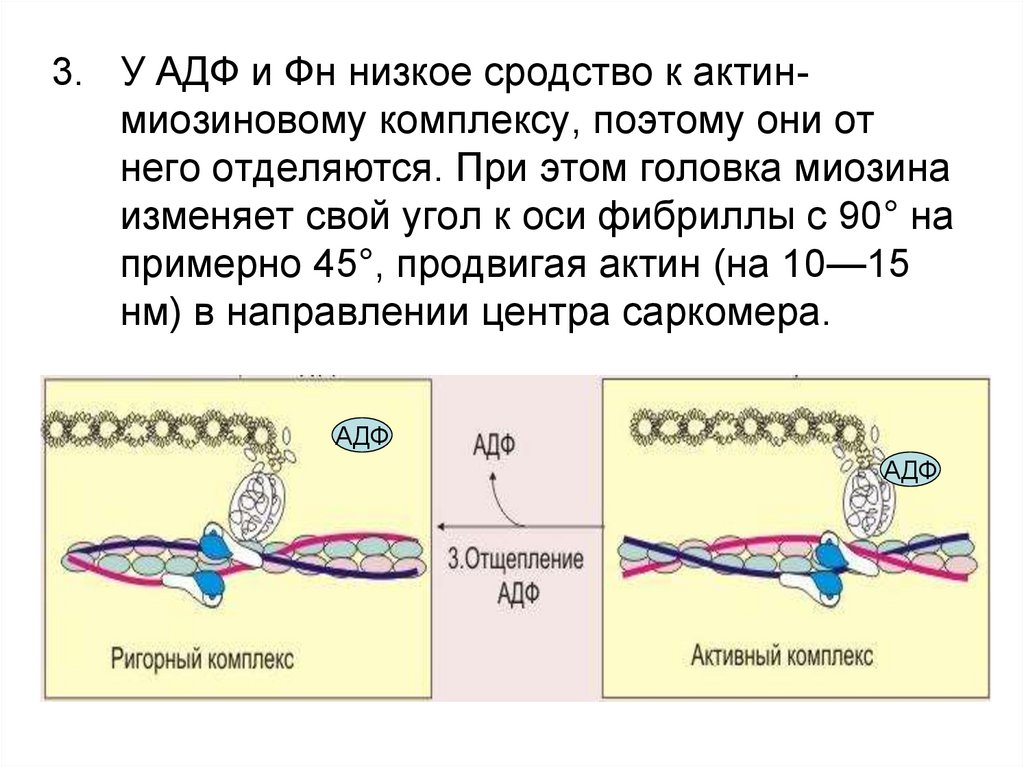
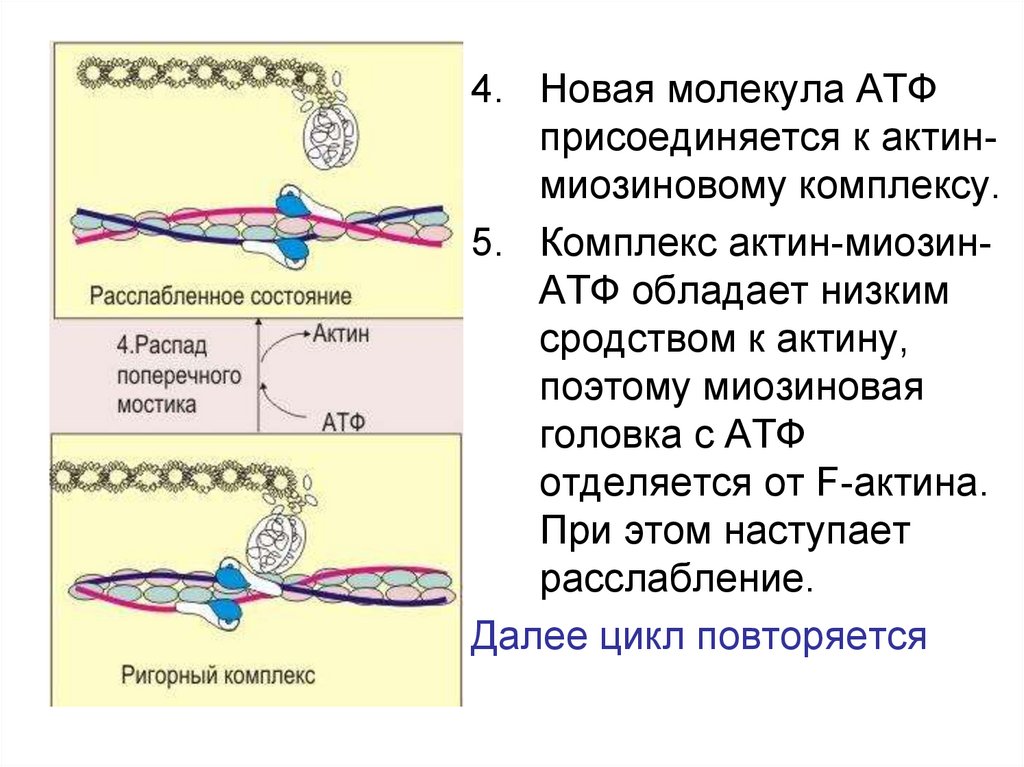
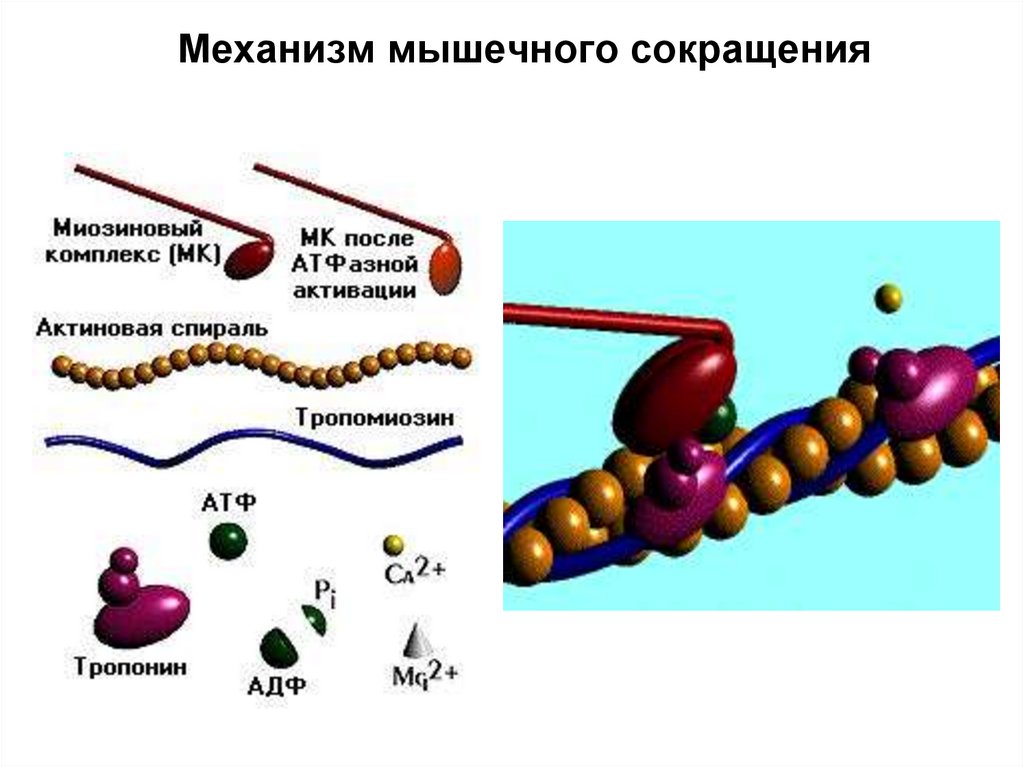

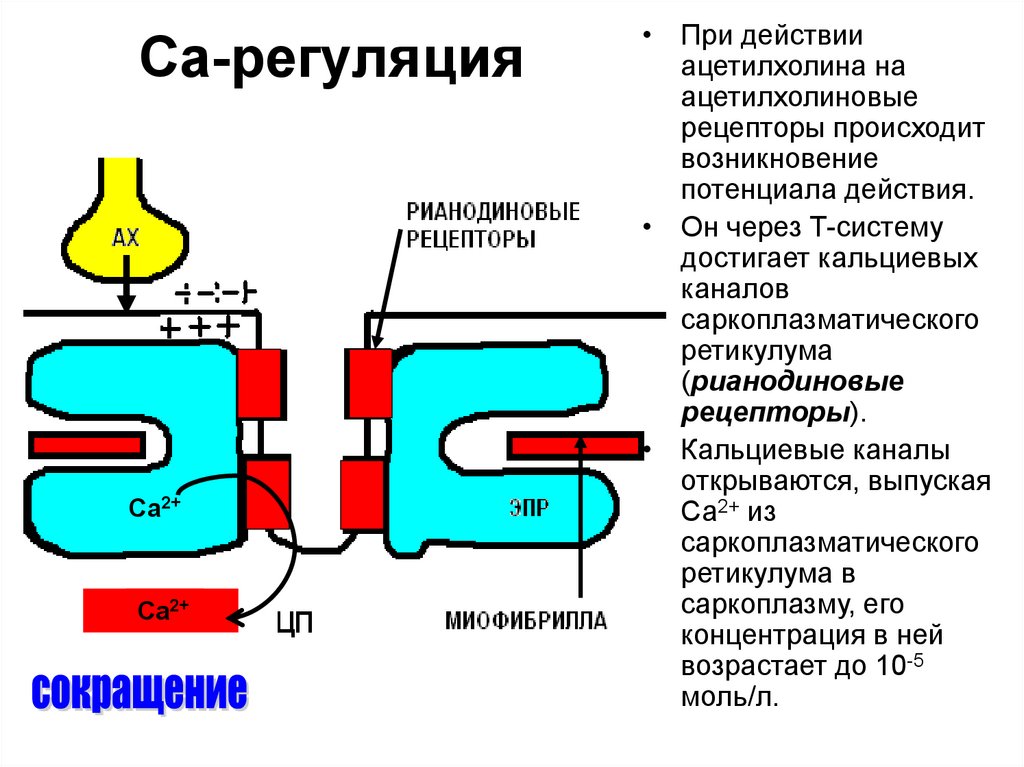
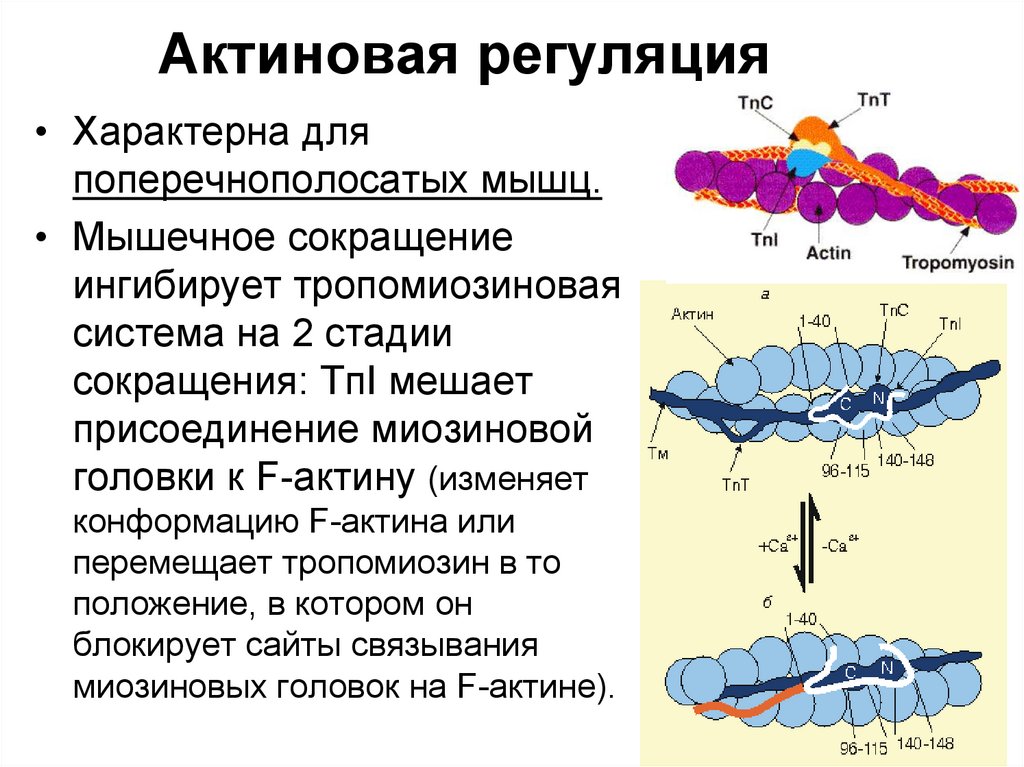
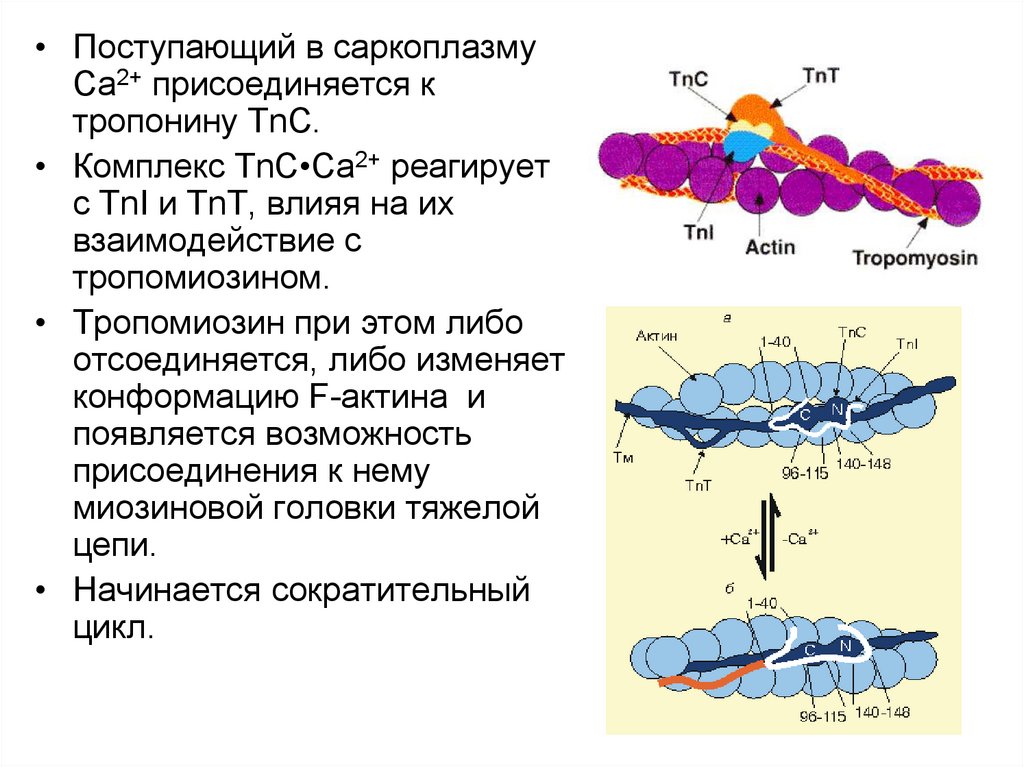

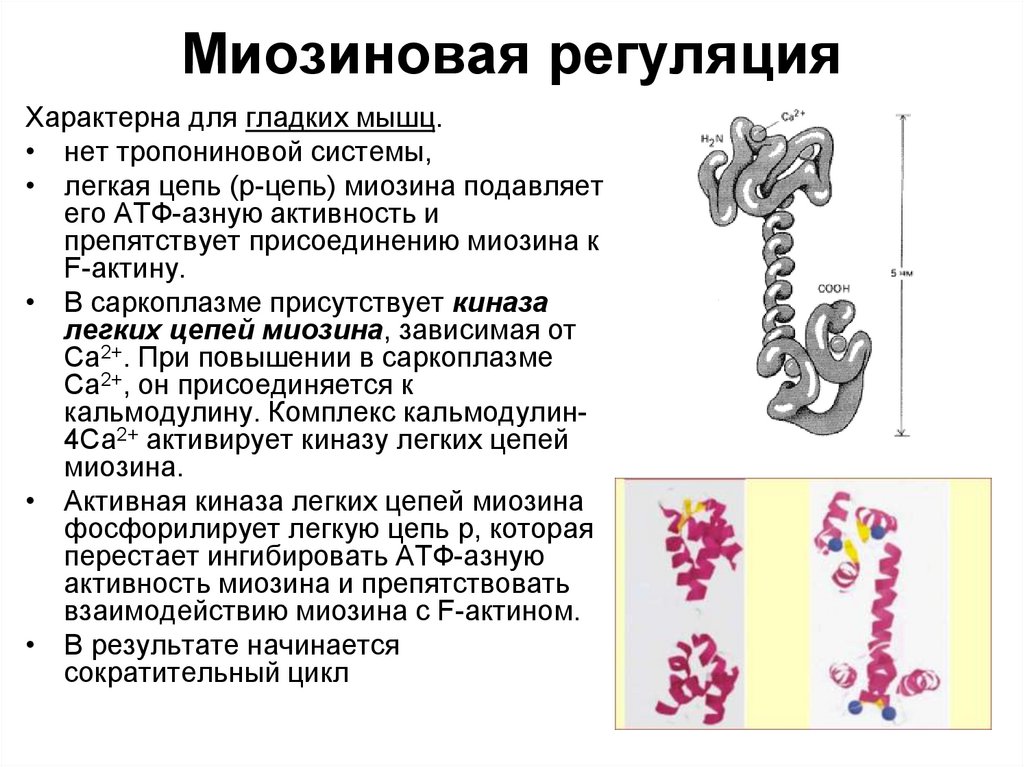




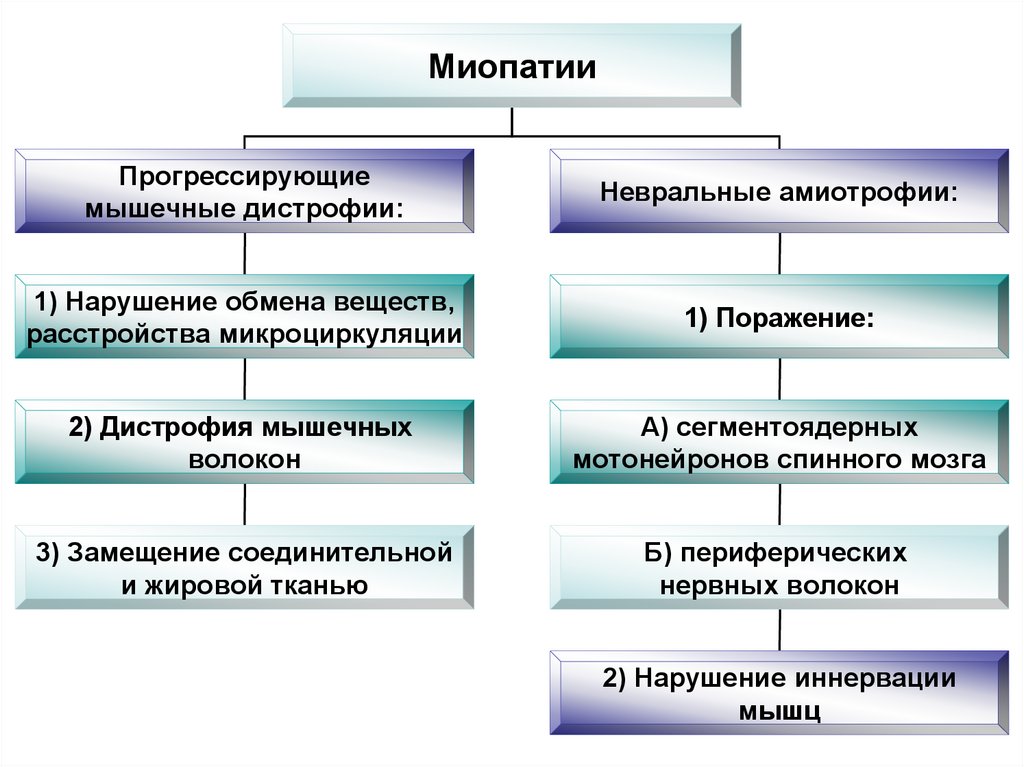

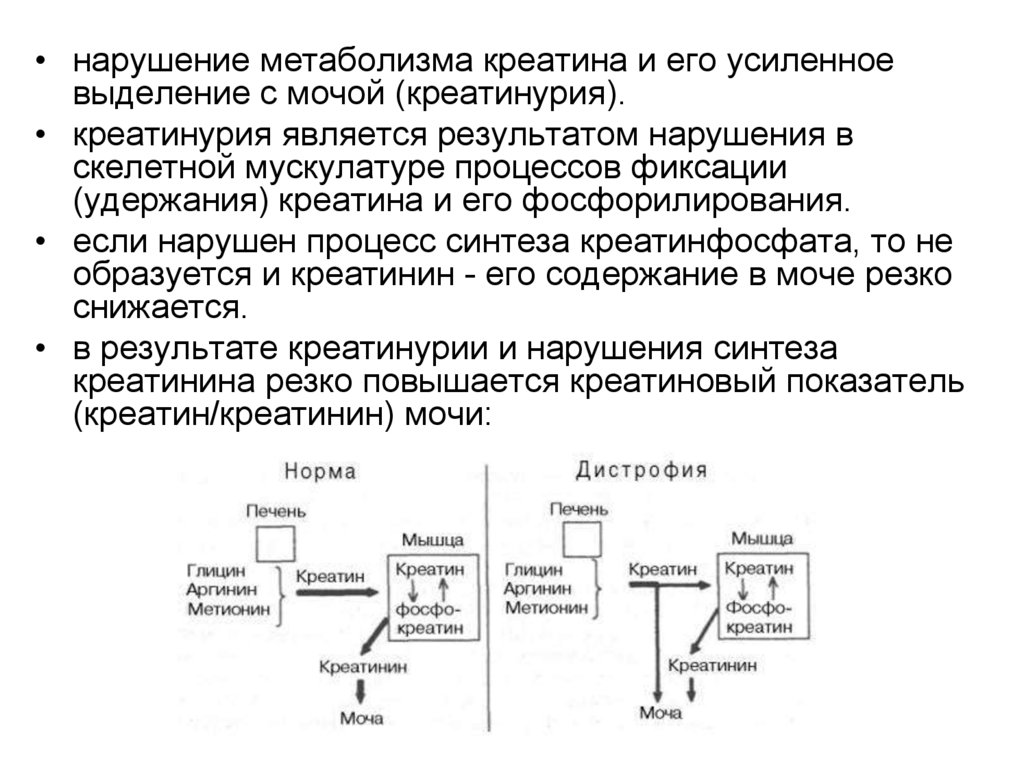


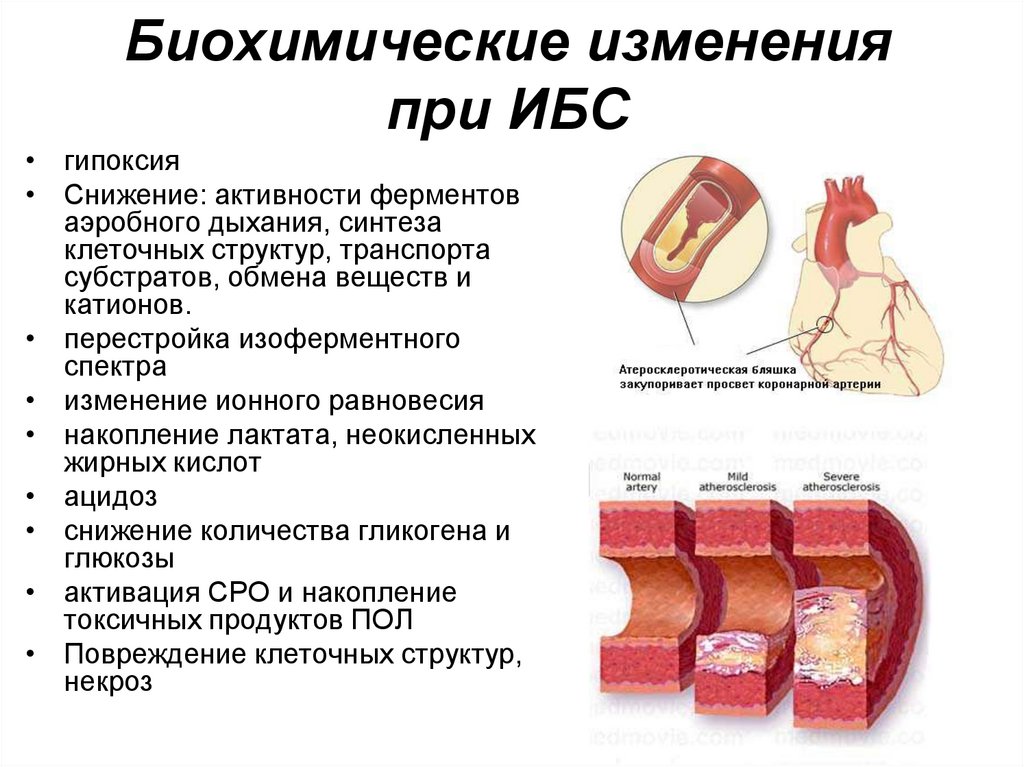
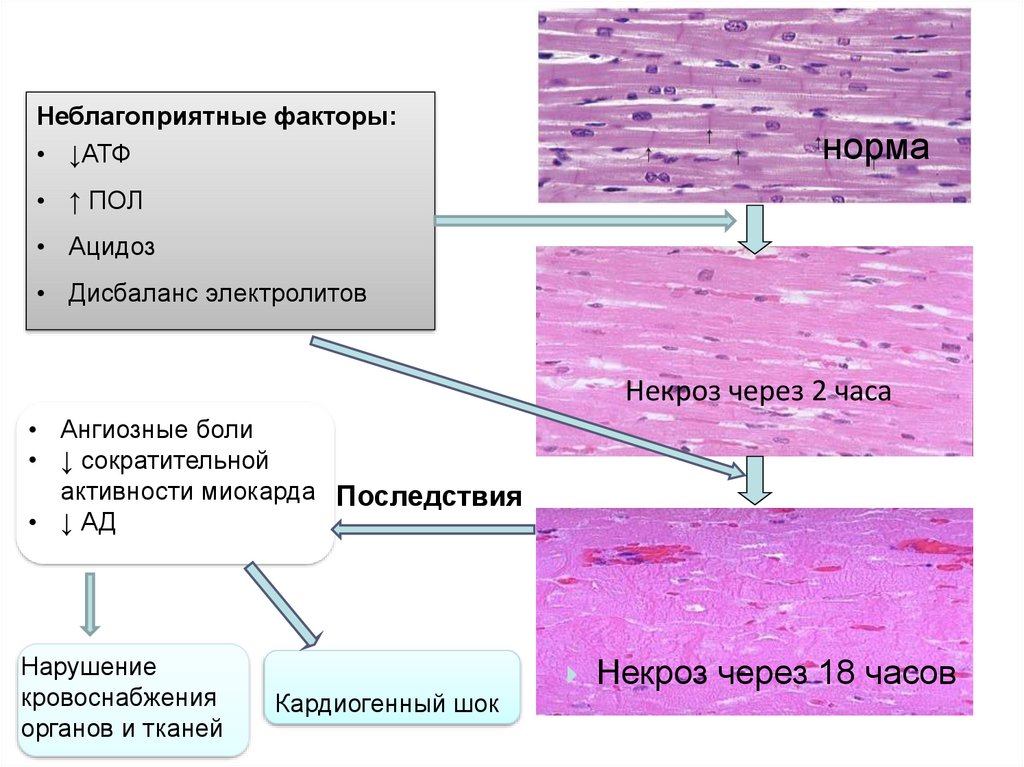
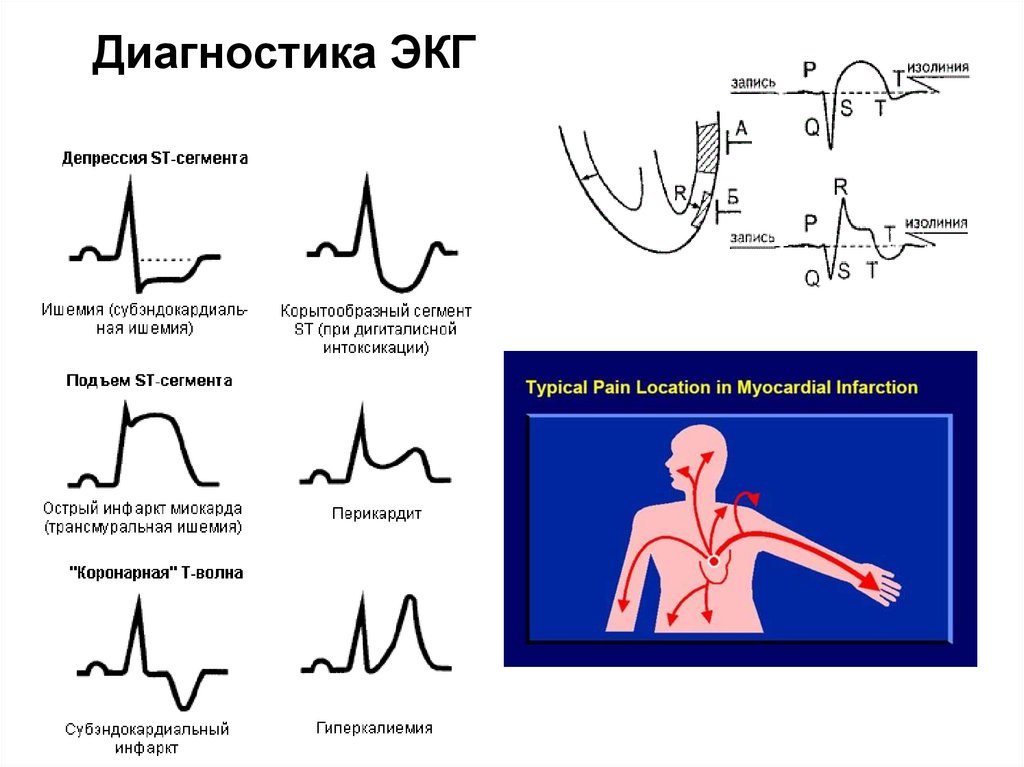

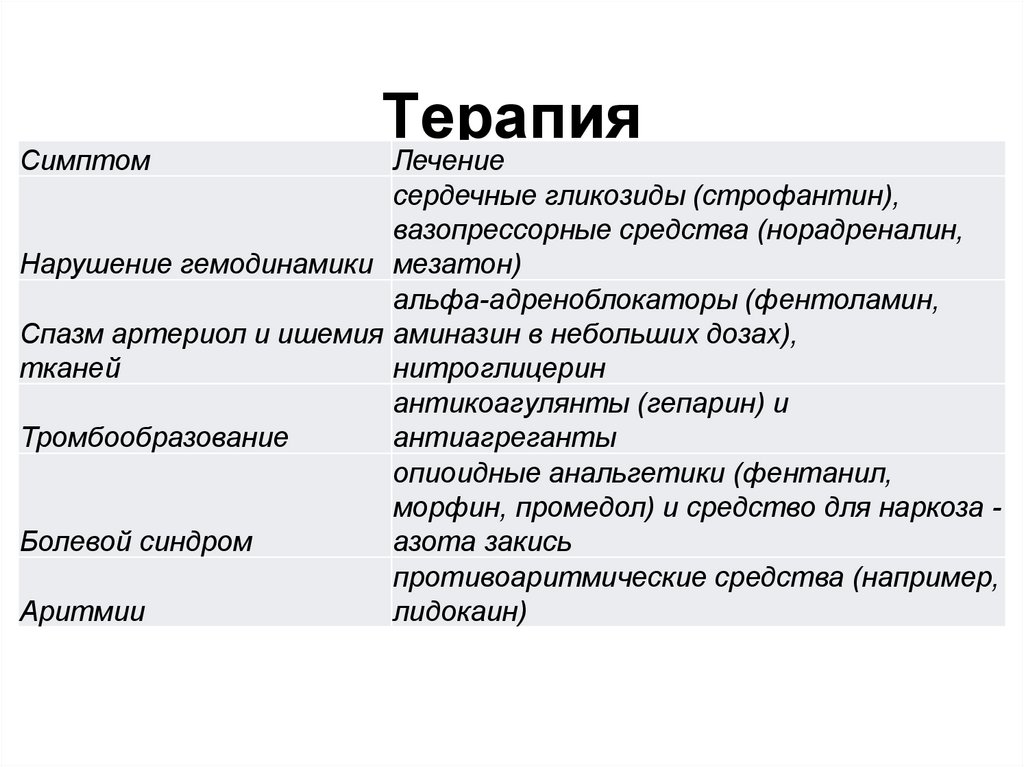



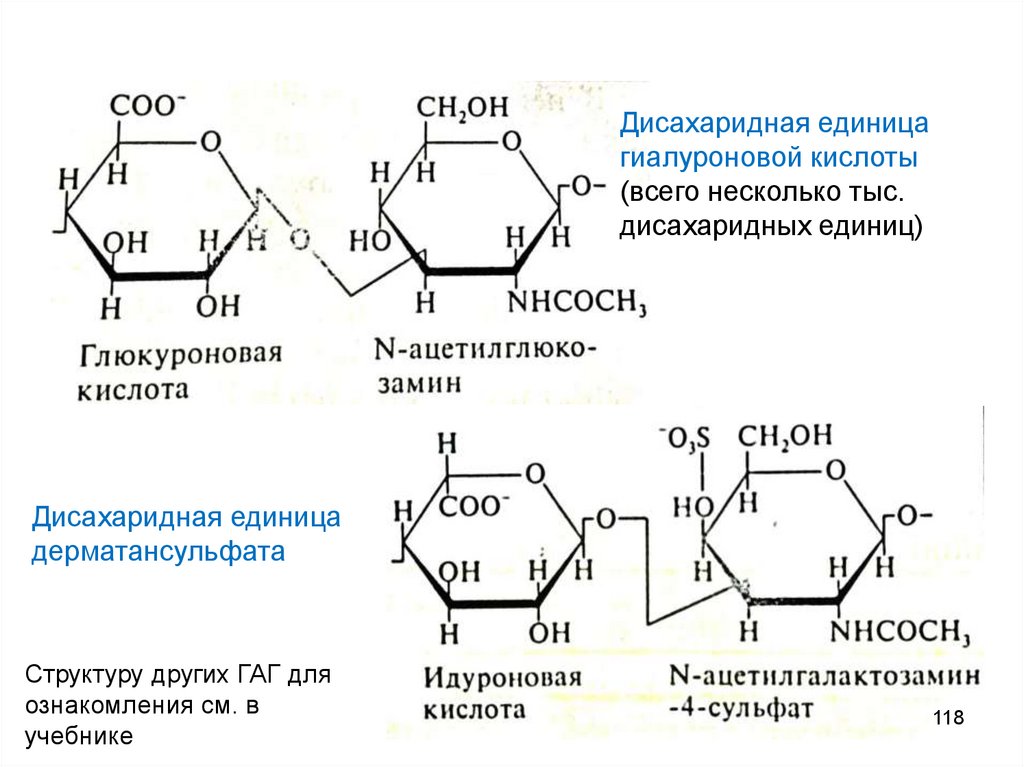



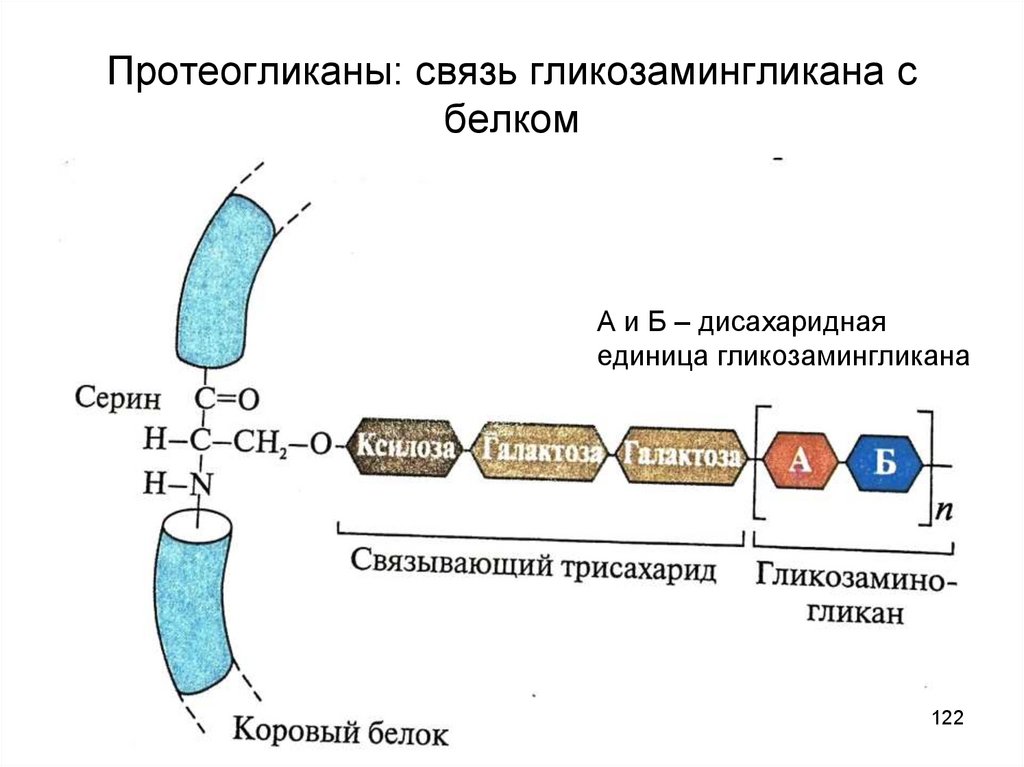

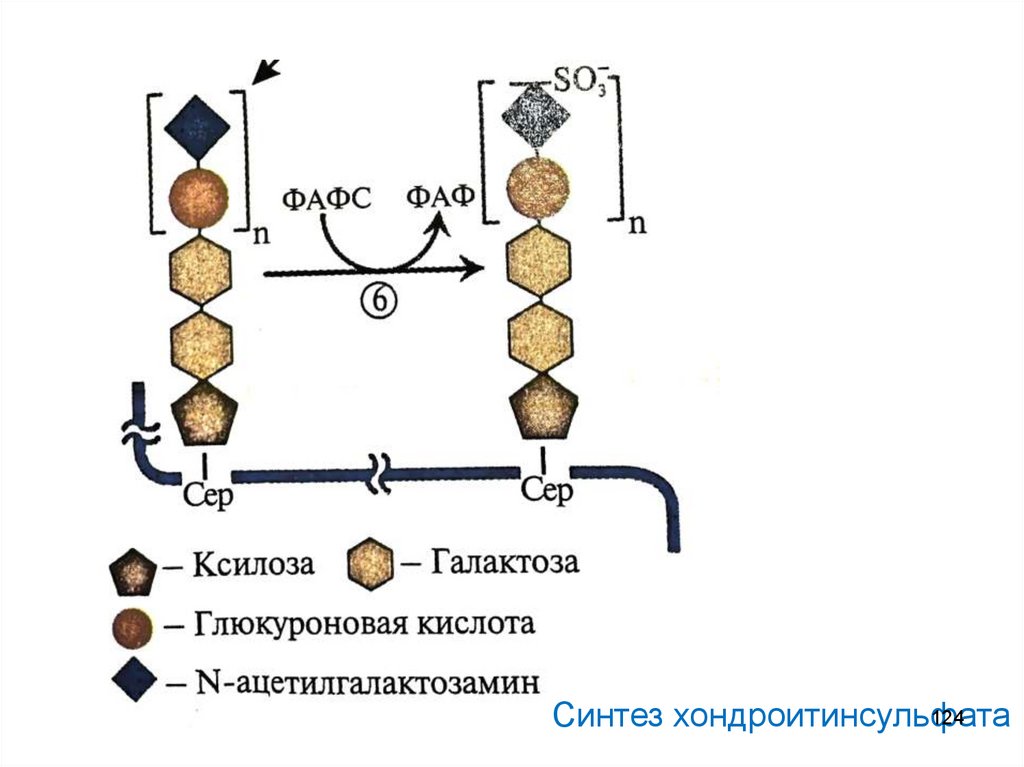




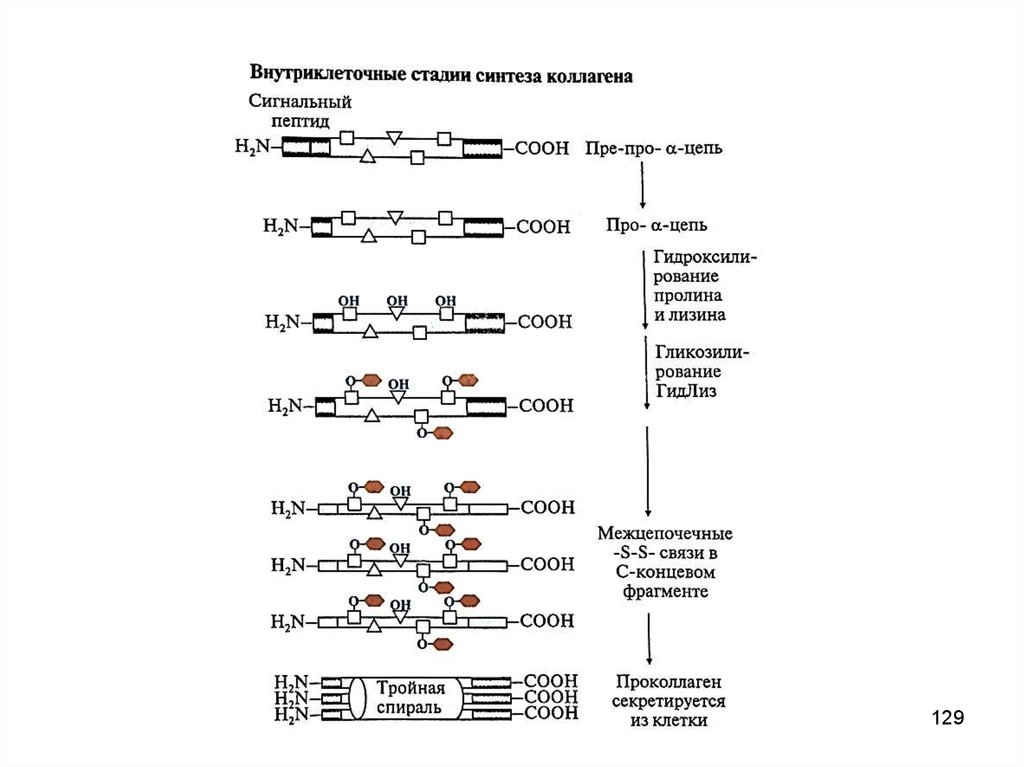
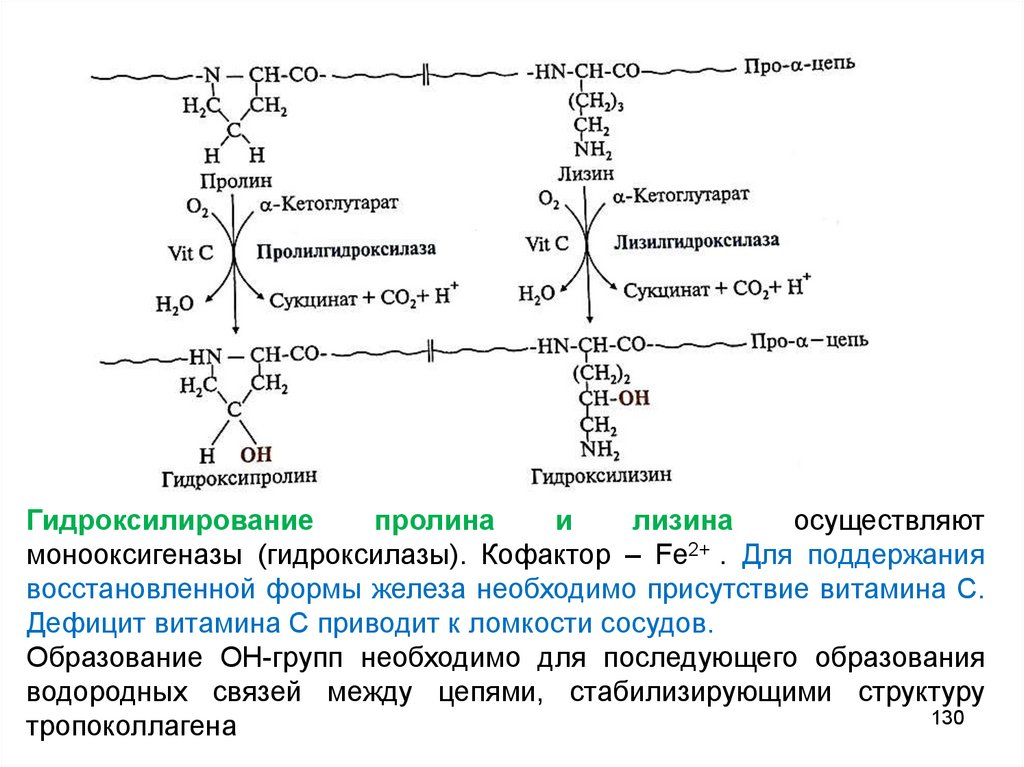
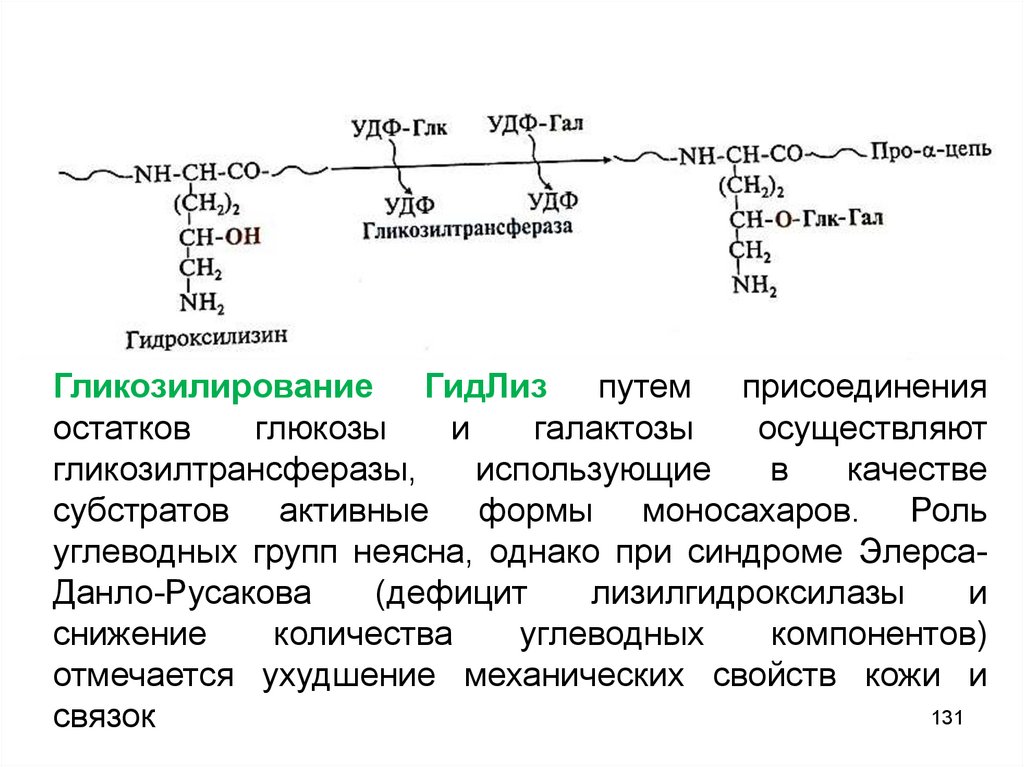
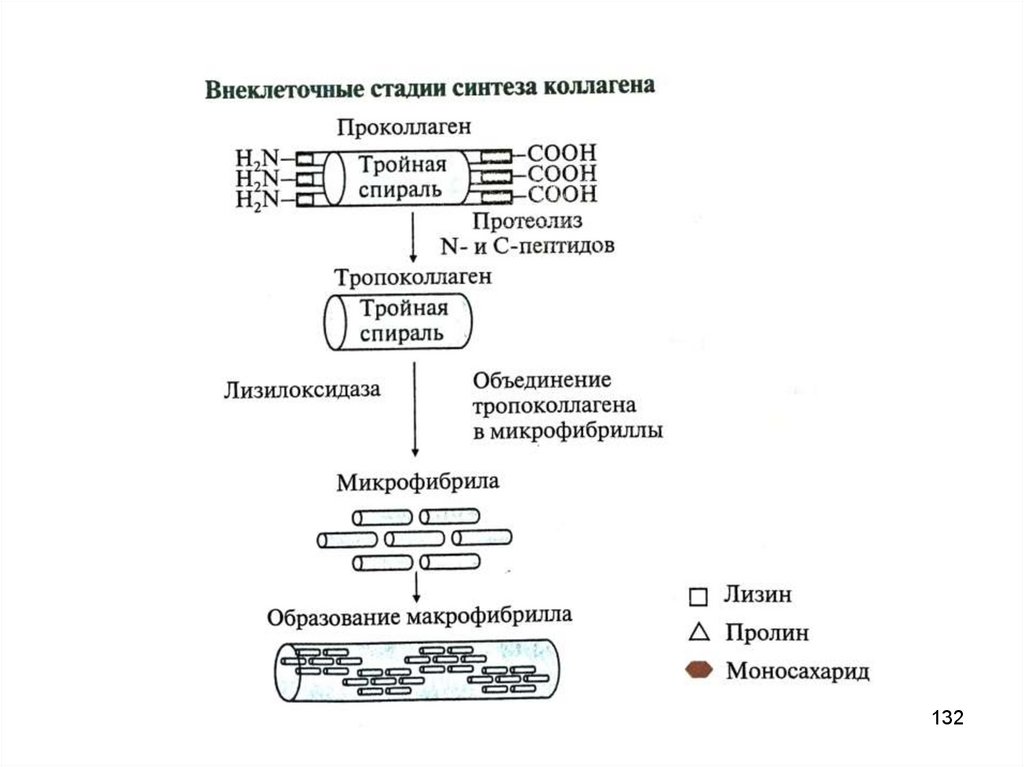
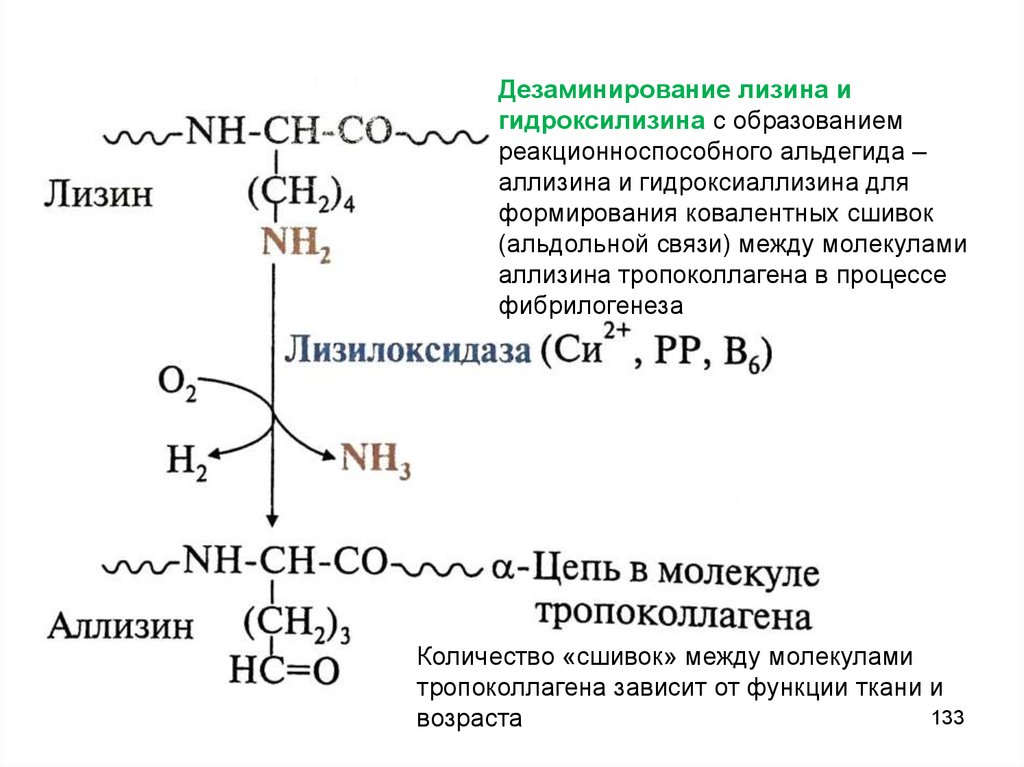
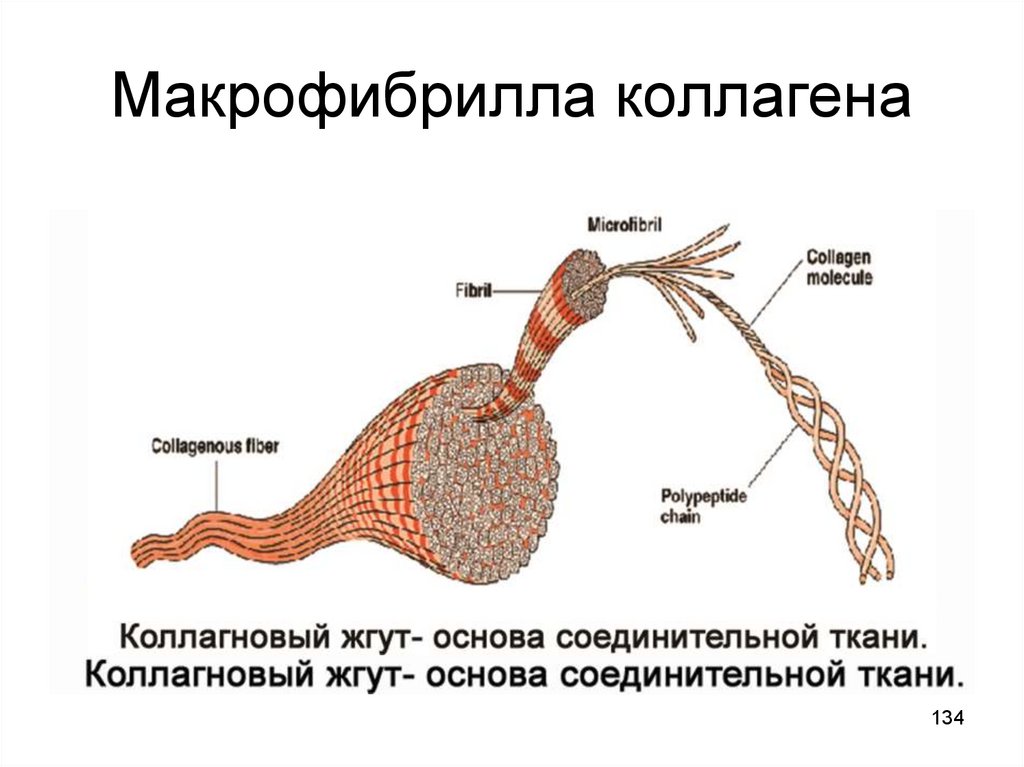
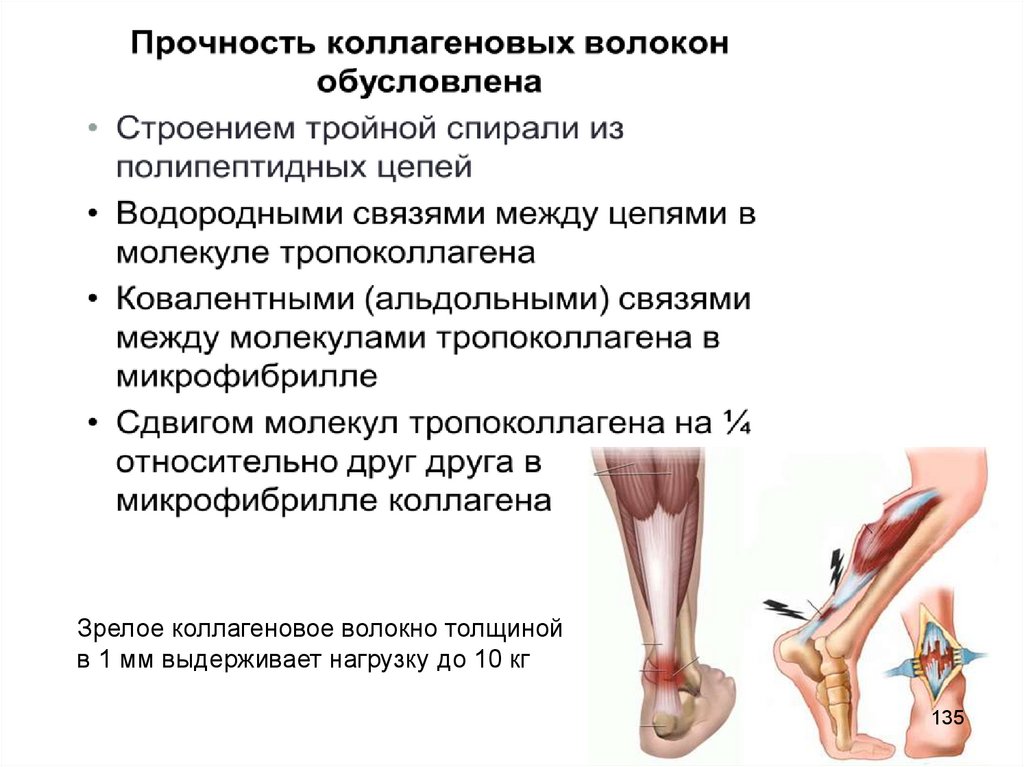







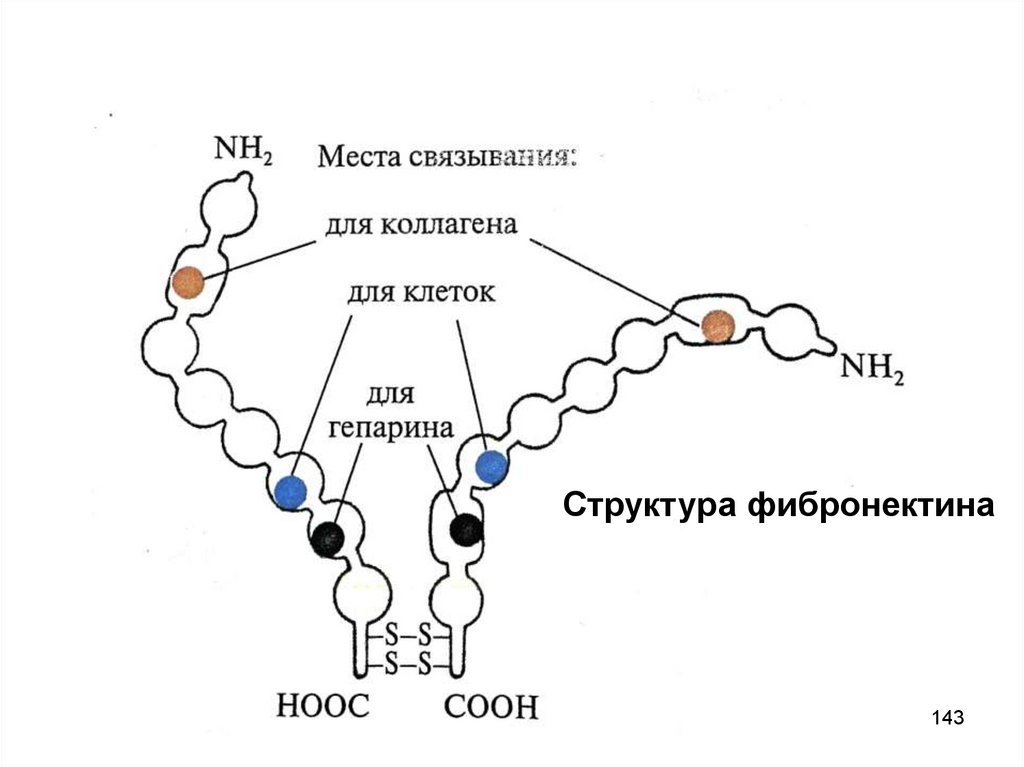
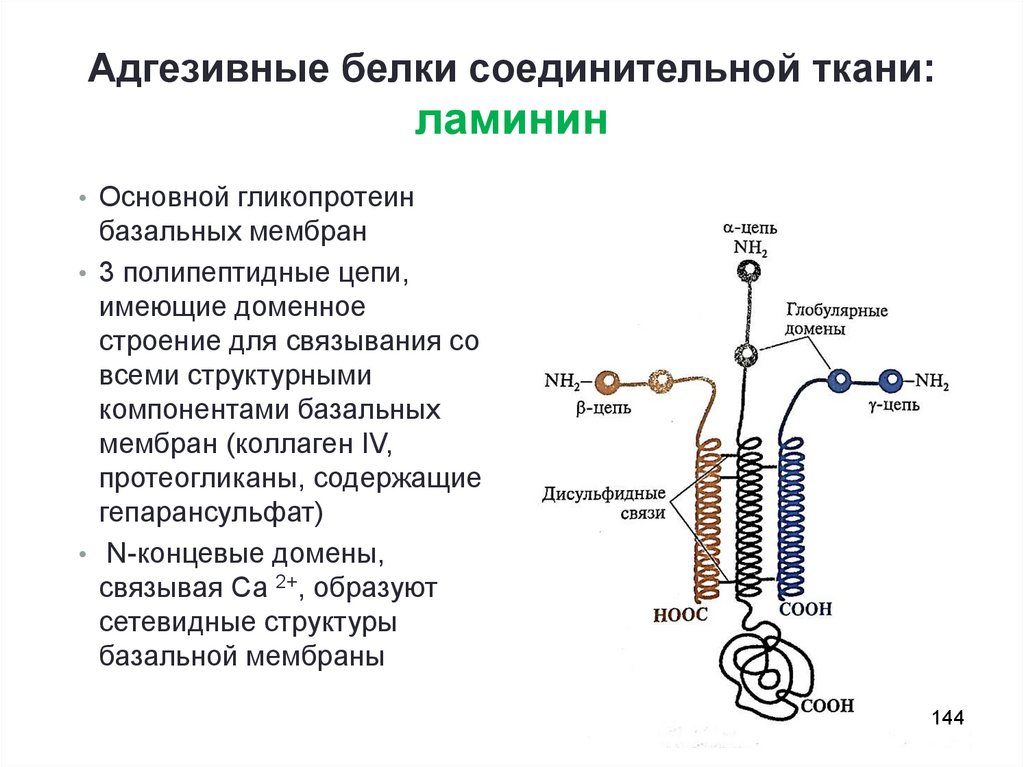



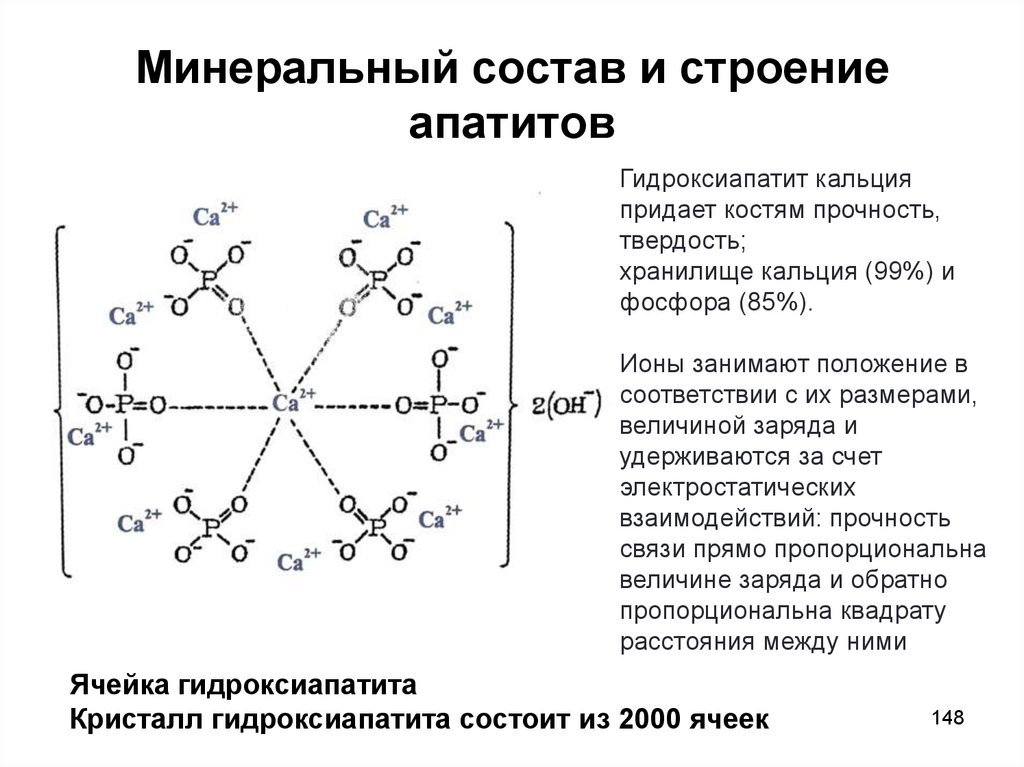





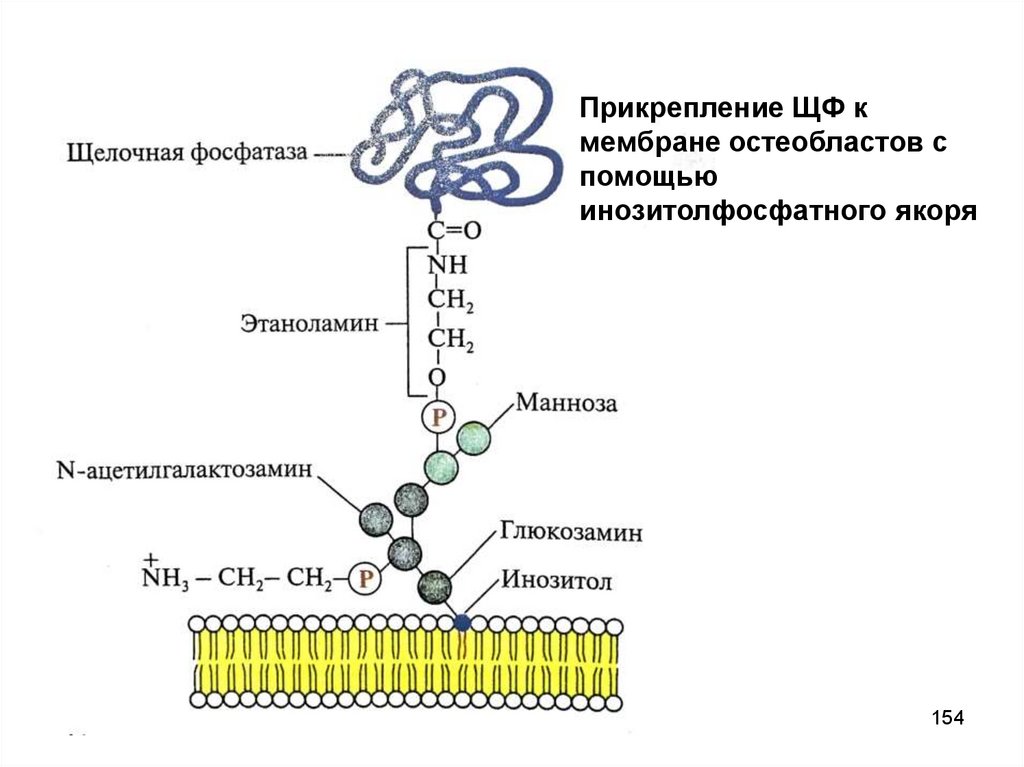




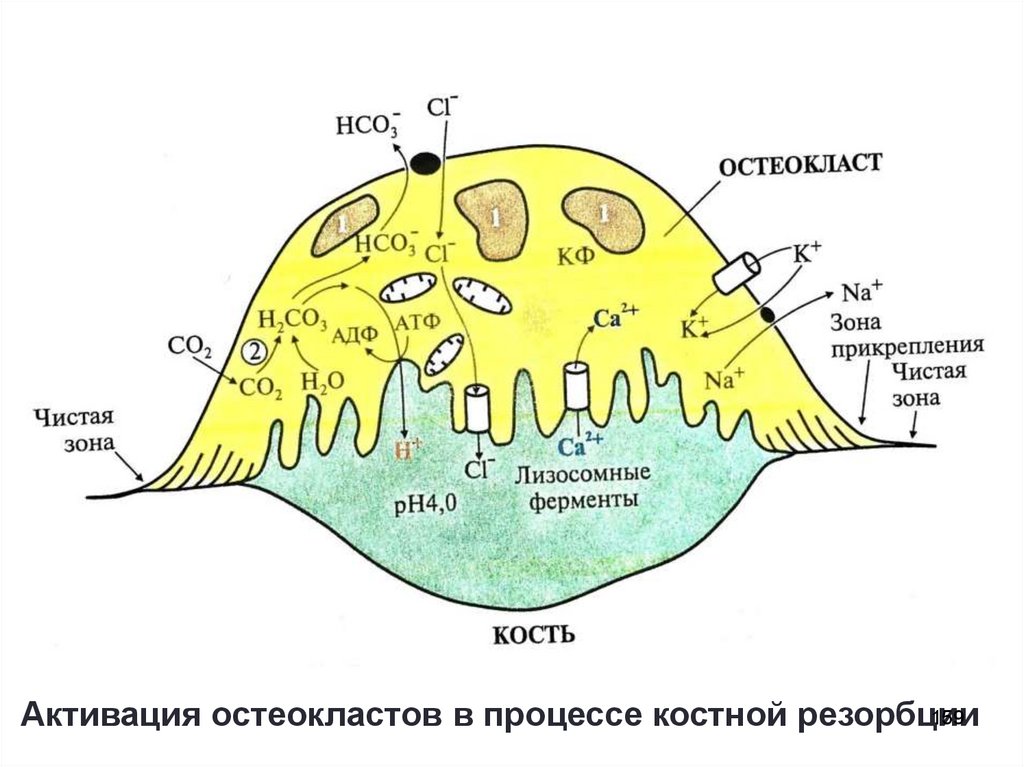


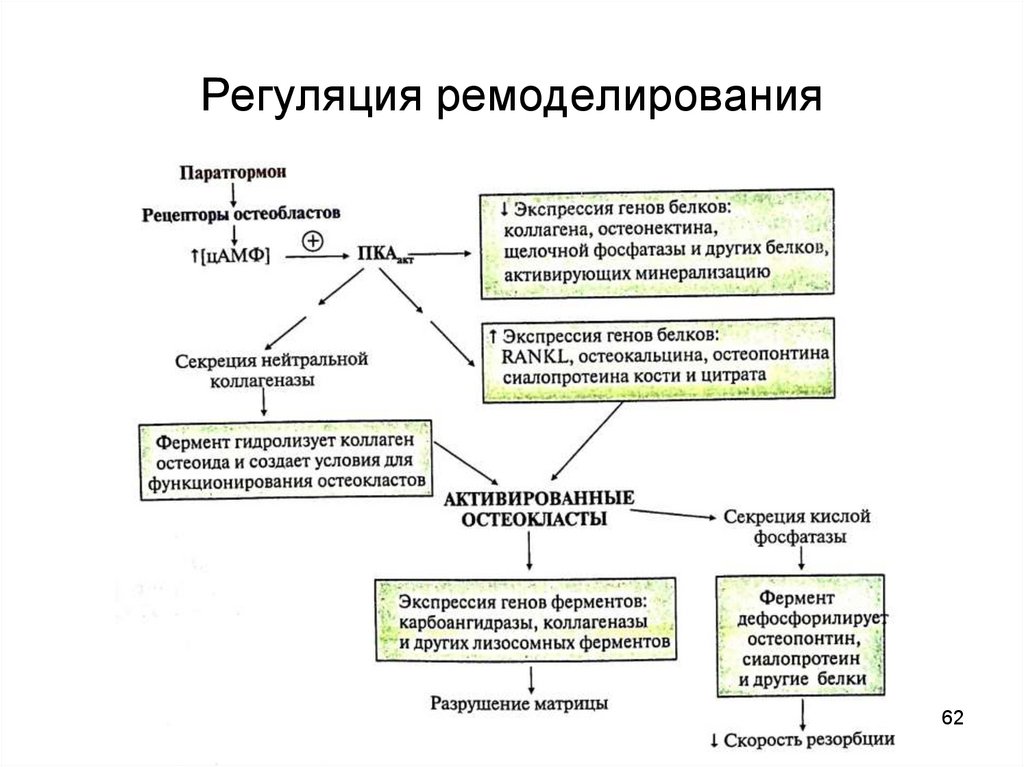
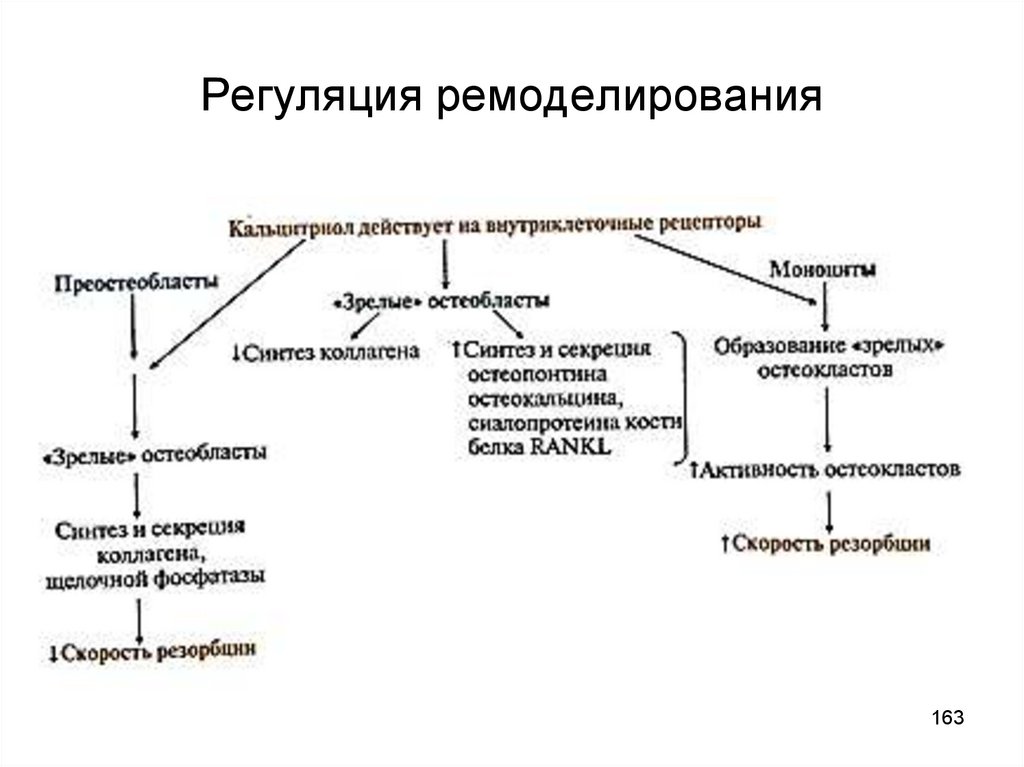
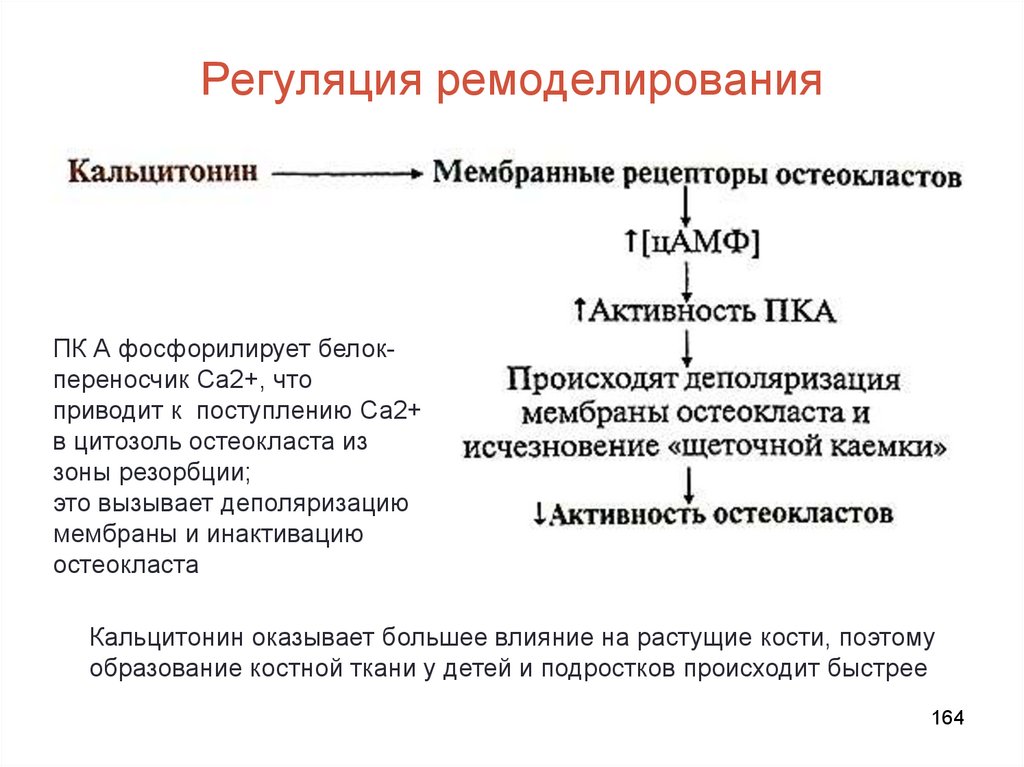


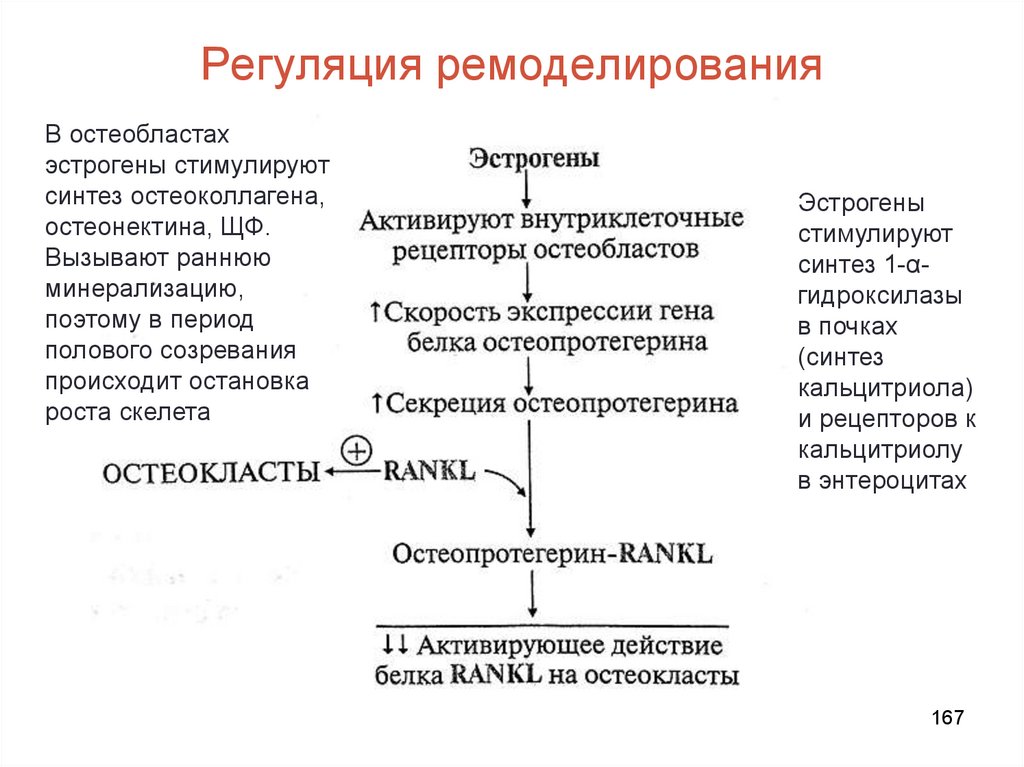

 Биология
Биология