Похожие презентации:
Алюминий и его соединения
1. Алюминий и его соединения(Составить план к теме урока и написать краткие ответы на вопросы)
Алюминий и егосоединения(Составить
план к теме урока и написать
Я - металл незаменимый,
краткие ответы на вопросы)
Очень летчиком любимый,
Легкий, электропроводный,
А характер - переходный
Д.з. изучить пар.46,47 , упр. Слайд 53,54
Al
2. Пли́ний Ста́рший — древнеримский писатель – эрудит.
Пли́ний Ста́рший —древнеримский писатель – эрудит.
Существует легенда о том, как к римскому
императору Тиберию пришёл незнакомец. В
дар императору он принёс изготовленную им
чашу из блестящего как серебро, но
чрезвычайно лёгкого металла. Мастер
поведал, что получил этот металл из
«глинистой земли». Но император, боясь, что
обесценятся его золото и серебро, велел
отрубить мастеру голову, а его мастерскую
разрушить.
3. Наполеон ІІІ
• В XIX веке на императорскихприёмах -------- посуда была
самой престижной. Наполеон
III устроил однажды банкет, на
котором особо почётным гостям
выдали ____ ложки и вилки.
Гости попроще удостоились
обычными для императорского
двора золотыми и серебряными
приборами. К тому же, только у
сына Наполеона III была
дорогая по тем временам
______________погремушка».
4. Д.И Менделеев
В период открытия этогометалла он был дороже
золота. Англичане, решив
почтить богатым подарком
великого русского химика
Д. И Менделеева,
подарили ему химические
весы, в которых одна
чаша была изготовлена из
золота, а другая из ...
Чаша из этого металла
стала дороже золотой.
Полученное «серебро» из
глины заинтересовало не
только ученых, но и
промышленников и даже
императора Франции
5.
Из глины я обыкновенной,Но я на редкость
современный.
Я не боюсь электротока,
Бесстрашно в воздухе лечу;
Служу на кухне я без срока Мне все задачи по плечу.
Горжусь своим я именем:
Зовусь я ...........
В 1860-е годы каждая парижская
модница непременно должна была
иметь в своем наряде хотя бы одно
украшение из алюминия - металла,
ценившегося выше серебра и золота
6.
«Этому металлу сужденовеликое будущее».
Чернышевский Н. Г.
Он важен, это - несомненно.
Он нужен нам всенепременно.
Красавец серебристый, легкий,
Проводит ток, пластичный, ковкий.
Не зря его крылатым называют,
О нем все люди на планете знают.
Металл сей вызывает восхищенье,
И уникальность свойств находит примененье.
7.
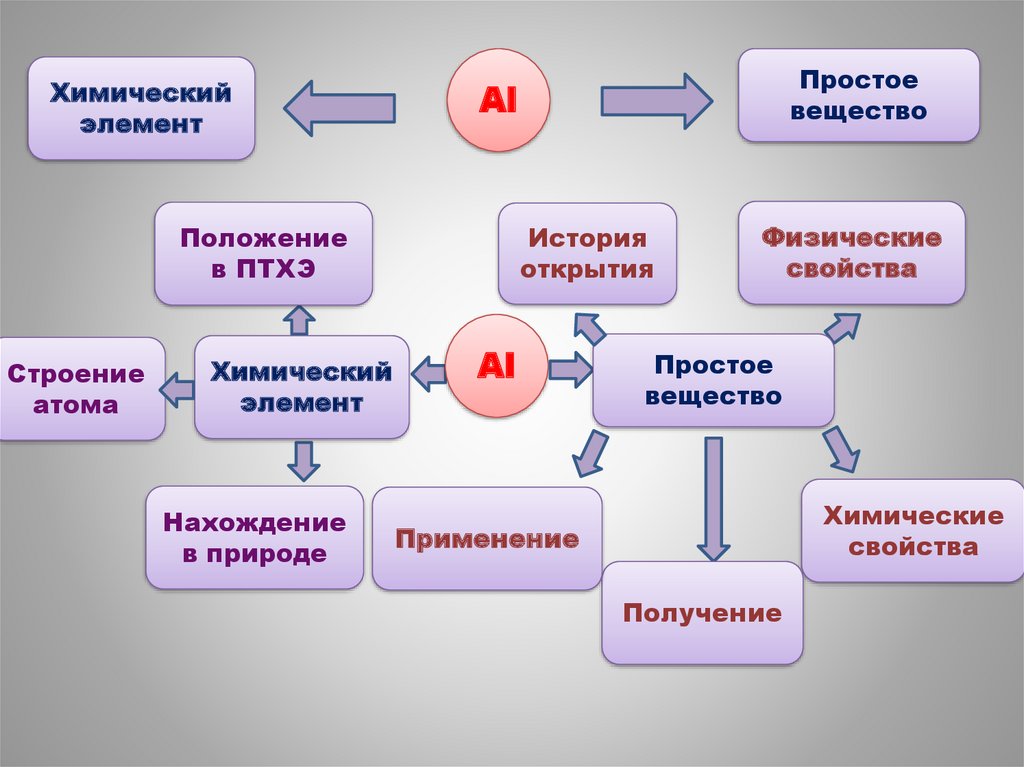
Химическийэлемент
Al
Положение
в ПТХЭ
Строение
атома
Химический
элемент
Нахождение
в природе
Простое
вещество
История
открытия
Al
Физические
свойства
Простое
вещество
Химические
свойства
Применение
Получение
8. Алюминий - химический элемент положение в периодической системе и строение атома
положение в периодической системе и строение атома1. Химический знак (металл или неметалл)
2. Атомная масса (Аr)
3. Положение элемента в периодической системе:
а)
порядковый номер;
б)
номер периода;
в)
четный или нечетный ряд;
г)
номер группы;
д)
подгруппа.
4. Строение атома:
а)
заряд ядра;
б)
состав ядра;
в)
число электронных слоев;
г)
общее число электронов (ē);
д)
электронная конфигурация атома;
е)
число электронов в наружном слое;
ж)
графическое изображение наружного слоя; валентность; степень
окисления;
з)
является ли этот слой завершенным или нет.
5. Формулы высшего оксида, его гидроксида, и их химическая
характеристика.
6. Формулы газообразных водородных соединений, если элемент их
образует.
7. Металлические или неметаллические свойства у элемента наиболее
ярко выражены.
8. Сравнение свойств данного элемента со свойствами элементовсоседей по периоду и подгруппе.
9.
положение в периодической системе и строениеатома
1. Химический знак (металл или
неметалл)
2. Атомная масса (Аr)
3. Положение элемента в
периодической системе:
порядковый номер;
номер периода;
четный или нечетный ряд;
номер группы;
подгруппа.
Al (металл)
Ar= 27
13
III
Нечётный
III
А (главная)
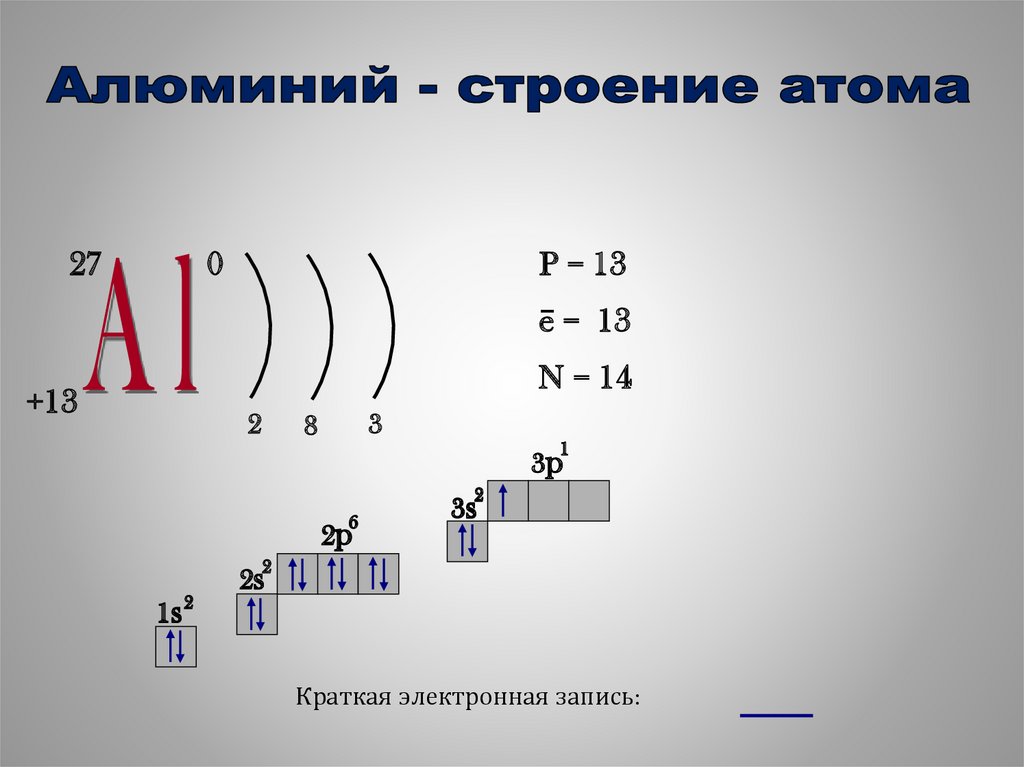
10.
270
P = 13
e− = 13
N = 14
+13
2
3
8
1
3p
2
6
2p
3s
2
1s 2
2s
Краткая электронная запись:
11.
+ 13Степень окисления
11
12.
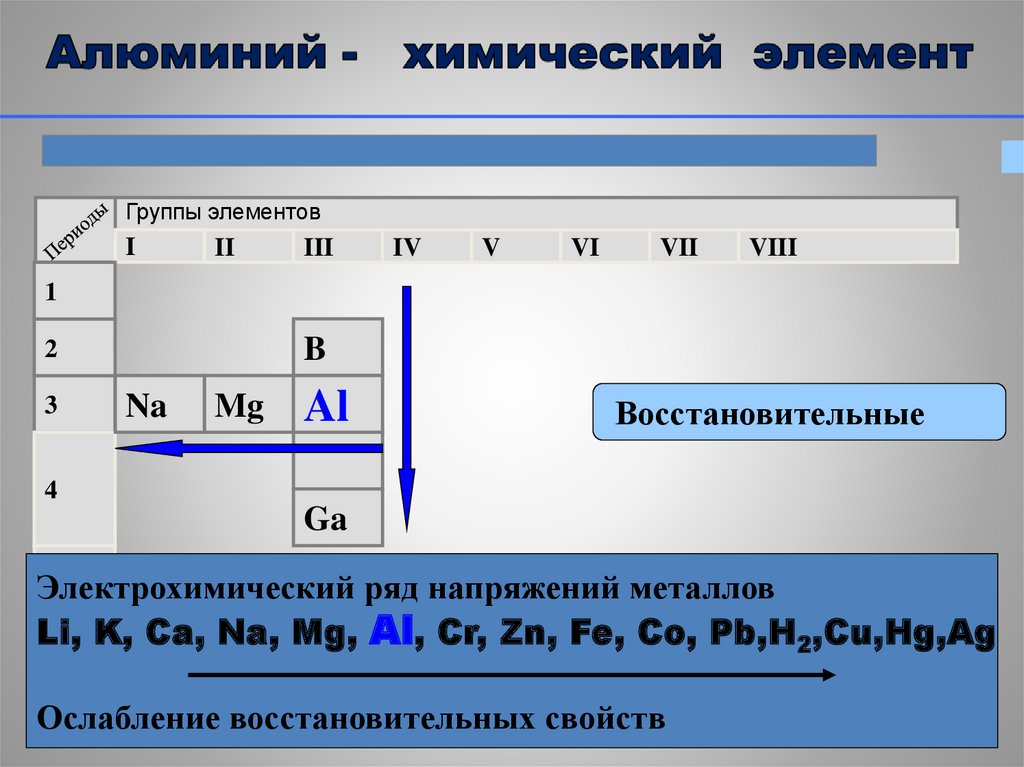
Группы элементовI
II
III
IV
V
VI
VII
VIII
1
B
2
3
Na
Mg
Al
Восстановительные
4
Ga
Электрохимический
ряд напряжений металлов
5
Li, K, Ca, Na, Mg, Al, Cr, Zn, Fe, Co, Pb,H2,Cu,Hg,Ag
Ослабление восстановительных свойств
12
13.
4. Строение атома:заряд ядра;
состав ядра;
число электронных слоев;
общее число электронов (ē);
+13
13p+, 14n0
3
13 ē
электронная конфигурация атома;
1s2 2s2 2p6 3s2 3p1
число электронов в наружном слое;
3
графическое изображение наружного слоя;
валентность; степень окисления;
Является ли этот слой завершенным или нет.
5. Формулы высшего оксида, его
гидроксида, и их химическая
характеристика.
6. Формулы газообразных водородных
соединений, если элемент их образует.
7. Металлические или неметаллические
свойства у элемента наиболее ярко
выражены.
8. Сравнение свойств данного элемента со
свойствами элементов-соседей по периоду
и подгруппе.
нет
Al2O3- амфотерный, Al (OH)3амфотерный
Металлические
Mg>Al<Ga
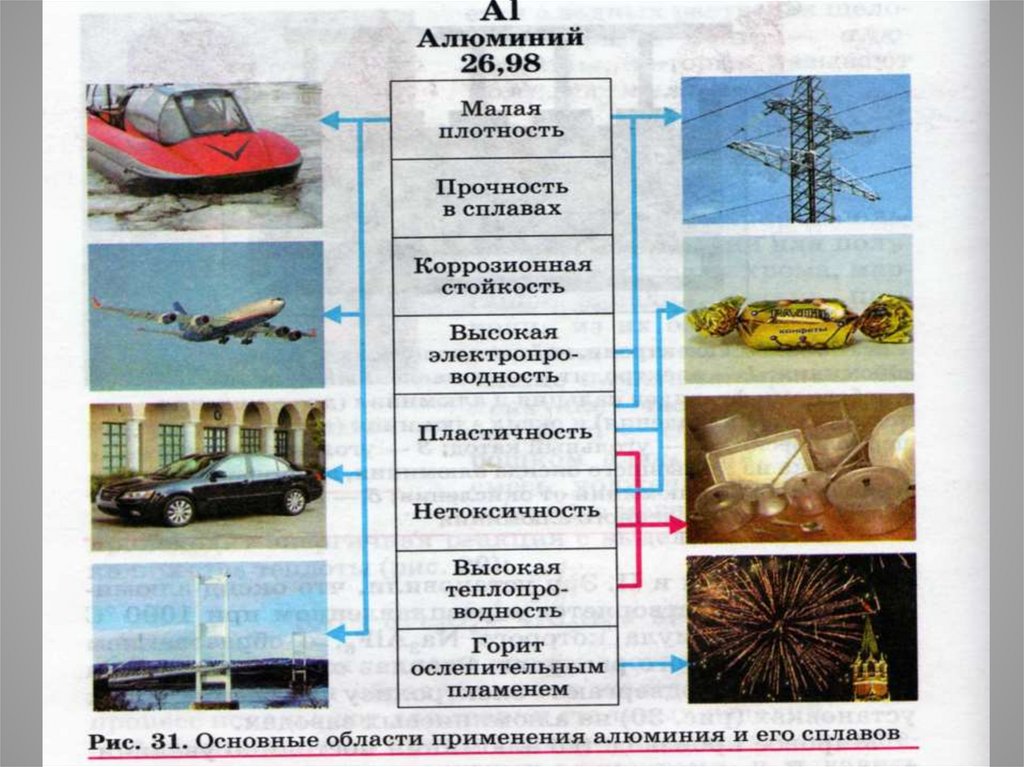
14. Строительство
Алюминий и его сплавы применяются впромышленном и гражданском строительстве при
изготовления каркасов зданий, ферм, оконных рам,
лестниц и др. конструкций.
15.
АЛЮМИНИЙ В РАКЕТНОМ ТОПЛИВЕ.При сгорании алюминия в кислороде и фторе выделяется много
тепла. Поэтому его используют как присадку к ракетному
топливу. Ракета "Сатурн" сжигает за время полёта 36 тонн
алюминиевого порошка. Идея использования металлов в качестве
компонента ракетного топлива впервые высказал Ф. А. Цандер.
16.
Алюминиевая посуда и под воздействием кипящегомолока и вареных овощей в микроскопических дозах
отщепляется от емкости и благополучным образом
проникает в наш желудок. Так что лучше
воздержаться от хранения каких-либо продуктов в
алюминиевых приборах.
Если приготовление пищи в такой посуде происходит на протяжении
многих лет, то, по мнению специалистов в организме на протяжении
всего этого времени накапливается достаточное количество алюминия,
которое способно вызвать заболевание анемии, почек, печени, а также
спровоцировать неврологические расстройства.
17.
По некоторым исследованиямпоступление алюминия в
организм человека было
сочтено фактором в развитии
болезни Альцгеймера
18.
Рассмотрите электрохимический ряд металлов.Li K Ba Ca Na Mg Al Mn Cr Zn Fe Co Sn Pb H2 Cu Hg Au
В каком виде (в свободном или в соединении)
находится алюминий в природе?
19.
Нахождение в природеАлюминий – самый распространенный в природе
элемент, по содержанию в земной коре (8%)
находится на третьем месте после кислорода и
кремния.
20.
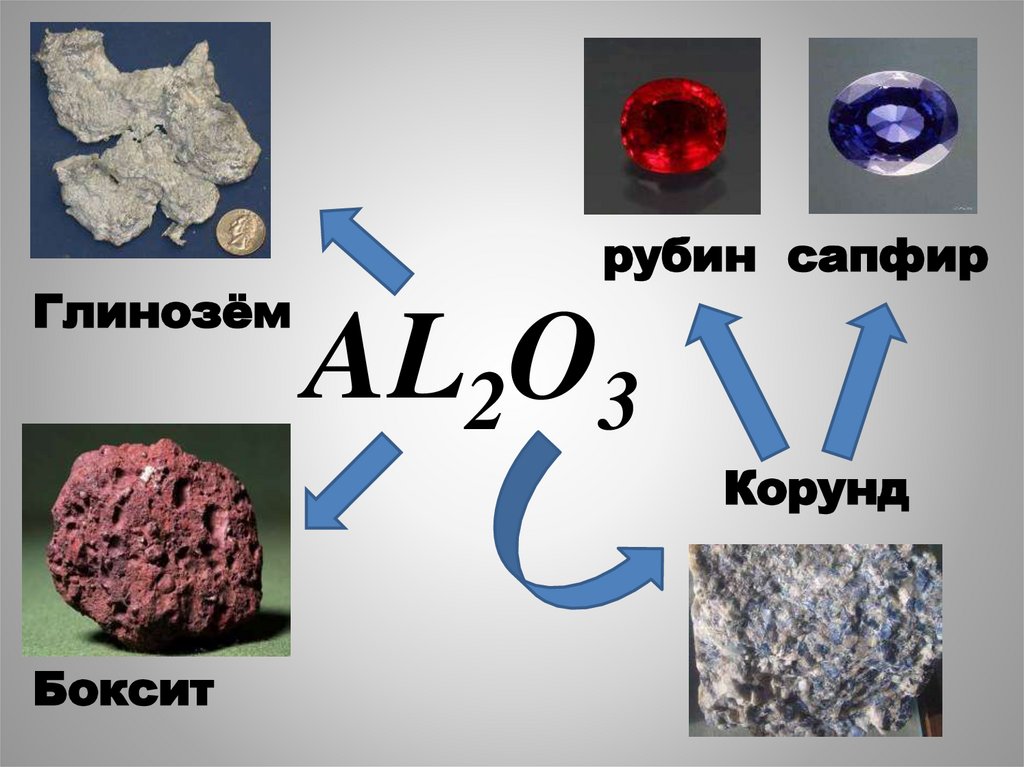
Бокситы – Al2O3 • H2OНефелины – KNa3[AlSiO4]4
Глиноземы - Al2O3
Ca3Al2(SiO4)3
Гранат
Be3Al2Si6O18
Берилл
21.
Глинозёмрубин сапфир
AL2O3
Корунд
Боксит
22.
Применение сапфиров и рубиновзнаменитые сапфиры
английской королевской
семьи
23.
«алюминий есть самыйраспространенный в природе;
достаточно указать на то, что
он входит в состав глины,
чтоб ясно было всеобщее
распространение алюминия в
коре земной. Алюминий, или
металл квасцов (alumen),
потому и называется иначе
глинием, что находится в
глине».
24. физические свойства
Алюминий является рекордсменом по многим параметрам.Перечислите их
Возьмите алюминиевую проволоку, рассмотрите ее, попробуйте изменить ее
форму. На основании наблюдения и вашего жизненного опыта охарактеризуйте
физические свойства алюминия и запишите их. В случае затруднения поставьте
знак вопроса напротив соответствующего свойства.
Общие физические свойства:
• 1. агрегатное состояние;
• 2. цвет;
• 3. металлический блеск;
• 4. запах;
• 5. пластичность;
• 6. электропроводность;
• 7. теплопроводность;
• 8. растворимость в воде.
Индивидуальные физические свойства:
• 9. плотность 2,698 г/см3
• 10. температура плавления 660,4 °С
• 11. температура кипения 2466,9 °С
• 12. легко поддается обработке
• 13. образует легкие и прочные сплавы
ЭТО ВАЖНО
Совокупность этих свойств позволяет отнести алюминий к числу
важнейших технических материалов
25. Алюминий как простое вещество химические свойства
Если поверхность алюминия потереть солью ртути, то происходит реакция:2Al + 3HgCl2 = 2AlCl3 + 3Hg
Выделившаяся ртуть растворяет алюминий, образуя амальгаму.
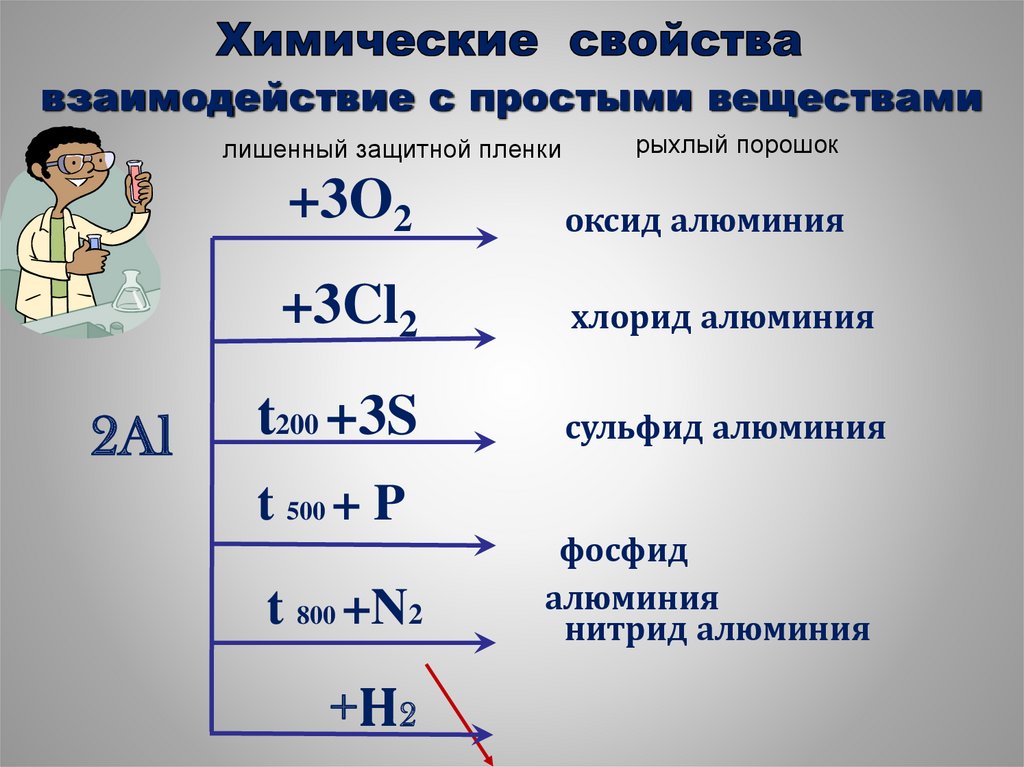
26.
взаимодействие с простыми веществамилишенный защитной пленки
2Al
рыхлый порошок
+3O2
оксид алюминия
+3Cl2
хлорид алюминия
t200 +3S
t 500 + P
t 800 +N2
+Н2
сульфид алюминия
фосфид
алюминия
нитрид алюминия
27. взаимодействие с водой
Если в отсутствии воздуха удалить с поверхности алюминияоксидную пленку, то он активно реагирует с водой.
2Al + 6H2O=2H2 + 2Al(OH)3
28.
взаимодействие со сложными веществами2. Легко взаимодействует с разбавленными кислотами
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15H2O
(в качестве продукта восстановления азотной кислоты
также может быть азот и нитрат аммония)
3. Концентрированная серная и азотная кислоты пассивируют
алюминий (образуется плотная оксидная пленка), реакция
протекает при нагревании.
2Al + 6H2SO4 = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3 = Al(NO3)3 + 3NO2 + 3H2O
29. взаимодействие со щелочами
2Al + 2NaOH + 6H2O=2Na[Al(OH)4] + 3H21.
2NaOH + Al2O3 + 3H2O=2Na[Al(OH)4]
2.
2Al + 6H2O=3H2 +2Al(OH)3
3.
NaOH + Al(OH)3=Na[Al(OH)4
По предложению химика Горбова, в русско-японскую войну
эту реакцию использовали для получения водорода для
аэростатов.
30.
Вытесняет металлы из их оксидов(алюминотермия):
8Al + 3Fe3O4 = 9Fe + 4Al2O3
8
Al0 - 3ē → Al+3 – окисление, восстановитель
3 24 Fe+2 + 2ē → Fe0 – восстановление, ок-ль
3
2Fe+3 + 6ē → 2Fe0 – восстановление, ок-ль
31.
Датский физикГанс Эрстед
(1777-1851)
Впервые алюминий был
получен им
в 1825 году действием
амальгамы калия
(сплав с ртутью)
на хлорид алюминия с
последующей отгонкой
ртути.
Название элемента образовано от
лат. aluminis — квасцы.
32.
Будучи студентом Оберлинскогоколледжа,
Холл Чарльз
он узнал, что можно
разбогатеть
и
(1863
– 1914)
американский
получить благодарность
человечества,
если изобрести способ получения
алюминия
инженер-химик
в промышленных масштабах.
Как одержимый, Чарльз проводил эксперименты
по выработке алюминия путем
электролиза криолитно-глиноземного
расплава.
23 февраля 1886 года спустя год
после окончания колледжа Чарльз получил с
помощью электролиза первый алюминий.
33.
Поль Эру(1863-1914) –
французский инженер - химик
В 1889 году открыл
алюминиевый завод во
Фроне (Франция), став
его директором. Он
сконструировал
электродуговую печь для
выплавки стали,
названную его именем; он
разработал также
электролитический
способ получения
алюминиевых сплавов
34.
Современные метод получения был разработаннезависимо друг от друга: американцем Чарльзом
Холлом и французом Полем Эру в 1886 году.
Современное
получение алюминия
Он заключается в
растворении оксида
алюминия в расплаве
криолита с
последующим
электролизом с
использованием
расходуемых коксовых
или графитовых
электродов.
35. Получение алюминия в промышленности
Алюминий получаютэлектрохимическим методом
из бокситов.
2Al2O3 ток> 4Al + 3O2
36.
ЛегкостьТеплопроводность
Электропроводность
Алюминий
Пластичность
Нетоксичность
36
37. Авиастроение
Слышу рокот самолёта,Где-то рядом – недалеко,
Лёгкий элемент крылатый
К нам пожаловал, ребята!
Применение Al и его
сплавов во всех видах
транспорта, а в
особенности воздушного
привело к уменьшению
собственной массы
транспортных средств и
резкому увеличению
эффективности их
использования
38. Кораблестроение
Al и его сплавыприменяют при
отделке и изготовлении
корпусов и дымовых
труб судов,
спасательных лодок,
радарных матч,
трапов
39. Пищевая промышленность
Алюминиевая фольга –упаковочный материал
для пищевых продуктов.
Алюминиевая тара
используется для
консервирования и
хранения продуктов
питания.
40. Машиностроение
Моторы, блоки, головкицилиндров, картеры,
коробки передач, насосы
и многие другие детали
также изготавливают
из Al и его сплавов
41. Электротехника
Алюминий и его сплавыиспользуют в
электротехнической
промышленности для
изготовления кабелей,
шинопроводов,
конденсаторов,
выпрямителей
переменного тока.
42. Военная промышленность
Алюминий, а также его сплавыявляется стратегическим
металлом и широко
используется в военной
промышленности при
строительстве военной техники и
оружия: самолетов, танков,
артиллерийских установок, ракет,
зажигательных веществ, а также
для других целей в военной
технике.
43. Соединения алюминия. Оксид
• Очень твердый порошок белого цвета.• Образуется:
а) при окислении или горении алюминия:
4Al + 3O2 = 2Al2O3
б) в реакции алюминотермии:
2Al + Fe2O3 = 2Fe + Al2O3
в) при термическом разложении гидроксида:
2Al(OH)3 = Al2O3 + H2O
44. Химические свойства оксида алюминия
Al2O3амфотерный оксид
Взаимодействует:
а) с кислотами:
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Al2O3 + 6H+ + 3SO42- = 2Al3+ + 3SO42- + 3H2O
Al2O3 + 6H+ = 2Al3+ + 3H2O
б) со щелочами:
Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O
Al2O3 + 6Na+ + 6OH- = 6Na+ + 2AlO33- + 3H2O
Al2O3 + 6OH- = 2AlO33- + 3H2O
Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4]
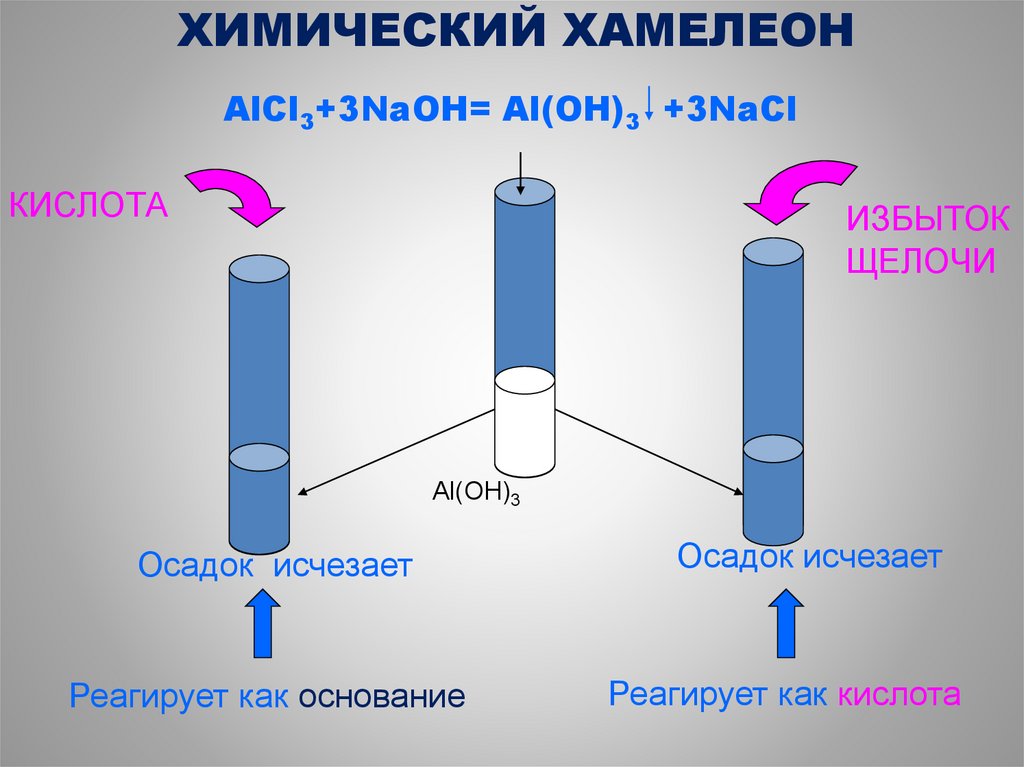
45.
ХИМИЧЕСКИЙ ХАМЕЛЕОНAlCl3+3NaOH= Al(OH)3 +3NaCl
КИСЛОТА
ИЗБЫТОК
ЩЕЛОЧИ
Al(OH)3
Осадок исчезает
Реагирует как основание
Осадок исчезает
Реагирует как кислота
46.
Амфотерный гидроксидКак основание:
Al(OH)3 + 3HCl AlCl3 + 3H2O
Как кислота
Al(OH)3 + NaOH Na[Al(OH)4]
Как нерастворимый гидроксид
2Al(OH)3 –t° Al2O3 + 3H2O
47.
Гель из гидроксида алюминия входит в состав лекарстдля лечения болезней желудка.
Гидроксид алюминия используется для очистки воды, т.
к. обладает способностью поглощать различные
вещества.
Оксид алюминия в виде корунда используется как
образивный материал для обработки металлических
изделий.
Оксид алюминия в виде рубина широко используется
в лазерной технике.
Оксид алюминия применяется в качестве
катализатора, для разделения веществ в хроматографии.
Хлорид алюминия AlCl3 – катализатор в производстве
органических веществ.
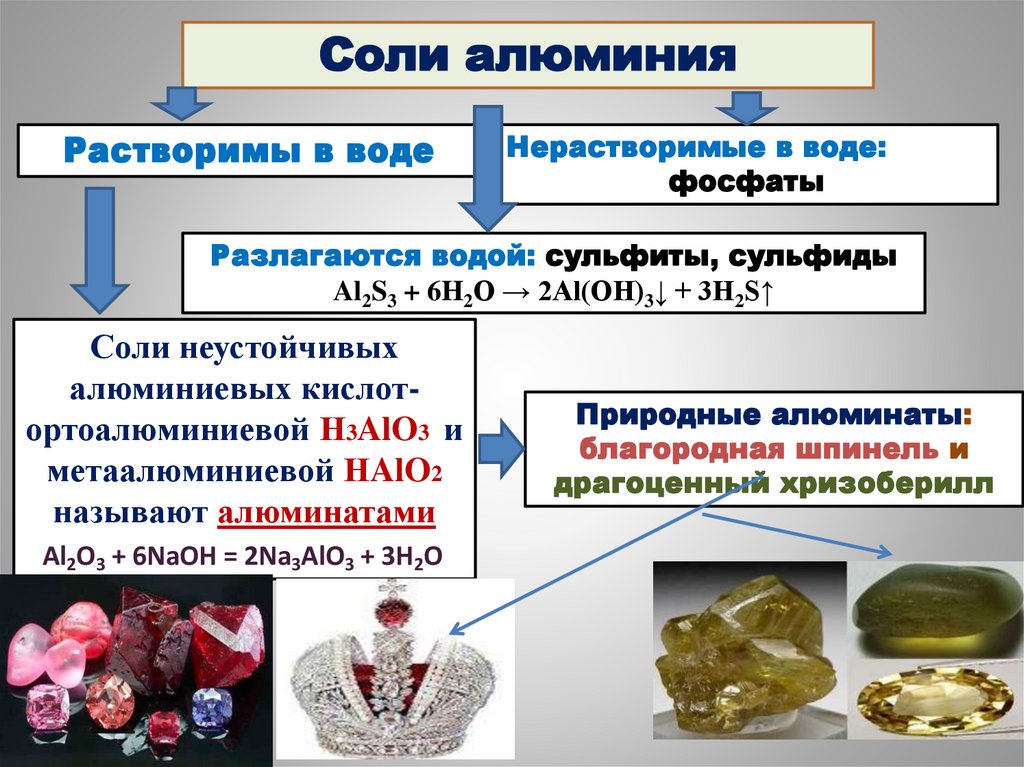
48.
Соли алюминияРастворимы в воде
Нерастворимые в воде:
фосфаты
Разлагаются водой: сульфиты, сульфиды
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
Соли неустойчивых
алюминиевых кислотортоалюминиевой Н3AlO3 и
метаалюминиевой НAlO2
называют алюминатами
Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O
Природные алюминаты:
благородная шпинель и
драгоценный хризоберилл
49.
50. Алюминий
AlАлюминий
«Он яркой звездой загорится,
Белый и легкий металл,
В 13-й клетке таблицы
Почетное место занял.
Для легкости в сплавы дается,
Мощь самолетов создал.
Тягуч и пластичен, отлично куется
Серебряный этот металл.
В составе багровых рубинов,
В сапфировой сине огней,
В серой обыденной глине
В виде наждачных камней,
Всюду металл тот я вижу,
В отчетливой клетке из линий.
К веку легчайших металлов идет
Наш чудесный металл».
51.
Э Т О И Н Т Е Р Е С Н О:Алюминий найдет свое место и в производстве новой так называемой
«умной» одежды. Уже сейчас производители создали ткань, покрытую
тонким слоем этого металла, которая получила название
алюминированная ткань.
Обладая интересными свойствами, такими как
последовательное согревание и охлаждение, она может
применяться в различных областях.
Например, если на окне висят занавески, выполненные из
этой ткани, то они будут отражать тепловые лучи в
жаркие дни, но пропустят свет. Таким образом, в комнате
будет прохладно и светло. Зимой занавески можно
перевернуть металлической стороной в комнату, это
позволит вернуть тепло в помещение. Такую ткань можно
считать универсальной — обладатель плаща из нее может
не опасаться ни зноя, ни холода. При этом в зависимости
от погоды плащ нужно перевернуть той или иной
стороной.
52.
8 А МФ ОТ Е Р Н Ы5 ЩЕ Л О Ч Е Й
6 А Л ЮМ И Н А Т Ы
7 К ИС Л ОТ А МИ
4 П А С С И В И Р У ЮТ
3 В О СС Т А НОВ И Т Е Л Ь
1 К Р И О Л И Т Е
2 К Р ЫЛ А Т Ы Й
53.
Какие из соединений вступят в реакцию с алюминием:Cl2
K2O
CuSO4
H2O
S
BaSO4
HCL
Fe2O3
Cr
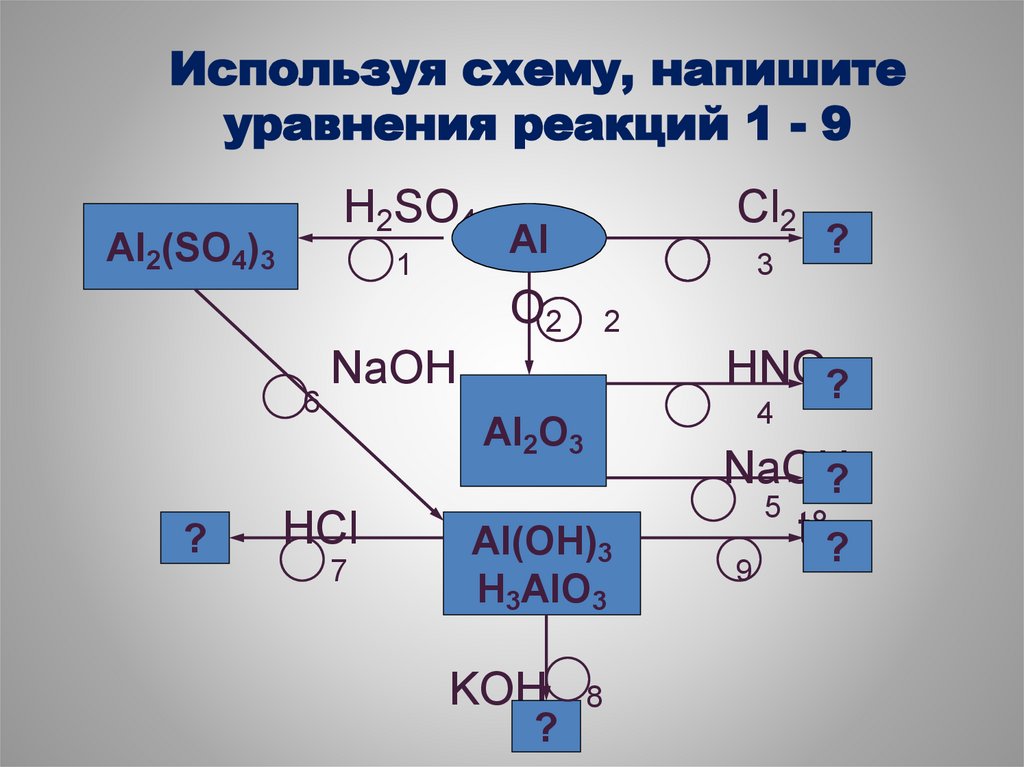
54. Используя схему, напишите уравнения реакций 1 - 9
H2SO4Al2(SO4)3
1
Cl2
Al
3
O2
6
?
2
NaOH
HNO?3
4
Al2O3
HCl
7
?
Al(OH)3
H3AlO3
KOH
?
8
NaOH
?
5
t°?
9
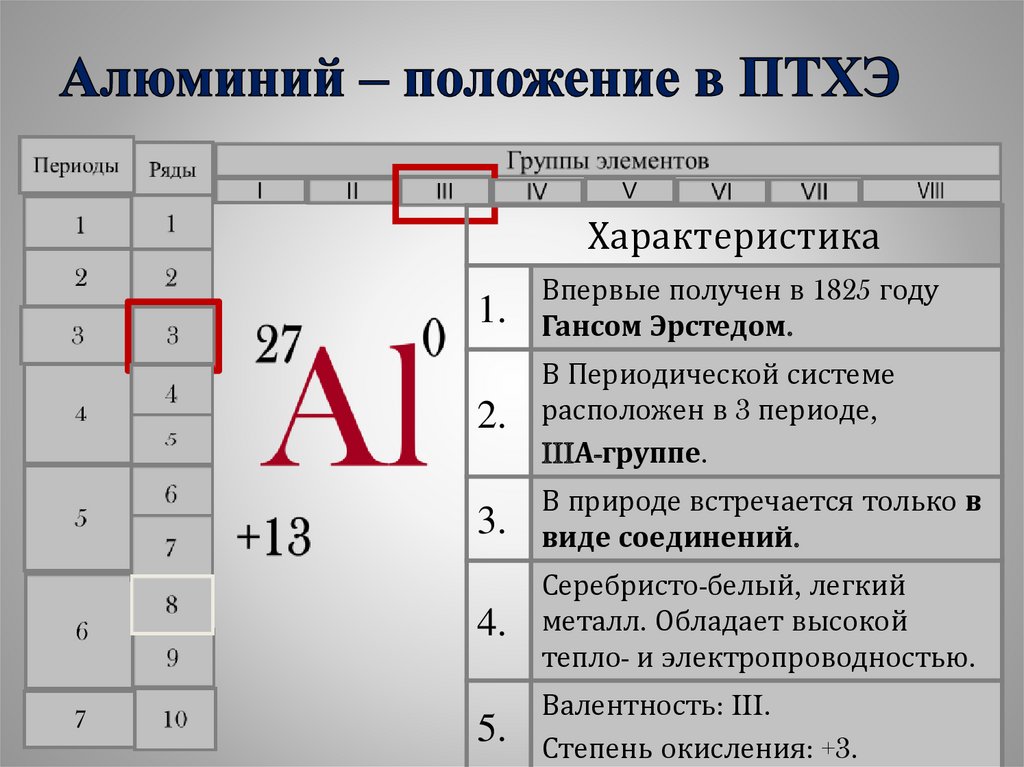
55.
Характеристика1.
Впервые получен в 1825 году
Гансом Эрстедом.
2.
В Периодической системе
расположен в 3 периоде,
IIIА-группе.
3.
В природе встречается только в
виде соединений.
4.
Серебристо-белый, легкий
металл. Обладает высокой
тепло- и электропроводностью.
5.
Валентность: III.
Степень окисления: +3.












































 Химия
Химия








