Похожие презентации:
Электролиз воды
1. Электролиз воды
Электролиз воды — хорошо разработанный и освоенный впромышленности способ производства водорода. Пока этот
способ
применяется в сравнительно небольших масштабах из-за
большого
расхода электроэнергии и электролитический водород по
себестоимости еще не может конкурировать с полученным
конверсионными
методами.
Планируемое широкомасштабное применение водорода
как энергоносителя, в частности как экологически безвредного
топлива для транспорта должно привести к значительному
развитию производства водорода электролитическим
разложением
воды.
2. При электролизе воды кроме водорода, выделяющегося на катоде, в качестве ценного побочного продукта на аноде выделяется
кислород, применяемый в металлургии, химическойпромышленности и в других отраслях народного
хозяйства. Электролитическое разложение воды
проводят в присутствии фонового электролита кислот, щелочей или солей, так как
электрическая проводимость воды весьма мала и
составляет 4-10*6 Ом-м*' для дистиллированной
воды и 1-10*1 водопроводной.
3. Для производства водорода электролиз проводят в водных растворах щелочей —NаОН или КОН, менее агрессивных по отношению к
конструкционным материалам электродов иэлектролизных ванн, чем кислоты (хотя электрическая
проводимость кислот выше). Материалом для катодов служит
сталь; иногда для снижения перенапряжения водорода на
стальной катод наносят покрытие из никеля, содержащего серу.
Анод изготовляется также
из стали с никелевым покрытием для защиты от коррозии.
В щелочной среде протекают следующие электродные процессы:
4. В стандартных условиях (25°С, 0,1 МПа) теоретическое напряжение разложения воды составляет 1,23в. Фактическое напряжение,
прилагаемое к электролизеру приэлектролизе воды, много выше вследствие поляризации
электродов и составляет 2,3—2,5 В. Теоретический расход
электроэнергии на получение 1 м3 водорода 2,55 квтч.
Фактический расходный коэффициент по электроэнергии
составляет при электролизе воды 5—6 кВт-ч/мЗ Н2, что
отвечает степени использования электроэнергии 50-60%.
Для снижения перенапряжения водорода и кислорода на
электродах, а также для уменьшения удельного
сопротивления электролита электролиз щелочных
растворов проводят при повышенных температурах.
Зависимость удельного сопротивления щелочного
электролита от температуры показана на рис.
5. Зависимость удельного сопротивления щелочного электролита р от температуры: 1— раствор КОН (мол. доля 35%); 2 — раствор NаОН
(мол.доля 25%)
6. При температурах выше 100°С удельное сопротивление электролита и, следовательно, напряжение на электролизере возрастает из-за
увеличения газонаполнения электролита. При высокихтемпературах электролиз проводят под давлением,
снижающим поляризацию электродов. Применение
давления 1—3 МПа позволяет проводить электролиз воды
при температуре около 120°С.
(Изменение электрического состояния электрода (его
потенциала, плотности заряда двойного электрического слоя)
под влиянием проходящего через границу раздела электрод –
электролит электрического тока называется поляризацией
электрода. При поляризации потенциал электрода
отличается от равновесного значения)
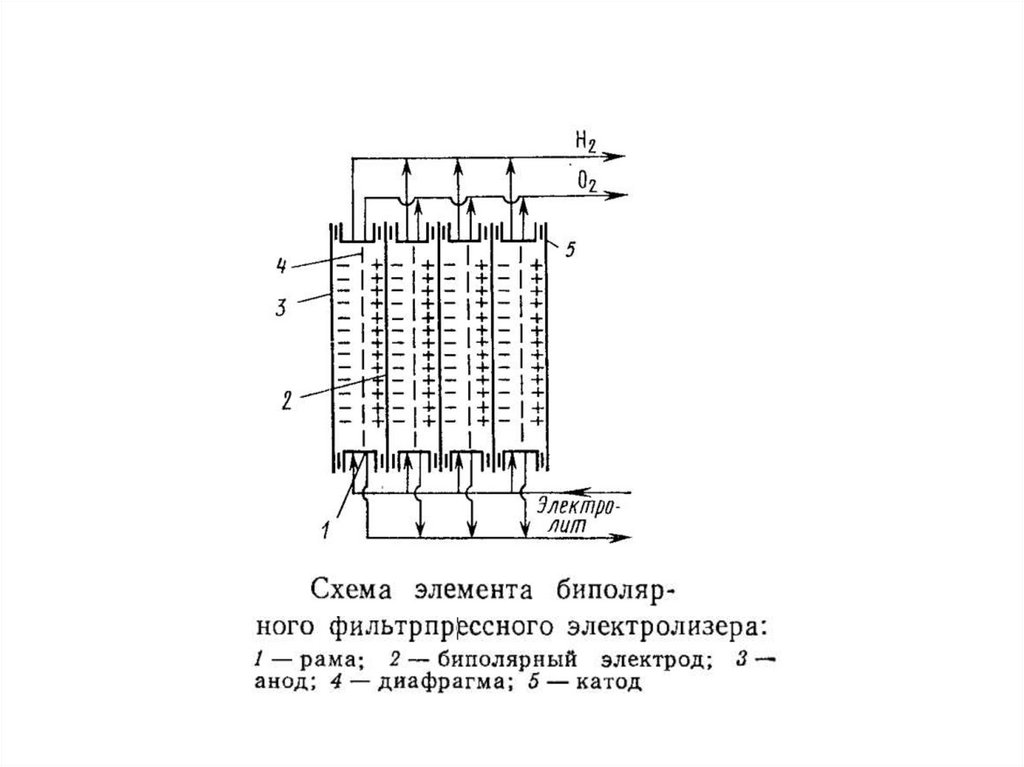
7. Для электролиза воды применяют биполярные электролизеры фильтрпрессного типа с циркуляцией электролита. Электролизер составлен
из 50— 170 отдельныхбиполярных ячеек. Для наиболее мощных электролизеров
число ячеек составляет 160— 170. Схема биполярного
электролизера представлена на рис. Ячейка состоит из двух
стальных биполярных электродов и стальной никелированной
рамы, к которой крепится пористая диафрагма, разделяющая
внутреннюю полость ячейки на анодное и катодное
пространства для раздельного выделения катодного
(водород) и анодного (кислород) продуктов. К сплошным
биполярным электродам крепятся выносные
перфорированные электроды (на рис. не показаны) с целью
развития электродной поверхности, на которой идут
электрохимические реакции.
8. ппппппп
9.
В качестве пористой диафрагмы используют асбестовуюткань,
армированную
никелевой
проволокой.
Соединенные последовательно ячейки представляют собой
биполярную конструкцию, в которой все промежуточные
электроды работают, с одной стороны, как анод, а с другой
— как катод, а крайние электроды работают монополярно;
к крайним монополярным электродам подведен постоянный электрический ток. Электролит циркулирует между
электролизером и сепараторами, в которых газообразные
продукты электролиза отделяются от жидкости. Водород и
кислород, выделенные в сепараторах, присоединяют к
основным газовым потокам, выходящим из электролизера
в сборные каналы, а электролит возвращают в электролизер. Фильтрпрессные электролизеры отличаются компактностью и минимальным межэлектродным расстоянием
при высокой их производительности.
10. Стоимость электроэнергии составляет 90% себестоимости электролитического водорода, причем степень использования электроэнергии
не превышает 30%. Это ограничиваетмасштабы производства электролитического водорода. Для
питания водородных электролизеров иногда используют
избыточную электроэнергию АЭС, в периоды недогрузки, а
также солнечную энергию (Япония). Одним из путей
снижения расхода электроэнергии и интенсификации
производства водорода служит высокотемпературный
электролиз водяного пара с применением твердых
электролитов. Электрохимическое разложение водяного пара
с использованием оксидных электролитов (оксиды циркония,
модифицированные оксидами кальция, иттрия, ванадия или
др.) производят при 800— 1000°С и напряжении на
электролизере около 1,3 В. Электрическая проводимость в
таком электролите достигается за счет ионов кислорода,
образующихся при разложении молекул воды:
11.
12.
На рис. приведена схема электрохимической стадиикомбинированной системы. Диоксид серы подают во
внутреннюю полость пористого анода, через поры которого
SО 2 диффундирует на поверхность и окисляется на ней.
Образовавшиеся ионы водорода мигрируют, проходят через
пористую диафрагму в като-дное пространство и
восстанавливаются на катоде, образуя газо-образный
водород. Серная кислота циркулирует в системе. В электролизере катод выполнен из нержавеющей стали,
устойчивой по отношению к серной кислоте. Анодом служит
полый внутри, пористый графитовый блок.
13.
14. Производство по данной схеме позволяет снизить энергопотребление в 2 раза. При крупномасштабном производстве электролитического
водорода в каскадесоединенных последовательно электролизеров в
качестве побочного продукта получают тяжелую воду
путем постепенного концентрирования тяжелой
воды в электролизерах и ее извлечения методом
изотопного обмена. Воду, обогащенную тяжелой
водой-(D20 ), выводят из последней ступени каскада
электролизеров.














 Химия
Химия








