Похожие презентации:
Поглощение и рассеяние света. Спектральный анализ и люминисценция и их использование в медицине
1. Лекция 20
Тема:Поглощение и рассеяниесвета.Спектральный анализ и
люминисценция и их использование в
медицине
2. Раздел 1
Закон поглощения света3. Опыт показывает, что изменение интенсивности света I пропорционально падающей интенсивности I и толщине этого слоя. Чем больше слой, тем б
dxI0
x
Опыт показывает, что
изменение
интенсивности света I
пропорционально
падающей
интенсивности I и
Iпрош толщине этого слоя.
Чем больше слой, тем
больше интенсивность.
Интенсивность изменяется так:
dI=-kIdx
4. dI = - kIdx = - kdx S = - kSdx ln I = - k ln C I = C I = I0, x = 0, C= I0
Решим это уравнениеdI = - kIdx
dI
=
kdx
I dI
S I = - kSdx
ln I = - k ln C
kt
I = Ce
I = I , x = 0,
C= I0
0
5.
kxIпрош = Io e – закон
поглощения света
(закон
Бугера)
Коэффициент k называют
показатель поглощения.
Измеряется в м –1 и зависит от
длины волны ( ) и эта зависимость
называется спектр поглощения
вещества
6. К = с – закон Бера - удельный показатель поглощения; с – концентрация; зависит от . Объединяя две формулы, получаем общий закон Бугер
К = с – закон Бера- удельный показатель
поглощения;
с – концентрация; зависит от .
Объединяя две формулы,
получаем общий закон БугераЛамберта-Бера :
– сx
Iпрош. = I0 е
7. Отношение Iпрош. к I0 Т = = – коэффициент пропускания D = lg = - lg T = 0,43 cx = 1cx – оптическая плотность Зависимость D от такая же как k и Т и предст
Отношение Iпрош. к I0I прош
cx
=e
– коэффициент
I0
пропускания
1
D = lg = - lg T = 0,43 cx = 1cx –
T
оптическая плотность
Зависимость D от такая же как
k и Т и представляет собой спектр
поглощения образца
D( ) k( ) ( )
Т=
8. Определив зависимость D от , можно узнать тип вещества, то есть провести качественный анализ. Зная коэффициенты D, и х, можно найти с, то е
Определив зависимость D от ,можно узнать тип вещества, то
есть провести качественный
анализ. Зная коэффициенты D,
и х, можно найти с, то есть
провести количественный анализ.
9. Схема фотоэлектроколориметра
71
2
3
4
8
5
6
10. 1-источник света
2-линза3-светофильтр
4-кювета с растворителем
5-фотометрический клин
6-фотоэлемент
7-микроамперметр
8-кювета с раствором
11. Передвигая оптический клин , можно изменять силу тока , в частности , установить ее равной 100 делениям. Это означает, что интенсивность света
,прошедшего через растворитель равна
100 условным единицам. Если вместо
кюветы с растворителем ввести кювету с
раствором , то отсчет на регистраторе
уменьшается за счет поглощения света.
12. Раздел 2
Рассеяние света13. Отклонение света на большие углы- рассеяние
Отклонение света на большиеуглырассеяние
Причины:
Оптическая неоднородность среды
I прош I 0e
a
x
- показатель рассеивания
Два вида рассеивания:
1.в чистых средах(молекулярное)
2.в мутных средах
14. Молекулярное рассеивание наблюдается ,если d<0,2
Молекулярное рассеиваниенаблюдается ,если d<0,2
где d-размер неоднородности(частиц), а λ -длина волны
(в воздухе ,в воде и других чистых средах)
В вакууме рассеяние не происходит
4
I
~ I / ( кр 760 нм , фиол 400 нм)
расс
Мутная среда:
I расс ~ I /
2
Если одновременно происходят рассеяние и
поглощение света ,то
( k ) x
I прош I 0e
15. Раздел 3
Оптические спектры атомов16. Впервые происхождение спектров атомов смог объяснить Нильс Бор. Постулаты Бора 1.Электроны в атоме могут находиться только в определенных
Впервые происхождение спектроватомов смог объяснить Нильс Бор.
Постулаты Бора
1.Электроны в атоме могут
находиться только в определенных
энергетических состояниях Е1, Е2,
Е3… Еn, в которых они не излучают и
не поглощают энергии.
17. 2.При переходе атома из одного состояния в другое, он излучает или поглощает квант электромагнитной энергии. h = Е1 - Е2 3.Стационарными состо
2.При переходе атома из одногосостояния в другое, он излучает или
поглощает квант электромагнитной
энергии.
h = Е1 - Е2
3.Стационарными состояниями
являются те, в которых момент
импульса электрона принимает
значения кратные величине
h=
h/2
mvr= n h/2 n = 1, 2, 3, 4…
18.
Ze / 4 0 r mV / r2
2
2
Найдем радиусы стационарных
орбит электронов
rn n 0 h / Ze m
2
2
2
Потенциальная энергия
электрона
Eпот e Ze / 4 0 r
2
Кинетическая энергия
E кин mV / 2 Ze / 8 0 r
2
2
Полная энергия электрона в атоме всегда отрицательна
E E пот E кин Ze 2 / 8 0 r
19. Полная энергия электрона в стационарных состояниях
E Z e m / 8 0 h n Z E0 / n2 4
2
2
2
2
2
где
4
2
2
18
E0 e m / 8 0 h 2,176 *10 Дж 13эВ
20. Полная энергия электрона равна: Е = - E0/ E0 = 13,6 эВ; n – номер орбиты (состояния); z – номер химического элемента.
Полная энергия электрона равна:2
2
Е = - z E0/n
E0 = 13,6 эВ;
n – номер орбиты (состояния);
z – номер химического элемента.
21. У каждого атома свой номер (z), следовательно, набор возможных энергетических состояний у каждого атома и элемента индивидуален и следовате
У каждого атома свой номер (z),следовательно, набор возможных
энергетических состояний у каждого
атома и элемента индивидуален и
следовательно, спектры испускания
и поглощения у каждого атома и
элемента тоже индивидуальны. Зная
спектр, можно определить вид
вещества.
22. РАЗДЕЛ 4
Спектр атома водорода.23. Еn = - E0/n2-энергия электронов в атоме водорода
Еn = - E0/n2-энергия электронов вE= - E /25
атоме водорода
0
E= - E0/16
E= - E0/9
E= - E0/4
Серия Пашена
Серия Бальмера
E= - E0
Серия Лаймана
Нижний уровень – основной. Переход вверх
требует поглощения света, переход вниз –
излучения света.
24. Частоты спектральных линий
1E0 1
= (Ек – Еn)/h =
2 2
k
h n
где n = 1, 2, 3, 4…;
k = n + 1, n + 2, n + 3 …;
h – постоянная Планка.
Формула Бальмера описывает и поглощение, и
излучение (частоты спектральных линий в
водороде)
25. Основные спектральные серии водорода
Спектральная серия – группа линий в спектревеществ, которым соответствуют переходы
электронов со всех верхних на один и тот же
нижний уровень.
1.Серия Лаймана (переход на самый нижний
уровень)
n=1
k = 2, 3, 4…
E0 1
1 2
=
лежат в УФ области
k
n
26. 2.Серия Бальмера
n=2k 3
E0 1 1
=
2
n 4 k
лежит в видимой области спектра
1.Серия Пашена
n=3
k = 4, 5, 6…
E0
=
n
1 1
2
9 k
27. РАЗДЕЛ 5
Спектры сложных атомов.28. Энергия электронов в сложных атомах зависит не только от главного квантового числа (h), но и от орбитального числа (l), l = 0, 1, 2… Число электрон
Энергия электронов в сложныхатомах зависит не только от
главного квантового числа (h), но
и от орбитального числа (l), l =
0, 1, 2…
Число электронов в состоянии с
заданным числом l равно k = 2
(2l + 1).
29. По принципу Паули в одном квантовом состоянии в атоме может находиться не более одного электрона. Последовательность заполнения: 1 2 2 3 3 4 3 4
По принципу Паули в одном квантовомсостоянии в атоме может находиться не
более одного электрона.
Последовательность заполнения:
2
6
6
10
6 2
2
2
1s 2s 2p 3s 3p 4s 3d 4p
в последнем самом верхнем занятом
электронами состоянии находятся
валентные электроны атома и это
состояние – основное энергосостояние –
энергия самая минимальная.
30. Переходы между уровнями подразделяются: а) излучательные (оптические) – поглощения будут возникать при переходе электронов из основного с
Переходы между уровнямиподразделяются:
а) излучательные (оптические) –
поглощения будут возникать при
переходе электронов из основного
состояния в свободные верхние
уровни. Возвращение их назад дает
испускание.
б) безызлучательные
(неоптические, тепловые).
31. Оптические переходы подчиняются правилам отбора: l = 1 S = 0. Энергоуровни, переходы из которых на нежелательные уровни запрещены правилам
Оптические переходы подчиняютсяправилам отбора:
l = 1 S = 0.
Энергоуровни, переходы из которых
на нежелательные уровни запрещены
правилами отбора называют
метастабильными, но такие
переходы иногда бывают.
32. РАЗДЕЛ 6
Спектры молекул.33. Е мол. = Еэл. дв. + Екол. дв. + Евращ.,
где Екол. дв - колебательноедвижение ядер;
Евращ - вращение молекулы
Еэл.дв. >> Екол. дв >> Евращ
34.
Спектры поглощениявозникают при переходах
молекулы из нижних
подуровней основных
состояний в верхние
состояния.
Испускание происходит с
самых нижних подуровней
верхних состояний на любые
подуровни основных
(нижних) состояний.
35. Спектры люминесценции молекул не совпадают по положению со спектрами поглощения, а смещены относительно их в сторону больших длин волн –
Спектры люминесценциимолекул не совпадают по
положению со спектрами
поглощения, а смещены
относительно их в сторону
больших длин волн – закон
Стокса.
36. РАЗДЕЛ 7
Виды спектров.37. =
E м ол.1 E м ол.2h
E эл. E кол. Евращ.
=
h
1.Электронно-колебательные-вращательные.
Электронные спектры Еэл 0
Екол 0 Евращ 0
2.Колебательно- вращательные
Колебательные Еэл = 0
Екол 0 Евращ 0
3.Вращательные Евращ 0 Еэл = Екол = 0
Наблюдаются в виде отдельных линий в радиодиапазоне
38. РАЗДЕЛ 8
Люминесценция39. Если атом или молекула совершает оптический переход из возбуждения в основное состояние, то испускаемое излучение называют люминесценцие
Если атом или молекуласовершает оптический переход из
возбуждения в основное
состояние, то испускаемое
излучение называют
люминесценцией.
По способу возбуждения
атома или молекулы
люминесценция бывает:
40. а) фотолюминесценция – возбуждение поглощения электромагнитной энергией; б) катодолюминесценция - возбуждение электрическим ударом; в) эл
а) фотолюминесценция –возбуждение поглощения
электромагнитной энергией;
б) катодолюминесценция возбуждение электрическим
ударом;
в) электролюминесценция возбуждение электрическим полем;
41. г) рентгенолюминесценция – возбуждение рентгеновскими лучами. д) химилюминесценция – возбуждение в результате химической реакции. А + В
г) рентгенолюминесценция –возбуждение рентгеновскими лучами.
д) химилюминесценция – возбуждение в
результате химической реакции.
А + В АВ АВ + h
е) биолюминесценция - возбуждение в
результате биохимических реакций,
происходящих в живом организме.
42. Механизм спонтанной люминисценции:
Каждому электронному уровню в веществесоответствует ряд колебательных подуровней энергии
Электронны
е
Колебательный
Тепловой переход
Излучательный переход
43. Эти кванты (hv) и представляют собой кванты люминисценции. А различие их энергии определяет спектр люминисценции. Таким образом механизм лю
Эти кванты (hv) и представляютсобой кванты люминисценции. А
различие их энергии определяет
спектр люминисценции. Таким
образом механизм люминисценции
обусловлен как безизлучательными
(тепловыми),так и излучательными
процессами
44. Характеристики и законы люминисценции
Спектр возбуждения - это зависимостьвозбуждающего люминисценцию света от
длины волны
Спектр люминисценции – это зависимость
интенсивности люминисценции от длины
волны света
45. Если изменяется электронная энергия , то спектр называется электронно-колебательно-вращательным
Если изменяется электронная энергия , тоспектр называется электронно-колебательновращательным
Электронные: полосы которых расположены в
ультрафиолетовой , видимой и инфракрасной
-
E эл. 0
Колебательные - E эл. 0, Eколебат. 0
наблюдаются только в поглощении.
Вращательные наблюдаются только в
радиодиапазоне.
46. Спектр люминесценции сложных молекул смещен относительно спектра возбуждения в сторону больших длин волн.
Закон Стокса:E эл. E кол б.эл. Eв ращ.
E m1 E m 2
v
h
h
Спектр люминесценции сложных молекул
смещен относительно спектра возбуждения в
сторону больших длин волн.
Данный сдвиг обусловлен
наличием тепловых
переходов в веществе
47. Закон Вавилова:
Спектр люминисценции сложныхмолекул является характеристикой
вещества и не зависит от длины
волны возбуждающего света.
48. Квантовый выход люминиценции:
Это отношение числа квантов излучаемых веществомк числу поглощенных квантов возбуждающего света.
если
0,01
N л.
N погл.
то говорят о хорошей
люминисценции вещества.
49. После прекращения возбуждения Iлюм. уменьшается по закону:
t/
Iлюм. = I0
e
- длительность люминесценции
определяет время, за которое
интенсивность уменьшается е = 2,7 р
длительность люминесценции ( )
делится на:
флуоресценцию < 10
7
с;
3
фосфоресценцию > 10 с.
50. В зависимости от того, что помещают в фокальную плоскость (7), различают следующие приборы:
-если стеклянная пластинка, то получаемспектроскоп – прибор для наблюдения
спектра;
-если фоточувствительный материал, то
получаем спектрограф – прибор для
регистрации
(фотографирования)
спектра;
51. -если узкую щель, то получаем монохромат – прибор для улавливания узкого спектрального диапазона излучения.
-спектрометр(в фокальной плоскости фотоэлемент)52. Схема спектрального прибора
линзаИсточник света
L1
L2
призма
s
Входная щель
Фокальная плоскость
53. Применение в медицине
Например в санитарии проверяютдоброкачественность мяса . Измеряется
люминисценция белкового экстракта. Свет
люминисценции меняется зеленый- голубойкрасный.
Содержание белков в молоке. Светятся
ароматические аминокислоты. Кожа и слизистые –
голубой цвет; печень – зеленовато-желтый; язык –
красный; кариес зубов – отсутствие
люминисценции; при подкожных кровоизлияниях
люминисценция пропадает. Определяют
беременность.
54. Вторичная люминисценция биологических объектов
Вещества, которыми подкрашиваютсябиологические объекты, называются
люминофорами.
Существуют два вида люминофоров.
1.Если люминофор связан с веществом нековалентно, то
это называется флюоресцирующим зондом.
2.Если вещество связывается с помощью химической
связи, то в этом случае говорят о флюоресцирующей
метке .
Флюоресцирующую метку используют в диагностике для
флюоресцентной амбиографии
55.
56.
ЛукьяницаВладимир Васильевич
доцент
кафедры физики
57.
ЛАЗЕРЫИ ИХ
ИСПОЛЬЗОВАНИЕ
В МЕДИЦИНЕ
58.
Введение. Свойства лазерного излученияРаздел 1. Устройство, принципы работы
и классификация лазеров
Раздел 2. Преимущества
полупроводниковых лазеров
Раздел 3. Применение лазеров в клинике
Раздел 4. Механизмы лазерного
воздействия
Раздел 5. Техника безопасности
Раздел 6. Демонстрационные опыты
Заключение. Контрольные вопросы
59.
ВВЕДЕНИЕСВОЙСТВА ЛАЗЕРНОГО
ИЗЛУЧЕНИЯ
60.
1. Высокая направленность или малая расходимостьлазерного луча (несколько угловых минут)
2. Монохроматичность ( =const, 0,01нм)
3. Когерентность (постоянство фазы излучения)
4. Широкий интервал мощности (от 1 мВт до 109 Вт)
или интенсивности излучения, которая может
достигать весьма больших значений (1011 1014Вт/см2)
61.
РАЗДЕЛ 1УСТРОЙСТВО,
ПРИНЦИПЫ РАБОТЫ
И
КЛАССИФИКАЦИЯ
ЛАЗЕРОВ
62.
СХЕМА ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ3
3
2
2
1
1
обычная среда
активная среда
63.
ФИЗИЧЕСКАЯ МОДЕЛЬ АКТИВНОЙСРЕДЫ — ПЕСОЧНЫЕ ЧАСЫ
Обычная среда
Активная среда
Песок ( электроны)- внизу
Песок ( электроны)- вверху
64.
Нет, давайсходим в
кино
Пойдем
в библиотеку
65.
Идем надискотеку
66.
Посмотрина эту
малышку
67.
Нет, вместо библиотеки еёзанесло сюда
«вынужденным излучением»
Она что, читать
сюда пришла?
68.
ПРИНЦИП РАБОТЫРУБИНОВОГО ЛАЗЕРА НА
АТОМНОМ УРОВНЕ
Е3
Е2
Е1
69.
ПРИНЦИП РАБОТЫРУБИНОВОГО ЛАЗЕРА НА
АТОМНОМ УРОВНЕ
Е3
Е2
Е1
70.
ПРИНЦИП РАБОТЫРУБИНОВОГО ЛАЗЕРА НА
АТОМНОМ УРОВНЕ
Е3
Е2
Е1
71.
ПРИНЦИП РАБОТЫРУБИНОВОГО ЛАЗЕРА НА
АТОМНОМ УРОВНЕ
Е3
Е2
Е1
72.
ПРИНЦИП РАБОТЫРУБИНОВОГО ЛАЗЕРА НА
АТОМНОМ УРОВНЕ
Е3
Е2
Е1
73.
ПРИНЦИП РАБОТЫРУБИНОВОГО ЛАЗЕРА НА
АТОМНОМ УРОВНЕ
Е3
Е2
затравочный
квант
луч лазера
Е1
74.
УСИЛЕНИЕ СВЕТААКТИВНОЙ СРЕДОЙ
I
I0
Активная
среда
L
I > I0
I
exp
I0
I = I0ekL
L
75.
ПРИНЦИПИАЛЬНАЯОПТИЧЕСКАЯ СХЕМА ЛАЗЕРА
лампы накачки
рабочее тело
(рубин)
лампы накачки
глухое зеркало
(коэффициент
отражения=100%)
выходное зеркало
(коэффициент
отражения<100%)
76.
НАЗНАЧЕНИЕ ОСНОВНЫХЭЛЕМЕНТОВ ЛАЗЕРА
1. Рабочее тело (акивная среда) генерирует
и усиливает лазерное излучение (свет)
2. Лампы накачки излучают ультрaфиолетовое
излучение, которое переводит рабочее тело в
состояние активной среды
77.
НАЗНАЧЕНИЕ ОСНОВНЫХЭЛЕМЕНТОВ ЛАЗЕРА
3. Резонатор
а) посредством отражения света от зеркал
искусственно удлиняет путь L лазерного излучения
внутри активной среды, что способствует усилению
интенсивности излучения [I exp (L)];
б) за счет строгой параллельности зеркал формирует
направленное излучение;
в) монохроматизирует лазерное излучение путем
выбора определенной длины резонатора
( - длина волны, n - целое число)
и подавления возможных излучений с другими длинами
волн за счет интерференции в многослойных зеркалах
l n
78.
ПРИНЦИП РАБОТЫ ЛАЗЕРАРАБОЧЕЕ
ТЕЛО
79.
ПРИНЦИП РАБОТЫ ЛАЗЕРАвспышка
АКТИВНАЯ
РАБОЧЕЕ
СРЕДА
ТЕЛО
вспышка
80.
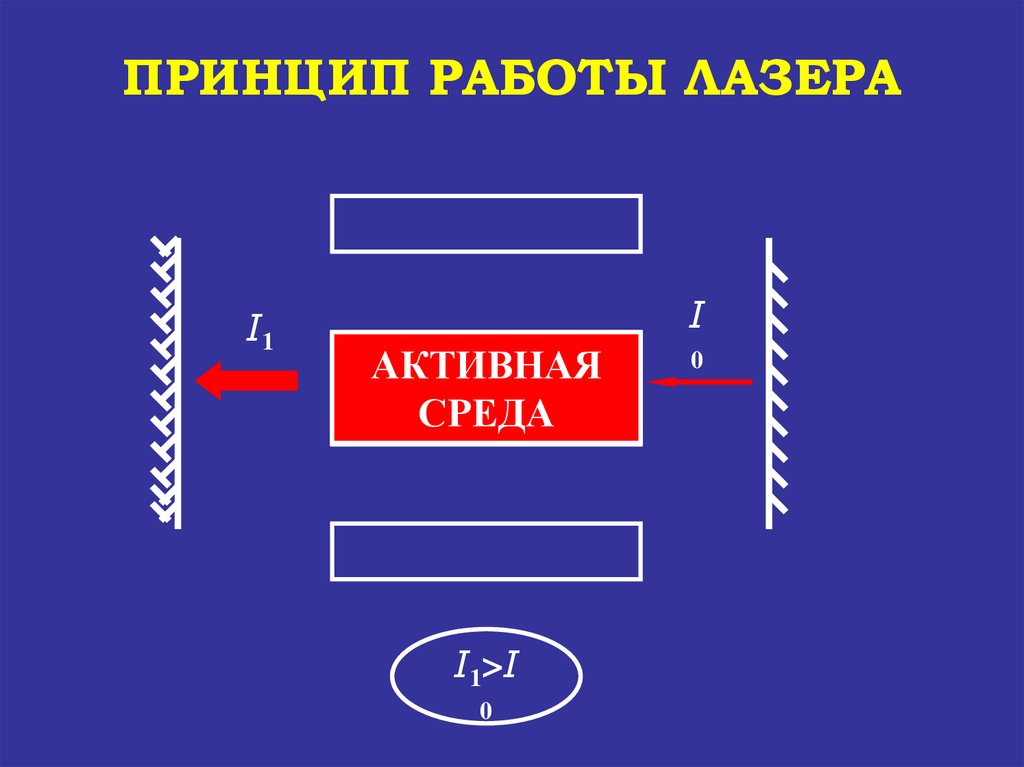
ПРИНЦИП РАБОТЫ ЛАЗЕРАI1
I
АКТИВНАЯ
УСИЛЕНИЕ
СРЕДА
СВЕТА
I1>I
0
0
81.
ПРИНЦИП РАБОТЫ ЛАЗЕРАI1
I
АКТИВНАЯ
УСИЛЕНИЕ
СРЕДА
СВЕТА
I2>I1
2
82.
ПРИНЦИП РАБОТЫ ЛАЗЕРАI4
I
АКТИВНАЯ
УСИЛЕНИЕ
СРЕДА
СВЕТА
I4>I3
3
I1* 0,01* I2
луч лазера
I3=I2 - I*
83.
ПРИНЦИП РАБОТЫ ЛАЗЕРАI4
УСИЛЕНИЕ
АКТИВНАЯ
АКТИВНАЯ
СРЕДА
СВЕТА
СРЕДА
I5>I4
I5
I2* 0,01* I5
луч лазера
I2* >I1*
84.
И так далеедо истощения активной
среды (I*=const).
Затем опять
срабатывают
лампы накачки,
которые
поддерживают
активную
среду в
“рабочем состоянии”
85.
ПРИНЦИП РАБОТЫ ЛАЗЕРАРАБОЧЕЕ
ТЕЛО
86.
ПРИНЦИП РАБОТЫ ЛАЗЕРАвспышка
АКТИВНАЯ
РАБОЧЕЕ
СРЕДА
ТЕЛО
вспышка
87.
ПРИНЦИП РАБОТЫ ЛАЗЕРАI1
I
АКТИВНАЯ
УСИЛЕНИЕ
СРЕДА
СВЕТА
I1>I
0
0
88.
ПРИНЦИП РАБОТЫ ЛАЗЕРАI1
I
АКТИВНАЯ
УСИЛЕНИЕ
СРЕДА
СВЕТА
I2>I1
2
89.
ПРИНЦИП РАБОТЫ ЛАЗЕРАI4
I
АКТИВНАЯ
УСИЛЕНИЕ
СРЕДА
СВЕТА
I4>I3
3
I1* 0,01* I2
луч лазера
I3=I2-I*
90.
ФИЗИЧЕСКАЯ МОДЕЛЬРАБОТЫ ЛАЗЕРА
переворот
сработали
лампы накачки
рабочее тело
в исходном
состоянии
часы заработали
свет начал
усиливаться
рабочее тело
превратилось в
активную среду
под действием
ламп накачки
время пошло
лазерное
излучение
пошло
появился
лазерный луч
91.
РАЗДЕЛ 2ПРЕИМУЩЕСТВА
ПОЛУПРОВОДНИКОВОГО
ЛАЗЕРА
92.
1. Малые габариты (размеры), что обусловленоиспользованием не ламп, а p-n-переходов для накачки
2.
= 0,33 32,0 мкм, что перекрывает возможности
других типов лазеров
3. Высокий КПД (от 30 до 100%)
4. Выходная мощность легко изменяется и модулируется
5. Хорошо сочетаются с волоконной оптикой, а также с
эндоскопической, ультразвуковой и магнитной
терапевтической аппаратурой
6. Обладают высокой степенью безопасности, т.к.
используют низкие напряжения (несколько вольт)
93.
РАЗДЕЛ 3ПРИМЕНЕНИЕ
ЛАЗЕРОВ В КЛИНИКЕ
94.
ДИАГНОСТИКА:а) лазерные приборы иммунологических реакций,
нефелометры, спектрофотометры
б) исследования микроциркуляции крови в различных
органах и тканях
в) манипуляции на клетке
г) глазных болезней и ЛОР заболеваний
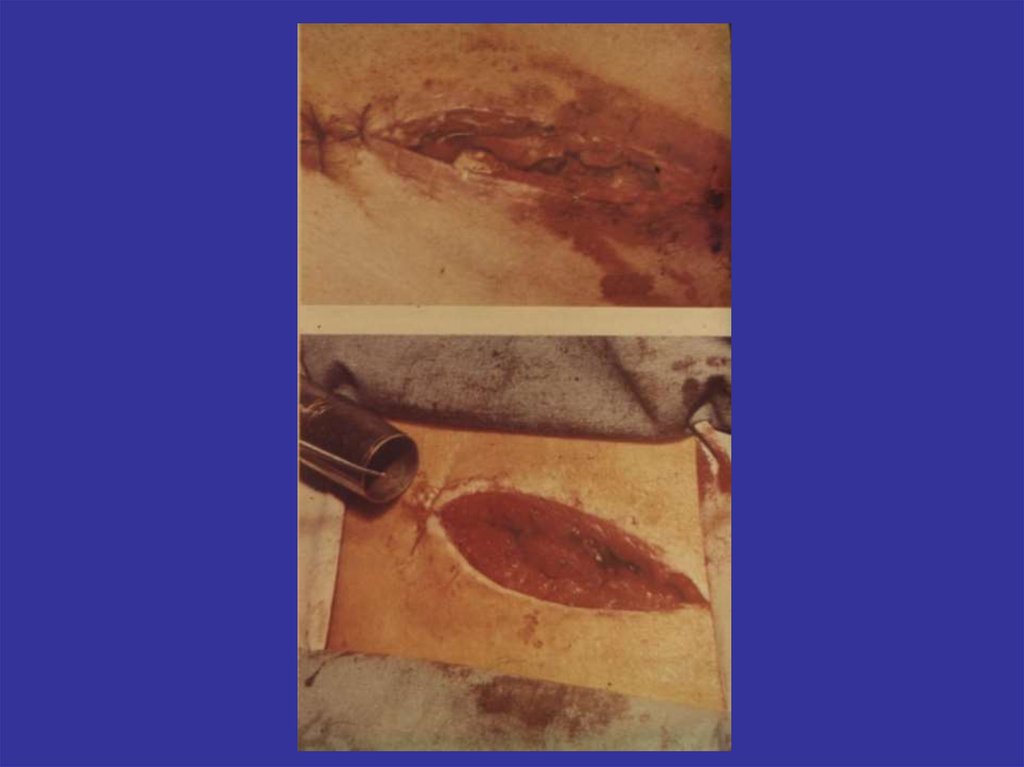
ХИРУРГИЯ:
лазерный (световой) скальпель (высокоэнергетические
приборы) применяется в нейро-, ангио-, офтальмо-,
ларинго- и общей хирургии
95.
96.
97.
ТЕРАПИЯ:стимуляция обменных процессов и активация механизмов
саногенеза (используются низкоэнергетические приборы).
Время зонального воздействия определяется из формулы:
t = (E S)/P,
где
доза облучения Е=(0,5 2) Дж/см2,
площадь облучения - [S] = см2
мощность лазера - [P] = Вт
98.
ТЕРАПЕВТИЧЕСКОЕ ДЕЙСТВИЕЛАЗЕРНОГО ИЗЛУЧЕНИЯ
1. Противовоспалительное
2. Обезболивающее
3. Спазмолитическое
4. Седативное
5. Стиммулирующее обменные
и регенеративные процессы
99.
РАЗДЕЛ 4МЕХАНИЗМЫ
ЛАЗЕРНОГО ВОЗДЕЙСТВИЯ
100.
ОСНОВНЫЕ КОНЦЕПЦИИ,ОБЪЯСНЯЮЩИЕ МЕХАНИЗМЫ
ЛАЗЕРНОГО ВОЗДЕЙСТВИЯ
1. Теория поглощения
2. Нейрорефлекторная теория
3. Теория резонансного волнового поля
101.
РАЗДЕЛ 5ТЕХНИКА
БЕЗОПАСНОСТИ
102.
ЛАЗЕРНАЯ БЕЗОПАСНОСТЬПо степени опасности лазеры делятся
на 4 класса:
I - безопасные (излучение не опасно для глаз)
II- малоопасные (опасно для глаз прямое излучение)
III - среднеопасные (опасно для глаз диффузионно
отраженное излучение на расстоянии 10 см и для кожи
прямое)
IV- высокоопасные ( опасно для кожи диффузионно
отраженное излучение на расстоянии 10 см)
103.
СПОСОБЫ ЗАЩИТЫ ОТЛАЗЕРНОГО ИЗЛУЧЕНИЯ
1. Коллективные: телевизионные системы; защитные
экраны, бленды и диафрагмы; системы блокировки и
сигнализации; ограждения (маркировка) лазерноопасной зоны
2. Индивидуальные: противолазерные очки, щитки,
маски, халаты и перчатки
Знак лазерной опасности
*
104.
РАЗДЕЛ 6ДЕМОНСТРАЦИОННЫЕ
ОПЫТЫ
105.
ЗАКЛЮЧЕНИЕКОНТРОЛЬНЫЕ ВОПРОСЫ
106.
С зонаэлектроны
n
электрохимический потенциал
(уровень Ферми)
p
V зона
дырки
n - типа
полупроводник
p - типа
107.
С зонаэлектроны
Еб- потенциальный барьер
С зона
n = p
дырки
дырки
p-n - переход
V зона
V зона
108.
Еб1Еб2
Еб2<<Еб1 p-n
при- прямом
переходсмещении
(включении) p-n - перехода











































































































 Медицина
Медицина Физика
Физика








