Похожие презентации:
Физические методы исследования в химии
1. ФИЗИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ В ХИМИИ
Локшин Борис Вениаминович,зав. лабораторией молекулярной
спектроскопии ИНЭОС РАН
2.
ЗАДАЧИ:1. Разделение и очистка веществ.
2. Установление состава и молекулярной массы.
3. Установление структуры молекул и кристаллов (расположение
атомов, длины связей, валентные углы, упаковка молекул в
кристалле)
4. Динамические свойства системы: подвижность молекул в
конденсированных фазах, фазовые переходы, подвижность
отдельных групп в молекуле (таутомерия, внутреннее вращение).
5. Межмолекулярные взаимодействия (водородные связи и др.).
6. Энергетические свойства атомов и молекул.
7. Взаимное влияние атомов и групп в молекуле.
8. Кинетика и механизм реакций.
9. Окислительно-восстановительные свойства.
10. Природа химической связи.
3.
Классификация методов:Методы химические
(аналитические и структурные)
Химический состав (сжигание).
Функциональный химический анализ
(содержание групп или ионов,
качественные реакции).
Встречный синтез.
4.
Методы физическиеАналитические методы
Разделение смесей
Определение
молекулярных масс
Микроскопия
Электрохимия
Термохимия
Структурные методы
Спектроскопия:
(Эмиссионная, рентгенофлуоресцентная. пламенная,
атомно-адсорбционная,
спектрофотометрия)
Нейтронно-активационный анализ
Хроматография (Газо-жидкостная,
жидкостная, гель-проникающая,
ионнообменная, на бумаге и др.)
Диффузия, седиментация,
светорассеяние, массспектрометрия, криоскопия,
эбулиоскопия, упругость пара.
Оптическая, электронная, атомносиловая.
Окислительно-восстановительные
потенциалы
Теплоты сгорания, энергии связей.
Теоретические (квантовая химия)
Экспериментальные
5.
Экспериментальные структурные методы.Спектральные
Не спектральные
1. Взаимодействие вещества с полем (электрическим,
магнитным).
2. Взаимодействие вещества с излучением (от -лучей до
радиоволн).
3. Взаимодействие вещества с потоком частиц (электроны,
нейтроны.
Физические методы, как правило, являются
неразрушающими (исключение - масс-спектрометрия)
Массспектрометрия
Не спектральные методы
ДифракЭлектриОптичесционные
ческие
кие
методы
свойства
свойства
Магнитные
свойства
6.
АДДИТИВНЫЕ МЕТОДЫМолекулярная рефракция:
n2 1 M
MR 2
n 1 d
n показатель преломления
М - молекулярная масса
d - плотность при данной
температуре
Молекулярная рефракция может быть выражена суммой
атомных рефракций (для D-линии Na или линий водорода)
7.
8.
Дипольные моментыР- Молекулярная поляризация:
1 M 4
2
P
N (
)
2 d
3 0
3kT
-дипольный момент
k - постоянная
Больцмана
N0 - число Авогадро
- диэлектрическая
проницаемость
- молекулярная
поляризуемость
Из зависимости P от T Р = а + в/Т определяют а и
b (угол наклона).
4
b
N
;
9
k
2
0
0,0127 b .
Учитывая численные значения
Дипольный момент молекулы выражается как
векторная сумма дипольных моментов связей.
9.
Парахорc(d ) 4
Парахор
M 1/ 4
P
d
или
M 1/ 4
P
d
- поверхностное натяжение жидкости,
d - плотность,
- плотность пара,
с- постоянная.
Парахор может быть представлен суммой атомных парахоров
и инкрементов связей, циклов и др. структурных элементов.
10.
Атомные доли парахора Π при расчете методом Мак-Гоуэна (Дж1/4•см5/2•моль−1)Элемент
Π
Элемент
Π
Элемент
Π
Al
1,07
I
1,76
S
1,19
As
1,46
Ir
1,51
Se
1,37
B
0,89
Mn
1,46
Sb
1,72
Bi
1,96
N
0,75
Si
1,25
Br
1,35
Nb
1,58
Sn
1,71
C
0,89
Np
1,83
Ta
1,60
Cd
1,46
O
0,64
Tc
1,57
Cl
1,10
Os
1,60
Te
1,73
Cr
1,42
P
1,24
Ti
1,60
F
0,60
Pb
1,96
U
1,90
Ga
1,21
Po
1,81
V
1,55
Ge
1,44
Pt
1,67
W
1,56
H
0,47
Pu
1,80
Xe
1,64
Hg
1,49
Re
11.
Магнитная восприимчивостьМ = А + М - магнитная
восприимчивость
молекулы
А - атомная
восприимчивость
- инкременты связей и
групп атомов
12.
Масс-спектрометрия. Веществоионизируется под действием
электронного удара, излучения
(лазерного), при столкновении с атомами
или ионами, в сильном электрическом
поле.
М + е М+ +2 е ; М + е М
Молекулярный ион - определение
молекулярной массы.
Осколочные ионы - фрагменты
молекулы, из которых можно составить
её структурную формулу.
13.
Дифракционные методыРассеяние от порошков Межплоскостные
расстояния.
(дебаеграммы).
Рентгеноструктурный
анализ
Электронография
Нейтронография
Координаты атомов,
параметры
элементарной ячейки
14.
15.
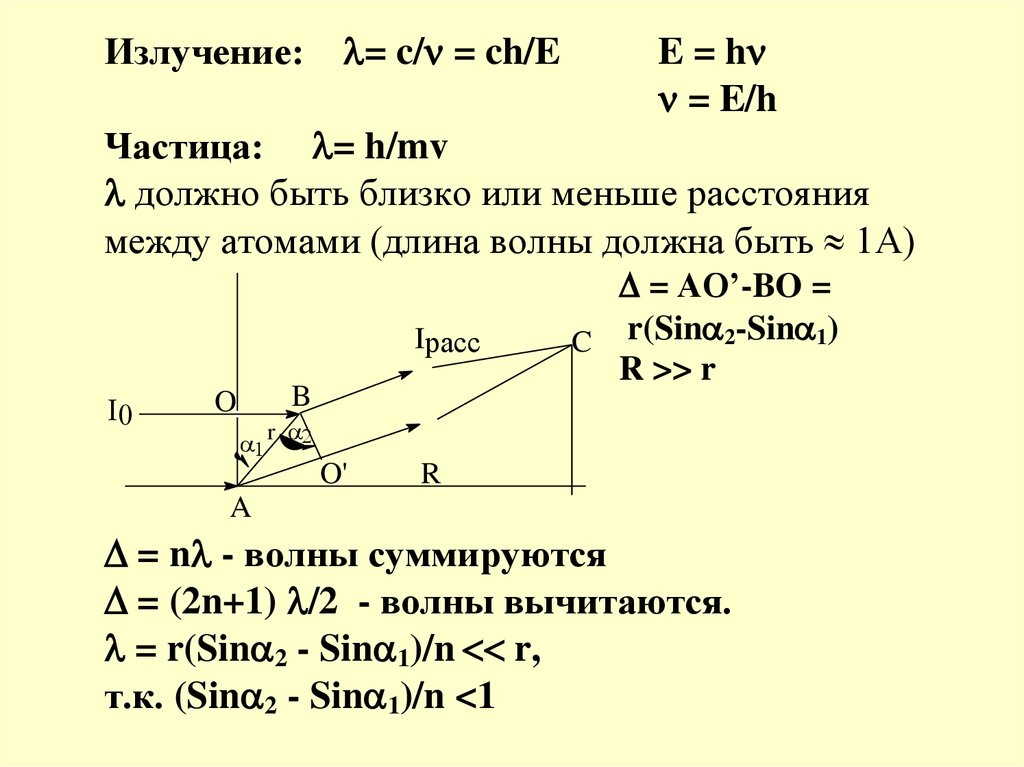
Излучение:= c/ = ch/E
E = h
= E/h
Частица: = h/mv
должно быть близко или меньше расстояния
между атомами (длина волны должна быть 1А)
Iрасс
I0
B
O
= AO’-BO =
C r(Sin 2-Sin 1)
R >> r
r
O'
R
A
= n - волны суммируются
= (2n+1) /2 - волны вычитаются.
= r(Sin 2 - Sin 1)/n r,
т.к. (Sin 2 - Sin 1)/n <1
16.
Рентгеновская дифракция:р 10-1нм = 10-10м = 1Ǻ
(Рассеяние на электронах).
Кристаллы, доли мм.
Электронография: эл 5.10 нм (Е = 40-60 эВ)
(Рассеяние в электрическом поле,
создаваемом ядрами и электронами).
Газы и тонкие пленки (10-5-10-6см).
-5
Нейтронография: н 10 нм (Рассеяние на
ядрах).
Кристаллы, несколько мм.
-1
17.
Рассеивающая способность:Ip : Iэл : Iн = 1 : 106 : 10-2 .
f
Рентген
Электронография
Нейтронография
0
50
100 Z
f - амплитуда рассеяния
Z- атомный номер
fp( ) Z (малые углы);
Z1/2 (большие углы)
fэ( ) Z2/3
fн ( ) - явно не зависит от Z.
18.
СПЕКТРАЛЬНЫЕ МЕТОДЫВзаимодействие вещества с
электромагнитным излучением. Переходы
между квантовыми состояниями.
1. Энергетические состояния атомов и
молекул.
2. Определение разности энергетических
уровней по частоте перехода
= (Еi - Ej)/h = E/h.
3. Определение вероятности перехода по
интенсивности полосы.
19.
Свет + веществоПоглощение,
испускание,
рассеяние.
Частица + вещество Фотоэлектронная
спектроскопия,
неупругое рассеяние
нейтронов,
Оже-спектроскопия
(взаимодействие с
электронами)
20.
E21.
ВОЛНОВЫЕ ХАРАКТЕРИСТИКИ ИЗЛУЧЕНИЯ- частота
Т - период
1 1
(c )
T
c
1
- волновое число (см-1)
= 1/
1м = 103 мм = 109 нм = 1010 А
_
c - скорость света в вакууме
v - cкорость света в среде
n = c/v
Воздух
1 с-1 = 1 Гц
1кГц = 103Гц
1 МГц = 106 Гц 1ГГц = 109Гц
n = 1,0003
v c
(Гц)
= ’
(см-1)
10
17
310
. (см/ с) 310
.
(Гц)
(см)
(нм)
’ = /n
7
1
10
( см 1 )
( см) ( нм)
22.
КВАНТОВЫЕ ХАРАКТЕРИСТИКИИЗЛУЧЕНИЯ
Е = h
h = 6,62.10-34 Дж с
1 эрг = 10-7 Дж
1 ккал = 4,19.109Дж
1эВ = 1,60.10-19 Дж = 3,84.10-23 ккал = 23,1 ккал/моль =
8061 см-1
(нм) = 107/ (см-1) = 28591,2/Е(ккал/моль) =
1239,81/Е(эВ)
(см-1) = 0,349758.103Е(ккал/моль) = 8,06575.103Е(эВ)
= 107 / (нм)
400 нм = 25000 см-1 =3,1 эВ = 71,5 ккал/моль
Е(ккал/моль) = 28600 / (нм) Е(эВ) = 1240 / (нм)
23.
ЭЛЕКТРОМАГНИТНЫЙ СПЕКТРИзлучение
-лучи
Рентген
, см
Е, эВ
10-11-10-8
10-8-10-6
107
105
УФ
10-6-10-4
10
ИК
10-4-10-2
МВ
10-1-10
доли
эВ
10-3
Радио
>100
10-6
Вид
Природа
спектроскопии
уровней
ЯГР
ядра атомов
Рентгеновские Внутренние
спектры
электроны
УФ поглощеВалентные
ние, флуоресэлектроны
ценция, ФЭС
ИККолебания
спектроскопия
атомов
МВВращение
спектроскопия
молекул
ЯМР, ЭПР, Спины ядер и
ЯКР
электронов,
квадрупольный момент
ядер
24.
1h 1
Поглощение
h 2
2
Испускание
2 фотона
Вынужденное
испускание
25.
34
2
E3
h 2
E2
1
=
=
+
2
= 1+ 2
Безизлучательный
переход
Двухфотонное
поглощение
и испускание
1
h 1
= 1 + 2
E1
Двухступенчатое
поглощение
26.
E3Релеевское
рассеяние
1
1
1
E2
E1
Стоксово Антистоксово
Флуоресценция
27.
28.
V' = 1E'
Стоксово
Релеевское
рассеяние
Антистоксово
V"=1
E"
29.
30.
31.
32.
33.
J'5
J'
5
J'
5
J'
5
v'
0 3
0
2
1
0
0
0 E'
evr
J"
5
J"
0 3
5
J"
5
J"
5
0
0
vr
0
2
v"
E
r
1
V
0
E"
34.
Ионизационный континуумИонизация
Возбуждение
h
}
Возбужденные
состояния
Падающий фотон
35.
Ионизационный континуум}
1
Виртуальные уровни
5
}
2
Валентные уровни
1
2
}
Поглощение в УФ и видимой областях
3 Рентгеновские спектры поглощения
3
4 Рентгеноэлектронные спектры (ESCA)
4
5 Фотоэлектронные спектры
}
Внутренние электроны
36.
КЛАССИФИКАЦИЯ МЕТОДОВ1. По типу взаимодействия: поглощение,
испускание, рассеяние, комбинационное
рассеяние, отражение и др.
2. По областям излучения: ИК-, УФ-, МВспектроскопия.
3. По объектам: атомная, молекулярная,
спектроскопия кристаллов и твердых тел.
4. По природе энергетических уровней:
вращательная, колебательная (колебательновращательная), электронная (электронноколебательная) спектроскопия, ЯМР, ЭПР и т.д.
5. Линейная и нелинейная спектроскопия.
37.
ПРИМЕНЕНИЯ СПЕКТРОСКОПИИ1. Идентификация веществ
2. Количественный анализ
3. Структурно-групповой (функциональный) анализ
4. Определение уровней энергии молекул
5. Определение расположения атомов и расстояний между
ними
6. Определение зарядов на атомах
7. Исследования кинетики (до 10-15с)
8. Времена жизни возбужденных состояний, процессы
релаксации
9. Определение термодинамических параметров
10. Межмолекулярные взаимодействия
11. Дистанционное исследование состава и строения
веществ и температуры газов
12. Исследование микроколичеств и малых объёмов
веществ
13. Изучение поверхности и адсорбции
14. Исследование динамических процессов
15. Изомерия, таутомерия, внутреннее вращение
16. Фазовые переходы и т.д.
38.
39.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗI0
D cl = log
I
1. Проверка соблюдения закона Ламберта-Бера
2. Наименьшие ошибки измерения при работе в области
20-80% поглощения.
3. Поглощение лучше измерять в максимуме полосы
поглощения.
4. Необходимо знать величины для данной длины
волны.
D
c
l
40.
АНАЛИЗ СМЕСЕЙСхематическое представление спектров поглощения
смеси веществ:
а - спектры веществ 1, 2 и 3 не перекрываются.
Б – спектры веществ 1 и 2 перекрываются во всей
исследуемой области.
41.
1Анализ смесей.
D 1= 1 1c1l + 2 1c2l
D 2= 1 2c1l + 2 2c2l
1. Если
есть область, где одна из компонент не
поглощает - можно исследовать систему как
однокомпонентную.
2. В случае перекрывания спектров - решают
систему уравнений.
3. Разностный метод. Компьютерное вычитание
спектра одной из компонент










































 Физика
Физика Химия
Химия








