Похожие презентации:
Складання рівнянь окисно-відновних реакцій. Метод електронного балансу
1.
Складання рівняньокисно-відновних реакцій.
Метод електронного балансу
2.
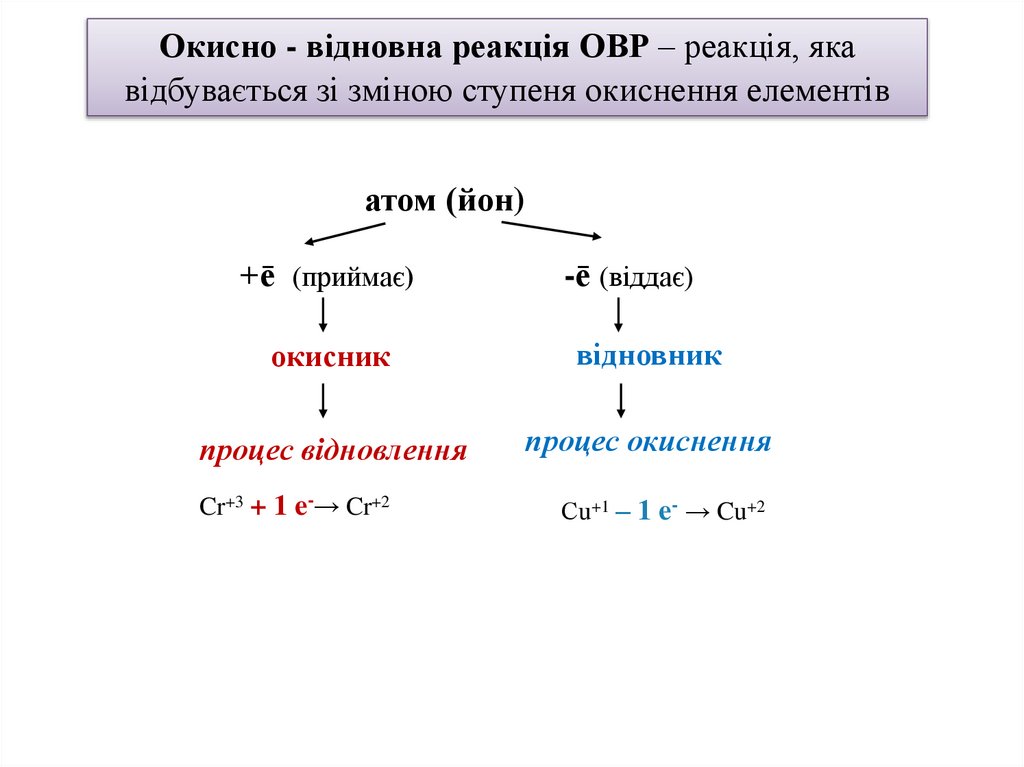
Окисно - відновна реакція ОВР – реакція, якавідбувається зі зміною ступеня окиснення елементів
атом (йон)
+ē (приймає)
-ē (віддає)
окисник
відновник
процес відновлення
процес окиснення
Cr+3 + 1 e-→ Cr+2
Сu+1 – 1 e- → Cu+2
3.
Приклад 1Розставте коефіцієнти методом електронного балансу, визначте
окисник і відновник, укажіть процеси окиснення й відновлення
+1 -1
+1 +5 -2
0
KClO3 +
P → KCl + P2O5
+5
-1
Cl + 6 e- → Cl
0
+5 -2
5
окисник, відновлення
6
відновник, окиснення
+5
Р – 5 e- → Р
6 P + 5KClO3 → 5 KCl + 3 P2O5
4.
Приклад 2+1 -1
+1 +5 -2
0
KClO3 +
S → KCl + SO2
+5
-1
Cl + 6 e- → Cl
0
+4 -2
+4
S – 4 e- → S
4
2 окисник, відновлення
6
3 відновник, окиснення
2 КСlО3 + 3 S → 2 КСl + 3 SО2
5.
Приклад 3+2 -1
+3 -1
0
0
CuCl2 + Al → AlCl3 + Cu
+2
0
Cu + 2ē → Cu
0
3
окисник, відновлення
2
відновник, окиснення
+3
Al - 3ē → Al
3 CuCl2 + 2 Al → 2 AlCl3 + 3 Cu
6.
Приклад 4+6 -2
0
0
+1 -2
WO3 + H2 → W + H2O
+6
0
W + 6ē → W
0
2
1 окисник, відновлення
6
3 відновник, окиснення
+1
H2 - 2ē → 2H
WO3 + 3 H2 → W + 3 H2O
7.
Приклад 5+1 +5 -2
0
+1 +6 -2
+4 -2
+1 -2
HNO3 + S → H2SO4 + NO2 + H2O
+5
N
+4
+1ē → N
0
6
окисник, відновлення
1
відновник, окиснення
+6
S - 6ē →S
6 HNO3 + S→ H2SO4 + 6 NO2 + 2 H2O
8.
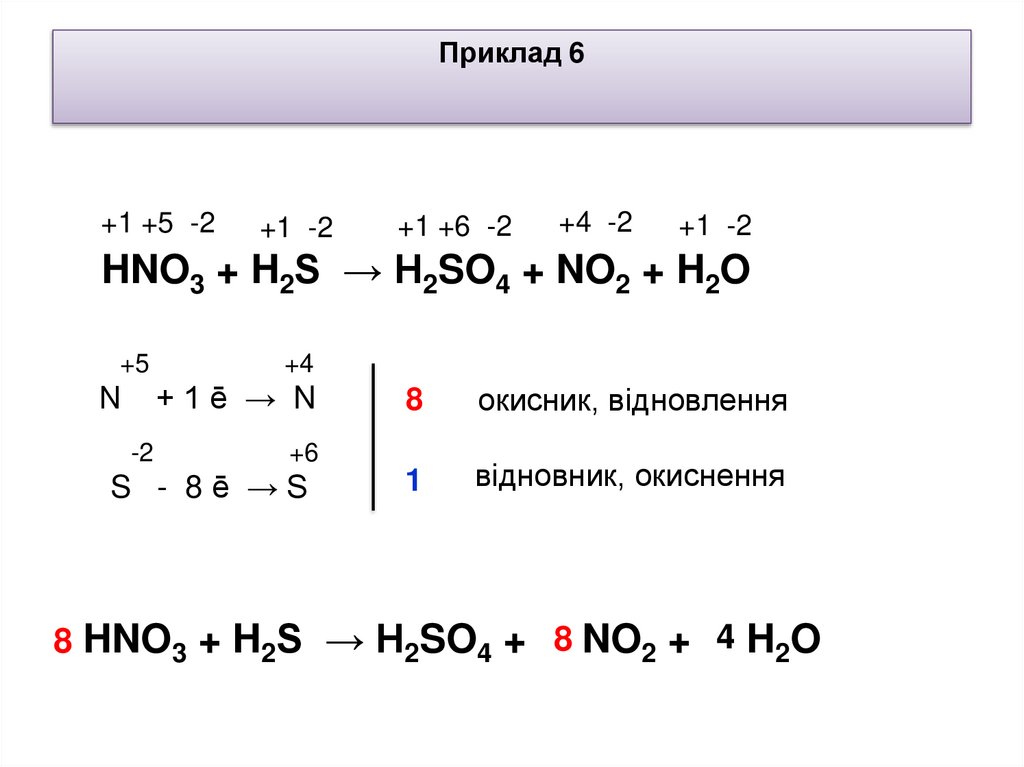
Приклад 6+1 +5 -2
+1 -2
+1 +6 -2
+4 -2
+1 -2
HNO3 + H2S → H2SO4 + NO2 + H2O
+5
N
+4
+1ē → N
-2
8
окисник, відновлення
1
відновник, окиснення
+6
S - 8ē →S
8 HNO3 + H2S → H2SO4 + 8 NO2 + 4 H2O
9.
Домашнє завдання1. Опрацювати § 18
2. Розібрати та записати приклади 1-6 (презентація)
3. Виконати тест за посиланням
https://vseosvita.ua/test/start/hpo642
до 04.12







 Химия
Химия








