Похожие презентации:
Водородные соединения. Оксиды
1.
ВОДОРОДНЫЕСОЕДИНЕНИЯ.
ОКСИДЫ
2.
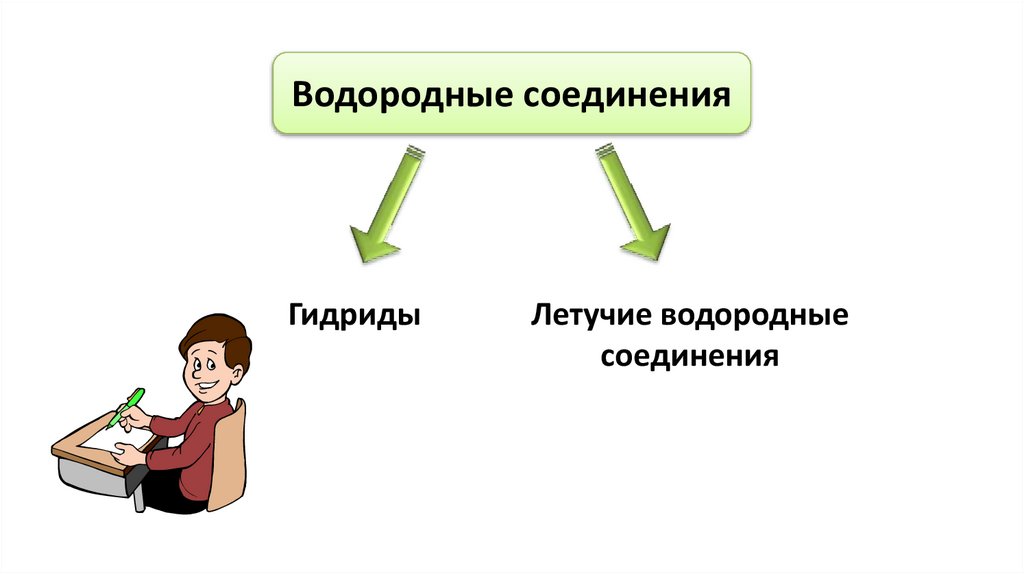
Водородные соединенияГидриды
Летучие водородные
соединения
3.
Гидриды – бинарныеЛетучие водородные
соединения металлов
соединения – бинарные
I и II A групп с водородом соединения неметаллов
с водородом
СаН2
NaH
BaH2
LiH
Это твердые, нелетучие,
тугоплавкие вещества с
ионным типом связи
Жидкости: Н2О
Газы: HCl, NH3
4.
Тяжелее воздухаБесцветный
газ
Хорошо
растворим в воде
HCl
В 1 объёме воды
растворяется
500 объёмов HCl
«Дымит» на
воздухе
5.
Бесцветнаяжидкость
«Дымит» на
воздухе
Соляная кислота
HCl
Тяжелее
воды
6.
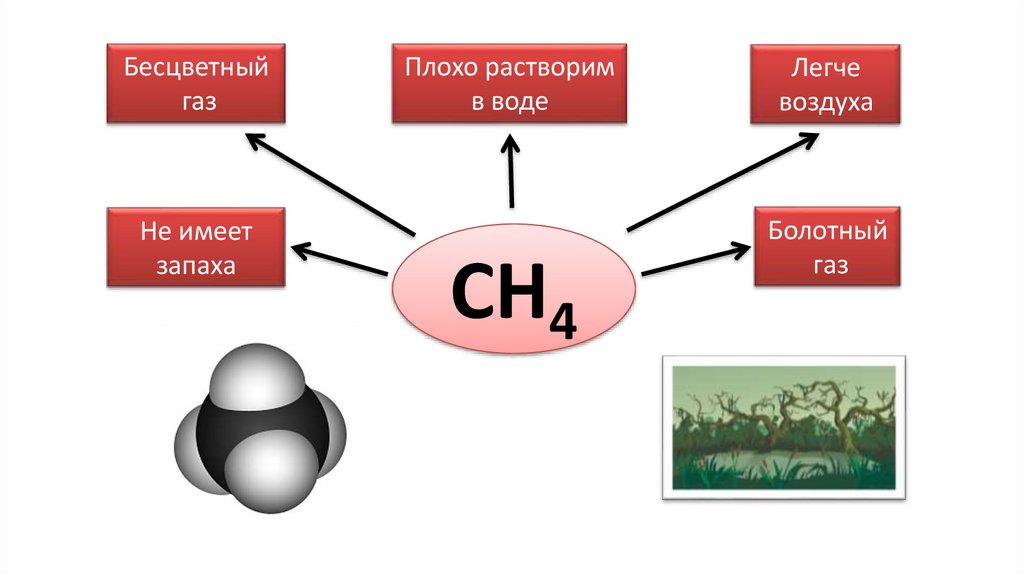
Бесцветныйгаз
Не имеет
запаха
Плохо растворим
в воде
СН4
Легче
воздуха
Болотный
газ
7.
Бесцветныйгаз
С резким
запахом
В 1 объёме воды
растворяется 700
объёмов аммиака
NH3
В 2 раза легче
воздуха
Раствор аммиака –
нашатырный спирт
8.
Бесцветныйгаз
В 1 объёме воды
растворяется
3 объёма
сероводорода
Имеет запах
тухлых яиц
Ядовит
H2S
Тяжелее
воздуха
9.
Оксиды – это сложные вещества, состоящие из двух элементов,одним из которых является кислород в степени окисления -2
Название оксидов
оксид (и. п.) + название элемента (р. п.)
СаО – оксид кальция
Fe2O3 – оксид железа (III)
Al2O3 – оксид алюминия
CuO – оксид меди (II)
10.
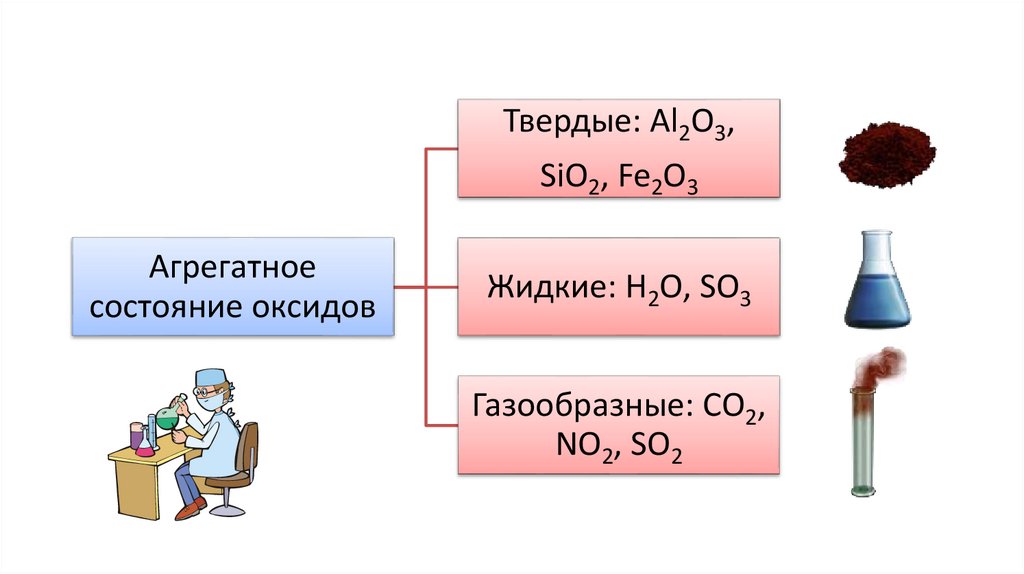
Твердые: Al2O3,SiO2, Fe2O3
Агрегатное
состояние оксидов
Жидкие: Н2О, SO3
Газообразные: СО2,
NO2, SO2
11.
12.
13.
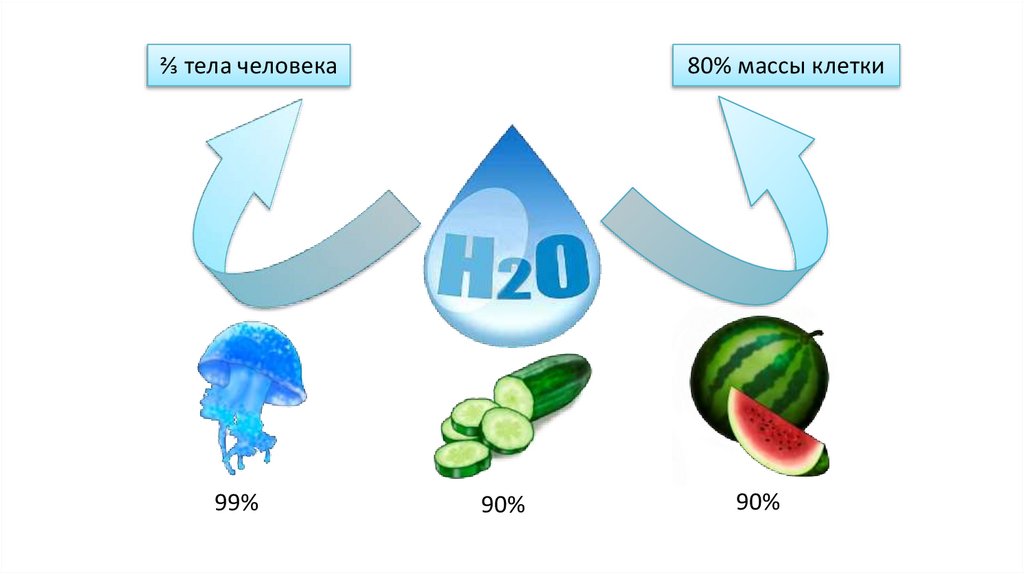
⅔ тела человека99%
80% массы клетки
90%
90%
14.
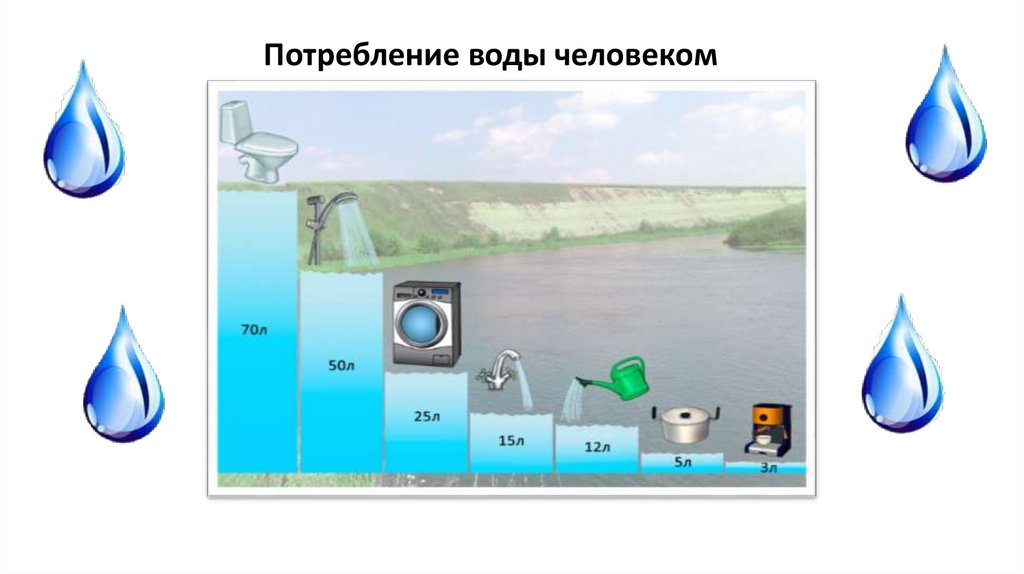
Потребление воды человеком15.
Круговорот воды в природеснег
дождь
испарение
16.
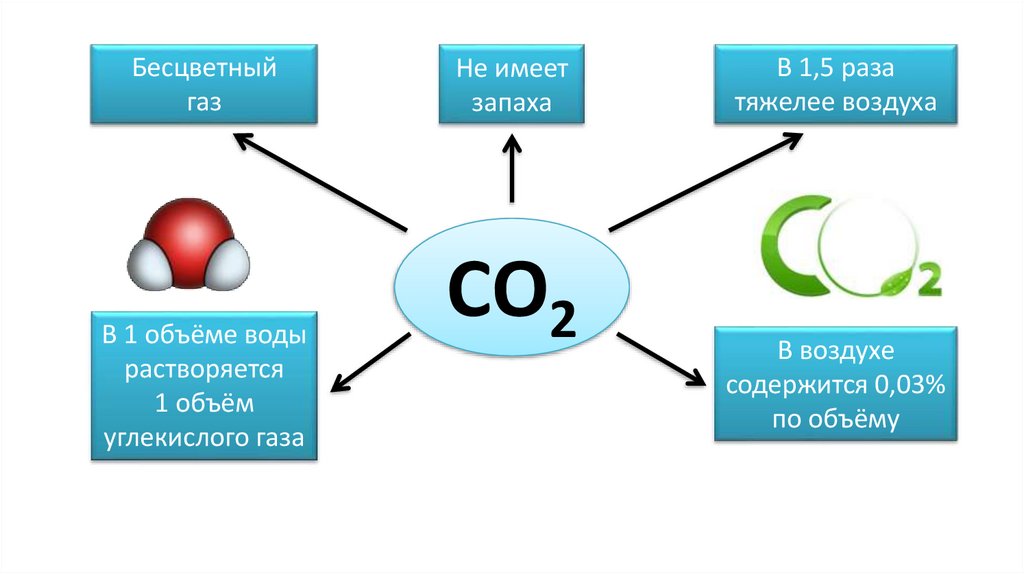
Бесцветныйгаз
В 1 объёме воды
растворяется
1 объём
углекислого газа
Не имеет
запаха
СО2
В 1,5 раза
тяжелее воздуха
В воздухе
содержится 0,03%
по объёму
17.
Собачья пещера18.
ДыханиеСгорание топлива
Гниение растений
19.
Использование углекислого газа20.
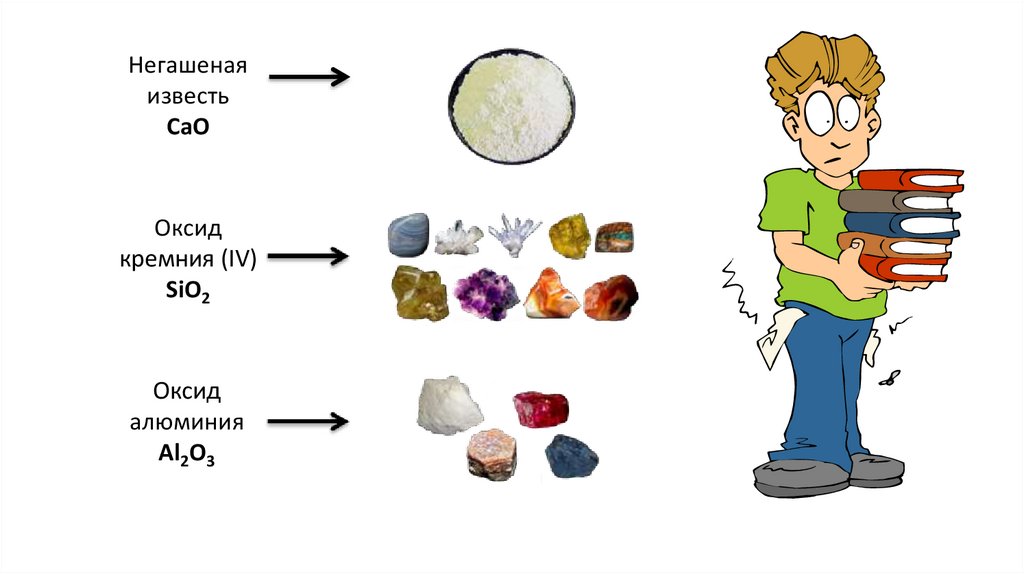
Негашенаяизвесть
СаО
Оксид
кремния (IV)
SiO2
Оксид
алюминия
Al2O3













 Химия
Химия








