Похожие презентации:
Химическое равновесие. Экзаменационные вопросы
1.
Экзаменационные вопросы6. Химическое равновесие
1. Термодинамическое условие химического равновесия. Стандартная (термодинамическая) константа
равновесия. Сдвиг равновесия. Изобара и изотерма реакции. Принцип Ле-Шателье.
2. Кинетическое условие химического равновесия. Константа равновесия.
3. Расчет равновесного состава газовой смеси.
4. Равновесие в растворах. Электролитическая диссоциация. Константа диссоциации.
5. Ионное произведение воды. Водородный показатель.
6. Расчет pH растворов кислот и оснований. Многоосновные кислоты и многокислотные основания.
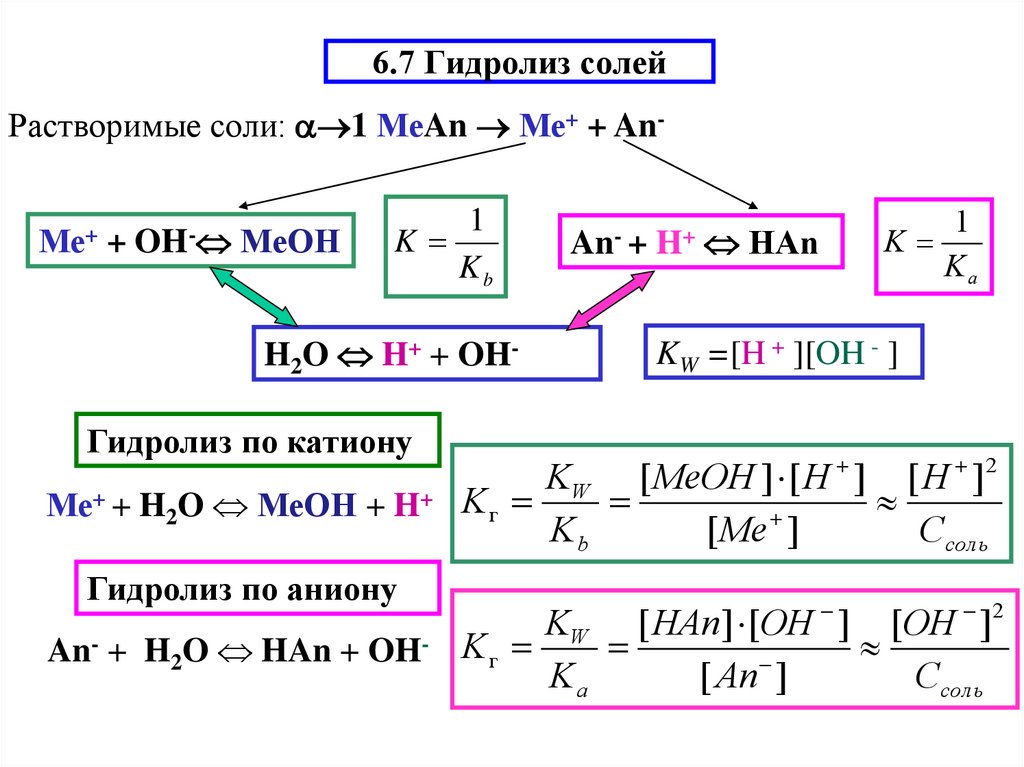
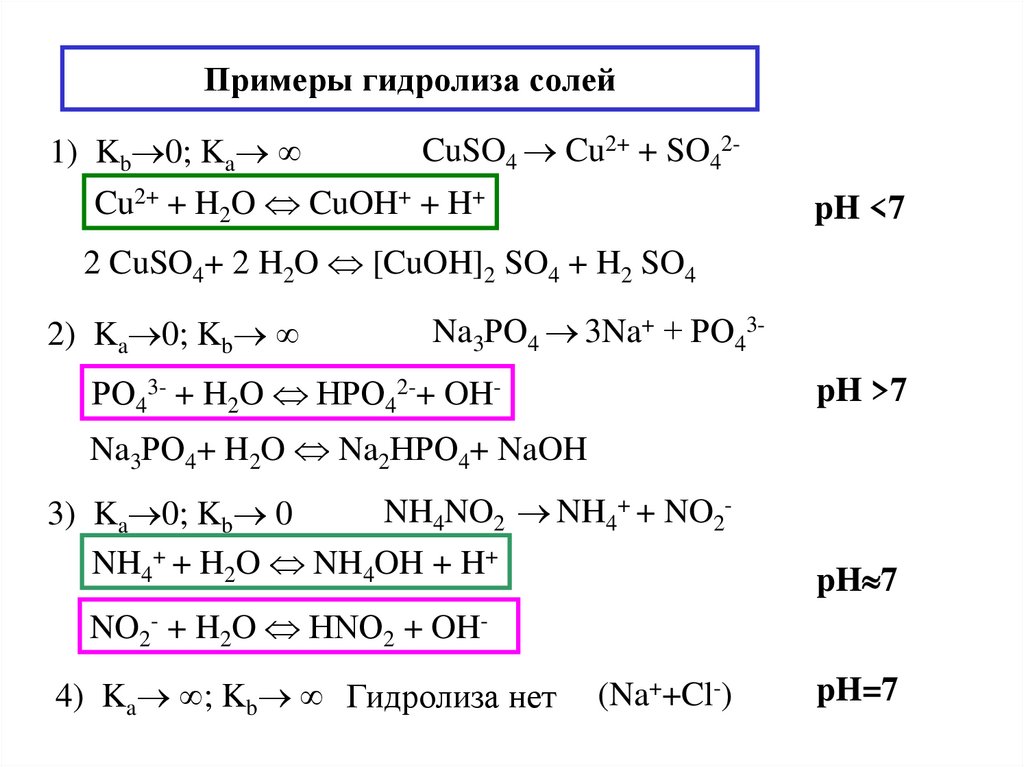
7. Гидролиз водных растворов солей. pH растворов солей.
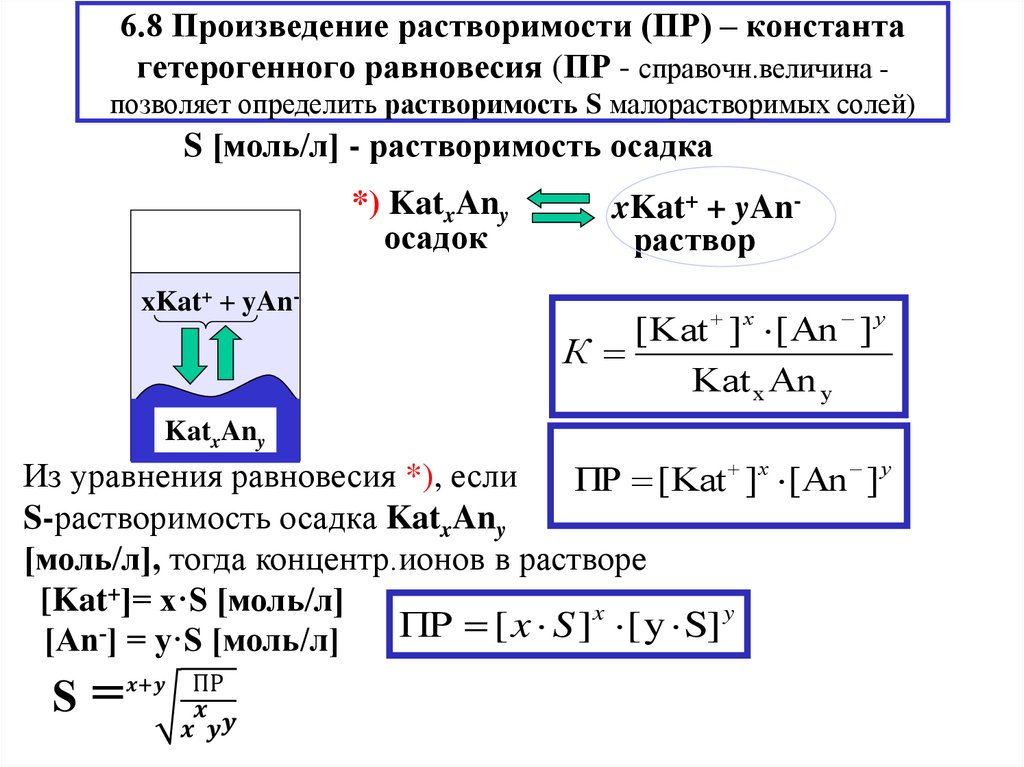
8. Произведение растворимости. Расчет растворимости малорастворимых веществ.
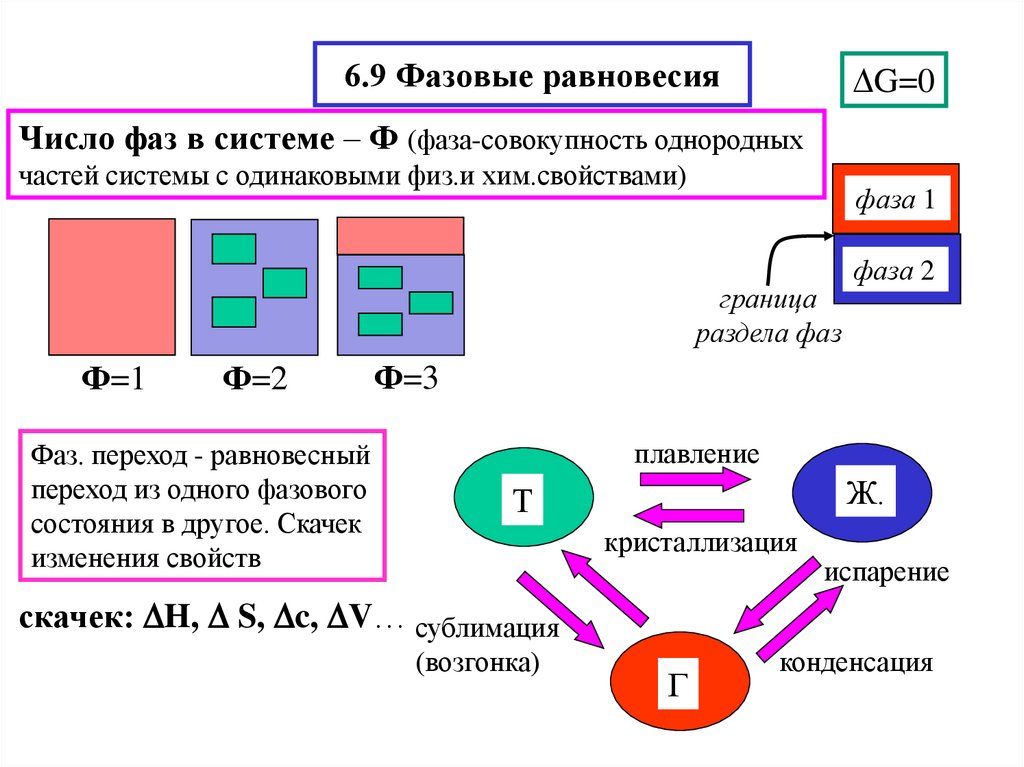
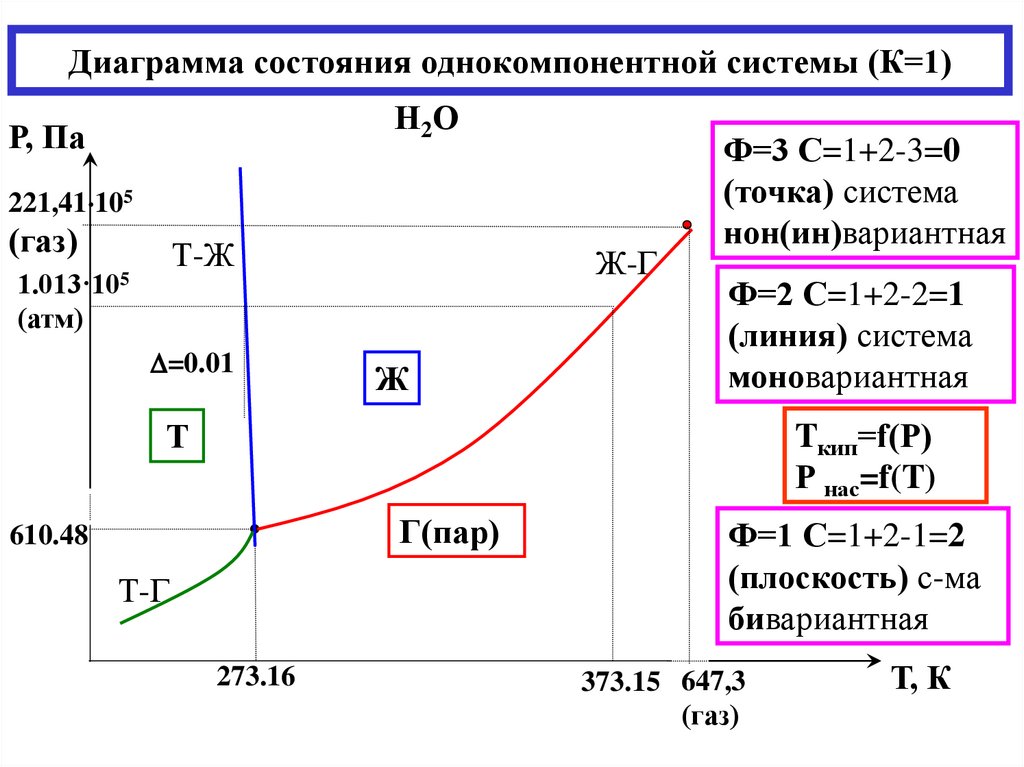
9. Фазовые равновесия. Понятие компонента, термодинамической степени свободы. Правило фаз Гиббса.
Диаграмма состояния однокомпонентной системы (воды как универсального растворителя).
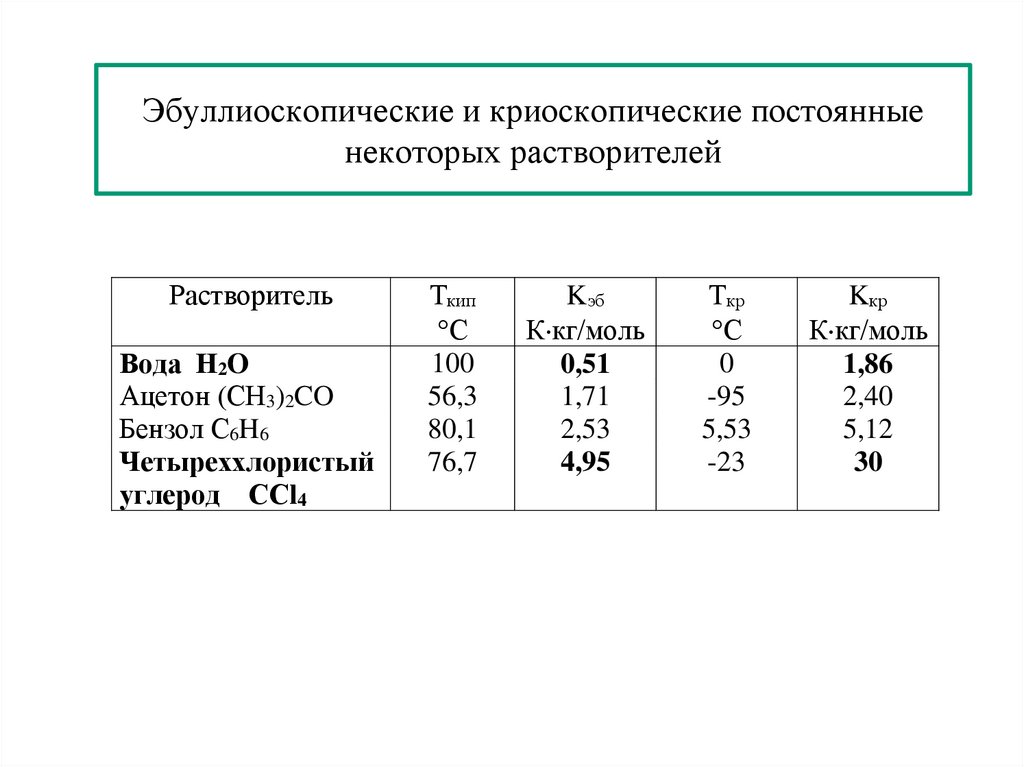
10. Молекулярные водные растворы. Закон Рауля. Диаграмма состояния двухкомпонентной системы. Изменение
температуры кристаллизации и кипения растворов.
11. Ионные водные растворы. Изотонический коэффициент. Изменение коллигативных свойств растворов.
2.
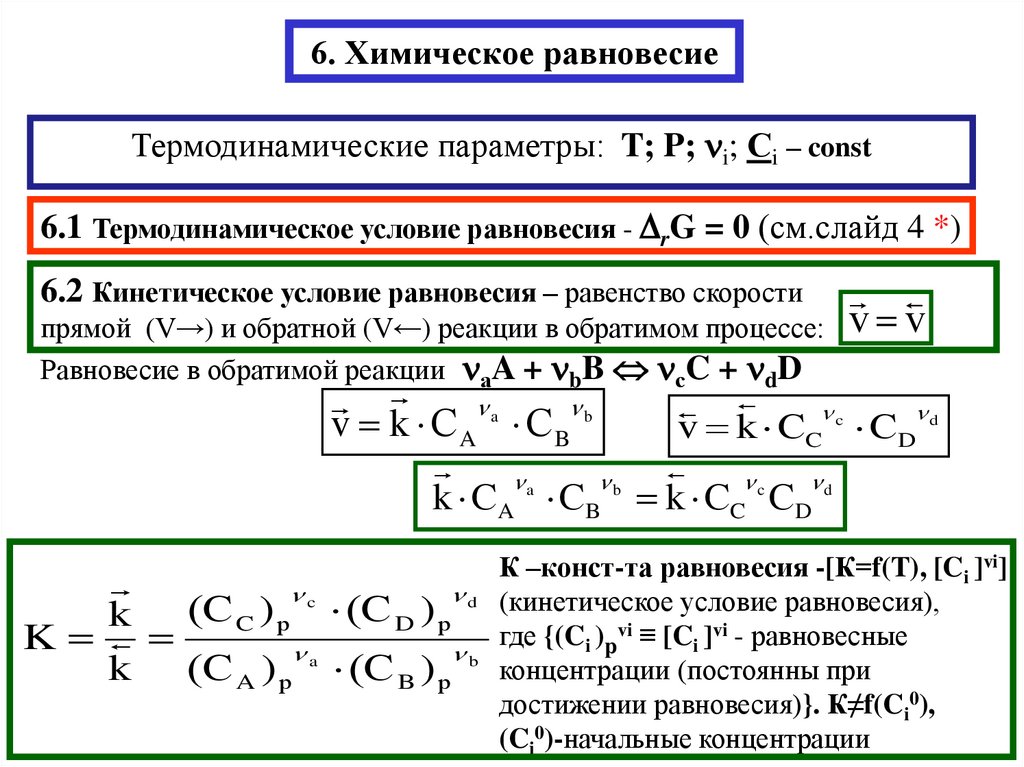
6. Химическое равновесиеТермодинамические параметры: T; P; i; Сi – const
6.1 Термодинамическое условие равновесия - rG = 0 (см.слайд 4 *)
прямой (V→) и обратной (V←) реакции в обратимом процессе: v v
6.2 Кинетическое условие равновесия – равенство скорости
Равновесие в обратимой реакции аA + bB сC + dD
a
b
v k СA СB
v k СC СD
k СA СB k СC СD
c
a
c
d
(С C ) р (С D ) р
k
K
(С A ) р a (С B ) р b
k
b
c
d
d
К –конст-та равновесия -[К=f(T), [Ci ]vi]
(кинетическое условие равновесия),
где {(Ci )pvi ≡ [Ci ]vi - равновесные
концентрации (постоянны при
достижении равновесия)}. К≠f(Ci0),
(Ci0)-начальные концентрации
3.
Энергия Гиббса реакции в нестандартных условияхДля реакции
аA + bB = сC + dD
Станд.услов. Сi0 =1 моль/л
rG0 = ( c fG0C + d fG0D ) – ( a fG0A + b fG0B )
Нестанд.условия Сi Сi0 , ( rGi ≠ fG0i ) rGi = fG0i + R T lnCi
p
с
i
i
С
X
i
i 0 0 – Ci безразмерная концентрация, где Сi –
p с текущая концентрация [моль/л ], С0 =1 моль/л
i
Xi
– мольная доля;
i
pi
– относительное парциальное давление [атм], p0 =1,013.105 Па
0
p
В нестандартных условиях: rG = ( c fG0C+ d fG0D ) – ( a fG0A+ b fG0B) +
+ R T ( c lnСC+ d lnCD– a lnCA– b lnCB)
c
d
С
С
0
C D
G
G
R
T
ln
r
r
v
v
a
b
С
С
A B
v
v
4.
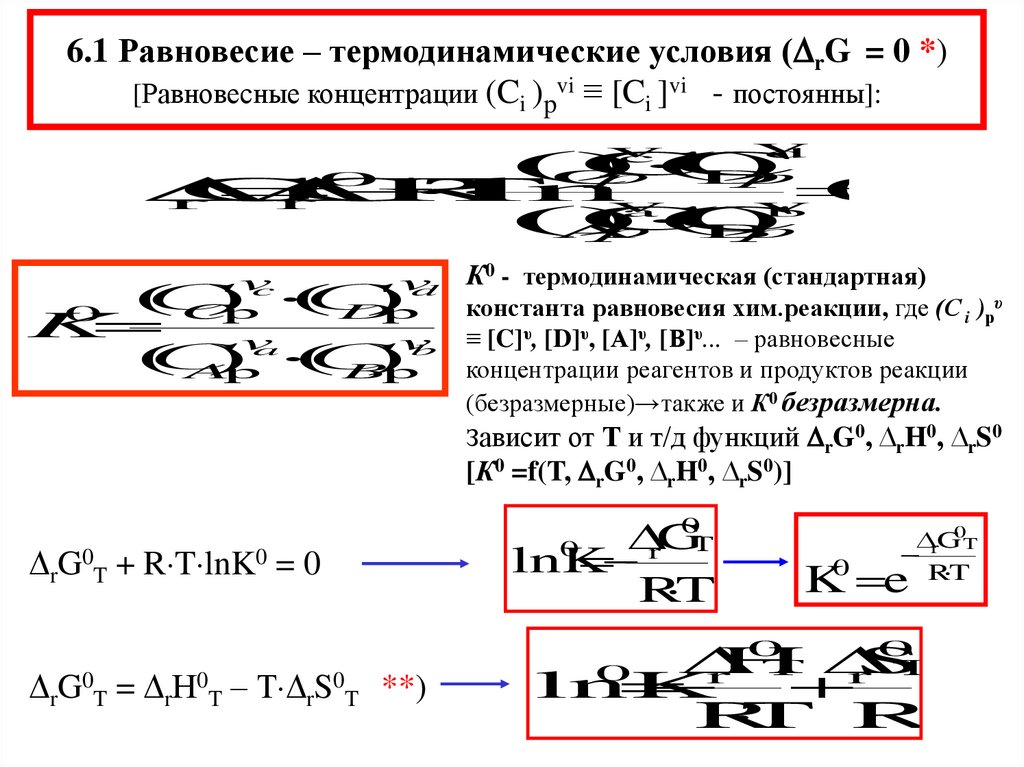
6.1 Равновесие – термодинамические условия ( rG = 0 *)[Равновесные концентрации (Ci )pvi ≡ [Ci ]vi - постоянны]:
v
d
c
(С
)
(
С
)
C
р
D
р
0
G
G
R
T
ln
0
r
r
v
v
a
b
(С
)
(
С
)
A
р
B
р
v
(
С
) (
С
)
K
(
С
) (
С
)
0
v
c
Cр
v
a
Aр
v
d
Dр
v
b
Bр
К0 - термодинамическая (стандартная)
константа равновесия хим.реакции, где (С i )рυ
≡ [C]υ, [D]υ, [А]υ, [В]υ... – равновесные
концентрации реагентов и продуктов реакции
(безразмерные)→также и К0 безразмерна.
Зависит от Т и т/д функций rG0, ∆rH0, ∆rS0
[К0 =f(T, rG0, ∆rH0, ∆rS0)]
rG0T + R T lnK0 = 0
rG0T = rН0T – Т rS0T **)
0
G
0
r Т
lnK
R T
rG0T
R T
K e
0
0
0
H
S
Т
0
r
r Т
lnK
R
T R
5.
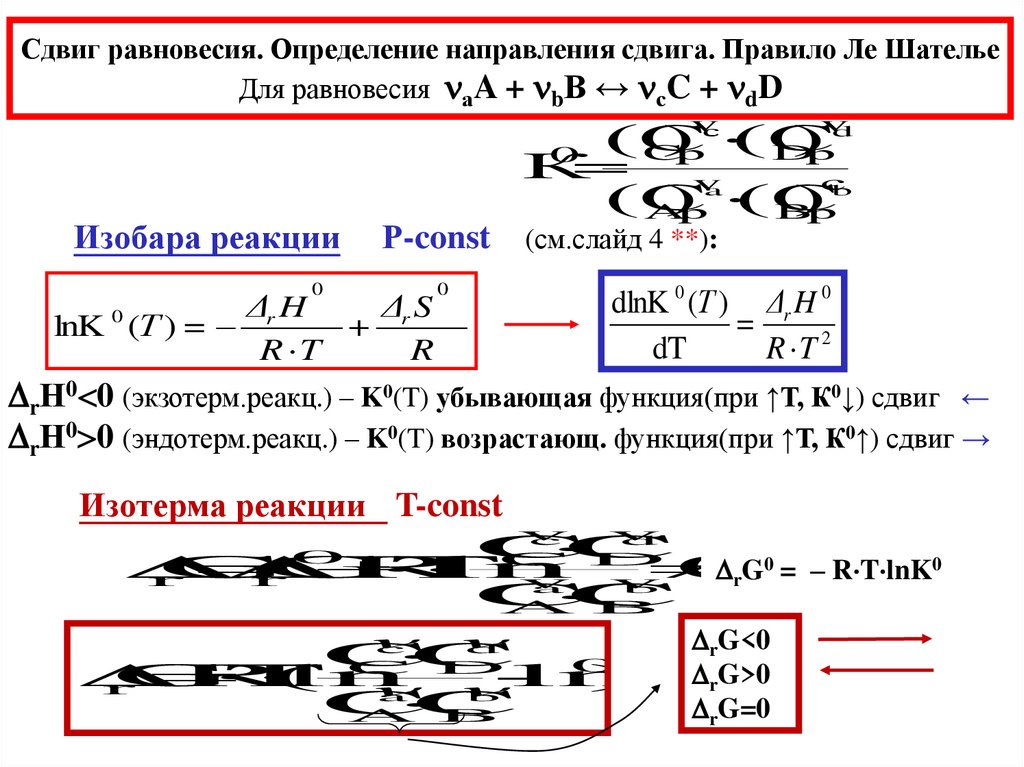
Сдвиг равновесия. Определение направления сдвига. Правило Ле ШательеДля равновесия аA + bB ↔ сC + dD
с
d
(С
)
(С
)
Cр
Dр
0
К
v
c
a
b
(С
)
(С
)
Aр
Bр
v
Изобара реакции
v
Р-const (см.слайд 4 **):
0
Δr H
Δr S
0
lnK (Т ) =
+
R T
R
0
dlnK 0 (Т ) Δr H 0
=
dT
R T 2
rН0 0 (экзотерм.реакц.) – K0(T) убывающая функция(при ↑Т, К0↓) сдвиг ←
rН0 0 (эндотерм.реакц.) – K0(T) возрастающ. функция(при ↑Т, К0↑) сдвиг →
Изотерма реакции T-const
c
d
С
С
0
C D
0 = – R T lnK0
G
G
R
T
ln
0
G
r
r
r
v
v
a
b
С
С
A
B
v
v
G<0
c
d
r
С
С
0
C D
rG>0
G
R
T
(
ln
lnK
)
r
a
b
С
С
rG=0
A
B
6.
Константа равновесия К, её размерность. Связь между К[кинетич.К-f(T), K≠f(Cнач)] и стандартной К0 [безразмерна, К0–
f(T, т/д функций)] Для равновесной реакции: аA + bB = сC + dD
K
a
A р
b
B р
(С C ) р c (С D ) р d
(С )
(С )
К≡KX - концентрации задаются мольными долями [безразмерная величина]
К≡Kp - концентрации задаются парциальными давлениями - [(Па) ]
= ( c+ d) - ( a+ b)
К≡KC – концентрации задаются молярной концентрацией - [(моль/л) ]
p
K X K ( 0 )
p
0
0
K p K (p )
p/p0 = p наз.физ.атм., относит.давл.
0
R T
KC K ( 0 )
p
0
р0 = 1,013 105 Па - стандартное
давление
7.
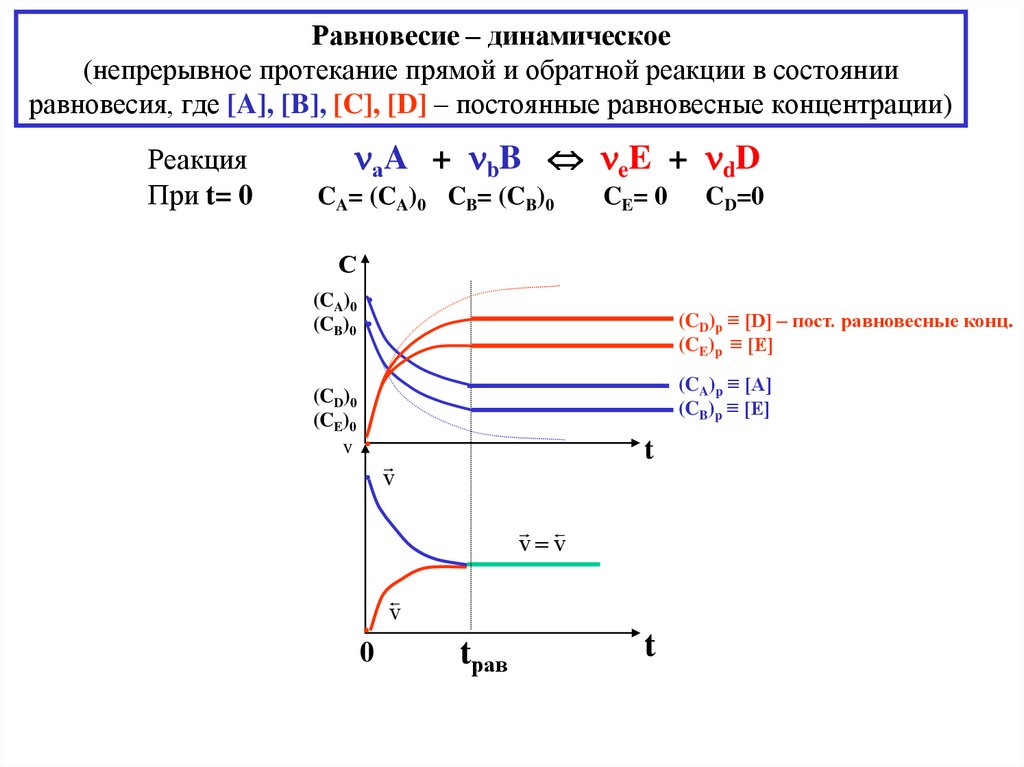
Равновесие – динамическое(непрерывное протекание прямой и обратной реакции в состоянии
равновесия, где [A], [B], [C], [D] – постоянные равновесные концентрации)
Реакция
При t= 0
аA + bB eE + dD
CA= (CA)0 CB= (CB)0
CE= 0
CD=0
С
(CA)0
(CB)0
(CD)р ≡ [D] – пост. равновесные конц.
(CE)p ≡ [E]
(CA)p ≡ [A]
(CB)p ≡ [E]
(CD)0
(CE)0
v
t
• v
v v
0
v
tрав
t
8.
6.3 Расчет равновесногосостава(концентраций) газовой
смеси
1. Расчет К0(Т)
термодинамической →
Для определенной Т рассчитывают ∆rG0 (T)
rG0(T)= rH0(T) –Т· rS0(T). Затем
ΔG0 (T)
















 Химия
Химия








