Похожие презентации:
Радикальная цепная полимеризация ненасыщенных мономеров
1. Радикальная цепная полимеризация ненасыщенных мономеров
Первая стадия – стадия инициирования:М→М
Способы получения радикального центра:
Термический способ (термическое инициирование)
Фотохимический способ (фотохимическое инициирование)
Радиохимический способ (радиохимическое инициирование)
Под действием инициаторов (вещественное инициирование)
1
2. Вещественное инициирование
1 ст.: распад инициатора, приводящий к образованиюпервичных радикалов
I2 → 2 J
(I2 – инициатор)
2 ст.: взаимодействие первичного радикала с мономером,
приводящее к образованию активного центра
J + СН2=СНR → J-CH2CH R
2
3. Распад инициаторов
Распад инициаторов осуществляется:)
Под действием температуры (термические инициаторы
В условиях окислительно-восстановительной реакции
(окислительно-восстановительное инициирование)
Под действием света (фотохимические инициаторы)
Под действием электрического тока (элетрохимические
инициаторы)
3
4. Термические инициаторы
Примеры термических инициаторов и схемы их инициирования:а) алкилпероксиды
(СН3)3С-О-О-С(СН3)3 -пероксид третбутила
С6Н5С(СН3)2-О-О-С(СН3)2С6Н5 - пероксид кумола др.
t˚ 2 (СН ) СО → 2 (СН ) С=О +2 СН
(СН3)3С-О-О-С(СН3)3 →
3 3
3 2
3
(СН3)3СО + СН2=СНR → (СН3)3СО-СН2-СНR
СН3 + СН2=СНR → CН3-СН2-СНR
4
5.
б) ацилпероксидыС6Н5С(О)-О-О-С(О)С6Н5 – пероксид бензоила
СН3С(О)-О-О-С(О)СН3 – пероксид ацетила и др.
t˚
С6Н5С(О)-О-О-С(О)С6Н5 → 2 С6Н5С(О)-О → 2 С6Н5 + 2 СО2
С6Н5С(О)-О + СН2=СНR → C6Н5C(О)-О-СН2СНR
С6Н5 + СН2=СНR → C6Н5-СН2-СН R
5
6. в) неорганические пероксиды
НООН - пероксид водородаMe2S2О8 (Ме = Na, К) – персульфат натрия, калия
(NH4)2S2O8 – персульфат аммония и др.
(NH4)2S2O8
2 NH4+ + ¯O-SO2-O-O-SO2-O¯
¯O-SO2-O-O-SO2-O¯ → 2 ¯O-SO2O
t˚
¯OSO2O + HOH → HSO4¯ + HO
HO + CH2=CHR → HO-CH2-CH R
6
7. Вторая стадия радикальной цепной полимеризации – рост цепи
Реакция роста цепи:JM + M → JMM
+nM
→ JMn+1M (растущий макрорадикал)
Два варианта присоединения мономера к активному центру:
1 вариант: «голова к хвосту»
JCH2CH + CH2=CHR → JСH2СH-CH2-CH
R
R
R
2 вариант: «хвост к хвосту»
JCH2CH + CH2=CHR → JCH2CH-CH-CH2
R
R R
7
8.
Таким образом:JСН2СH + n CH2=CHR → JСН2СH-[CH2-CH-]n-CH2CH
R
R
R
R
Третья стадия радикальной
цепной полимеризации
Заключительная стадия радикальной цепной полимеризации, приводящая к образованию полимера реализуется
двумя способами:
1 способ: обрыв цепи
2 способ: передача цепи
8
9. Обрыв цепи
J-[-M-]n-M → J-[-M-]nMРеакции, приводящие к обрыву цепи:
реакция рекомбинации (соединения) радикалов
J-[-CH2-CH-]n-CH2-CH + J-[-CH2-CH-]m-CH2-CH →
R
R
R
R
→ J-[-CH2-CH-]n-CH2-CH-CH-CH2-[-CH-CH2-]m-J
R
R R
R
J-[-CH2-CH-]n-CH2-CH + J → J-[CH2-CH-]n-CH2-CH-J
R
R
R
R
9
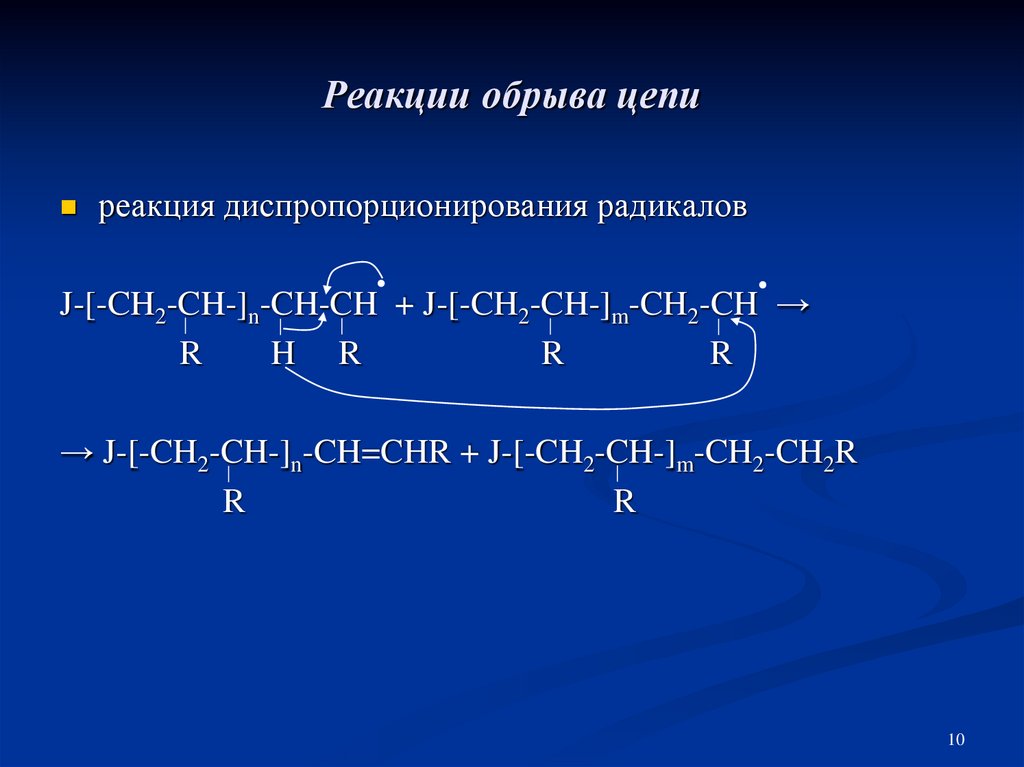
10. Реакции обрыва цепи
реакция диспропорционирования радикаловJ-[-CH2-CH-]n-CH-CH + J-[-CH2-CH-]m-CH2-CH →
R
H R
R
R
→ J-[-CH2-CH-]n-CH=CHR + J-[-CH2-CH-]m-CH2-CH2R
R
R
10
11. Реакции передачи цепи
Реакция передачи цепи:J-[CH2-CH-]n-CH2-CH + AB → J-[-CH2-CH-]n-CH2-CH-A + B
R
R
R
B + n CH2=CHR → рост цепи
Реакции передачи цепи:
передача цепи на полимер
передача цепи на мономер
передача цепи на растворитель
передача цепи на добавки
11
12. Реакции передачи цепи
Реакция передачи цепи на полимерH
J-[-CH2-CH-]n-CH2-CH + ··· - CH2-C- ··· → ··· -CH2-C- ··· +
R
R
R
R
+ J-[-CH2-CH-]n-CH2-CH2R
R
··· -CH2-C- ··· + n CH2=CHR → ··· -CH2-CR- ···
R
[-CH2-CH-]n-1-CH2CH
R
R
Характерна для мономеров – этилен, винилацетат,
винилхлорид (где активность радикала не снижена
сопряжением с R )
12
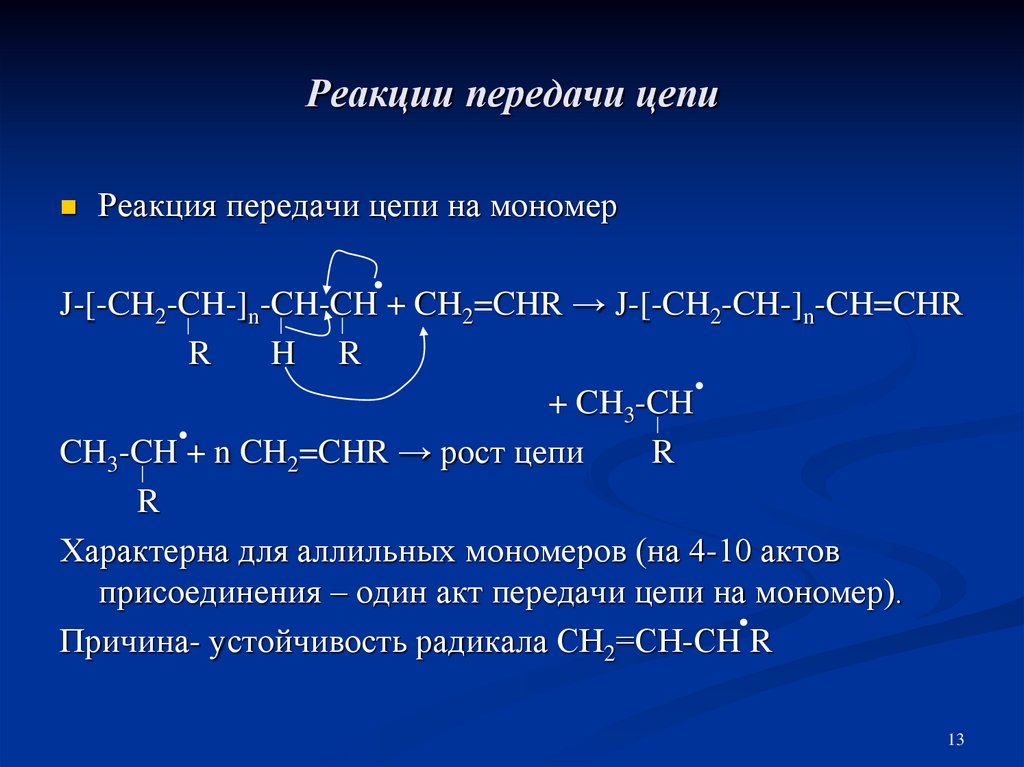
13. Реакции передачи цепи
Реакция передачи цепи на мономерJ-[-CH2-CH-]n-CH-CH + CH2=CHR → J-[-CH2-CH-]n-CH=CHR
R
H R
+ CH3-CH
CH3-CH + n CH2=CHR → рост цепи
R
R
Характерна для аллильных мономеров (на 4-10 актов
присоединения – один акт передачи цепи на мономер).
Причина- устойчивость радикала СН2=СН-СH R
13
14. Реакции передачи цепи
Реакция передачи цепи на растворитель (С6Н5СН3, CCl4,CBr4, RSH и другие)
J-[-CH2-CH-]n-CH2-CH + C6H5CH2-H → C6H5CH2 +
R
R
+ J-[-CH2-CH-]n-CH2-CH2R
R
C6H5CH2 + n CH2=CHR → рост цепи
Пример реакции теломеризации:
n СН2=СН2 + CCl4 → Cl-[CH2-CH2-]n- CCl3
15. Реакции передачи цепи
Реакция передачи цепи на добавки (АВ)J-[-CH2-CH-]n-CH2-CH + AB → J-[-CH2-CH-]n-CH2-CHA + B
R
R
R
R
В зависимости от активности В добавки делятся на два вида:
Регуляторы (В – активен).
В + СН2=СНR → рост цепи
Ингибиторы (В – малоактивен)
В + СН2=СНR → нет роста цепи
B + B → B-B
B + J-[CH2-CHR-]n-CH2-CH R → J-[CH2-CHR-]n-CH2CHRB
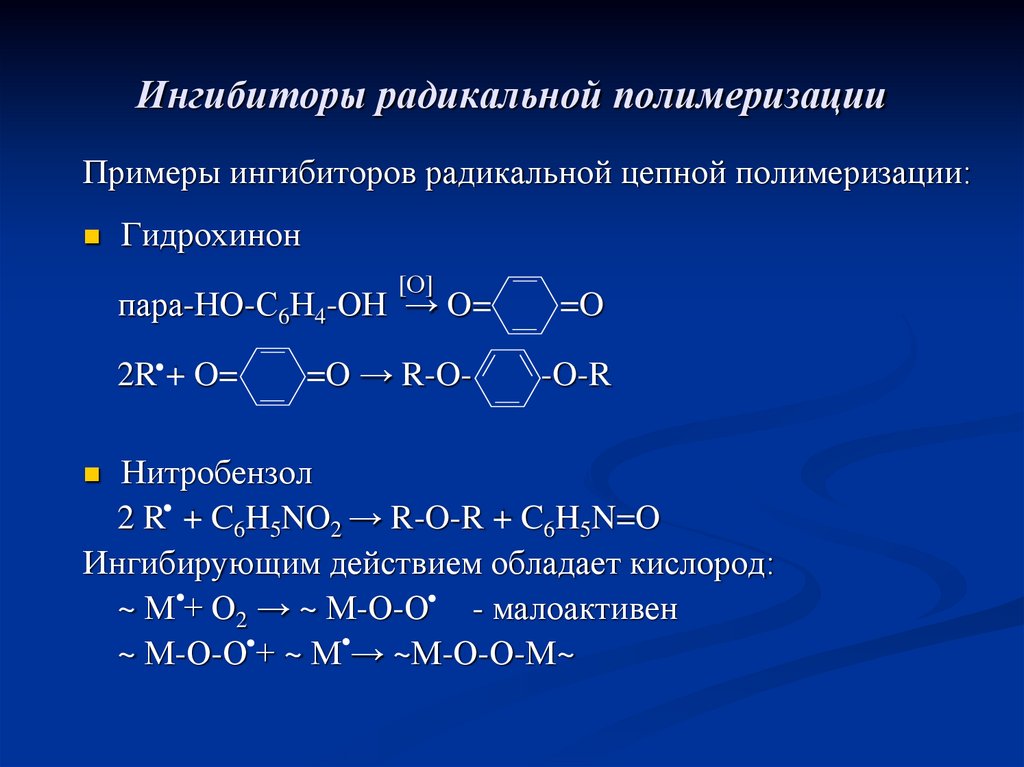
16. Ингибиторы радикальной полимеризации
Примеры ингибиторов радикальной цепной полимеризации:Гидрохинон
[О]
пара-НО-С6Н4-ОН → O=
=O
=O → R-O-
-O-R
2R + O=
Нитробензол
2 R + C6H5NO2 → R-O-R + C6H5N=O
Ингибирующим действием обладает кислород:
~ М + О2 → ~ М-О-О - малоактивен
~ М-О-О + ~ М → ~М-О-О-М~
17. Катионная полимеризация ненасыщенных мономеров
Первая стадия катионной полимеризации –стадия инициирования
Можно выделить четыре основных способа инициирования:
Инициирование протонодонорными кислотами
Инициирование кислотами Льюиса
Инициирование ионизирующим облучением
Инициирование УФ-светом
17
18. Инициирование катионной полимеризации
Инициирование протонодонорными кислотами(CF3COOH, HClO4, HI и др.):
HX + CH2=CHR → CH3-CH+X¯
R
Сильные кислоты не инициируют полимеризацию:
HOSO3H + CH2=CHR → CH3CH+OSO3H¯ → CH3CH-OSO3H
R
R
18
19. Инициирование катионной полимеризации
Инициирование кислотами ЛьюисаИнициирующая система:
кислота Льюиса (BF3, FeCl3, SnCl4, AlCl3 и др.) + сокатализатор
Виды сокатализаторов:
а) протонодонорные соединения (H2O, ROH, RCOOH и др.)
SnCl4 + H2O → [SnCl4OH]¯ H+
[SnCl4OH]¯H+ + CH2=CHR → CH3-CH+[SnCl4OH]¯
R
19
20. Инициирование катионной полимеризации
б) галогенопроизводные углеводородов ((СH3)3CCl, Ph3CCl идр.)
R΄3СCl + SnCl4 → [SnCl5]¯С+R΄3
[SnCl5]¯C+R΄3 + CH2=CHR → R΄3C-CH2-CH+R [SnCl5]¯
в) галогены (I2, Br2, F2)
I2 + ZnI2 → I+[ZnI3]¯
I+[ZnI3]¯ + CH2=CHR → I-CH2-CH+R[ZnI3]¯
В последнее время особое распространение получила инициирующая система: HI + I2 → H+[I3]¯ (где I2 ведет себя как
кислота Льюиса)
20
21. Вторая и третья стадии катионной полимеризации
2 стадия – рост цепи:СН3-СH+R[SnCl4OH]¯ + n CH2=CHR →
→ CH3-CHR-[-CH2-CHR-]n-1-CH2-CH+R[SnCl4OH]¯
3 стадия:
а) обрыв цепи
СH3-CHR-[-CH2-CHR-[n-1-CH2-CH+R[SnCl4OH]¯ →
CH3-CHR-[-CH2-CHR-]n-1-CH2-CH(R)-OH + SnCl4
21
22. Вторая и третья стадии катионной полимеризации
б) передача цепиПередача цепи на катализатор
CH3-CHR-[CH2-CHR-]n-1-CH-CH+R[SnCl4ОН]¯ →
H
→ CH3-CHR-[CH2-CHR-]n-1-CH=CHR + H+[SnCl4OH]¯
H+[SnCl4OH]¯ + n CH2=CHR → рост цепи
Передача цепи на мономер
СH3-СHR-[-CH2-CHR-]n-1-CH-CH+R[SnCl4OH]¯ + CH2=CHR
H
→ CH3CHR-[-CH2-CHR-]n-1СH=CHR + CH3-CH+R[SnCl4OH]¯
CH3-CH+R[SnCl4OH]¯ + CH2=CHR → рост цепи
22
23. Передача цепи при катионной полимеризации
Передача цепи на растворительCH3-CHR-[-CH2-CHR-]n-1-CH2-CH+R[SnCl4OH]¯ + R΄Cl →
→ CH3-CHR-[-CH2-CHR-]n-1–CH2-CH(R)Cl + R΄+[SnCl4OH]¯
R΄+[SnCl4OH]¯ + CH2=CHR → рост цепи
R΄Cl – третичные хлорпроизводные
Передача цепи на сокатализатор
СH3-CHR-[-CH2-CHR-]n-1-CH2-CH+R[SnCl4OH]¯ + HOH →
→ CH3-CHR-[-CH2-CHR-]n-1-CH2-CH(R)-OH + H+[SnCl4OH]¯
H+[SnCl4OH]¯ + n CH2=CHR → рост цепи
23
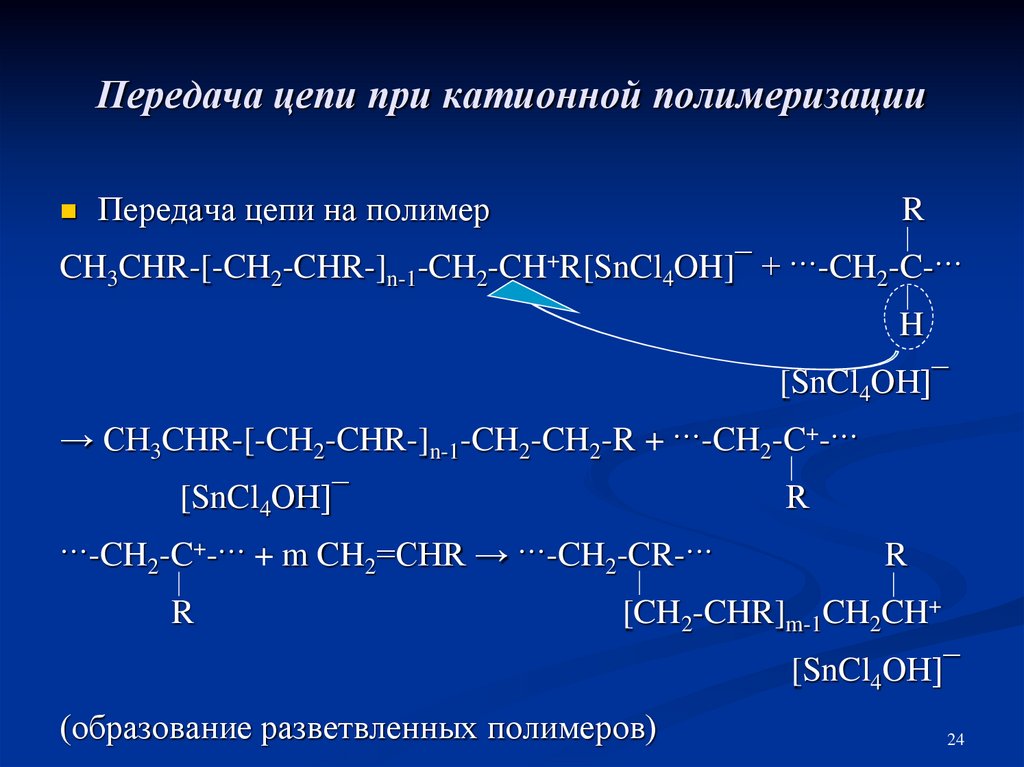
24. Передача цепи при катионной полимеризации
Передача цепи на полимерR
CH3CHR-[-CH2-CHR-]n-1-CH2-CH+R[SnCl4OH]¯ + ···-CH2-C-···
H
[SnCl4OH]¯
→ CH3CHR-[-CH2-CHR-]n-1-CH2-CH2-R + ···-CH2-C+-···
[SnCl4OH]¯
R
···-CH2-C+-··· + m CH2=CHR → ···-CH2-CR-···
R
R
[CH2-CHR]m-1CH2CH+
[SnCl4OH]¯
(образование разветвленных полимеров)
24
25. Анионная полимеризация ненасыщенных мономеров
Первая стадия анионной полимеризации – стадияинициирования
Основные способы инициирования:
Инициирование металлорганическими соединениями
Инициирование щелочными металлами
Инициирование амидами щелочных металлов
Инициирование слабыми основаниями
25
26. Инициирование анионной полимеризации
Инициирование металлорганическими соединениямиn-С4Н9Li + CH2=CHA → СH3(CH2)2CH2-CH2-CH¯A Li+
A= -NO2, -CN, -C=O, -COOH и другие электроноакцепторы
Инициирование щелочными металлами
Na + CH2=CH-CH=CH2 → Na+CH2¯-CH-CH=CH2
Na+ CH2¯-CH=CH-CH2
2 Na+CH2¯-CH=CH-CH2 → Na+ CH2¯-CH=CH-CH2
Na+ CH2¯-CH=CH-CH2
26
27. Инициирование анионной полимеризации
Инициирование амидами щелочных металлов (в жидкомаммиаке)
KNH2 → K+ + NH2¯
NH2¯ + CH2=CHA → H2N-CH2-CH¯A
Инициирование слабыми основаниями
R3N + CH2=CHA → R3N+-CH2-CH¯A
(цвиттер-ион)
27
28. Вторая стадия анионной полимеризации – рост цепи
Рост цепи при инициировании металлорганическимисоединениями
RCH2CH¯ Me+ + n CH2=CHA → R-[-CH2CH-]n-CH2-CH¯ Me+
A
A
A
Рост цепи при инициировании щелочными металлами
Na+ CH¯-CH2-CH2-CH¯ Na+ + n CH2=CHA →
A
A
Na+
Na+ CH¯CH2[CH-CH2]m-CHCH2CH2CH-[CH2-CH]n-m- CH2CH¯
A
A
A
A
A
А
28
29. Вторая стадия анионной полимеризации – рост цепи
Рост цепи при инициировании амидами щелочныхметаллов
H2N-CH2-CH¯ + n CH2=CHA → H2N-[-CH2-CH-]n-CH2-CH¯
А
A
A
Рост цвиттер-ионов
R3N+-CH2CH¯ + n CH2=CHA → R3N+-[-CH2-CH-]n-CH2-CH¯
A
A
A
R3N+-[-CH2-CH-]n-CH2-CH¯ R3N+-[-CH2-CH-]m-CH2-CH¯
A
A
A
A
29
30. Третья стадия анионной полимеризации
Передача цепи на растворительH2N-[CH2-CH]n-CH2CH¯ + NH3 → H2N-[CH2-CH]n-CH2-CH2 +
A
A
A
A
+ H2N¯
H2N¯ + n CH2=CHA → рост цепи
Образование «живых» полимеров
R-[-CH2-CH-]n-CH2-CH¯ Me+
Дезактивация:
A
A
R-[CH2-СН]n-CH2CHˉMe+ + HX → R-[CH2-CH]n-CH2CH2A
A
A
A
+ MeX
30
31. Анионно-координационная полимеризация
Гомогенный катализ:δ+
RH
δ1 стадия: RLi + CH2=CHA → R-CH2-CH-Li (инициироваА
ние)
А
δ+
δ2 стадия: R-CH2-CH-Li + CH2=CHA → R-СH2-CH····Li →
A
CH2-CHA
δδ+
→ RCH2-CH-CH2-CH-Li и т.д. (рост цепи) – образование
А
А
«живых» полимеров
Гетерогенный катализ:
Катализаторы Циглера-Натта TiCl3 + AlR3
31
32. Полимеризация сопряженных алкадиенов
Радикальная полимеризацияРост цепи (три способа):
1,2-присоединение
R + CH2=CH-CH=CH2 → R-CH2-CH
CH=CH2
цис-1,4-присоединение
R + CH2=CH-CH=CH2 → R-CH2
CH2
C=C
H
H
32
33. Полимеризация сопряженных алкадиенов
транс-1,4-присоединениеR + CH2=CH-CH=CH2 → R-CH2
H
C=C
H
CH2
Аналогично при ионной полимеризации.
Анионно-координационная полимеризация
RLi (неполярный растворитель) – цис-1,4-присоединение:
~ СН2..Li
~ CH2-CH2
CH2-Li
CH2
СН2 →
С=С
CH - СН
H
H
33
34. Полимеризация сопряженных алкадиенов (анионно-координационная)
RLi (полярный растворитель)– транс – 1,4-присоединение:Активный центр – ионная пара ~ CH2ˉ Li+
~CH2ˉ Li+ + CH2=CH-CH=CH2 → ~ CH2-CH2-CHˉ-CH=CH2
↕
~ CH2-CH2-CH=CH-CH2ˉ
CH2 CH
Н
δδ~ CH2 CH CH2 →
СН2 С
Li+
~ СН2 С СН2ˉ Li+
Н
34
35. Полимеризация сопряженных алкадиенов (анионно-координационная)
Катализаторы Циглера – Натта:- СH2
CH2 C=C
(95-100 %) TiCl3- Al(C2H5)3
CH3
H
- CH2
H
C=C
CH3
CH2 -
(95-100 %) VCl3-Al(C2H5)3
35
36. Полимеризация карбонильных соединений
Rn R-C=O → [- C-O-]n
H (R)
H (R)
Характеризуются низкой предельной температурой полимеризации для многих соединений. Исключением является
формальдегид (Тпр. = 1200 С):
n H2C=O → [-CH2-O-]n
36
37. Полимеризация гетероциклов
1. Полимеризация простых эфиров. Например:n СН2-СН2 → [-CH2-CH2-O-]n
О
2. Полимеризация циклических амидов (лактамов).
Например:
n (СН2)5-С=О → [-NН-(СН2)5-С-]n
NН
О
3. Полимеризация циклических сложных эфиров (лактонов).
(СН2)n-С=О → [-О-(СН2)n-С-]n
О
О
37
38. Поликонденсация как метод синтеза полимеров
n H2N-R-COOH[-HN-R-C-]n + n H2O
O
H2NRCOOH + H2NRCOOH
H2NRCNHRCOOH + H2O
O димер
H2NRCOOH + H2NRCNHRCOH
H2NRCNHRCNHRCOH +
O
О
O
O
O
тример
+ Н2О
мономер + тример
тример + тример
димер + димер
димер + тример и т.д.
38
39. Поликонденсация
Классификация реакций поликонденсации по мономеру:Гомополиконденсация
n HO-CH2CH2-OH → [-O-CH2CH2-]n + n H2O
Гетерополиконденсация
n H2N-(CH2)6-NH2 + n HOOC-(CH2)4-COOH
[-NH-(CH2)6-NH-C-(CH2)4-C-]n + 2n H2O
O
O
Сополиконденсация
H2N(CH2)6NH2+HOOC(CH2)4COOH+HООС(CH2)8COOH
-HN(CH2)6NH-C(O)(CH2)4C(O)NH(CH2)6NHC(O)(CH2)8C(O)- +
+ Н2О
39
40. Поликонденсация
Классификация реакций поликонденсации по характерухимической реакции:
Равновесная
n НОCH2CH2OH + n пара-HOOC-C6H4-COOH
[-OCH2CH2OC-C6H4C-]n + 2n H2O
O
O
Неравновесная
1. n Cl-R-Cl + n Na2Sx → [-R-Sx-]n + 2n NaCl
2. ROOR → 2RO
RO + C6H5CH2C6H5 → C6H5CHC6H5 + ROH
40
41. Поликонденсация
Ph Ph2 С6H5СHC6H5 → CH-CH
Ph Ph
Ph Ph
Ph Ph
CH-CH + RO → CH-C + ROH
Ph Ph
Ph Ph
Ph Ph
Ph Ph
2 CH-C → Ph2CH-C-C-CPh2 и т.д.
Ph Ph
Ph Ph
Ph
[-C-]n
Ph
41
42. Линейная поликонденсация
Конкурирующие реакции:1. Поликонденсация n X-R-Y
[-Z-R-]n + n А
2. Циклизация
a) на стадии мономера: X-R-Y R-Z + A
Например:
CH2-CH2
H2NCH2CH2CH2CH2COOH
CH2
C=O + H2O
CH2-NH
б) на стадии димера: 2 X-R-Y
XRZRY + A RZRZ + A
Например: 2 H2NCH2COOH H2NCH2CNHCH2COOH + H2O
O=C-NH
O
CH2 CH2 + H2O
NH-C=O
42
43. Поликонденсация многофункциональных мономеров
Af – многофункциональный мономерf – количество функциональных групп А в молекуле мономе-ра
( ≥ 3)
n A-R-A + m AB→ ~ -AB-AB-AB-A-R-A-BA-BA-BA-BA- ~
A
A-BA-BA-BA-BA- ~ →
B-B
→ ~ AB-AB-AB-A-R-A-BA-BA-BA- BA-BA-~
A-BA-BA-BA-BA- BB
A
~ -AB-AB-AB-AB-AB-A-R-A-BA-BA-BA- ~
1.A-A + Bf 2.A-A + B-B + Вf 3.Af +Bf
4.A-B + Af + B-B
43
44. Примеры важнейших реакций поликонденсации
Поликонденсация диоловПоликонденсация диолов и дикарбоновых кислот
Поликонденсация аминокислот
Поликонденсация дикарбоновых кислот и диаминов
Поликонденсация оксикислот:
n НО-R-COOH
[-O-R-C-]n + n H2O
O
Получение фенолформальдегидных смол (новолак, резол,
резит)
Получение глифталевой смолы
44
45. Примеры важнейших реакций поликонденсации
Поликонденсация мочевины с формальдегидом:n H2C=O + n NH2-C-NH2 → [-CH2-NH-C-NH-]n + n H2O
O
··· O
n H2C=O + m NH2-C-NH2 → ~ -CH2NCNCH2NHCNH ~
O
O CH2
O + Н2О
~ -CH2N-CNCH2NHCNH- ~
·· O
O
Получение полисилоксанов:
CH3 CH3
CH3 CH3
n HO-Si-OH → [- Si-O-]n + n H2O
45
46. Примеры важнейших реакций поликонденсации
Получение полиазинов:n O=CH-CH=O + H2N-NH2 → [=CH-CH=N-N=]n + 2n H2O
Получение полисульфидов
и многие другие.
46
47. Химические превращения полимеров
Классификация химических реакций полимеров:1. Реакции, протекающие без изменения степени полимеризации макромолекул (полимераналогичные
превращения и внутримолекулярные реакции полимеров)
2. Реакции, приводящие к уменьшению степени
полимеризации макромолекул (реакции деструкции
полимеров)
3. Реакции, приводящие к увеличению степени
полимеризации макромолекул (реакции сшивания
полимеров)
47
48. Реакции, протекающие без изменения степени полимеризации макромолекул
1. Полимераналогичные превращения полимеров[-CH2-CH-]n → [-CH2-CH-]n
X
Y
Например:
H+
-CH2-CH- + HOH
-CH2-CH- + CH3COOH
OOCCH3
OH
Химическая модификация поливинилового спирта
H+
-СН2-СН- + RCOOH
-СН2-СН- + H2O
ОН
ООСR (производство лаков)
48
49.
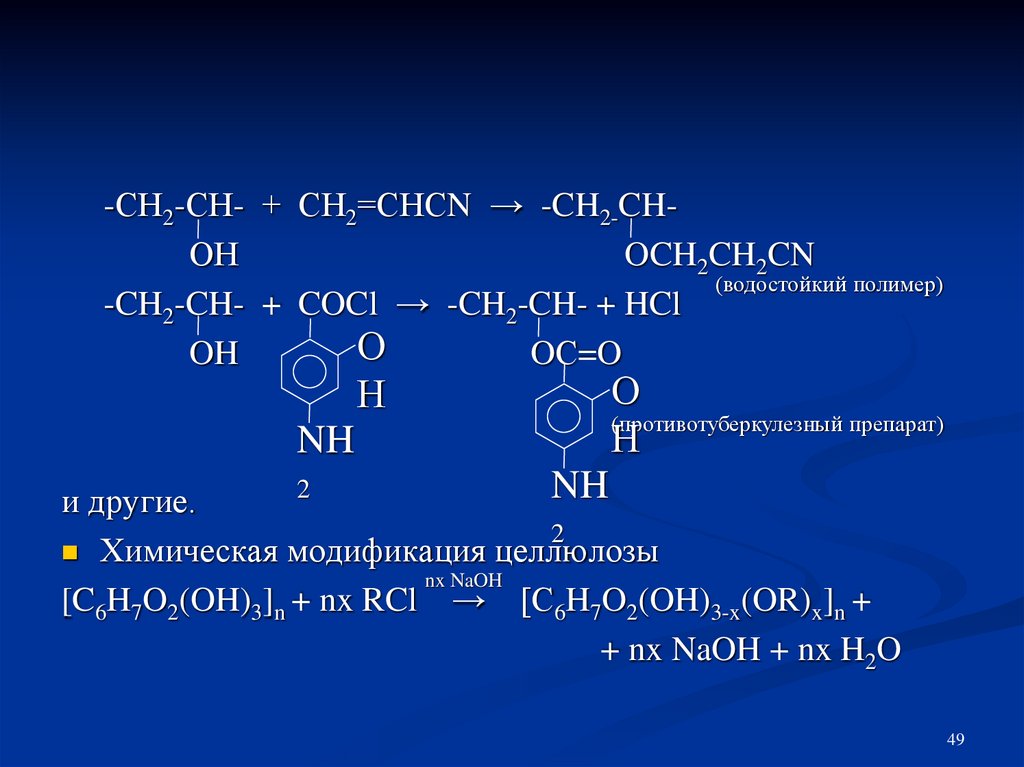
-СН2-СН- + СН2=СНСN → -CH2-CHОНOCH2CH2CN
(водостойкий полимер)
-CH2-CH- + COCl → -CH2-CH- + HCl
О
OH
OС=O
Н
NH
О
(противотуберкулезный препарат)
Н
NH
2
и другие.
2
Химическая модификация целлюлозы
nx NaOH
[C6H7O2(OH)3]n + nx RCl → [C6H7O2(OH)3-x(OR)x]n +
+ nx NaOH + nx H2O
49
50.
nx NaOH[C6H7O2(OH)3]n + nx (CH3)2SO4 → [C6H7(OH)3-x(OCH3)x]n +
+ nx CH3OSO2ONa + nx H2O
(метиловый, этиловый, бензиловый эфиры используются для производства лаков, волокон)
NaOH
[С6Н7О2(ОН)3]n + n CH2 = CHCN → [C6H7(OH)2OCH2CH2CN]n
H2SO4
[C6H7O2(OH)3]n + n HNO3 → [C6H7O2(OH)2ONO2]n + n H2O
(производство нитроцеллюлозных лаков)
H2SO4
[C6H7O2(OH)2ONO2]n + n HNO3 → [C6H7O2OH(ONO2)2]n
(производство коллодия)
H2SO4
[C6H7O2OH(ONO2)2]n + n HNO3 → [C6H7O2(ONO2)3]n + n H2O
(производство бездымного пороха)
50
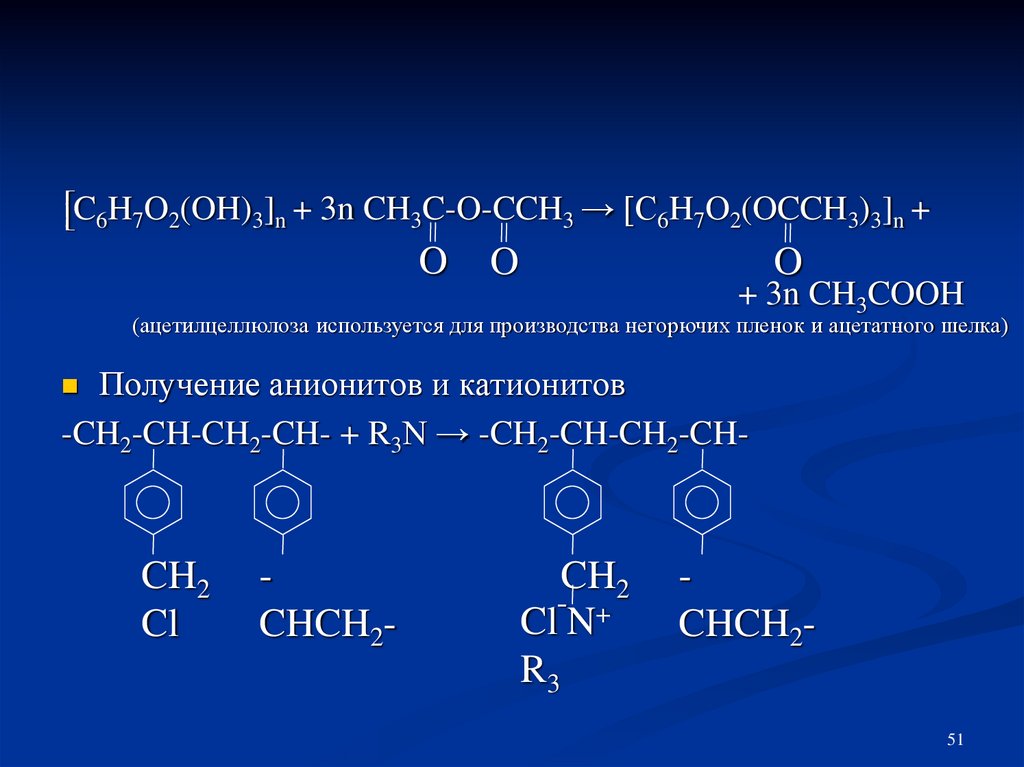
51.
[C6H7O2(OH)3]n + 3n CH3C-O-CCH3 → [C6H7O2(OCCH3)3]n +O
O
O
+ 3n CH3COOH
(ацетилцеллюлоза используется для производства негорючих пленок и ацетатного шелка)
Получение анионитов и катионитов
-CH2-CH-CH2-CH- + R3N → -CH2-CH-CH2-CH
CH2
Cl
CHCH2-
CH2
ClˉN+
R3
CHCH251
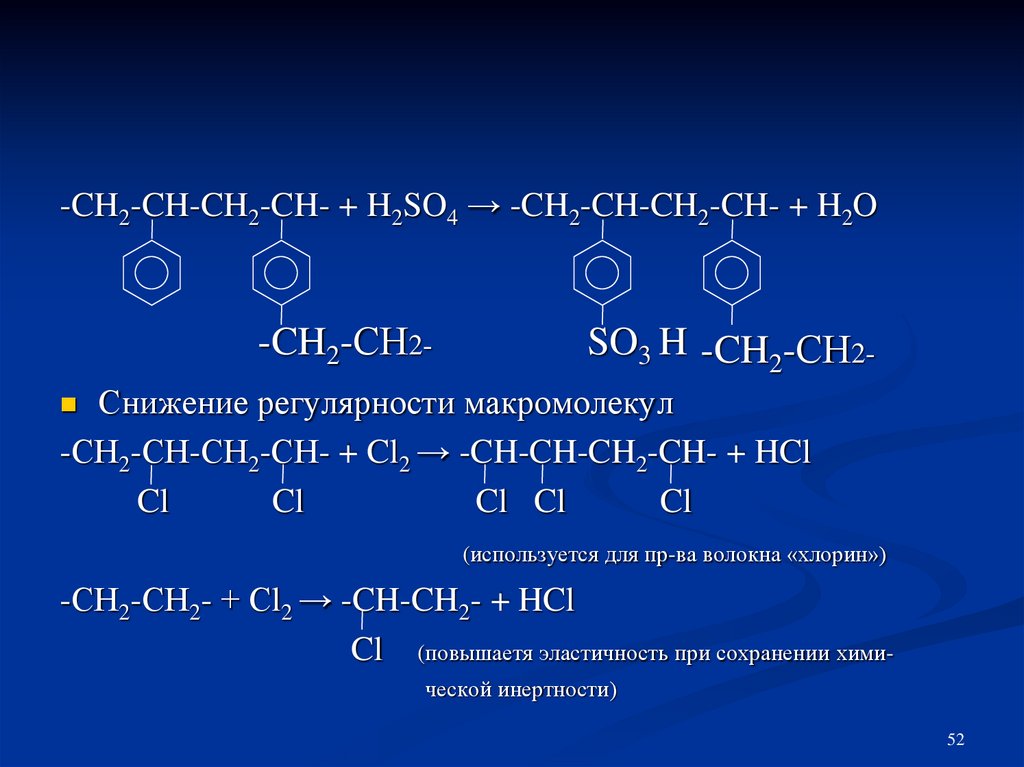
52.
-CH2-CH-CH2-CH- + H2SO4 → -CH2-CH-CH2-CH- + H2O-CH2-СН2-
SO3 H -CH2-СН2-
Снижение регулярности макромолекул
-СН2-СН-СН2-СН- + Cl2 → -CH-CH-CH2-CH- + HCl
Cl
Cl
Cl Cl
Cl
(используется для пр-ва волокна «хлорин»)
-СН2-СН2- + Сl2 → -CH-CH2- + HCl
Cl (повышаетя эластичность при сохранении химической инертности)
52
53.
Превращения полиакролеина-СН2-СН- + NaHSO3 → -CH2-CHН-С=О
H-C-OH
SO3Na
-CH2-CH- + NH2OH → -CH2-CH- + H2O
H-C=O
CH=N-OH
-CH2-CH- + NH2NHC6H5 → CH2-CH- + H2O
H-C=O
CH=NNHC6H5
53
54.
Превращения полиакриловой кислоты-СH2-CH- + NaOH → -CH2-CH- + H2O
COOH
COONa
H
-CH2-CH- + ROH
-CH2-CH- + H2O
COOH
COOR
и многое другое.
Химически модифицированный полимер:
a) Полидисперсен
б) Структурно неоднороден
R-OH + RCOOH → RCOOR +H2O
-CH2СHCH2CHCH2CH- + RCOOH H -CH2CHCH2CHCH2CHOH
OH
OH
OH
OCR OH
O
+
+
54
55. Реакции, протекающие без изменения степени полимеризации макромолекул
2. Внутримолекулярные реакции2.1. Образование макромолекул с системой сопряженных
связей
RONa
-СH2-СH-CH2-CH-CH2-CH- → -CH=CH-CH=CH-CH=CH- +
Cl
Cl
Cl
+ NaCl + ROH
t°, кат.
-CH2-CH-CH2-CH-CH2-CH- → -CH=CH-CH=CH-CH=CH- +
OH
OH
OH
+ H 2O
(Поливинилен обладает полупроводниковыми и магнитными свойствами)
55
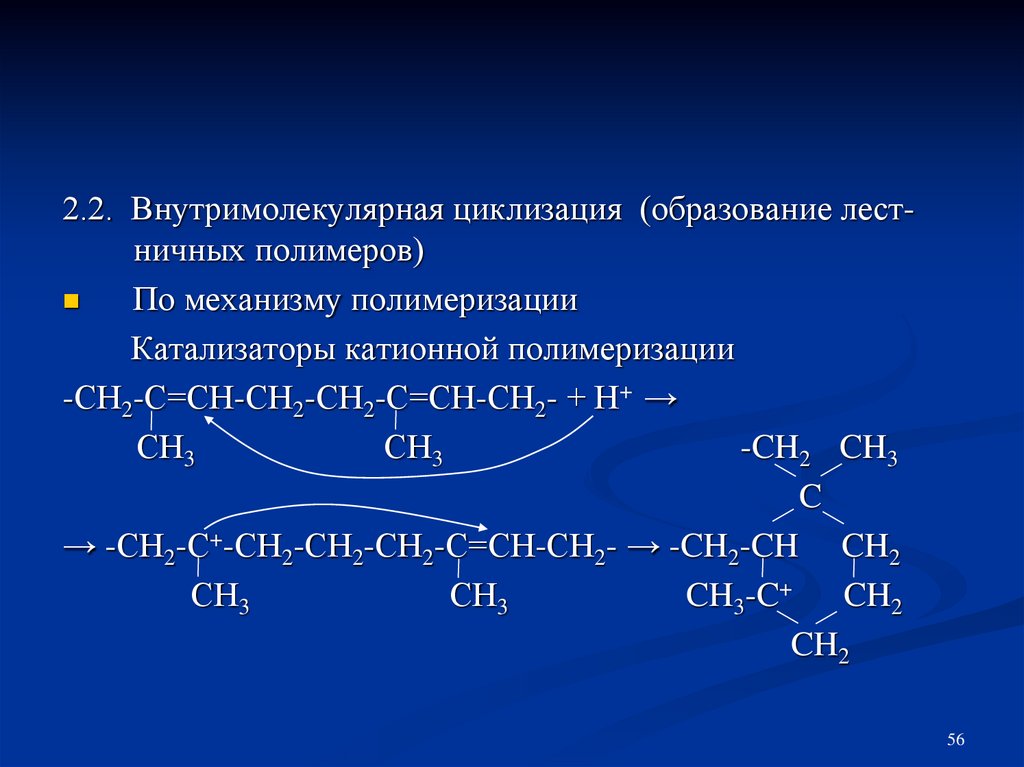
56.
2.2. Внутримолекулярная циклизация (образование лестничных полимеров)По механизму полимеризации
Катализаторы катионной полимеризации
-СН2-С=СН-СН2-СН2-С=СН-СН2- + Н+ →
СН3
СН3
-CH2 CH3
C
→ -СН2-С+-СН2-СН2-СН2-С=СН-СН2- → -CH2-CH CH2
СН3
СН3
CH3-C+ CH2
CH2
56
57.
-СH2-C-CH3-CH2-C-CH3
-H2C CH3
CH2-CH I CH2 → H+ + CH2-C CH2 + CH2 C
H2C CH3-C + CH2
H2C CH3-C CH2 H2C CH CH2
CH3-C II
CH2
CH3-C I CH2
C+ C
CH2
CH
CH
H3C HC
CH2 II
CH2
CH2
H2C CH
3
и т.д.
( Циклокаучук используется для производства клеев, нанесения защитных покрытий, как средство для
пропитки и т.д.)
57
58.
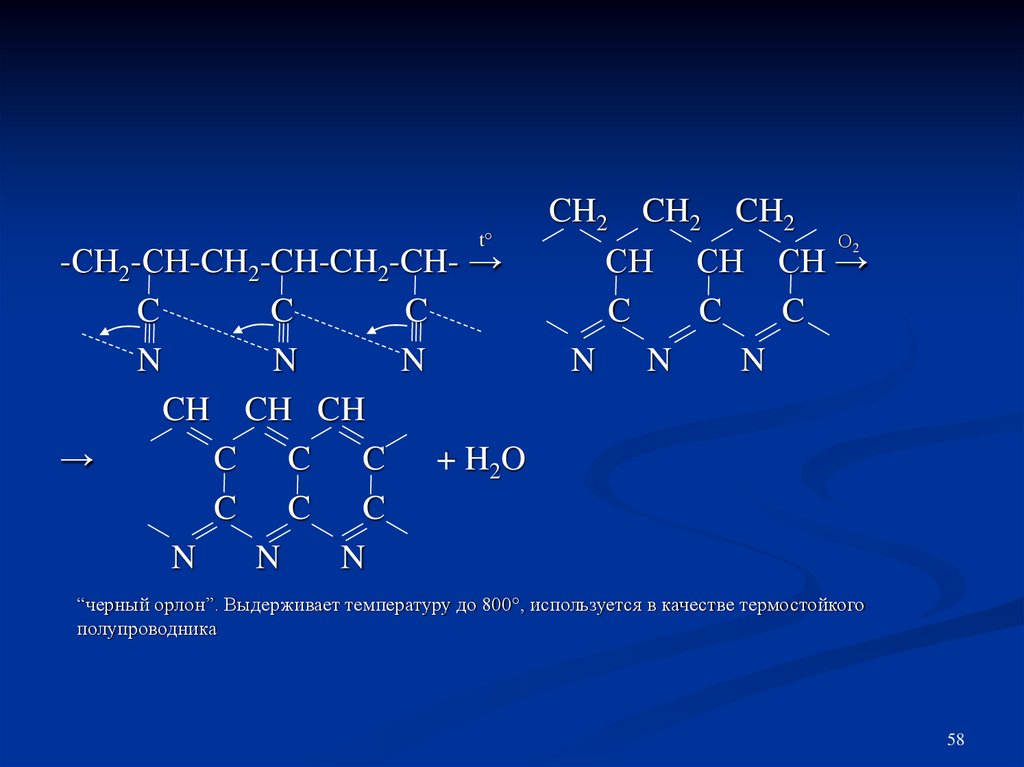
t°-СН2-СН-CH2-CH-CH2-CH- →
C
C
C
N
N
N
CH CH CH
→
C
C
C
+ H2O
C C
C
N
N
N
CH2 CH2 CH2
О
СH CH CH →
C
C
C
N N
N
2
“черный орлон”. Выдерживает температуру до 800°, используется в качестве термостойкого
полупроводника
58
59. Внутримолекулярная циклизация
По механизму поликонденсацииCH2 CH2
СН2 СН2
HС CH СН → НС СН СН + H2O
О=С C=О C=O
О=С С=О СООН
НО ОН OH
О
Zn, t°
-СH2-CH-CH2-CH-CH2-CH-CH2-CH-CH2-CH- →
Cl
Cl
Cl
Cl
Cl
CH2
CH2
→ -CH2-CH―CH-CH2-CH-CH2-CH―CH- + ZnCl2
Cl
59
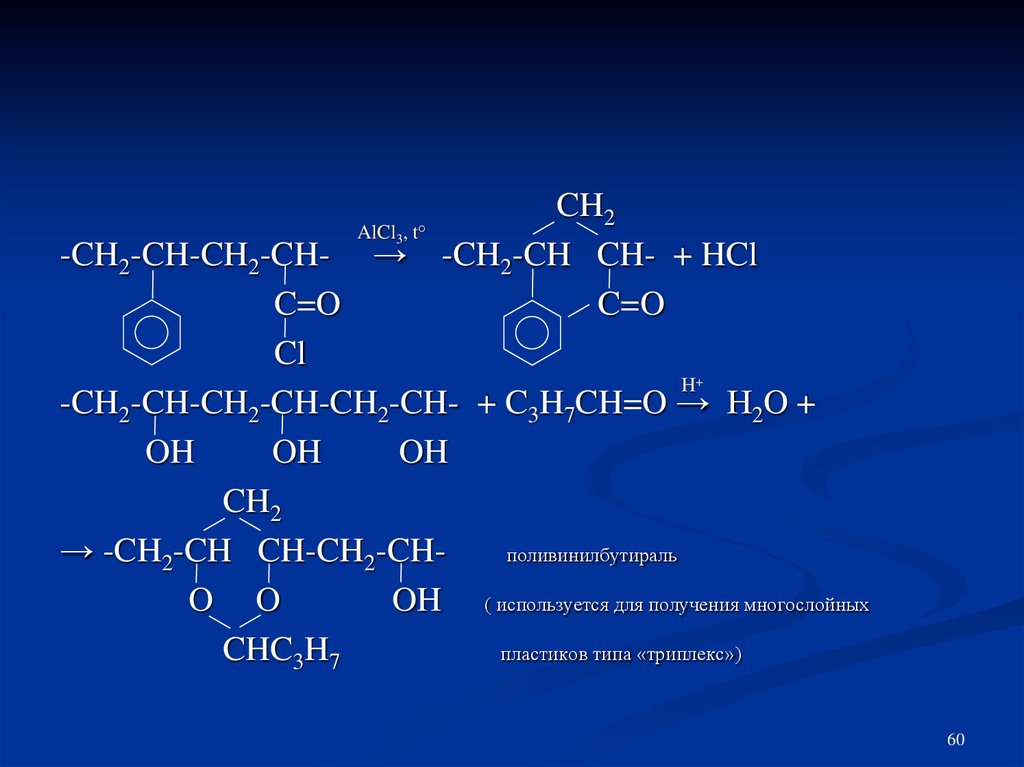
60.
CH2AlCl , t°
-CH2-CH-CH2-CH- → -CH2-CH CH- + HCl
C=O
C=O
Cl
H
-CH2-CH-CH2-CH-CH2-CH- + C3H7CH=O → H2O +
OH
OH
OH
CH2
→ -CH2-CH CH-CH2-CHполивинилбутираль
O O
OH ( используется для получения многослойных
CHC3H7
пластиков типа «триплекс»)
3
+
60
61. Реакции деструкции полимеров
Классификация реакций деструкции:Химическая деструкция (под действием химических
веществ). Характерна для гетероцепных полимеров.
Окислительная деструкция (под действием кислорода).
Характерна для карбоцепных полимеров.
Физическая деструкция (под действием физических
факторов – температура, свет, механ.воздействие и т.д.)
Характерна для карбоцепных полимеров.
61
62. Химическая деструкция полимеров
Гидролиз полимеров1. Полиэфиры
Н[-OCH2CH2OC-C6H4- C-]n-OH + HOH →
O
O
→ H[OCH2CH2OCC6H4C]m-OH + H[OCH2CH2OCC6H4C]k-OH
O
O
O
O
→ n HOCH2CH2OH + n HOOCC6H4COOH
n=m+k
α HOH, H+
62
63. Химическая деструкция полимеров
2. ПолиамидыН
H-[-NH(CH2)6NHC(CH2)4C-]n-OH + n HOH →
O
O
→ n H2N(CH2)6NH2 + n HOOC(CH2)4COOH
+
3. Полиацетали (крахмал, целлюлоза)
Н+
[C6H7O2 (OH )3]n + n HOH → n C6H12O6
и т.д.
63
64. Термическая деструкция полимеров
При нагревании полимеров происходит:Деполимеризация
Снижение молекулярной массы макромолекул с
образованием термически устойчивых продуктов
Выделение низкомолекулярных соединений
Деполимеризация
CH3
CH3
[-CH2-C-]n ; [-CH2-C-]n ; [-CH2-CH-]n (60-65 %)
COOCH3
C6H5
C6H5
64
65.
Снижение молекулярной массы макромолекул с образованием термически устойчивых продуктов[-CH2-CH2-]n ; [-CH2-CH-]n и т.п.
COOCH3
65
66. Термическая деструкция полимеров
Деструкция с выделением низкомолекулярных продуктовt°
[-CH2-CH-]n →
HCl + ··-CH2-CH=CH-CH-··
Cl
Cl
t°
[-CH2-CH-]n → CH3COOH + ·· -CH2-CH=CH-CH-··
OOCCH3
OOCCH3
66
67. Реакции полимеров, приводящие к увеличению степени полимеризации макромолекул
···-СH2-CH-······-CH2-CH-···
OH
→
O
+ H2O
OH
···-CH2-CH-···
···-CH2-CH-···
···-CH2-CH-···
···-CH2-CH···
COOH
C=O
+ HO-CH2-CH2-OH → O-CH2-CH2-O + 2 H2O
COOH
C=O
···-CH2-CH-···
···-CH2-CH-···
67
68. Вулканизация каучуков
Два способа вулканизации каучуков:1. Серный способ
2. Бессерный способ
1. Серный способ вулканизации каучуков
Радикальный механизм
активаторы + ускорители → R
R + S8 → R-S6-S-S → R-S6-S + S
↓
R-S5-S + S-S и т.д.
S
···-СH2-СH=СH-СH2-···
···-CH2-CH-CH-CH2···
+ S →
S
···-СН2-СН=СН-СН2-···
···-CH2-CH-CH-CH2-···
68
69. Серный способ вулканизации каучуков
···-CH2-CH=CH-CH2-······-CH2-CH-CH-CH2-···
+ S-S →
S-S
···-CH2-CH=CH-CH2···-CH2-CH-CH-CH2-···
S-S···-CH2-CH=CH-CH2-··· + S → ···-CH-CH=CH-CH2-··· +H2S
···-CH-CH=CH-CH2-··· + S → ···-CH-CH=CH-CH2-···
↓
S
···-CH-CH=CH-CH2-···
···-CH-CH=CH-CH2-··
···-CH-CH=CH-CH2-···
и т.д.
69
70. 2. Бессерный способ вулканизации каучуков
1 стадия –инициированиеt°
ROOR → 2 RO
RO + ··-CH2-CH=CH-CH2-·· → ROH + ··-CH-CH=CH-CH2-··
2 стадия – развитие цепи вулканизации
··-СН-СН=СН-СН2-·· + ··-СН2-СН=СН-СН2-·· →
→ ··-СН-СН=СН-СН2-·· ··-СН2-СН=СН-СН2-··
··-СН2-СН-СН-СН2-··
→
и т.д.
3 стадия – обрыв цепи вулканизации (рекомбинация или
диспропорционирование радикалов)
70
71. Конфигурационная изомерия полимеров
Геометрическая изомерия полимеров-CH2 H
[-CH2-C=CH-CH2-]n → [ C=C ]n
CH3
CH3 CH2↓
-CH2
CH2[ C=C ]n
CH3
H
71
72. Конфигурационная изомерия полимеров
Оптическая изомерия полимеровR
R
R
H
H
H
H C H C H C
H C H C H C
[-CH2-CH-]n → C H C H C H или С R C R C R
R
H
H
H
H
H
H
↓
изотактический
R
H
R
H C H C H C
C H C R C H
H
H
H
синдиотактический
72






























































 Химия
Химия








