Похожие презентации:
Общие свойства кислот. Часть 1. Параграф 35
1.
Общие свойства кислотЧасть 1
Параграф 35
2.
КислотыВспомним, что мы уже о них знаем?
-сложные вещества, которые состоят из
атомов водорода и кислотного остатка.
Сильные кислоты
Слабые кислоты
HClO4
HNO3
H2SO3
H3PO4
HF
H2SO4
HCl
HNO2
H2CO3
H2S
HBr
HI
H2SiO3
CH3COOH
3.
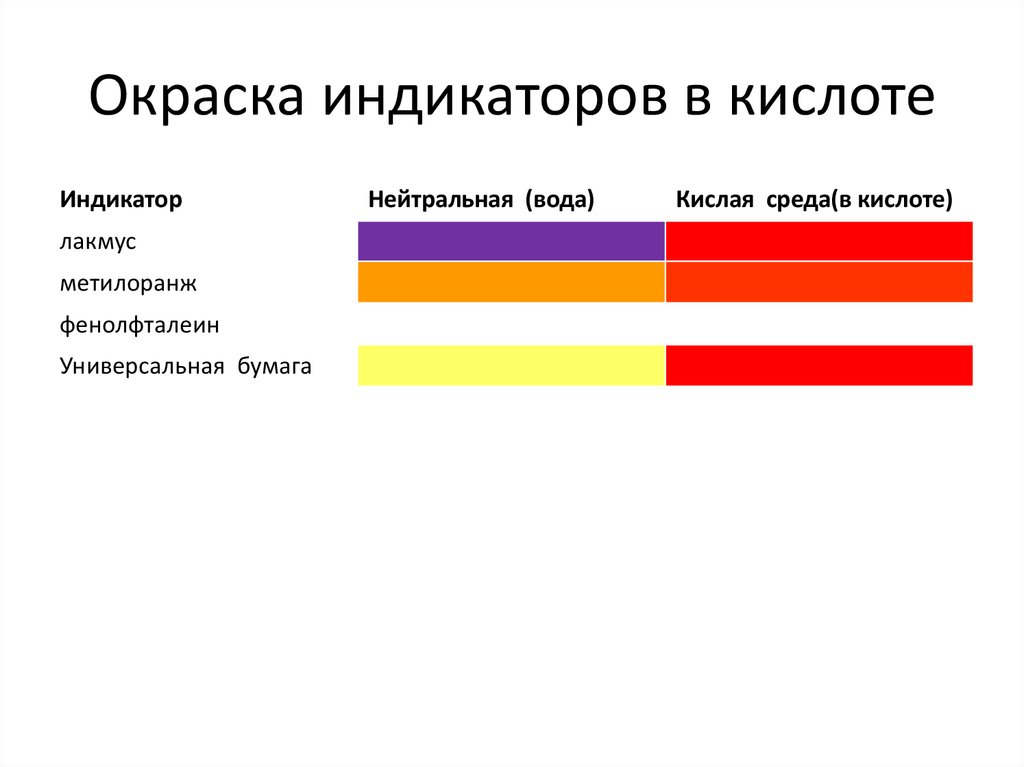
Окраска индикаторов в кислотеИндикатор
лакмус
метилоранж
фенолфталеин
Универсальная бумага
Нейтральная (вода)
Кислая среда(в кислоте)
4.
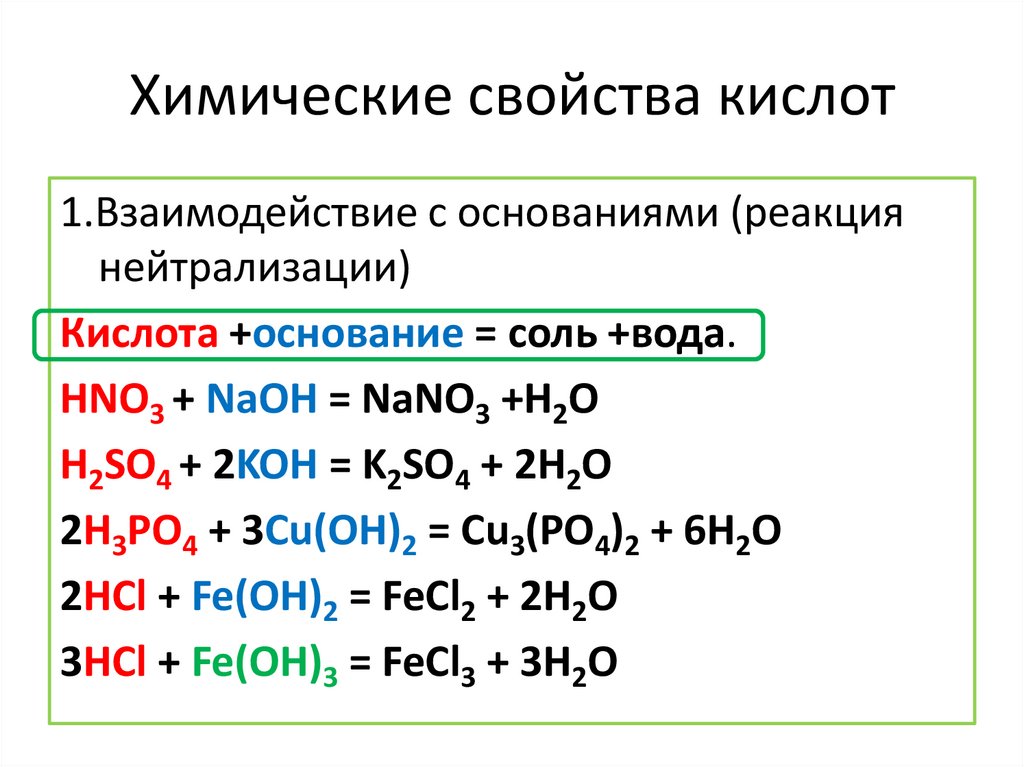
Химические свойства кислот1.Взаимодействие с основаниями (реакция
нейтрализации)
Кислота +основаниe = соль +вода.
HNO3 + NaOH = NaNO3 +H2O
H2SO4 + 2KOH = K2SO4 + 2H2O
2H3PO4 + 3Cu(OH)2 = Cu3(PO4)2 + 6H2O
2HCl + Fe(OH)2 = FeCl2 + 2H2O
3HCl + Fe(OH)3 = FeCl3 + 3H2O
5.
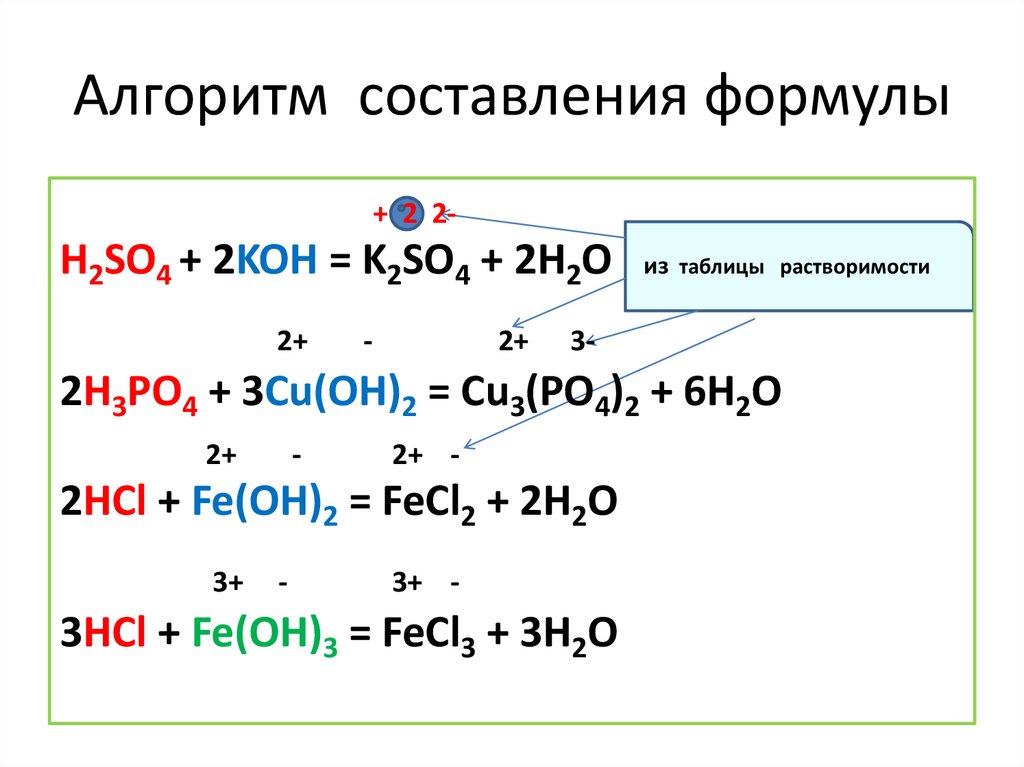
Алгоритм составления формулы+ 2 2-
H2SO4 + 2KOH = K2SO4 + 2H2O из таблицы растворимости
2+
-
2+
3-
2H3PO4 + 3Cu(OH)2 = Cu3(PO4)2 + 6H2O
2+
-
2+ -
2HCl + Fe(OH)2 = FeCl2 + 2H2O
3+
-
3+ -
3HCl + Fe(OH)3 = FeCl3 + 3H2O
6.
Химические свойства кислот2. Взаимодействие с основными и
амфотерными оксидами
Кислота + основный оксид = соль +вода.
2HNO3 + Na2O = 2NaNO3 +H2O
H2SO4 + K2O = K2SO4 + H2O
II
II
2+
3-
2H3PO4 + 3CuO = Cu3(PO4)2 + 3H2O
II II
2+
-
2HCl + FeO = FeCl2 + H2O
7.
Химические свойства кислот2. Взаимодействие с основными и
амфотерными оксидами
Кислота + амфотерный оксид = соль +вода.
III II
3+ -
6HCl + Fe2O3 = 2FeCl3 + 3H2O
8.
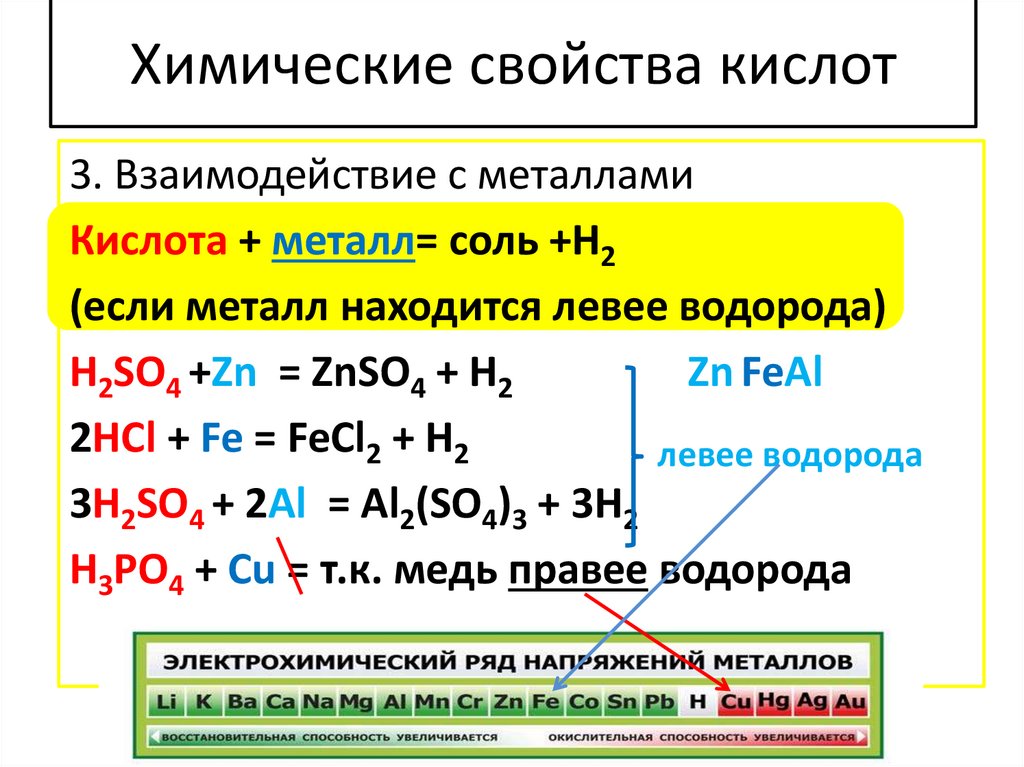
Химические свойства кислот3. Взаимодействие с металлами
Кислота + металл= соль +Н2
(если металл находится левее водорода)
H2SO4 +Zn = ZnSO4 + H2
Zn FeAl
2HCl + Fe = FeCl2 + H2
левее водорода
3H2SO4 + 2Al = Al2(SO4)3 + 3H2
H3PO4 + Cu = т.к. медь правее водорода
9.
Что знаем сейчасН 2О
Основный
оксид
Основный
оксид
Если
образуется
щелочь
Амфотерны
й оксид
соль
Кислотный
оксид
Если
соль
образуется
растворим
ая кислота
Щелочь
Кислота
Соль
Амфотерный Кислотный Щелочь
оксид
оксид
Кислот
а
соль
Соль
+
вода
соль
соль
Соль
+
вода
Соль
+
вода
соль
Соль
+
вода
Соль
+
вода
Металлы
Соль
+
вода
Соль
+
вода
Соль
+
вода
Соль
+
вода
Соль
+
вода
Если металл
до Н→
соль+Н2
10.
Домашнее задание.Параграф 35 читать.
Определения из слайдов 5-9 наизусть
Выучить сильные и слабые кислоты.
Составить уравнения реакций между соляной кислотой и
веществами из перечня:
магний,
оксид магния,
гидроксид магния,
алюминий,
оксид алюминия,
гидроксид алюминия.
Назвать продукты реакции и указать класс исходных веществ.






 Химия
Химия








