Похожие презентации:
Фосфор и его соединения (9 класс)
1.
Фосфор и его соединения2.
Отрывок из произведения Артура КонанДойля «Собака Баскервилей».
• «…Да. Это была собака, огромная, черная, как смоль. Но
такой собаки никто из нас, смертных, еще не видывал.
Из ее пасти вырывалось пламя, глаза метали искры, по
морде и загривку переливался мерцающий огонь. Ни в
чьем воспаленном мозгу не могло бы возникнуть
видение более страшное, более омерзительное, чем
это адское существо, выскочившие на нас из
тумана…Страшный пес величиной с молодую
львицу. Чудовище лежало перед нами…
• Его огромная пасть все еще светилась голубоватым
пламенем, глубоко сидящие дикие глаза обведены
огненными кругами. Я дотронулся до этой светящейся
головы и, подняв руку, увидел, что мои пальцы тоже
засветились в темноте».
3.
«Фосфор и его соединения».4.
Девиз нашего урока«Фосфор-элемент жизни и мысли»
(академик А.Е.Ферсман)
5.
Охарактеризуйте фосфор как химический элементпо его положению в периодической системе
химических элементов Д.И. Менделеева по плану:
1. Порядковый номер, номер периода, группа,
подгруппа;
2. Заряд ядра, электронная формула;
Сколько протонов, нейтронов и электронов в
атоме фосфора.
3. Валентность и степень окисления;
4. Формула летучего водородного соединения и
высшего оксида.
6.
1. Элемент VA группы2. Электронная формула 1s22s22p63s23p3.
3. Валентность: максимальная V.
Минимальная III. Наиболее характерные
степени окисления: +5, +3, 0, -3.
Оксиды Р2О5 и Р2О3 имеют кислотные свойства.
Летучее водородное соединение – фосфин
PH3
7.
Фосфор в свободном состоянии в природе невстречается.
Он находится не менее чем в 190 минералах,
из которых главнейшими являются апатиты
и фосфориты.
8.
Получение.В промышленности :
Фосфор получают из апатитов и
фосфоритов, нагревая их в
электрической печи без доступа
воздуха в присутствии оксида
кремния IV:
Печь для
получения фосфора
в промышленности
9.
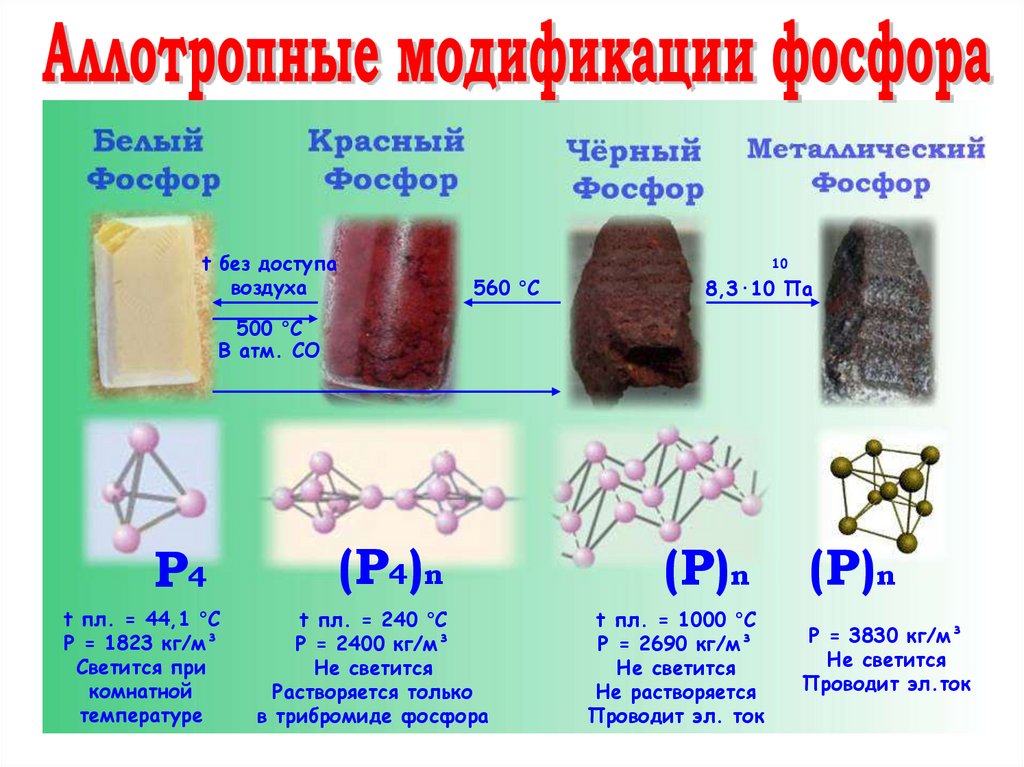
Что называется аллотропией?Аллотропия - способность атома
одного химического элемента
образовывать простые вещества
разного состава или разного
строения
10.
t без доступавоздуха
10
560 °C
8,3·10 Па
500 °C
В атм. СО
P4
t пл. = 44,1 °С
Ρ = 1823 кг/м³
Светится при
комнатной
температуре
(P4)n
t пл. = 240 °С
Ρ = 2400 кг/м³
Не светится
Растворяется только
в трибромиде фосфора
(P)n
t пл. = 1000 °С
Ρ = 2690 кг/м³
Не светится
Не растворяется
Проводит эл. ток
(P)n
Ρ = 3830 кг/м³
Не светится
Проводит эл.ток
11.
Химические свойства фосфора:12.
Химические свойства.Как окислитель
Взаимодействует с металлами с
образованием ________:
Р + Са →
P + Na →
13.
Химические свойства.Как окислитель
Взаимодействует с металлами с образованием
фосфидов:
2Р + 3Са → Са3Р2
(фосфид кальция)
P + 3Na → Na3P
(фосфид натрия)
14.
Как восстановительГорит в кислороде и на воздухе с образованием
оксида фосфора (V):
0
0
+5 -2
4Р
5О
)→
Р ++ О
О )О =
Р22ОР52О5
2( изб
2( изб
2
2
(оксид фосфора (V), или фосфорный ангидрид.)
O20+4е → 2 O-2 5 ок – ль; вос – ние;
P0 -5е → P+5
4 вос – ль; ок – ние;
0
0
+3 -2
4РР ++ 3О
= 2 РР22О
О22→
О33 ( недостаток О2)
(оксид фосфора III, или фосфористый ангидрид.)
O20 +4е → 2 O-2 3 ок – ль; вос – ние;
P0 -3е →P+3
4 вос – ль; ок – ние;
15.
Видеофрагмент «сравнениетемператур воспламенения
фосфора»
16.
Взаимодействует с галогенами и с серой.P + Cl2 (изб) →
P + Cl2 (недостаток)→
P + S (изб)→
P + S (недостаток)→
17.
Взаимодействует с галогенами и с серой.2P + 5Cl2 (изб) → 2PCl5
2P + 3Cl2 (недостаток)→ 2PCl3
2P + 5S (изб)→ P2S5
2P + 3S (недостаток)→ P2S3
18.
С водородом фосфор не соединяется.19.
20.
Взаимодействие со щелочамиВ холодных концентрированных растворах
щелочей также медленно протекает
реакция диспропорционирования:
-3
0
+1
t
KOH ++ 3H
H2O
O→
→t PH
PH3 ++ 3KH
KH2PO
4PP44 ++ 3KOH
PO2
Р0 + 3е → Р-3 1
Р0 - 1е → Р+1 3
2
3
2
2
ок – ль; вос – ние;
вос – ль; ок – ние;
21.
Сильные окислители превращают фосфор вфосфорную кислоту:
0
+5
+5
+4
PP++5HNO
HNO 3 (конц) → H 3PO 4 + 5NO
NO22 ↑ + H22O
N+5 + 1е → N+4
5 ок – ль; вос – ние;
Р0
1 вос – ль; ок – ние;
- 5е → Р+5
22.
Сильные окислители превращают фосфор вфосфорную кислоту:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO ↑
2P + 5H2SO4 (конц) → 2H3PO4 + 5SO2 ↑ + 2H2O
23.
Реакция окисления фосфора происходит при поджигании спичек, вкачестве окислителя выступает бертолетова соль:
0
-1
+5
+5
6P
P ++ 5KClO
KClO3 →
→5KCl
KCl+ 3P
+ 2PO5O
3
2
5
Cl+5 + 6е → Cl-1 5 ок – ль; вос – ние;
Р0
- 5е → Р+5
6 вос – ль; ок – ние;
Такая реакция происходит,
когда мы зажигаем спички.
В головке спичек
содержится бертолетова
соль, в намазке шкурки –
красный фосфор
24.
Соединения фосфораРН3 – фосфин.
• Бесцветный,
• Ядовитый газ,
• С чесночным запахом,
• Легко самовоспламеняется на воздухе.
Получение:
Действие соляной кислоты на фосфиды
металлов, например:
Zn3P2 + 6HCl → 2PH3 ↑ + 3ZnCl2
25.
Химические свойства PH3 :Фосфин при температуре около 150 ºС
самовоспламеняется на воздухе.
2PH3 + 4O2 t→ P2O5 + 3H2O
Фосфин восстанавливает соли некоторых
малоактивных металлов до свободных
металлов, например:
PH3 + 8AgNO3 + H2O = H3PO4 + 8Ag + 8HNO3
Практического значения фосфин не имеет.
26.
Р2О5 – оксид фосфора (V), или фосфорный ангидрид.• Белый порошок,
• Без запаха,
• Хорошо растворяется в воде,
• Является кислотным оксидом,
• Образует несколько кислот:
Р2О5 +3 Н2О = 2Н3РО4 При нагревании
Ортофосфорная, или фосфорная, кислота
Р2О5 +Н2О = 2НРО3 На холоде
Метафосфорная кислота.
27.
С чем кислотный оксид Р2О5 будетвзаимодействовать :
28.
С основными оксидамиР2О5 + 3 СаО = Са3 (РО4)2
Со щелочами
Р2О5 + 6 Nа ОН = 2 Nа3РО4 + 3 Н2О
29.
При взаимодействии в избытке Р2О5 сощелочами могут образовываться не
только средние, но и кислые соли:
Р2О5 + 4NaOH = 2Na2HPO4 + H2O
Гидрофосфат натрия
Р2О5 + 2NaOH + H2O = 2NaH2PO4
Дигидроосфат натрия
30.
Н3РО431.
Химические свойства ортофосфорной кислотыобщие с другими кислотами
Н3РО4
1. Водный раствор кислоты изменяет
окраску индикаторов. Диссоциация
происходит ступенчато:
Н3РО4———>Н++Н2РО4Н2РО-4———> Н++НРО42НРО42- ———> Н++РО43Легче всего идет диссоциация по первой
ступени и труднее всего — по третьей
32.
Химические свойства ортофосфорной кислотыобщие с другими кислотами
2. Реагирует с металлами, расположенными в
вытеснительном ряду до водорода:
6Nа+2Н3РО4 ———>2Nа3РО4+ЗН2
3. Реагирует с основными оксидами:
ЗСаО+2Н3РО4 ———>Са3(РО4)2+ЗН2О
33.
Химические свойства ортофосфорной кислотыобщие с другими кислотами
4. Реагирует с основаниями и аммиаком; если
кислота взята в избытке, то образуются кислые
соли:
Н3РО4+3NaОН ———>Nа3РО4+ЗН2О
Н3РО4+2NН3———>(NН4)2НРО4
Н3РО4+NаОН ———>NаН2РО4+Н2О
5. Реагирует с солями слабых кислот:
2Н3РО4+ЗNа2СО3 ——>2Nа3РО4+ЗСО2+ЗН2О
34.
Химические свойства ортофосфорной кислотыспецифические
1.При нагревании постепенно превращается в
метафосфорную кислоту:
2Н3Р04 ———>Н4Р207+Н20
(двуфосфорная кислота)
Н4Р2О7 ———>2НРО3+Н2О
35.
Качественная реакцияна фосфат-ион РО43• Н3РО4+ЗАgNО3———> Ag3P04+3HN03
желтый осадок
• РО43- + 3 Ag+ = Ag3РО4 ↓ (желтый
фосфат серебра)
• Полученный осадок растворяется
в сильных кислотах.
• По этому признаку его можно
отличить от других
нерастворимых солей серебра
желтого цвета – AgI, AgBr
36.
Соли фосфорной кислоты3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
Фосфаты являются хорошими удобрениями, которые повышают
урожайность.
Перечислим наиболее значимые:
Фосфоритная мука - Ca3(PO4)2
Простой суперфосфат - смесь Ca(H2PO4)2 • H2O и CaSO4
Двойной суперфосфат - Ca(H2PO4)2 • 2H2O
Дигидрофосфат аммония ( Аммофос) - в основном состоит из
моноаммонийфосфата - NH4H2PO4
Гидрофосфат аммония – (NH4) 2HPO4 с (NH4) 2SO4 и другими
примесями
Костная мука - продукт переработки костей домашних
животных Ca3(PO4)2
Преципитат - CaHPO4 • 2H2O
37.
Применение38.
ЗакреплениеОсуществите превращение согласно схеме:
P →P2O5 → Mg3(PO4)2 → MgCI2 → Mg(OH)2





































 Химия
Химия








