Похожие презентации:
Органическая химия. Теоретические основы органической химии
1.
Органическаяхимия
2.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫОРГАНИЧЕСКОЙ ХИМИИ
Часть I
2
3.
Органическая химия в рядудругих наук
Органическая химия вполне
может свести человека с ума.
Она создает у меня
впечатление девственного
тропического леса, полного
самых удивительных вещей;
из этой чудовищной и
безграничной чащи
невозможно выбраться и в
нее страшно войти.
Фридрих Велер (1835)
Фридрих Велер
(1800-1882)
3
4.
Органическая химия в рядудругих наук
4
5.
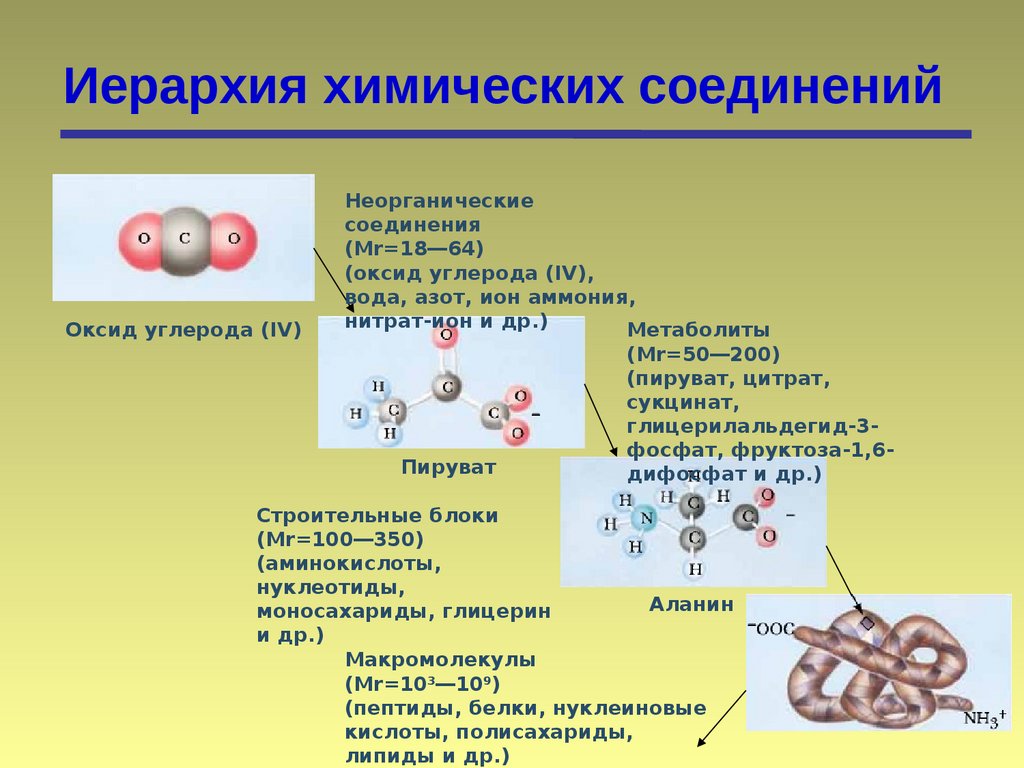
Иерархия химических соединенийОксид углерода (IV)
Неорганические
соединения
(Mr=18―64)
(оксид углерода (IV),
вода, азот, ион аммония,
нитрат-ион и др.)
Метаболиты
Пируват
(Mr=50―200)
(пируват, цитрат,
сукцинат,
глицерилальдегид-3фосфат, фруктоза-1,6дифосфат и др.)
Строительные блоки
(Mr=100―350)
(аминокислоты,
нуклеотиды,
Аланин
моносахариды, глицерин
и др.)
Макромолекулы
(Mr=103―109)
(пептиды, белки, нуклеиновые
кислоты, полисахариды,
липиды и др.)
5
6.
Предмет органической химииОрганическая химия — химия
соединений углерода.
Элементы Н, О, N, S,P, галогены –
называют органогенами.
органогенами
Органическая химия — химия
углеводородов и их производных.
6
7.
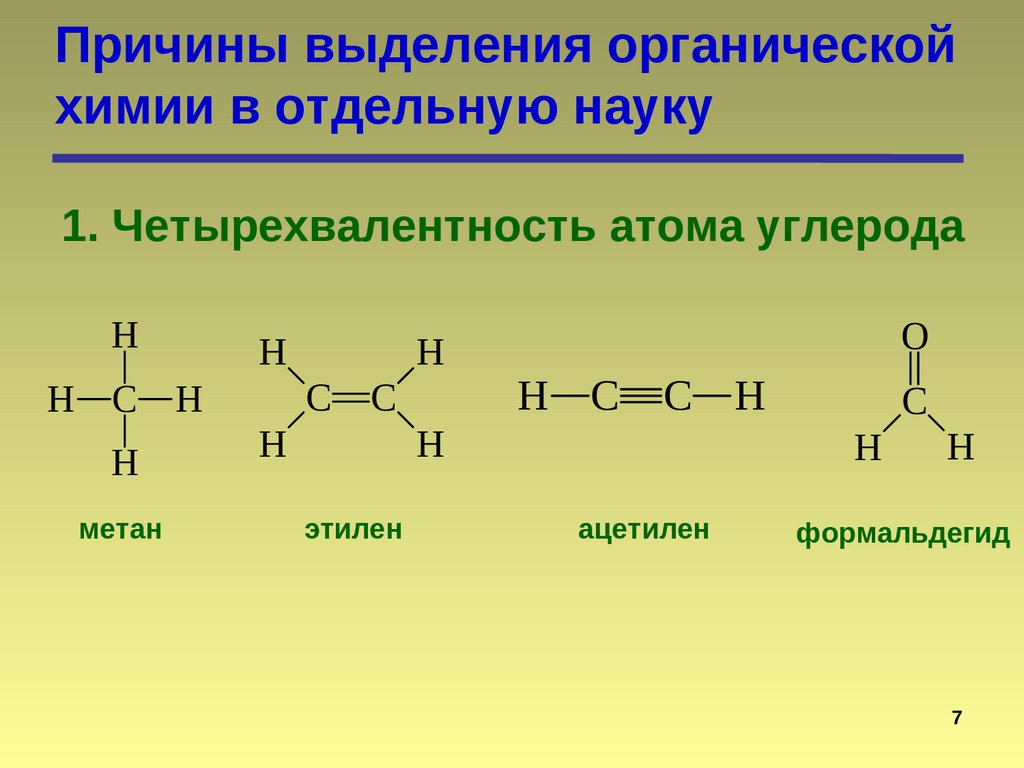
Причины выделения органическойхимии в отдельную науку
1. Четырехвалентность атома углерода
H
H C H
H
метан
H
H
C
C
этилен
H
H
O
H C
C H
ацетилен
H
C
H
формальдегид
7
8.
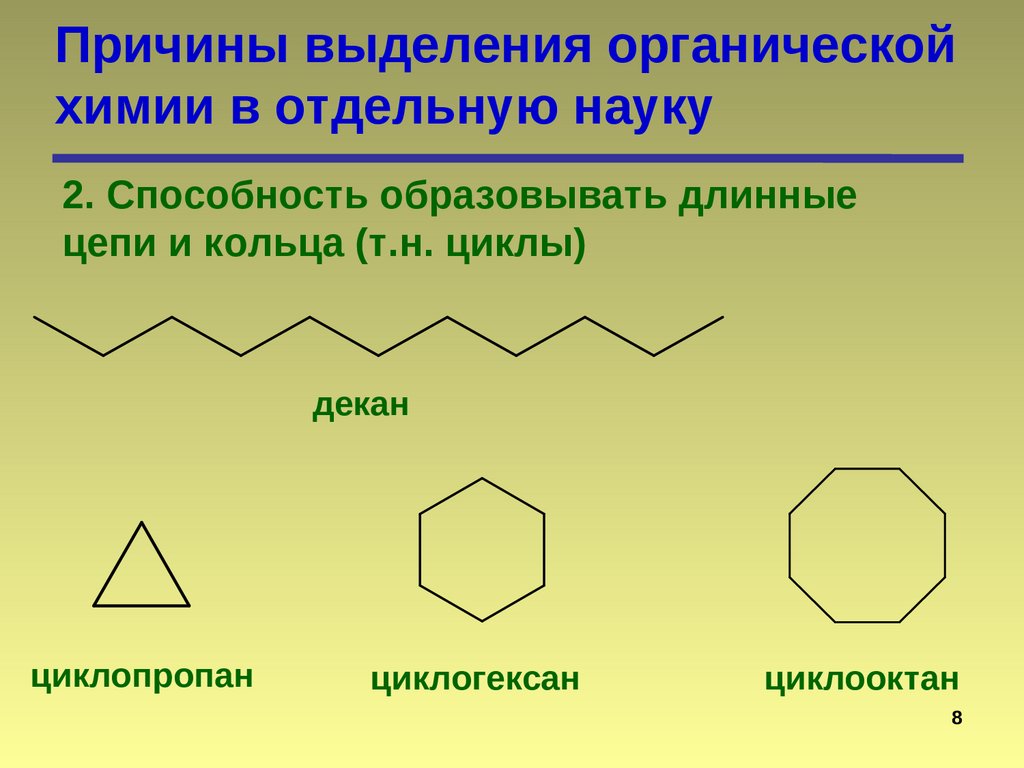
Причины выделения органическойхимии в отдельную науку
2. Способность образовывать длинные
цепи и кольца (т.н. циклы)
декан
циклопропан
циклогексан
циклооктан
8
9.
Причины выделения органическойхимии в отдельную науку
2. Способность образовывать длинные
цепи и кольца (т.н. циклы)
бензол
кубан
адамантан
9
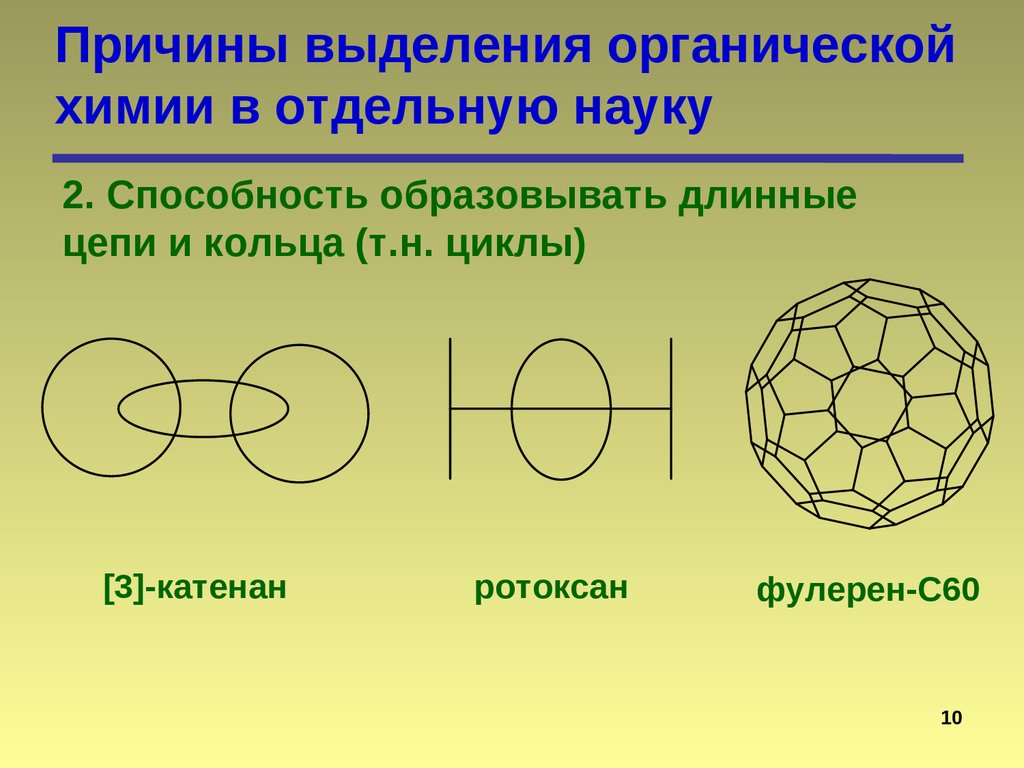
10.
Причины выделения органическойхимии в отдельную науку
2. Способность образовывать длинные
цепи и кольца (т.н. циклы)
[3]-катенан
ротоксан
фулерен-С60
10
11.
Причины выделения органическойхимии в отдельную науку
3. Способность образовывать устойчивые
или очень устойчивые связи с другими
элементами
11
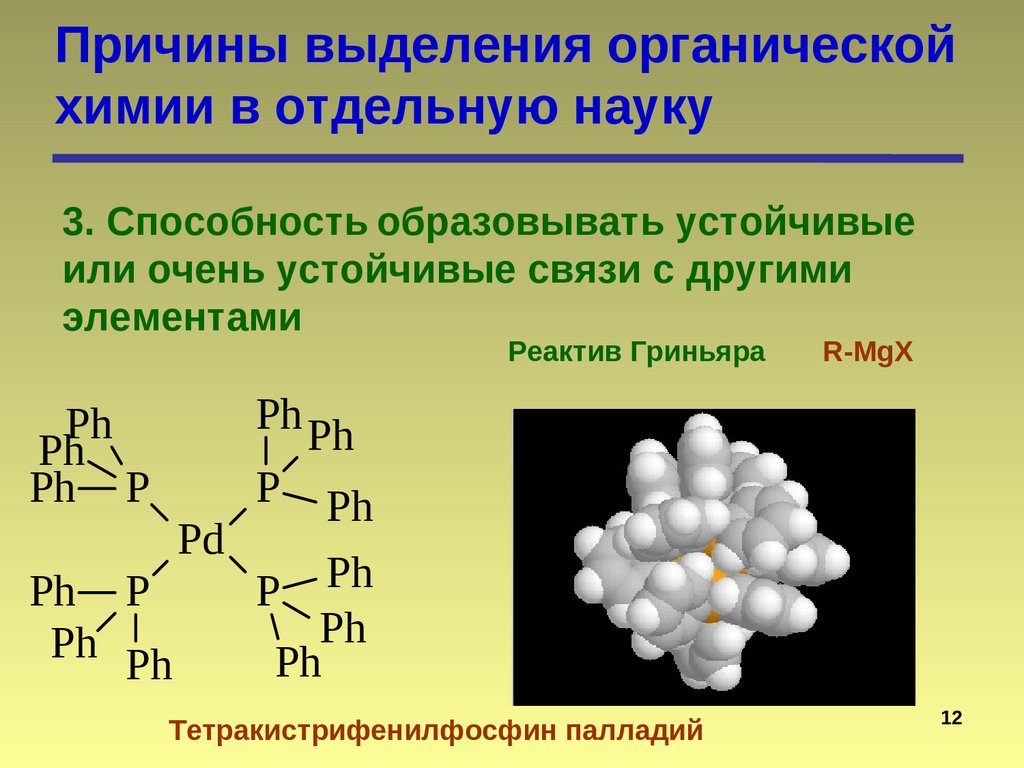
12.
Причины выделения органическойхимии в отдельную науку
3. Способность образовывать устойчивые
или очень устойчивые связи с другими
элементами
Реактив Гриньяра
Ph
Ph
Ph P
R-MgX
Ph Ph
P
Ph
Pd
Ph P
P Ph
Ph
Ph Ph
Ph
Тетракистрифенилфосфин палладий
12
13.
Причины выделения органическойхимии в отдельную науку
4. Из всех элементов периодической
системы именно углерод играет главную и
определяющую роль в биологическом мире
13
14.
Многочисленность органическихсоединений
Chemical Abstract
Service (CAS)
http://www.cas.org
14
15.
Многочисленность органическихсоединений http://www.cas.org/cgi-bin/regreport.pl
15
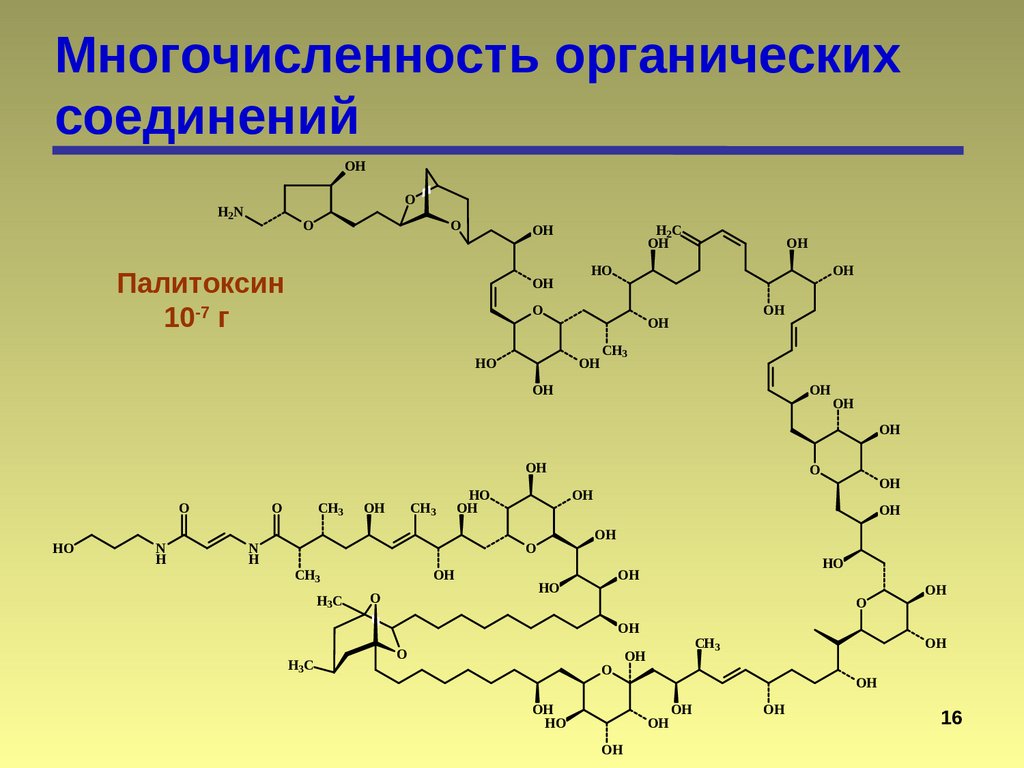
16.
Многочисленность органическихсоединений
OH
O
H2N
O
O
OH
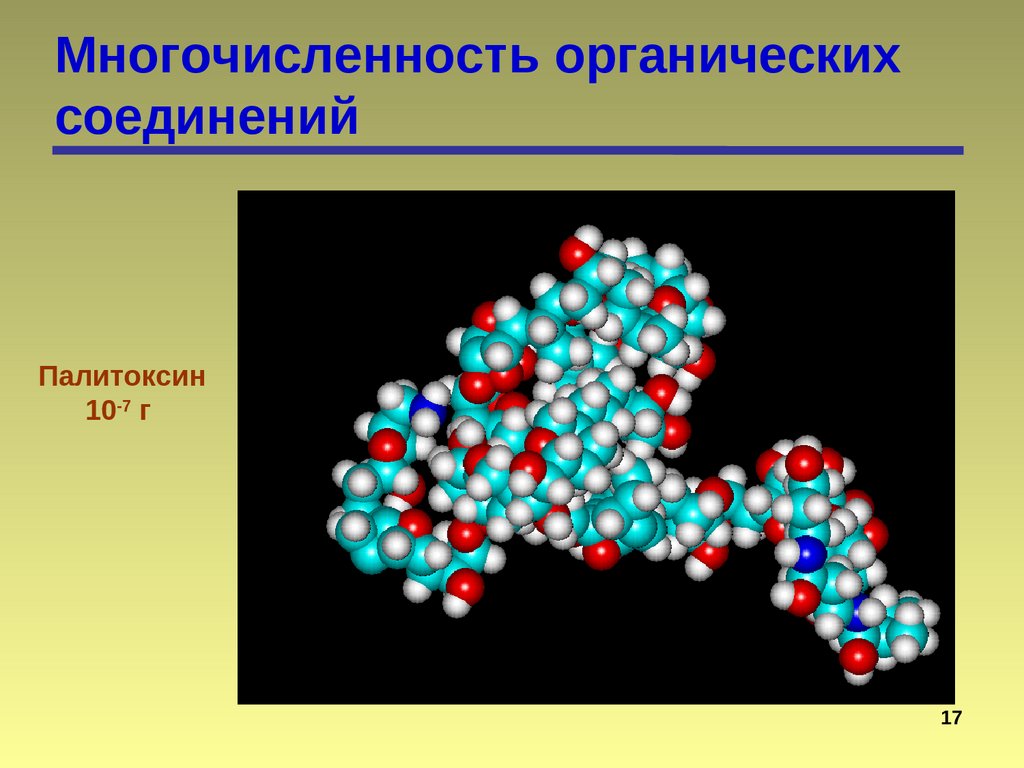
Палитоксин
10-7 г
OH
H2C
OH
HO
OH
O
HO
OH
OH
OH
OH
CH3
OH
OH
OH
OH
OH
O
HO
N
H
O
N
H
CH3
OH
CH3
HO
OH
H3C
OH
O
OH
OH
HO
OH
HO
O
OH
H3C
OH
OH
O
CH3
O
O
O
OH
HO
CH3
OH
OH
OH
OH
OH
OH
OH
OH
16
17.
Многочисленность органическихсоединений
Палитоксин
10-7 г
17
18.
Многочисленность органическихсоединений
Итак, богатство и разнообразие
мира органических соединений
является первой и важной
причиной выделения
органической химии в
самостоятельную науку.
18
19.
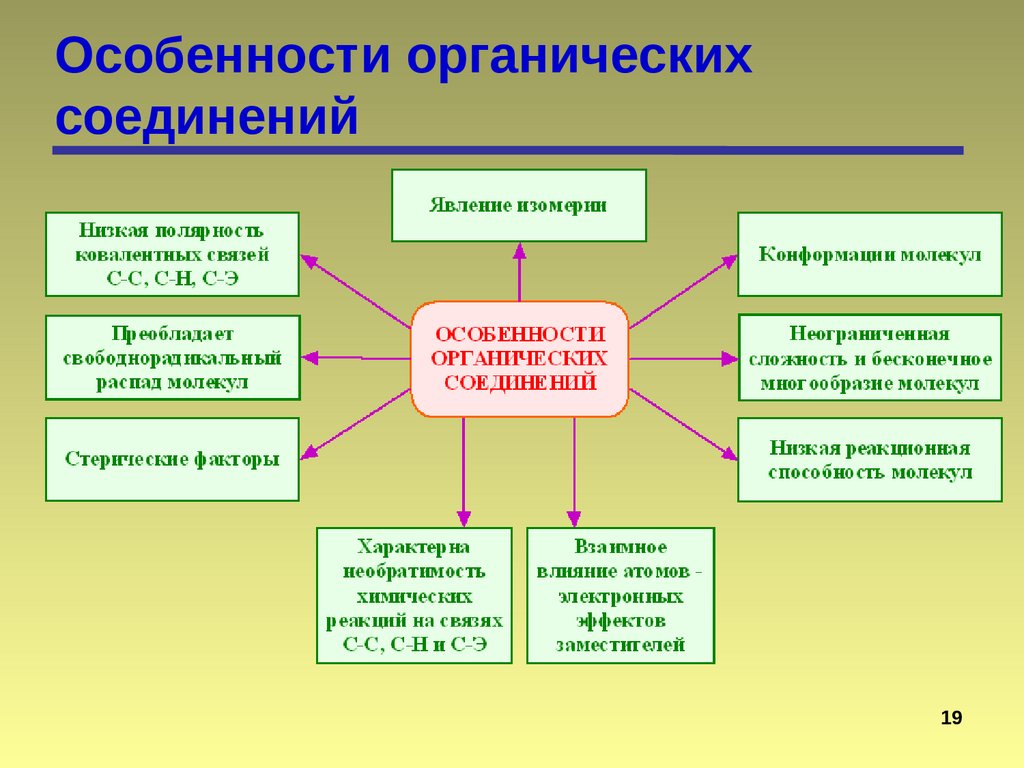
Особенности органическихсоединений
19
20.
Источники органических соединений20
21.
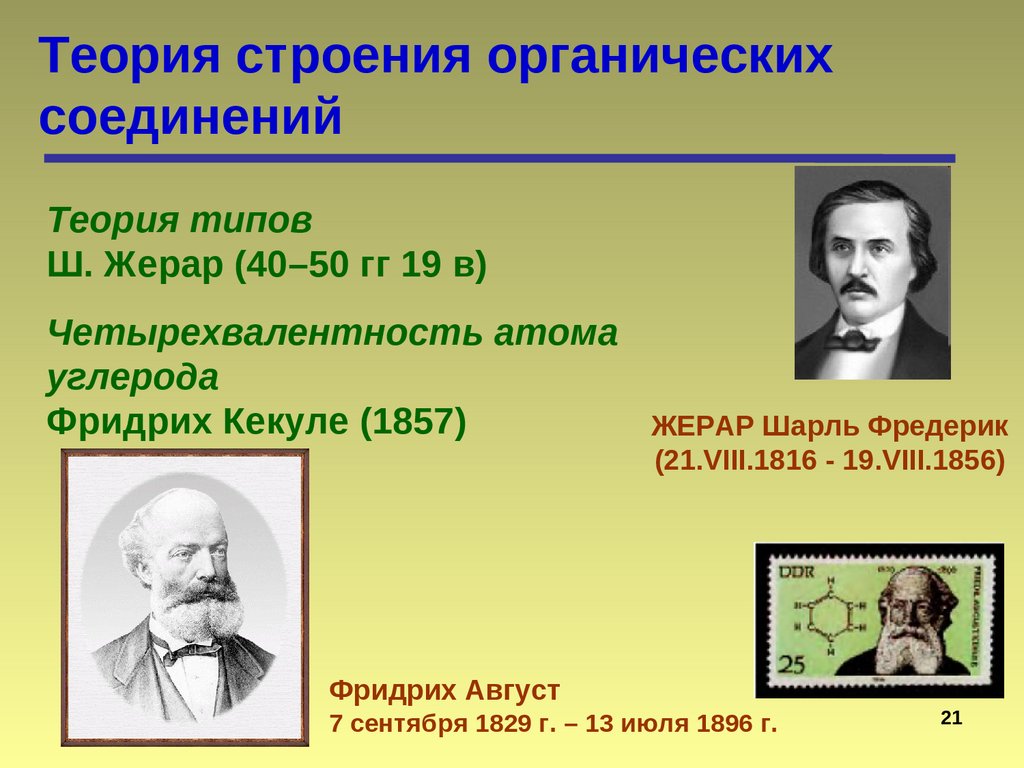
Теория строения органическихсоединений
Теория типов
Ш. Жерар (40–50 гг 19 в)
Четырехвалентность атома
углерода
Фридрих Кекуле (1857)
Фридрих Август
ЖЕРАР Шарль Фредерик
(21.VIII.1816 - 19.VIII.1856)
7 сентября 1829 г. – 13 июля 1896 г.
21
22.
Основные положения теории строенияорганических соединений (1861)
БУТЛЕРОВ
Александр Михайлович
3(15) сентября 1828 г. –
5(17) августа 1886 г. 22
23.
Основные положения теории строенияорганических соединений (1861)
1) атомы в молекулах соединены друг с
другом химическими связями в соответствии
с их валентностью;
2) атомы в молекулах органических веществ
соединяются между собой в определенной
последовательности, что обусловливает
химическое строение молекулы;
3) свойства органических соединений зависят
не только от числа и природы входящих в их
состав атомов, но и от химического строения
23
молекул;
24.
Основные положения теории строенияорганических соединений (1861)
4) в молекулах существует взаимное
влияние атомов как связанных, так и
непосредственно друг с другом не
связанных;
5) химическое строение вещества можно
определить в результате изучения его
химических превращений и, наоборот, по
строению вещества можно характеризовать
его свойства.
24
25.
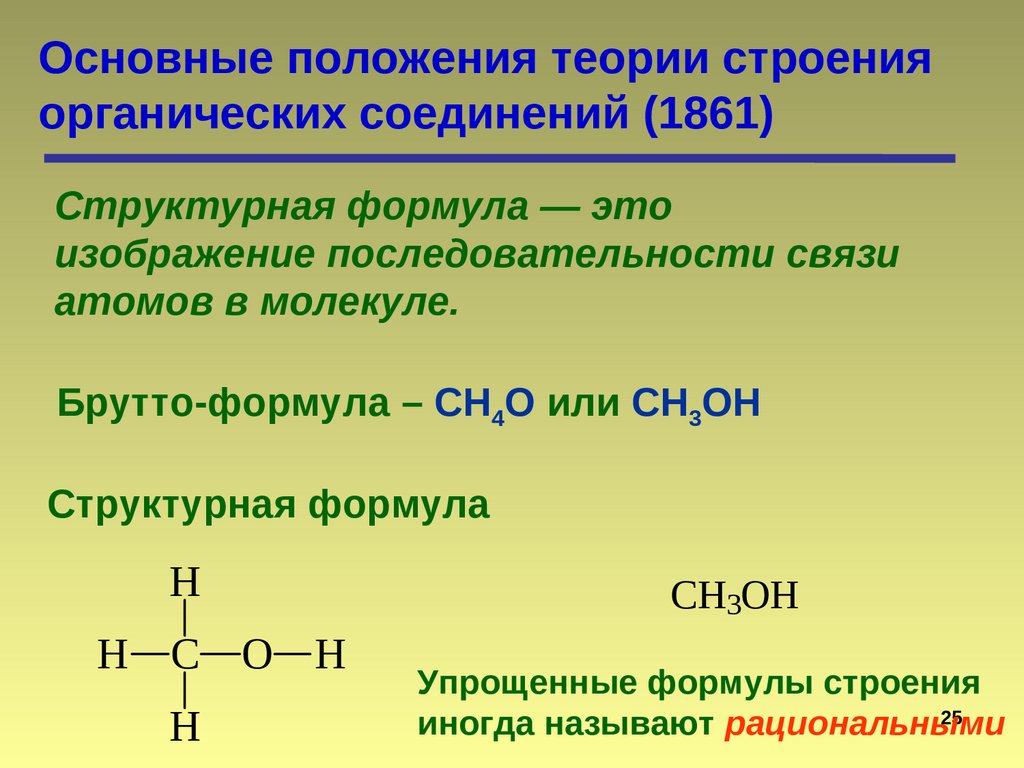
Основные положения теории строенияорганических соединений (1861)
Структурная формула — это
изображение последовательности связи
атомов в молекуле.
Брутто-формула – СН4О или CH3OH
Структурная формула
H
H C O H
H
CH3OH
Упрощенные формулы строения
25
иногда называют рациональными
26.
Структурные формулыH3C CH2 CH2 CH3
н-бутан
CH3 CH2 OH
OH
этиловый спирт
26
27.
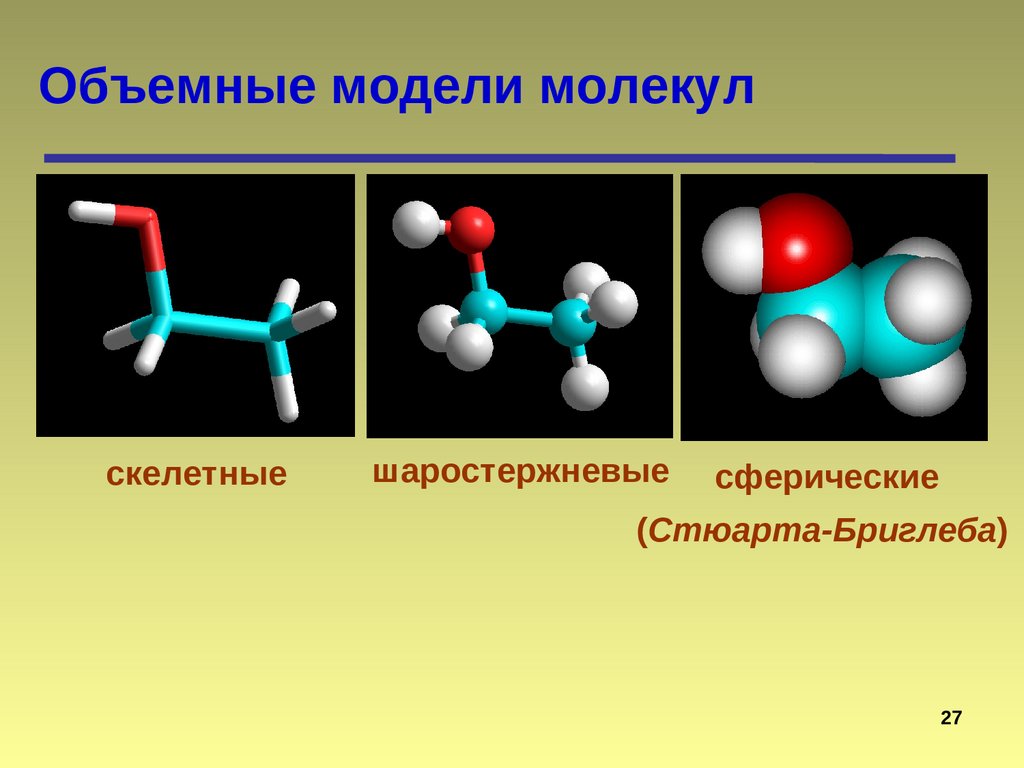
Объемные модели молекулскелетные
шаростержневые
сферические
(Стюарта-Бриглеба)
27
28.
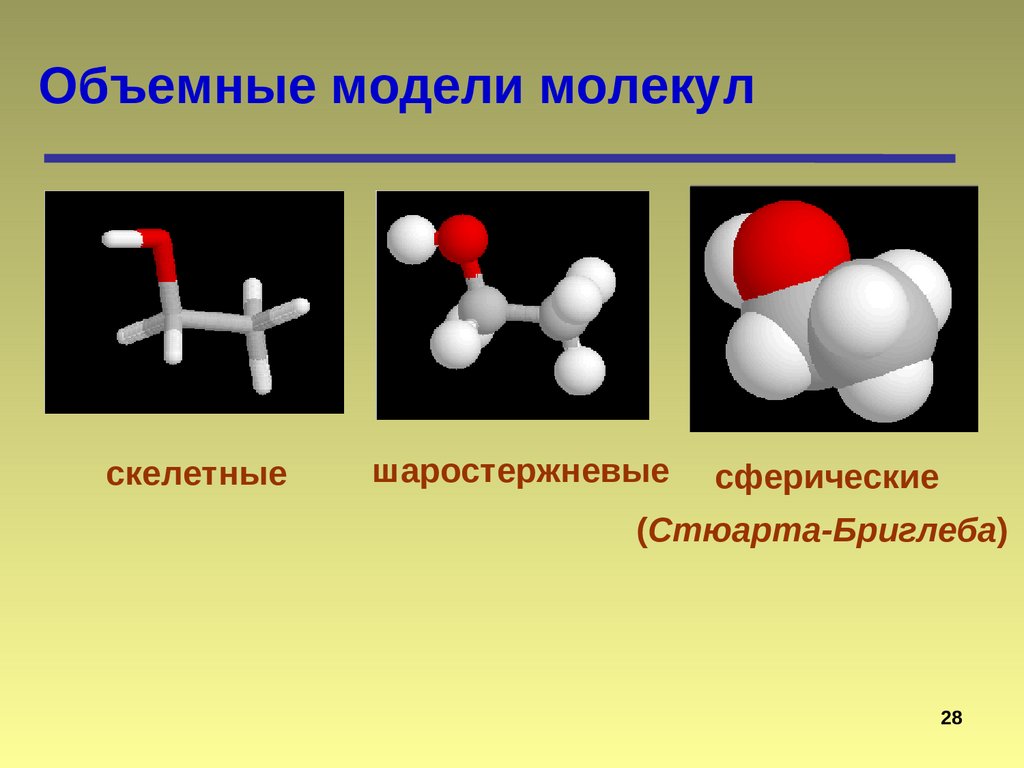
Объемные модели молекулскелетные
шаростержневые
сферические
(Стюарта-Бриглеба)
28
29.
Функциональная группаФункциональная группа – атом или группа
определенным способом связанных атомов,
наличие которой в молекуле органического
вещества придает ему характерные
свойства и определяет его принадлежность
к тому или иному классу соединений.
O
CH3 C
O
OH
уксусная кислота
C
OH
бензойная кислота
H2N
CH2 C
O
OH
глицин (аминокислота)
29
30.
ИзомерияС 2Н 6О
H H
H C C O H
H H
этиловый спирт
Ткип= 78 С
H
H
H C O C H
H
H
диметиловый эфир
Ткип= -24 С
30
31.
ИзомерияИзомерия (от греч. isos — равный)
С4Н10
CH3
H3C CH2 CH2 CH3
н-бутан
Ткип= -0,5 С
H3C
CH CH3
изобутан
Ткип= -11,7 С
31
32.
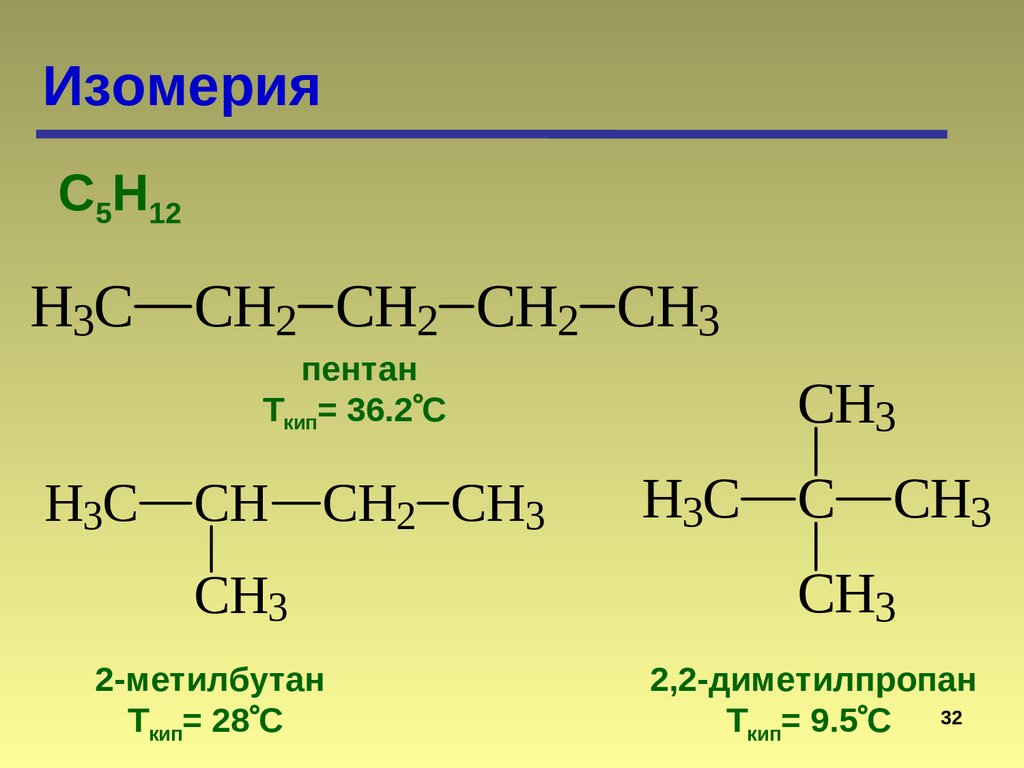
ИзомерияС5Н12
H3C CH2 CH2 CH2 CH3
пентан
Ткип= 36.2 С
H3C CH CH2 CH3
CH3
2-метилбутан
Ткип= 28 С
CH3
H3C
C
CH3
CH3
2,2-диметилпропан
Ткип= 9.5 С 32
33.
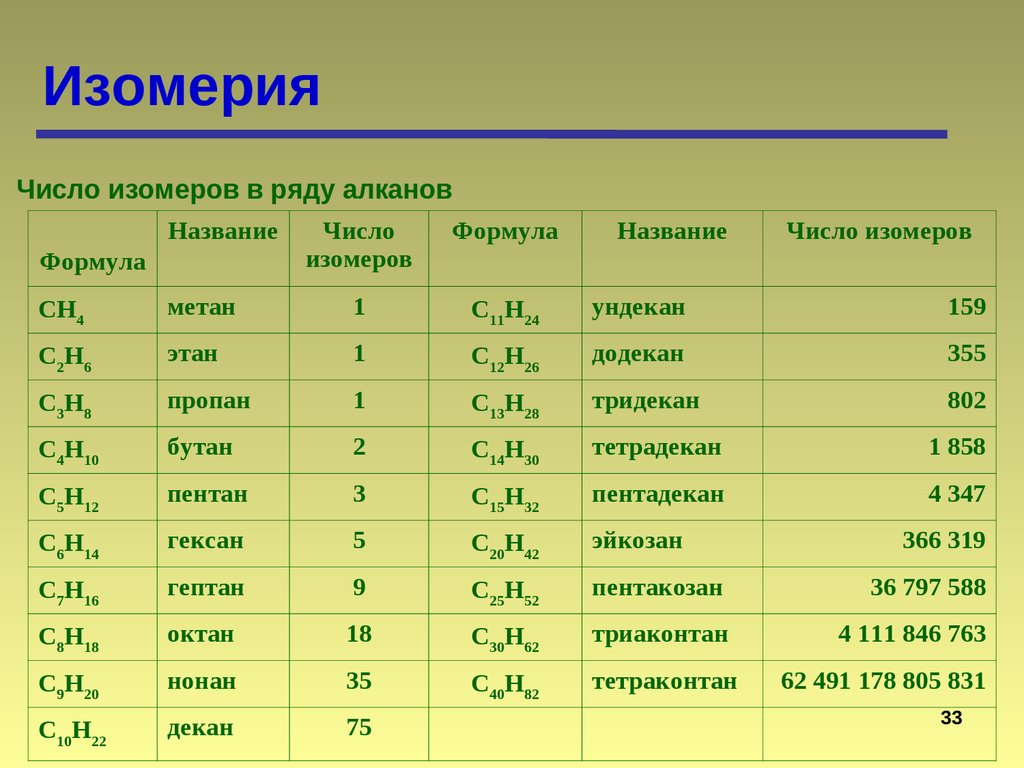
ИзомерияЧисло изомеров в ряду алканов
Формула
Название
Число
изомеров
Формула
Название
Число изомеров
CH4
метан
1
C11H24
ундекан
159
C2 H6
этан
1
C12H26
додекан
355
C3 H8
пропан
1
C13H28
тридекан
802
C4H10
бутан
2
C14H30
тетрадекан
1 858
C5H12
пентан
3
C15H32
пентадекан
4 347
C6H14
гексан
5
C20H42
эйкозан
C7H16
гептан
9
C25H52
пентакозан
36 797 588
C8H18
октан
18
C30H62
триаконтан
4 111 846 763
C9H20
нонан
35
C40H82
тетраконтан
62 491 178 805 831
C10H22
декан
75
366 319
33
34.
ИзомерияИзомеры — это вещества,
которые имеют одинаковую
молекулярную формулу, но
различное химическое строение,
а поэтому обладают разными
свойствами.
34
35.
ИзомерияИЗОМЕРИЯ
С тр ук тур н а я
П р о с тр а н с тв е н н а я
У г л е ро д н о г о с к е л е та
О п ти ч е с к ая
П о л о ж е н и я ф ун к ц и о н ал ь н о й
г руп п ы и л и к ратн ы х с в язе й
В ал е н тн ая
Г е о м е три ч е с к ая
35
36.
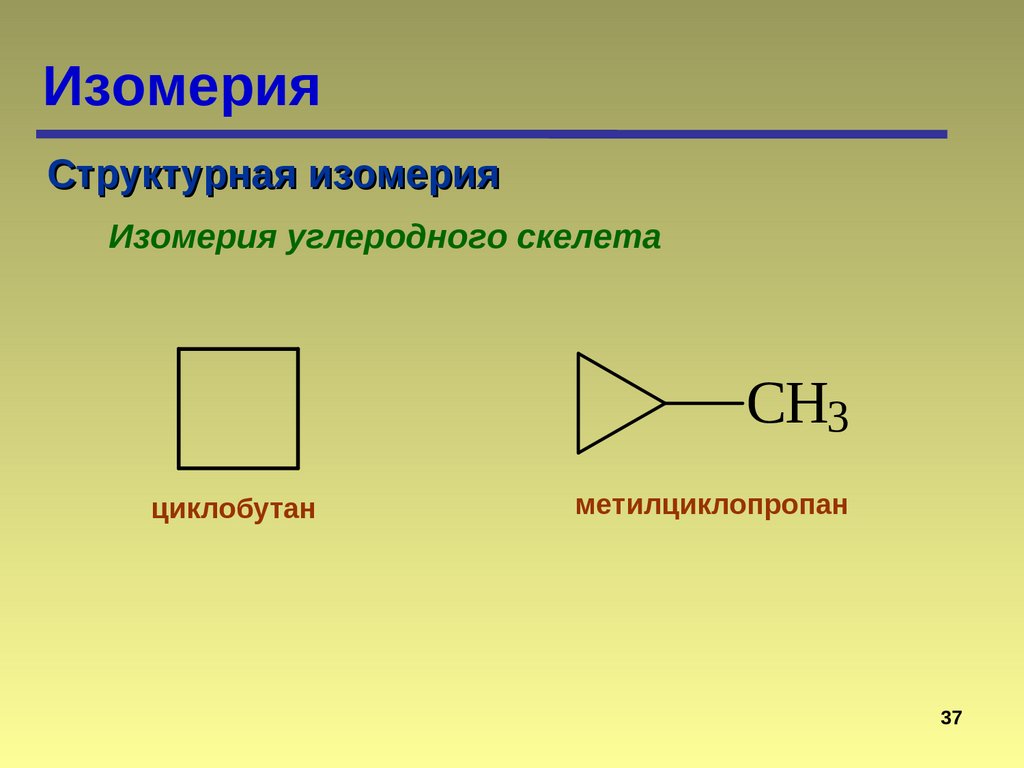
ИзомерияСтруктурная изомерия
Изомерия углеродного скелета
CH3
циклобутан
метилциклопропан
37
37.
ИзомерияСтруктурная изомерия
Изомерия положения функциональной группы
CH3CH2CH2CH2OH
CH3CHCH2CH3
OH
бутан-1-ол
бутан-2-ол
CH2 CHCH3CH3
CH3CH CHCH3
бут-1-ен
бут-2-ен
38
38.
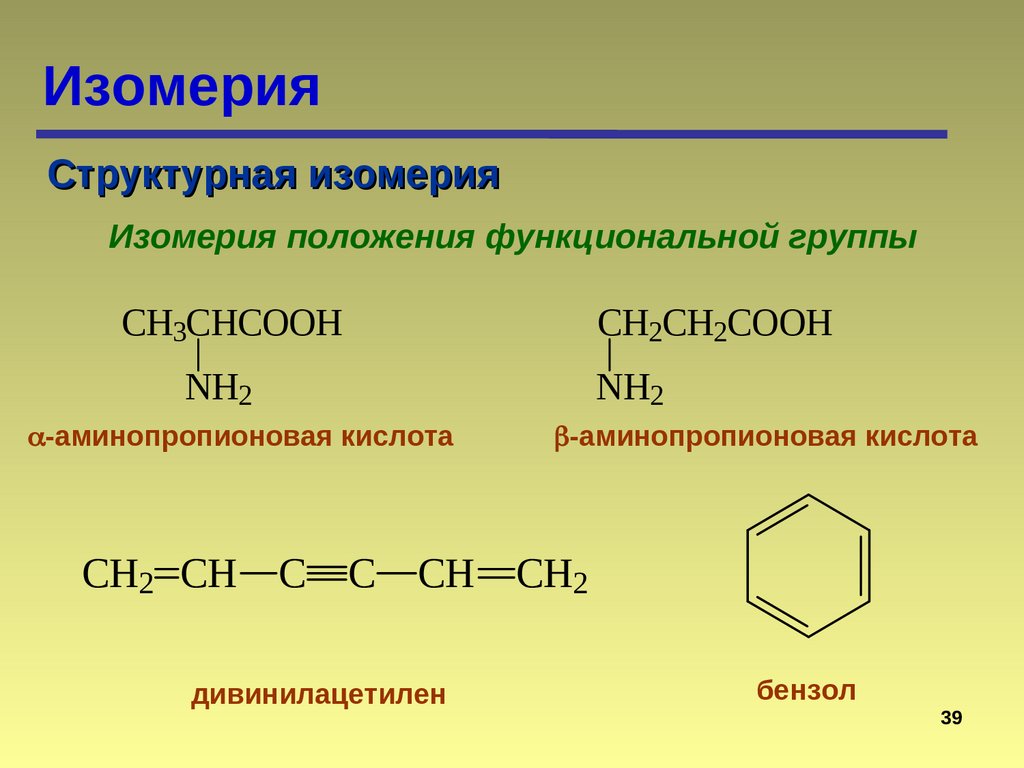
ИзомерияСтруктурная изомерия
Изомерия положения функциональной группы
CH2CH2COOH
CH3CHCOOH
NH2
NH2
-аминопропионовая кислота
-аминопропионовая кислота
CH2 CH C C CH CH2
дивинилацетилен
бензол
39
39.
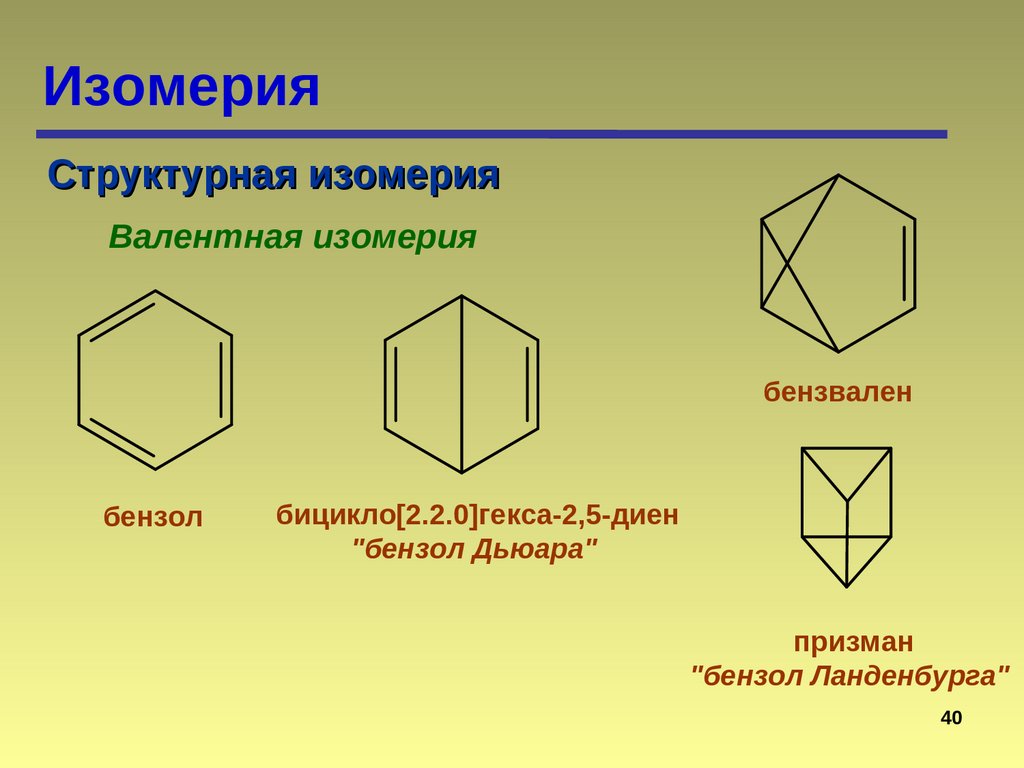
ИзомерияСтруктурная изомерия
Валентная изомерия
бензвален
бензол
бицикло[2.2.0]гекса-2,5-диен
"бензол Дьюара"
призман
"бензол Ланденбурга"
40
40.
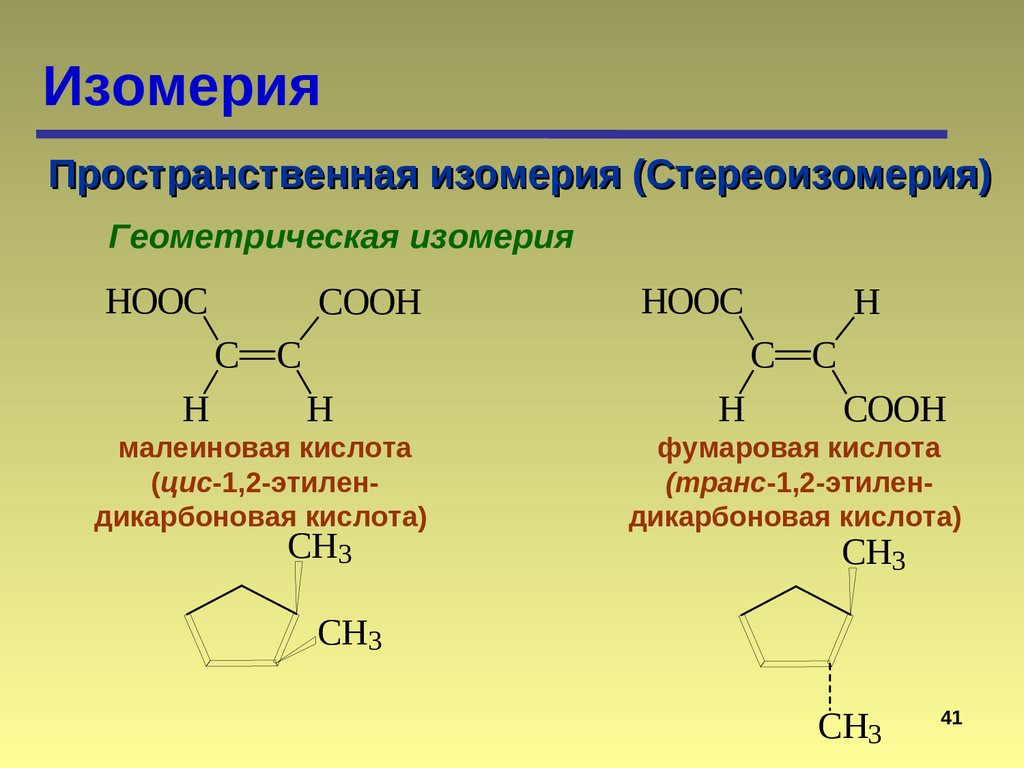
ИзомерияПространственная изомерия (Стереоизомерия)
Геометрическая изомерия
HOOC
COOH
C
H
HOOC
C
H
C C
H
малеиновая кислота
(цис-1,2-этилендикарбоновая кислота)
CH3
H
COOH
фумаровая кислота
(транс-1,2-этилендикарбоновая кислота)
CH3
CH3
CH3
41
41.
ИзомерияПространственная изомерия (Стереоизомерия)
Геометрическая изомерия
HOOC
COOH
C
H
HOOC
C
H
C C
H
малеиновая кислота
(цис-1,2-этилендикарбоновая кислота)
H
COOH
фумаровая кислота
(транс-1,2-этилендикарбоновая кислота)
42
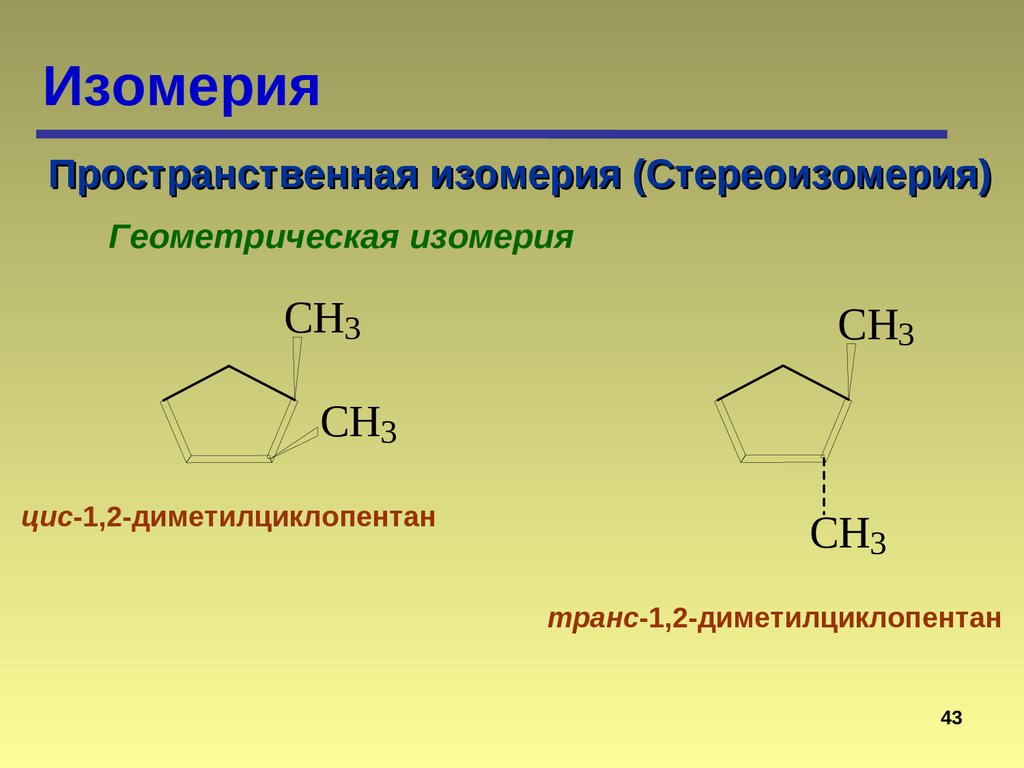
42.
ИзомерияПространственная изомерия (Стереоизомерия)
Геометрическая изомерия
CH3
CH3
CH3
цис-1,2-диметилциклопентан
CH3
транс-1,2-диметилциклопентан
43
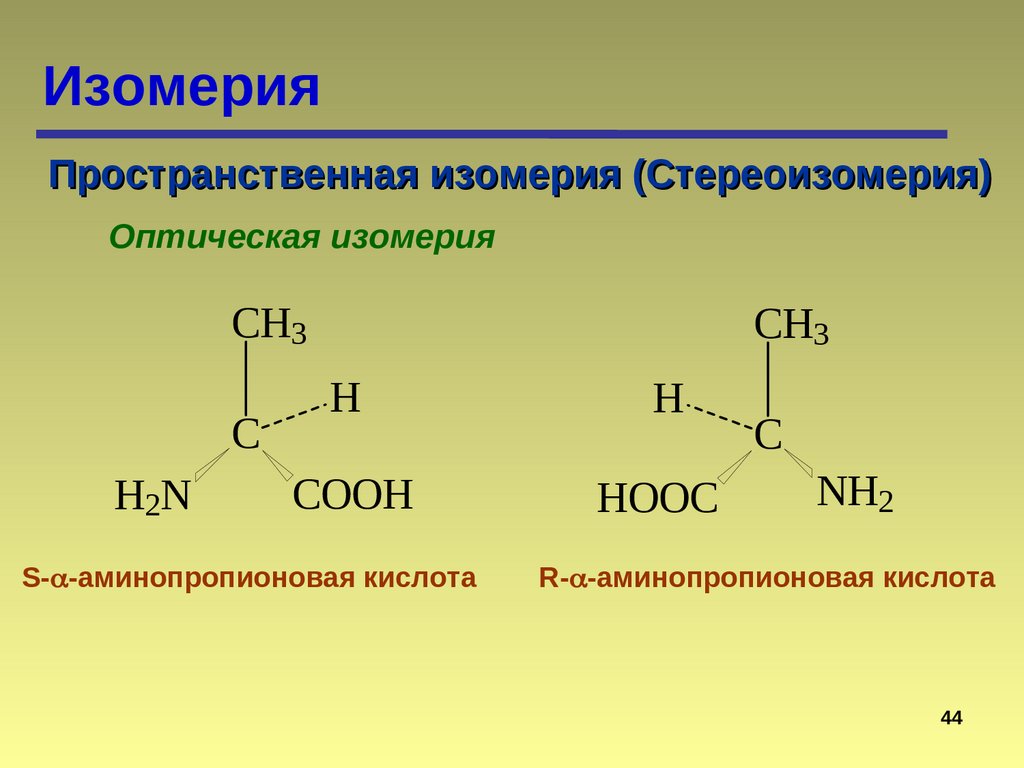
43.
ИзомерияПространственная изомерия (Стереоизомерия)
Оптическая изомерия
CH3
C
H2N
CH3
H
H
COOH
HOOC
S- -аминопропионовая кислота
C
NH2
R- -аминопропионовая кислота
44
44.
ИзомерияПространственная изомерия (Стереоизомерия)
Оптическая изомерия
S- -аминопропионовая кислота
R- -аминопропионовая кислота
Изомерия — одно из наиболее своеобразных
проявлений специфики и особенности
органической химии
45
45.
ГомологияГруппы органических соединений
однотипной структуры с одинаковой
функциональными группами,
отличающиеся друг от друга по
количеству групп CH2 в углеродной цепи,
составляют гомологический ряд.
Гомологический ряд метана
CH4 CH3CH3 CH3CH2CH3 CH3CH2CH2CH3
и т.д.
46
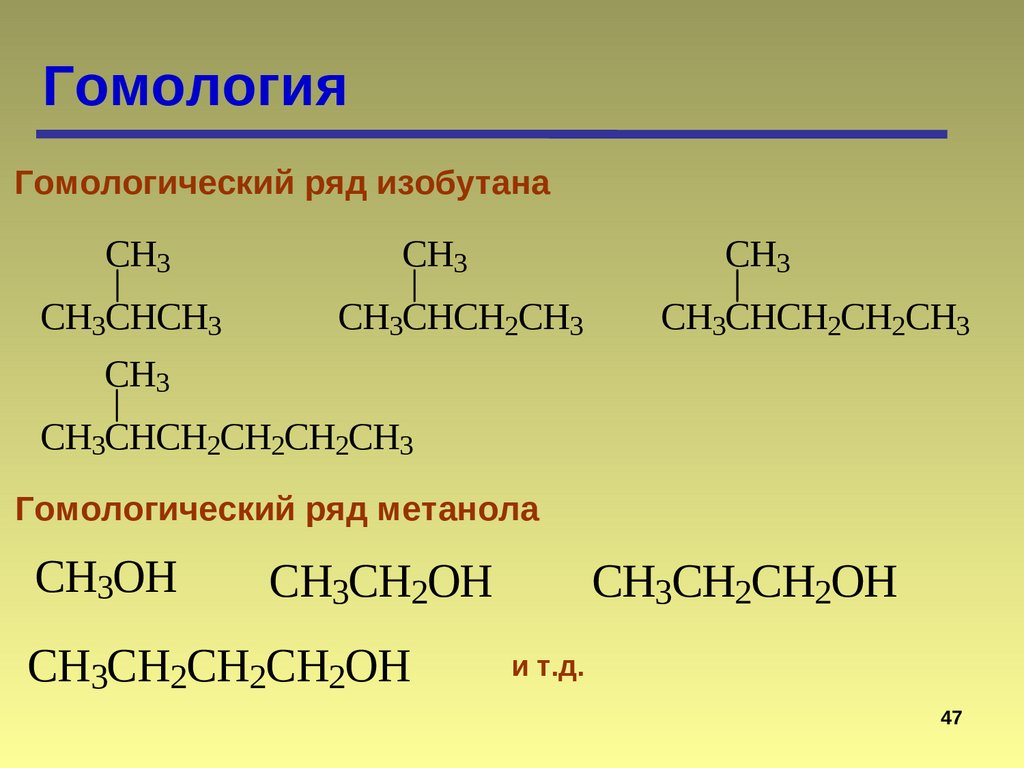
46.
ГомологияГомологический ряд изобутана
CH3
CH3
CH3
CH3CHCH3
CH3CHCH2CH3
CH3CHCH2CH2CH3
CH3
CH3CHCH2CH2CH2CH3
Гомологический ряд метанола
CH3OH
CH3CH2OH
CH3CH2CH2CH2OH
CH3CH2CH2OH
и т.д.
47
47.
Учение о взаимном влиянииатомов в молекуле
МАРКОВНИКОВ
Владимир Васильевич
1837–1904
48
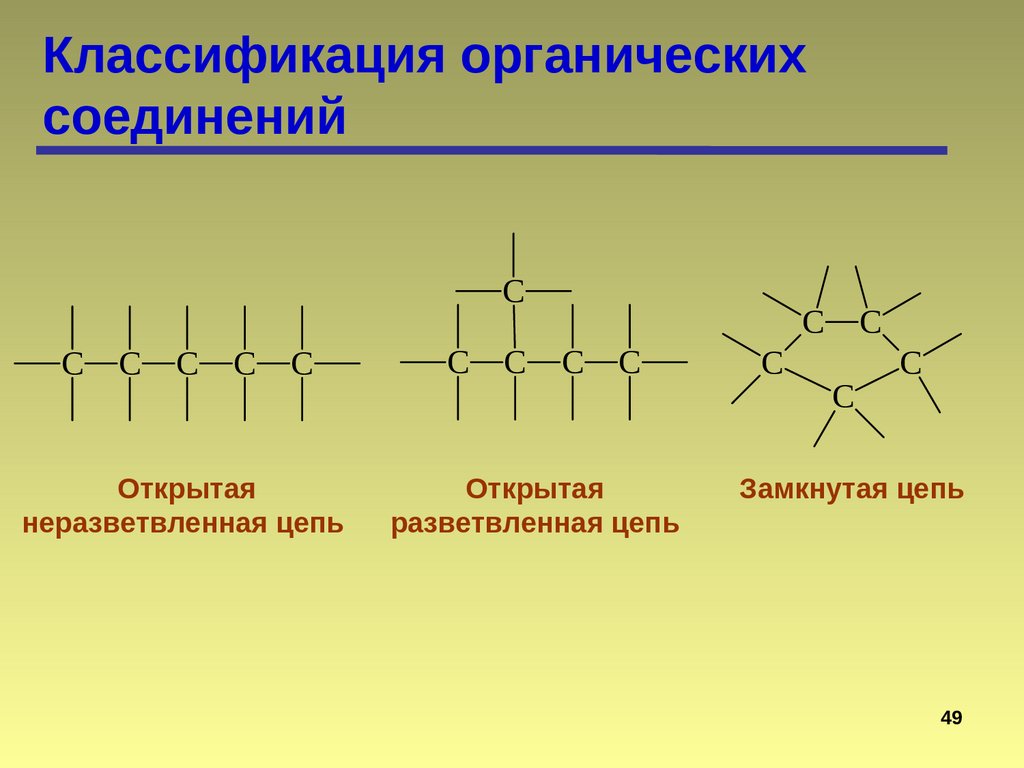
48.
Классификация органическихсоединений
C
C
C
C
C
C
Открытая
неразветвленная цепь
C C
C C
Открытая
разветвленная цепь
C
C C
C
C
Замкнутая цепь
49
49.
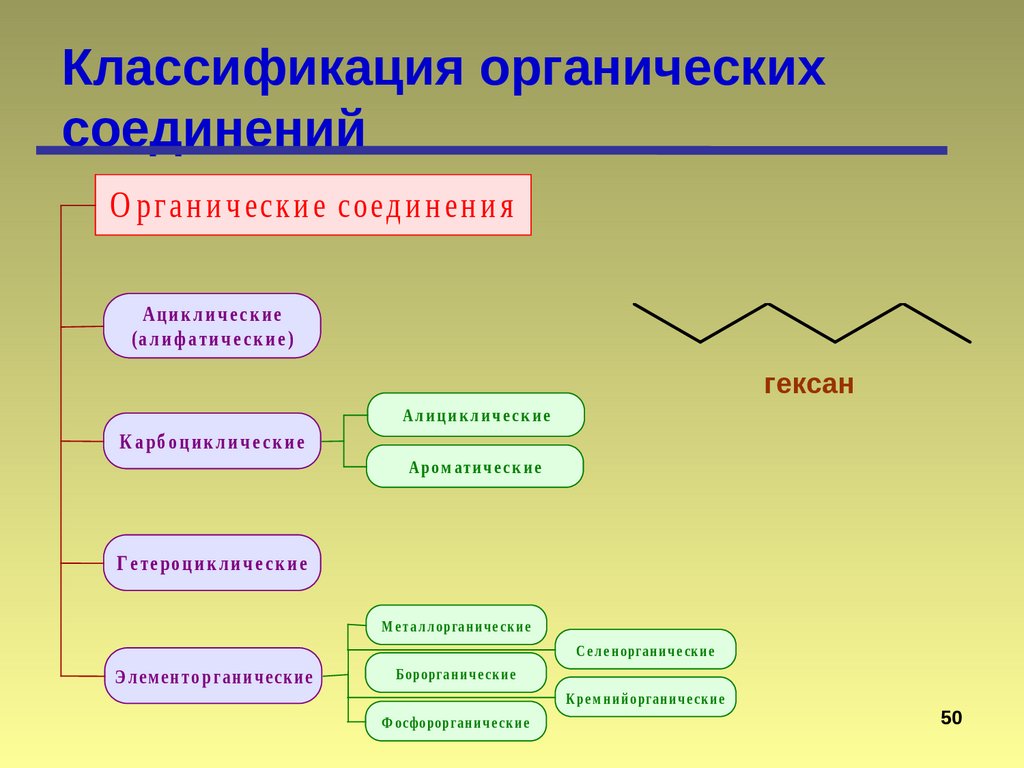
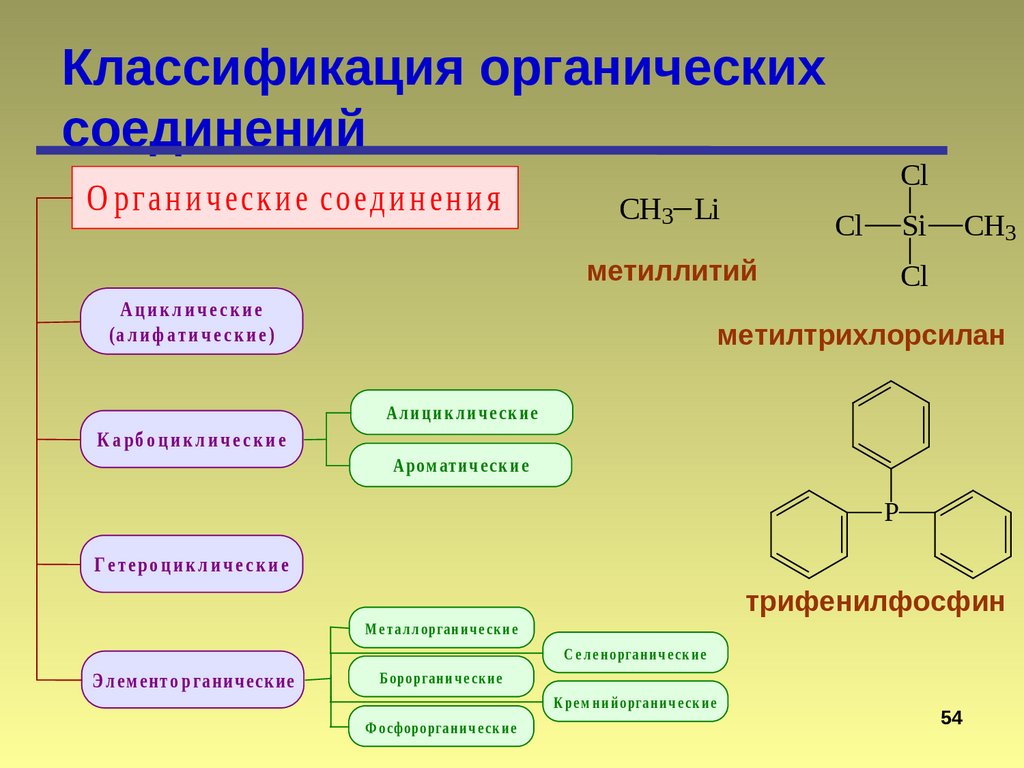
Классификация органическихсоединений
О рг а н и ч еск и е соед и н ен и я
Ациклические
(а л и ф а ти ч е с к и е )
гексан
К а рб о ц и к л и ч е с к и е
Ал и ц и к л и ч е с к и е
Аро м ати ч е с к и е
Г е те ро ц и к л и ч е с к и е
М е т а л л о рга н и ч е ск и е
С е л е н о рга н и ч е ск и е
Э л ем е н т о р га н и ч еск и е
Б о ро рга н и ч е ск и е
К ре м н и й о рга н и ч е ск и е
Ф о сфо ро рга н и ч е ск и е
50
50.
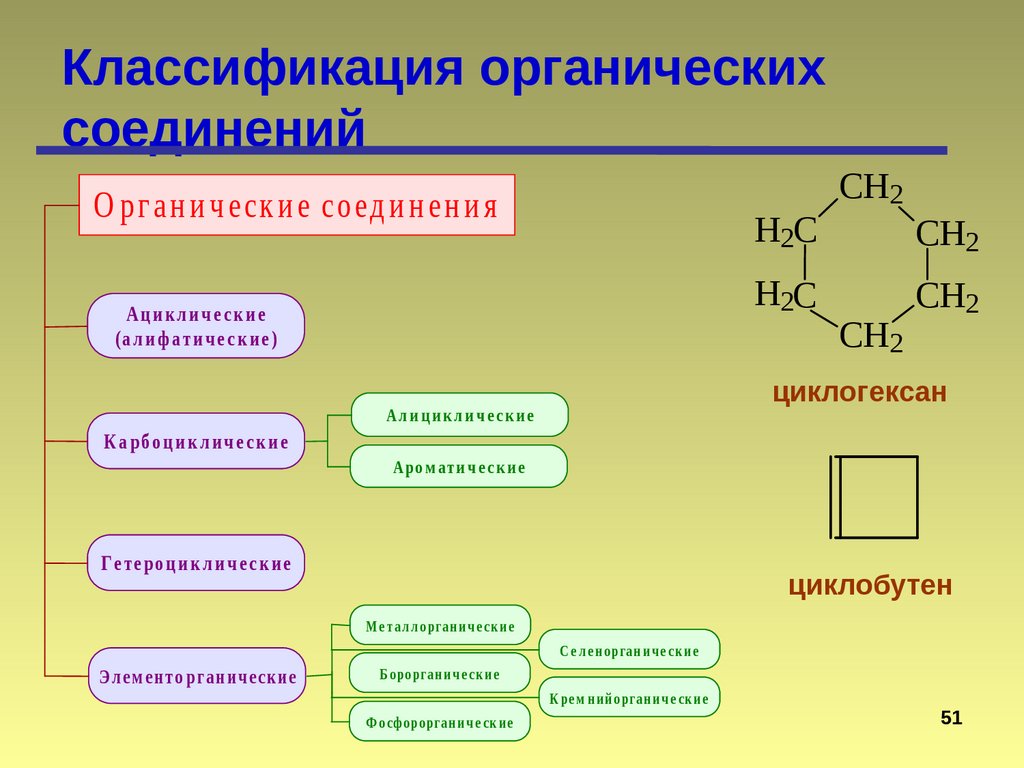
Классификация органическихсоединений
О рг а н и ч еск и е соед и н ен и я
H2C
H2C
Ациклические
(а л и ф а ти ч е с к и е )
К а рб о ц и к л и ч е с к и е
CH2
CH2
CH2
CH2
циклогексан
Ал и ц и к л и ч е с к и е
Аро м ати ч е с к и е
Г е те ро ц и к л и ч е с к и е
циклобутен
М е т а л л о рга н и ч е ск и е
С е л е н о рга н и ч е ск и е
Э л ем е нт о р га н и ч е ск ие
Б о ро рга н и ч е ск и е
К ре м н и й о рга н и ч е ск и е
Ф о сфо ро рга н и ч е ск и е
51
51.
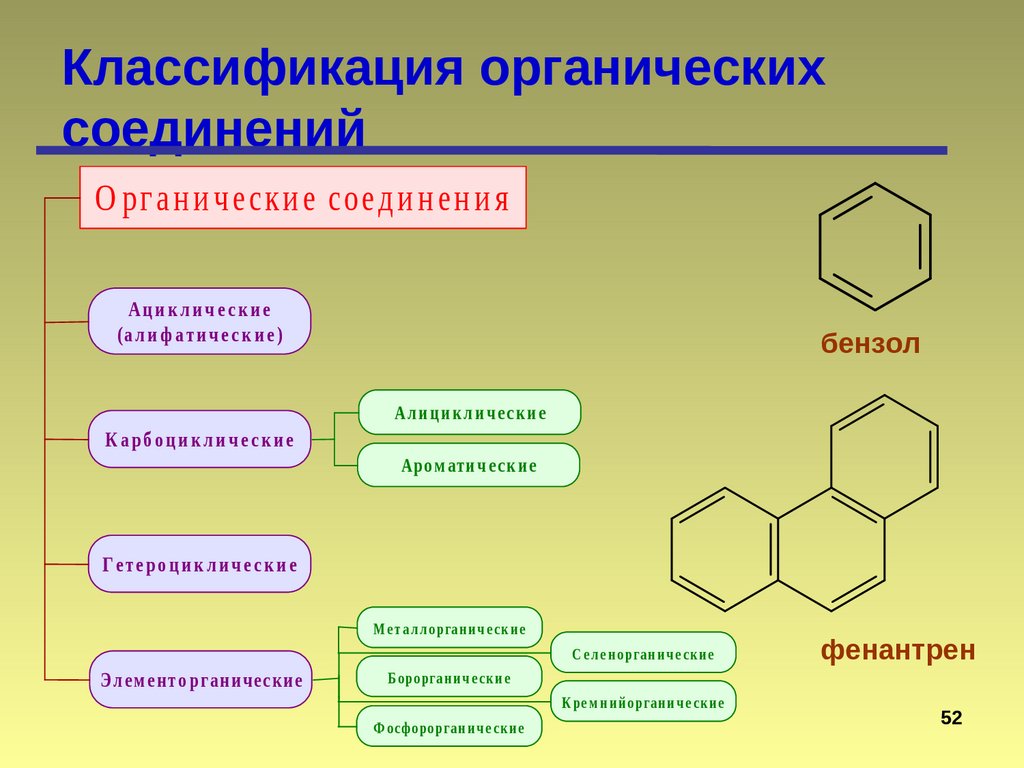
Классификация органическихсоединений
О рг а н и ч еск и е соед и н ен и я
Ациклические
(а л и ф а ти ч е с к и е )
бензол
Ал и ц и к л и ч е с к и е
К а рб о ц и к л и ч е с к и е
Аро м ати ч е с к и е
Г е те ро ц и к л и ч е с к и е
М е т а л л о рга н и ч е ск и е
С е л е н о рга н и ч е ск и е
Э л ем ен т о р га н и ч еск и е
Б о ро рга н и ч е ск и е
К ре м н и й о рга н и ч е ск и е
Ф о сф о ро рга н и ч е ск и е
фенантрен
52
52.
Классификация органическихсоединений
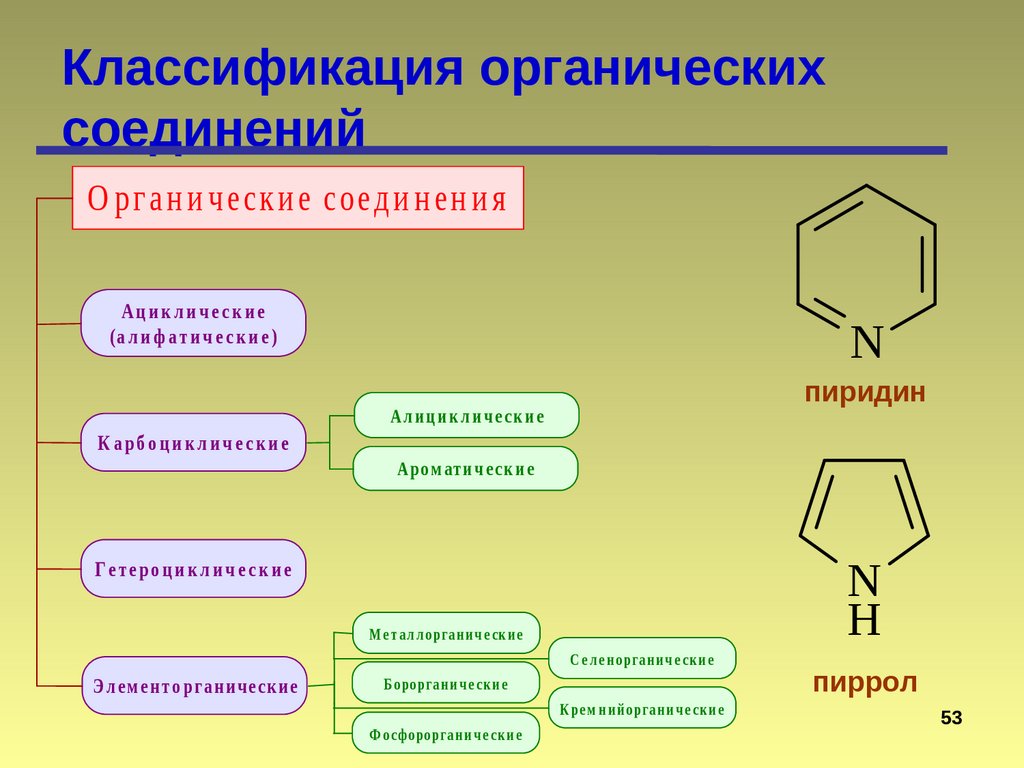
О рг а н и ч еск и е соед и н ен и я
Ациклические
(а л и ф а ти ч е с к и е )
К а рб о ц и к л и ч е с к и е
N
пиридин
Ал и ц и к л и ч е с к и е
Аро м ати ч е с к и е
Г е те ро ц и к л и ч е с к и е
М е т а л л о рга н и ч е ск и е
С е л е н о рга н и ч е ск и е
Э л е м ент о р га нич е ск ие
Б о ро рга н и ч е ск и е
К ре м н и й о рга н и ч е ск и е
Ф осфо ро рга н и ч е ск и е
N
H
пиррол
53
53.
Классификация органическихсоединений
О рг а н и ч еск и е соед и н ен и я
CH3 Li
Cl
Cl
Si
метиллитий
Ациклические
(а л и ф а ти ч е с к и е )
CH3
Cl
метилтрихлорсилан
Ал и ц и к л и ч е с к и е
К а рб о ц и к л и ч е с к и е
Аро м ати ч е с к и е
P
Г е те ро ц и к л и ч е с к и е
трифенилфосфин
М е т а л л о рга н и ч е ск и е
С е л е н о рга н и ч е ск и е
Э л ем ен т о р га н и ч еск и е
Б оро рга н и ч е ск и е
К ре м н и й о рган и ч е ск и е
Ф о сф о ро рга н и ч е ск и е
54
54.
Классификация органическихсоединений
55
55.
Классификация органическихсоединений
56
56.
Классификация органическихсоединений
57
57.
Классификация органическихсоединений
Соединения могут содержать не одну, а
несколько функциональных групп. Если эти
группы одинаковые, то соединения
называются полифункциональными.
CHCl3
хлороформ
CH2 CH CH2
OH OH OH
глицерин
58
58.
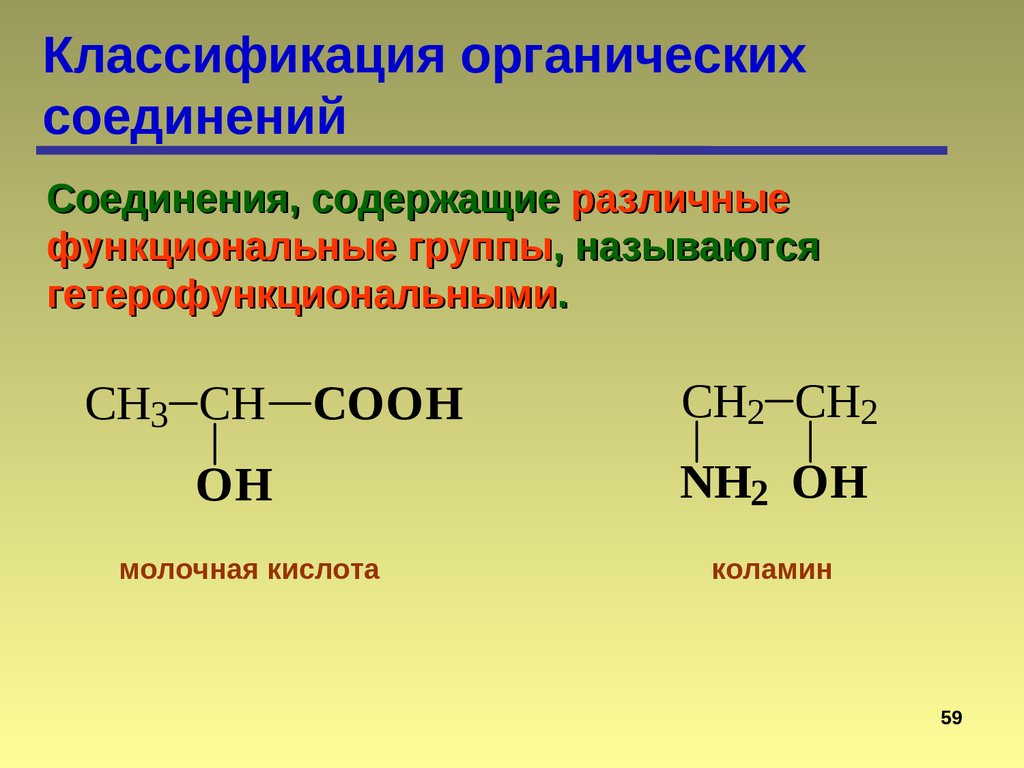
Классификация органическихсоединений
Соединения, содержащие различные
функциональные группы, называются
гетерофункциональными.
CH3 CH COOH
CH2 CH2
OH
NH2 OH
молочная кислота
коламин
59
59.
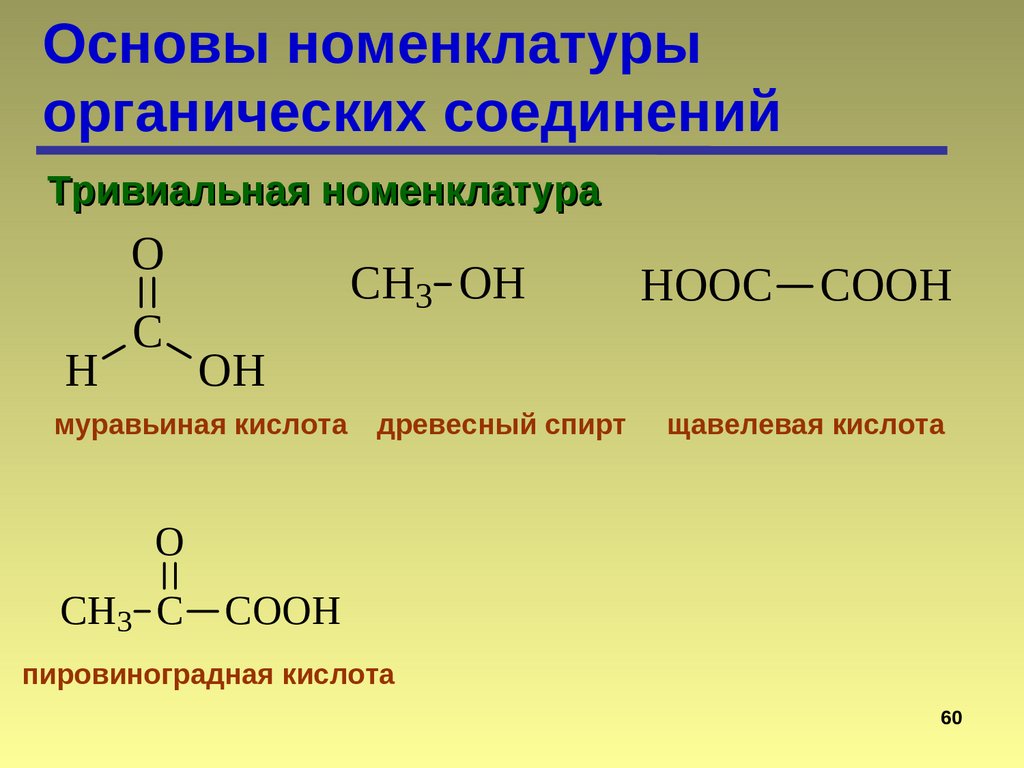
Основы номенклатурыорганических соединений
Тривиальная номенклатура
O
H
C
CH3 OH
HOOC
COOH
OH
муравьиная кислота
древесный спирт
щавелевая кислота
O
CH3 C COOH
пировиноградная кислота
60
60.
Основы номенклатурыорганических соединений
Тривиальная номенклатура
O
O
HN
NH
O
Барбитуровая кислота
31.10.1835 – 20.08.1917
Иоганн Фридрих Вильгельм Адольф фон Байер
61
61.
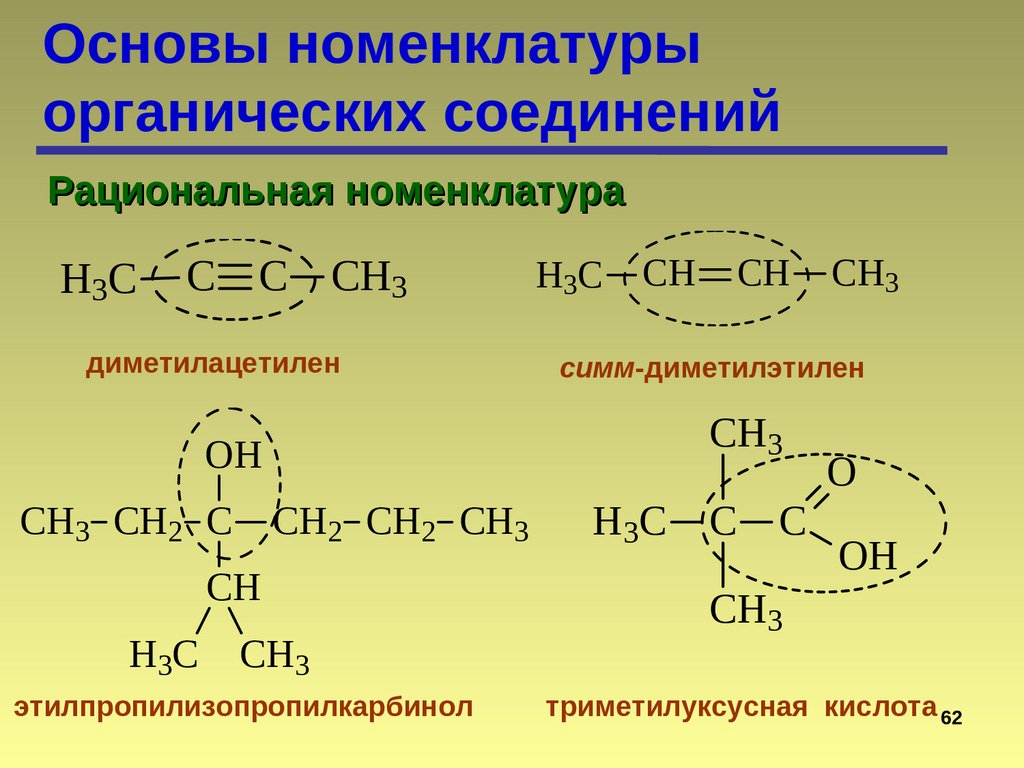
Основы номенклатурыорганических соединений
Рациональная номенклатура
H3C
C C
CH3
диметилацетилен
H 3C
CH
CH3
CH2 CH2 CH3
CH
H3C
CH3
этилпропилизопропилкарбинол
CH3
симм-диметилэтилен
OH
CH3 CH2 C
CH
H 3C
C
C
CH3
O
OH
триметилуксусная кислота 62
62.
Основы номенклатуры органическихсоединений
Заместительная номенклатура ИЮПАК
ИЮПАК [от английского названия Международного
союза чистой и прикладной химии — International
Union of Pure and Applied Chemistry (IUPAC)]
Систематические названия
составлены из слов, специально
созданных или выбранных для
описания структурных особенностей
соединения.
63
63.
Основы номенклатуры органическихсоединений
Заместительная номенклатура ИЮПАК
Характеристическая
группа
Префикс
Суффикс
—(C)OOH
—
-овая кислота
—COOH
карбокси-
-карбоновая кислота
—SO3H
сульфо-
-сульфокислота
—(C)H=O
оксо-
-аль
—CH=O
формил-
-карбальдегид
оксо-
-он
—OH
гидрокси-2
-ол
—SH
меркапто-
-тиол
—NH2
амино-
-амин
—NO2
ннтро-
—
—OR
алкокси-
—
фтор-, хлор-, бром-, иод-
—
C O
—F, —Cl, —Br, —I (Hal)
64
































 Химия
Химия








