Похожие презентации:
Производство алюминия электролизом криолито-глиноземного расплава
1. Производство алюминия электролизом криолито-глиноземного расплава
2.
Производство алюминия –ведущая подотрасль цветной металлургии:
- По объему производства и потреблению
- По уровню рентабильности
- По уровню получаемой прибыли
3.
Андреас Маргграф (18 век) - alumina
1825 г. – Ганс Эрстед
получил чистый Al
1808 г. – Хэмфри Дэви пытался получить
металлический алюминий
электролизом. Дал название «Al»
п
4. История
1854 год Анри Сент-Клер Девиль изобрёлпервый способ промышленного производства
алюминия, основанный на вытеснении Аl
металлическим Na из двойного хлорида
натрия и алюминия NaCl·AlCl3.
В 1855 году был получен первый слиток
металла.
С 1855 по 1890 год способом Сент-Клер Девиля
было получено 200 тонн
металлического алюминия.
5. История
В 1885 году, основываясь на технологии,предложенной Николаем Бекетовым, построен
завод по производству алюминия в немецком
городе Гмелингеме.
Технология Бекетова мало отличалась от
способа Девиля, но была проще и заключалась
во взаимодействии между криолитом (Na3AlF6) и
магнием.
6.
7. История
Метод, изобретённый почти одновременноЧарльзом Холлом во Франции и Полем Эру в
США в 1886 году, основан на получении
алюминия электролизом глинозема,
растворённого в расплавленном криолите,
положил начало современному способу
производства алюминия.
1892 – первый завод в Швейцарии
1929 – получен первый Al в России
1932 – первый алюминиевый завод в России
8. Рост производства Al
1939 год - общемировое производство 668 тыс. т,1943 год - 1,9 млн тонн
1956 год - 3,4 млн т
1965 год - 5,4 млн т
1980 год - 16,1 млн т
1990 год - 18 млн т
2007 год - 38 млн т
2008 год - 39,7 млн т
Лидеры производства:
Китай
Россия
Канада США Австралия
Бразилия Индия
Норвегия ОАЭ Бахрейн
ЮАР
Мозамбик Исландия
Таджикистан
Лидеры по объему потребления:
Китай, США, Германия
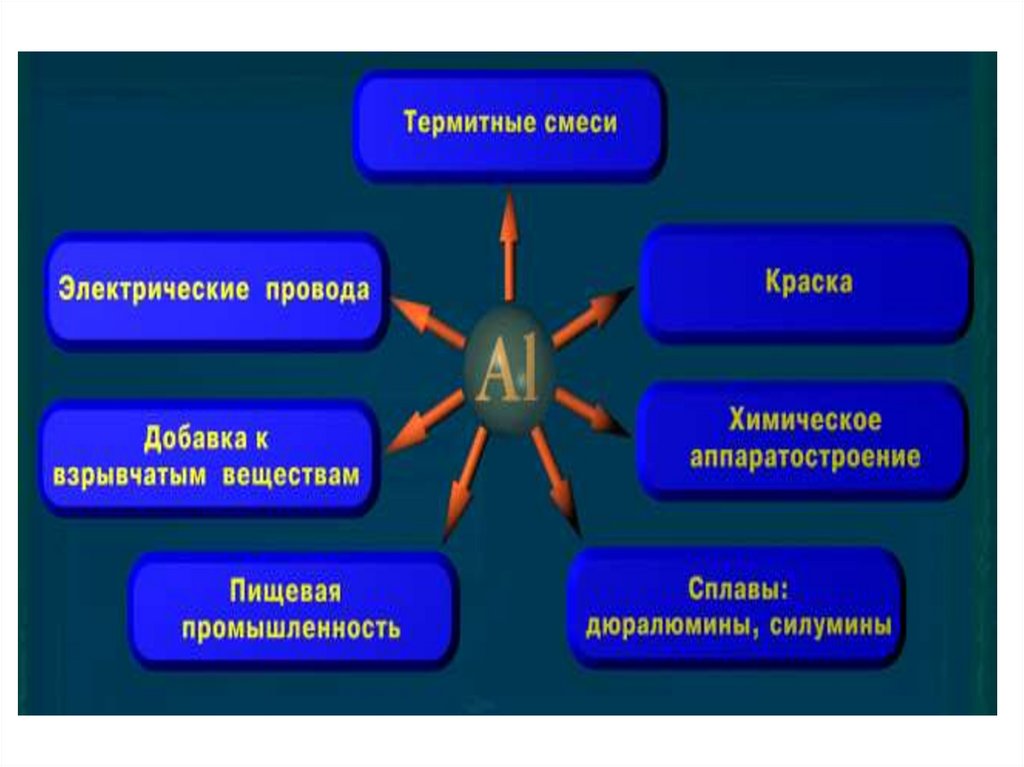
9. Области применения
Конструкционный материалДостоинства Al — лёгкость, податливость
штамповке, коррозионная стойкость, высокая
теплопроводность, нетоксичность соединений.
Недостаток Al — малая прочность, поэтому его
обычно сплавляют с небольшим количеством
меди и магния (сплав дюралюминий).
10.
11. Области применения
• Электропроводность Al всего в 1,7 раза меньше, чем у Cu, приэтом Al приблизительно в 2 раза дешевле – применяется в
электротехнике для изготовления проводов, их экранирования
и даже в микроэлектронике при изготовлении проводников в
чипах.
Недостаток - наличие прочной оксидной плёнки,
затрудняющей пайку.
• Аl и его сплавы сохраняют прочность при сверхнизких
температурах – используется в криогенной технике.
• Высокий коэффициент отражения в сочетании с дешевизной и
лёгкостью напыления делает Al идеальным материалом для
изготовления зеркал.
• В производстве строительных материалов как
газообразующий агент.
12. Области применения
• Al - важный компонент многих сплавов:- в алюминиевых бронзах основные компоненты —
медь и алюминий.
- в магниевых сплавах чаще всего используется
алюминий.
- для спиралей в электронагревательных приборах
используют фехраль (Fe, Cr, Al)
• Al иногда используют в производстве бижутерии
• В стекловарении используются фторид, фосфат и оксид Al
• Al зарегистрирован в качестве пищевой добавки Е173
• Al и его соединения используются в качестве ракетного
горючего в двухкомпонентных ракетных топливах и в
качестве горючего компонента в твёрдых ракетных
топливах.
13. Токсичность Al
• Al отличается незначительным токсическим действием,но многие растворимые в воде неорганические
соединения алюминия сохраняются в растворённом
состоянии длительное время и могут оказывать вредное
воздействие на человека и теплокровных животных через
питьевую воду.
• Наиболее ядовиты хлориды, нитраты, ацетаты, сульфаты
и др. Для человека токсическое действие при попадании
внутрь оказывают следующие дозы соединений
алюминия (мг/кг массы тела): ацетат алюминия — 0,2-0,4;
гидроксид алюминия — 3,7-7,3; алюминиевые квасцы —
2,9.
• В первую очередь действует на нервную систему
(накапливается в нервной ткани, приводя к тяжёлым
расстройствам функции ЦНС).
• ПДК в воде хозяйственно-питьевого использования
составляет 0,2 мг/дм3.
14. Состав электролита
• Na3AlF6 – основа электролита- растворительAl2O3
• NaF, AlF3 – для корректировки состава
электролита
• CaF2,MgF2 – для понижение темп
электролита
• NaCl, BaCl2 – для корректировки вязкости
электролита
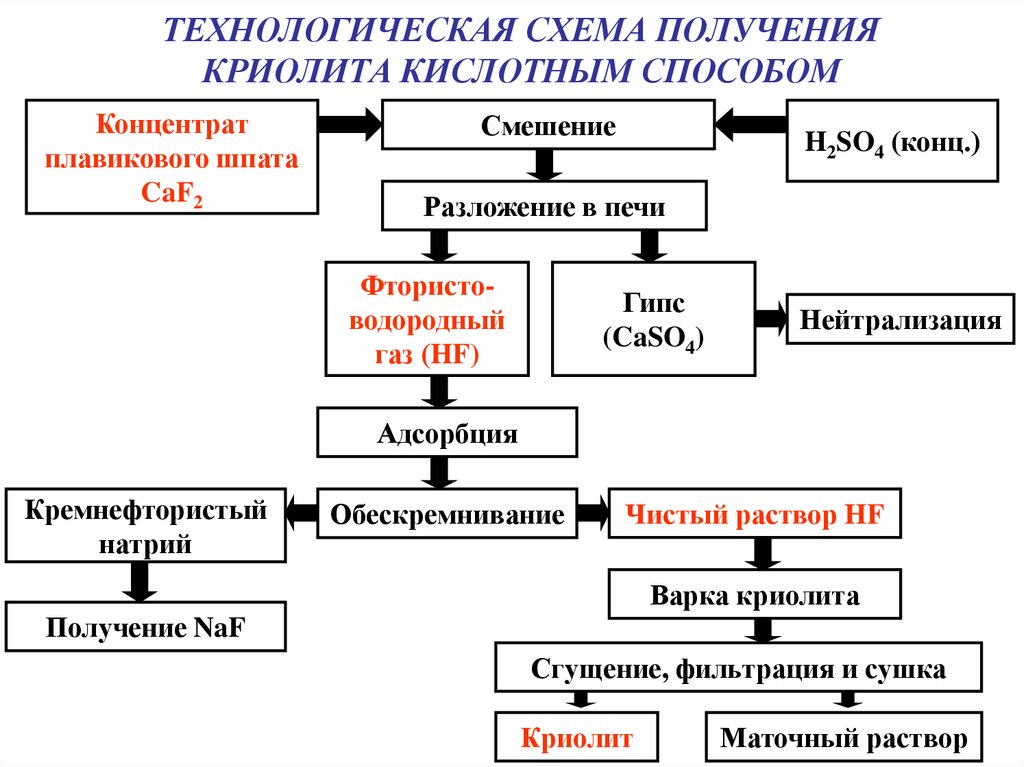
15. ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПОЛУЧЕНИЯ КРИОЛИТА КИСЛОТНЫМ СПОСОБОМ
Концентратплавикового шпата
CaF2
Смешение
H2SO4 (конц.)
Разложение в печи
Фтористоводородный
газ (HF)
Гипс
(CaSO4)
Нейтрализация
Адсорбция
Кремнефтористый
натрий
Обескремнивание
Чистый раствор HF
Варка криолита
Получение NaF
Сгущение, фильтрация и сушка
Криолит
Маточный раствор
16. КО – криолитовое отношение
КО = (NaF) / (AlF3) (мольн.)КО = 3 – электролит нейтральный
КО > 3 – электролит щелочной
КО < 3 – электролит кислый
На практике КО = 2,5÷2,8
17.
18. Разновидности электролизеров
• По типу анодов:- Обожженные
- Непрерывно самообжигающиеся
По принципу токоподвода:
- С верхним токоподводом
- С боковым токоподводом
• По рабочей мощности:
- Малой мощности(100-130кА)
- Средней мощн(150-175кА)
- Большей мощн(255-500кА)
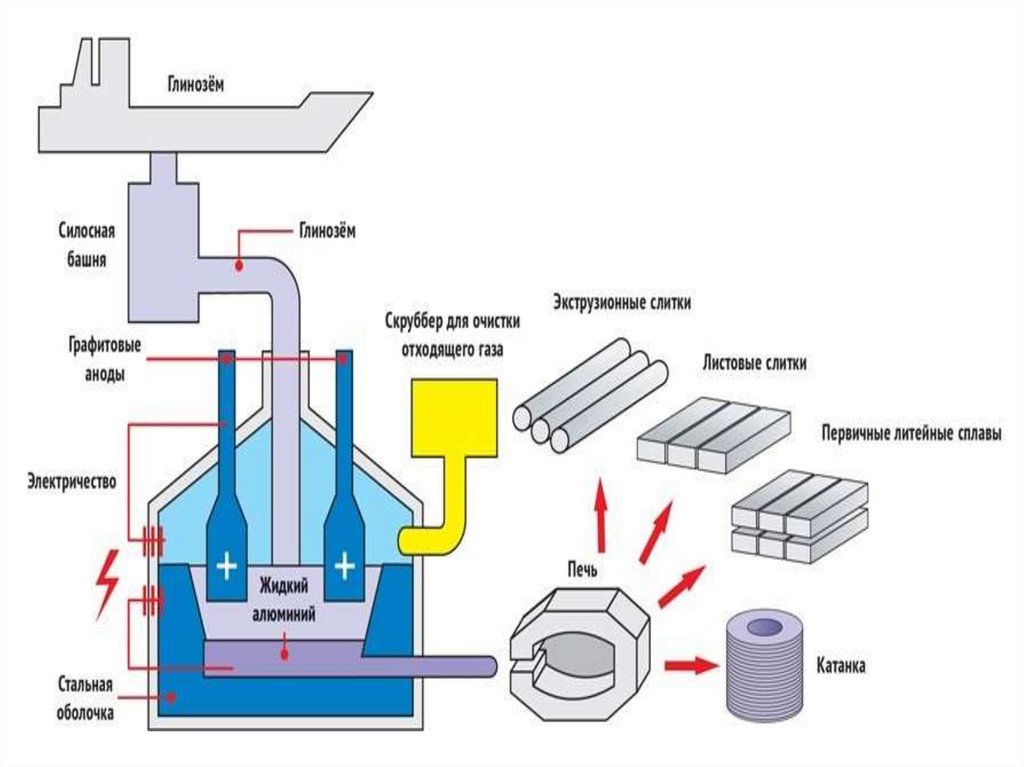
19. ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПРОИЗВОДСТВА ЭЛЕКТРОДНЫХ ИЗДЕЛИЙ
Твердыйуглеродистый
материал:
антрацит,
кокс.
Дробление
Прокаливание (Т = 1200 С 1400 С)
Размол
Классификация по крупности
Прессование
Готовые блоки
Отжиг
Готовые электроды
Дозировка и смешение
Связующее:
каменноугольный пек
Угольная масса
Формовка
анодная масса
или
подовая масса
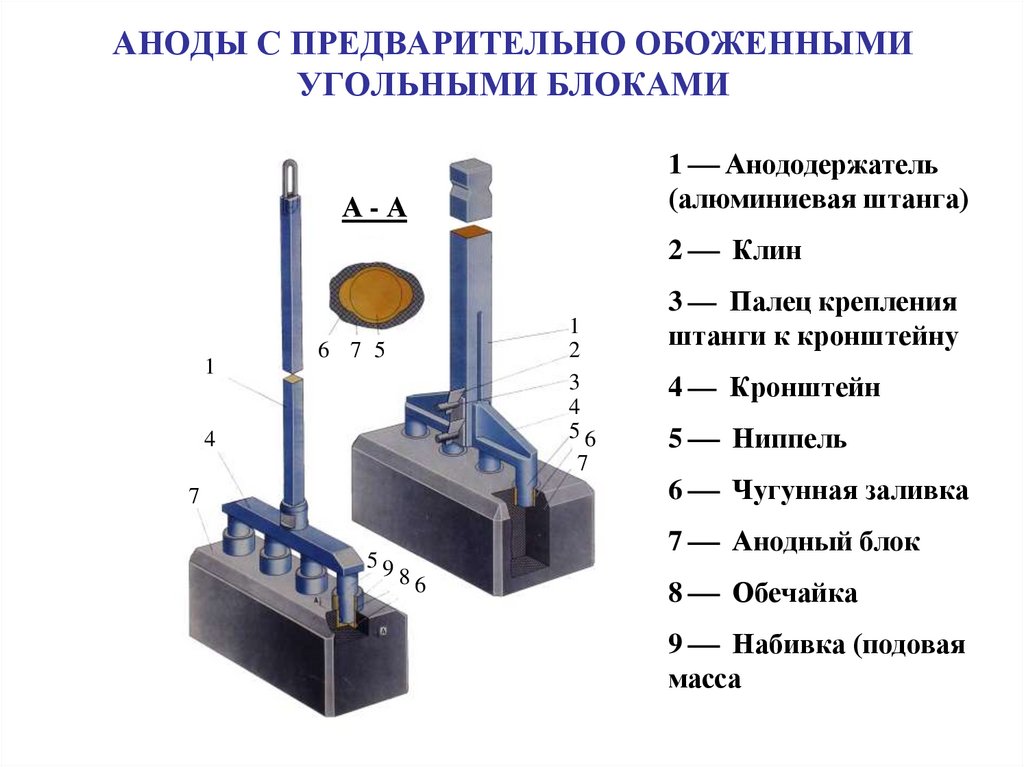
20. АНОДЫ С ПРЕДВАРИТЕЛЬНО ОБОЖЕННЫМИ УГОЛЬНЫМИ БЛОКАМИ
1 Анододержатель(алюминиевая штанга)
А-А
2 Клин
1
1
2
3
4
56
7
6 7 5
4
7
59
3 Палец крепления
штанги к кронштейну
4 Кронштейн
5 Ниппель
6 Чугунная заливка
7 Анодный блок
86
8 Обечайка
9 Набивка (подовая
масса
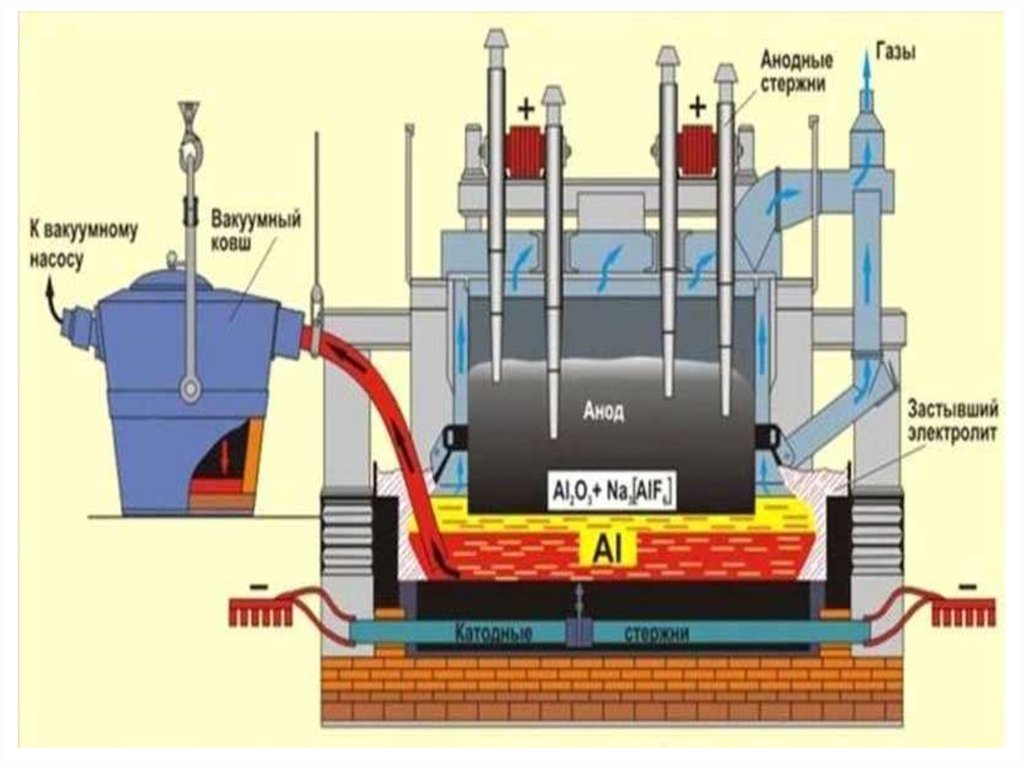
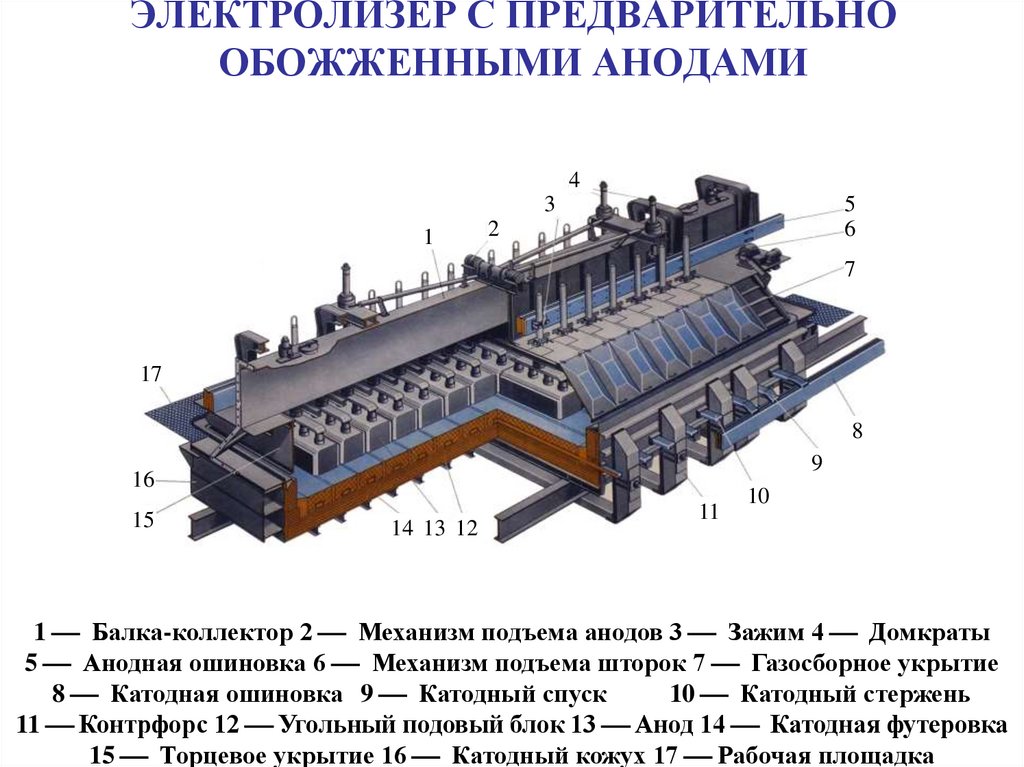
21. ЭЛЕКТРОЛИЗЕР С ПРЕДВАРИТЕЛЬНО ОБОЖЖЕННЫМИ АНОДАМИ
43
1
5
6
2
7
17
8
9
16
15
14 13 12
11
10
1 Балка-коллектор 2 Механизм подъема анодов 3 Зажим 4 Домкраты
5 Анодная ошиновка 6 Механизм подъема шторок 7 Газосборное укрытие
8 Катодная ошиновка 9 Катодный спуск
10 Катодный стержень
11 Контрфорс 12 Угольный подовый блок 13 Анод 14 Катодная футеровка
15 Торцевое укрытие 16 Катодный кожух 17 Рабочая площадка
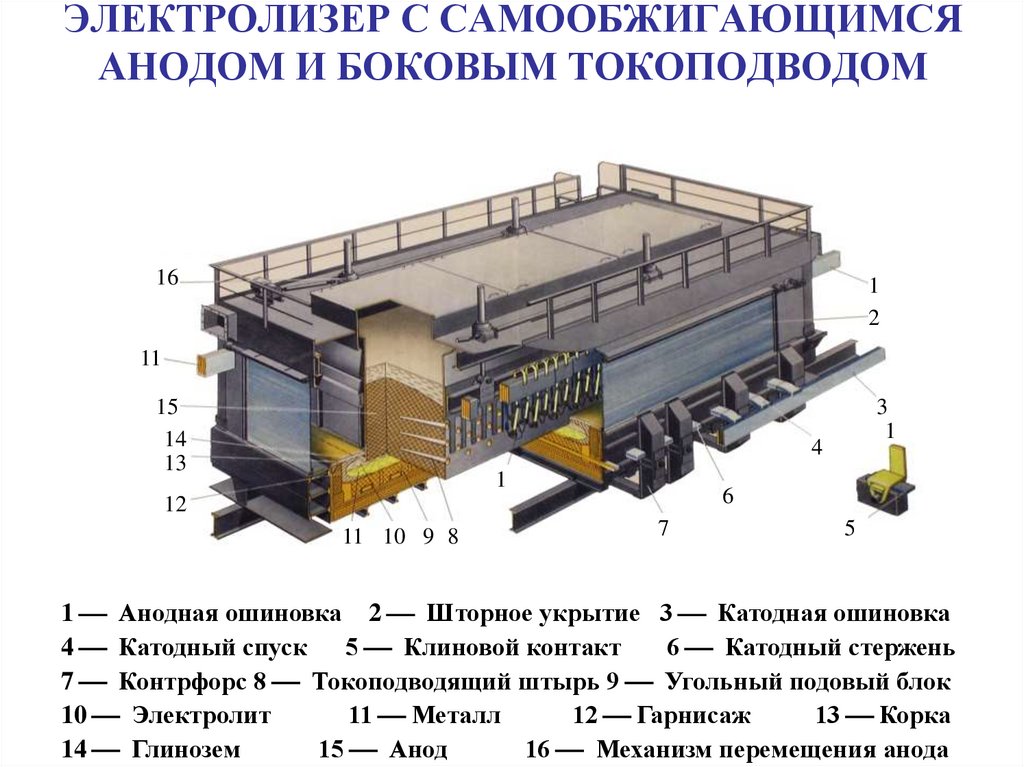
22. ЭЛЕКТРОЛИЗЕР С САМООБЖИГАЮЩИМСЯ АНОДОМ И БОКОВЫМ ТОКОПОДВОДОМ
161
2
11
15
14
13
3
1
4
1
6
12
11 10 9 8
7
5
1 Анодная ошиновка 2 Шторное укрытие 3 Катодная ошиновка
4 Катодный спуск 5 Клиновой контакт
6 Катодный стержень
7 Контрфорс 8 Токоподводящий штырь 9 Угольный подовый блок
10 Электролит
11 Металл
12 Гарнисаж
13 Корка
14 Глинозем
15 Анод
16 Механизм перемещения анода
23. ЭЛЕКТРОЛИЗЕР С САМООБЖИГАЮЩИМСЯ АНОДОМ И ВЕРХНИМ ТОКОПОДВОДОМ
32
4
1
4
13
5
12
11
6
10
9
8
7
1 Токоподводящий штырь 2 Домкраты перемещения анода (вспомогательный
механизм) 3 Домкраты перемещения анода (основной механизм) 4 Анодная
ошиновка 5 Катодная ошиновка 6 Катодный спуск 7 Катодный стержень
8 Контрфорс 9 Катодная футеровка 10 Угольный подовый блок
11 Газосборный колокол 12 Анод 13 Горелка газосборной системы
24.
25.
26.
27. Химизм процесса
Растворение глинозема в электролитеNa 3ALF6 + Al2O3 = 3 NaAlOF2
Диссоциация
NaAlOF2 = Na+ + AlOF2Реакции на электродах
K: 2Al3+ + 6ē = 2 Alo
А: 3O2- - 6ē = 1,5 O2
O2 + C → CO + CO2
Суммарная химическая реакция
2 Al2O3 + 3 С = 4 Al + 3 CO2
Al2O3 + 3 С = 2 Al + 3 CO
28.
29. Основные показатели процесса
Выход по токуМасса теоретическая
Электрохимический
эквивалент
, г
, г/А час
, кВт час/т
Удельный расход
энергии
, кВт час/т
30. Основные показатели процесса
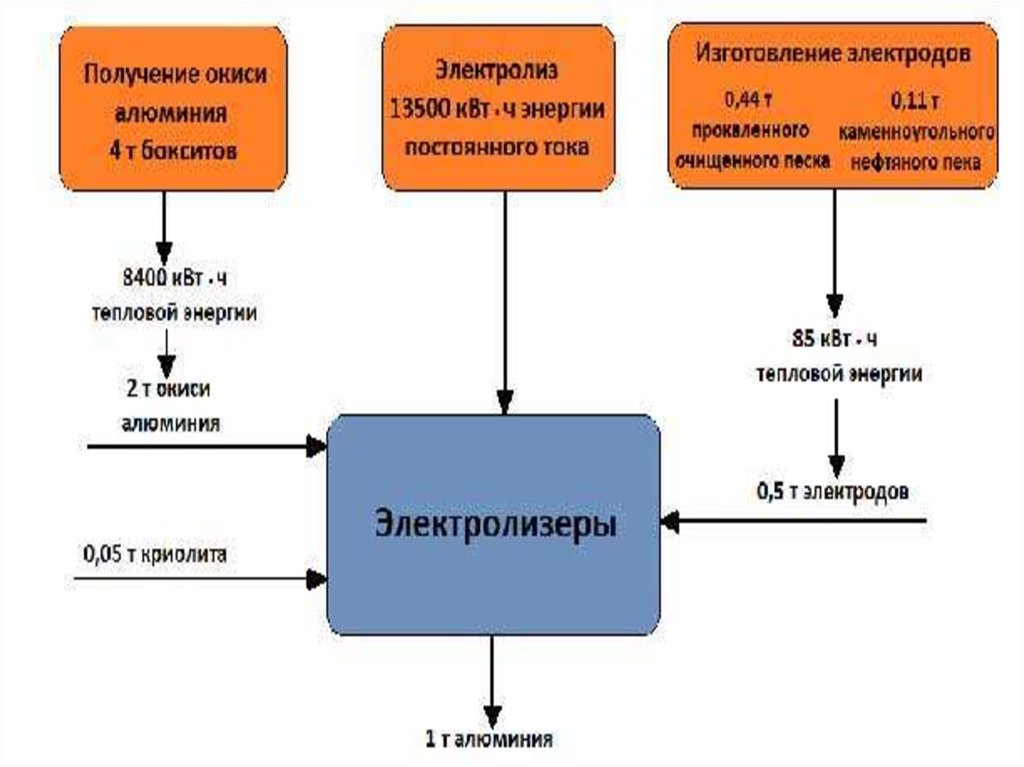
• Выход по току 88÷90 %• Удельный расход энергии 13900 кВт*час/т Al
• Uраб= 4 ÷ 4,5 В
• Q= 550 ÷ 1200 кг/сутки
• кAl = 0,3355 г/А*час
31. Факторы, влияющие на показатели процесса
• Плотность токаia>ik
ia=0,7/1,0 А/см^2
• Состав электролита
KO=2,5/2,8
содержание Al2O3=4/8 %
• Температура электролиза
T= 930/960 град. C
• Межполюсное расстояние
L= 3/5 см
32. Анодный эффект
Признаки- Повышение напряжение(до 60В)
- Искровой заряд
- Несмачиваемость анода
- Изменение состава анодных газов
Причина- Обеднение электролита
глиноземам
33.
34.
35. Качество алюминия
• Первичный алюминий – сырецА85, А8, А7, А7Е, А7Э, А6, А5, А5Е,А0
Цифры это чистота металла.
• Алюминий высокой чистоты (АВЧ)
А995, А99, А97, А95
• Алюминий особой чистоты (АОЧ)
А999
А999 – 99,999% Al
36. Примесей в первичном Al
• Неметаллические- Газообразные(СО, СО2)
- Механические
• Металлические
- Низкой раств-мостью
- Высокой раств-ю
37. ТЕХНОЛОГИЧЕСКАЯ СХЕМА ЭЛЕКТРОЛИТИЧЕСКОГО РАФИНИРОВАНИЯ АЛЮМИНИЯ ПО ТРЕХСЛОЙНОМУ СПОСОБУ
AlF3Na3AlF6
NaCl добавка
BaCl2
сушка, дозировка, смешение
Al техн.
Al катодный
плавление и рафинирование
электролита
Al техн.
электролит
Cu
газ HF, HCl на
нейтрализацию
шлам в отвал
анодный сплав 40% Cu
анодные осадки
интерметаллиды
ЭЛЕКТРОЛИТИЧЕСКОЕ
РАФИНИРОВАНИЕ
корки и шлам
на заводы
Al высокой чистоты
в отвал
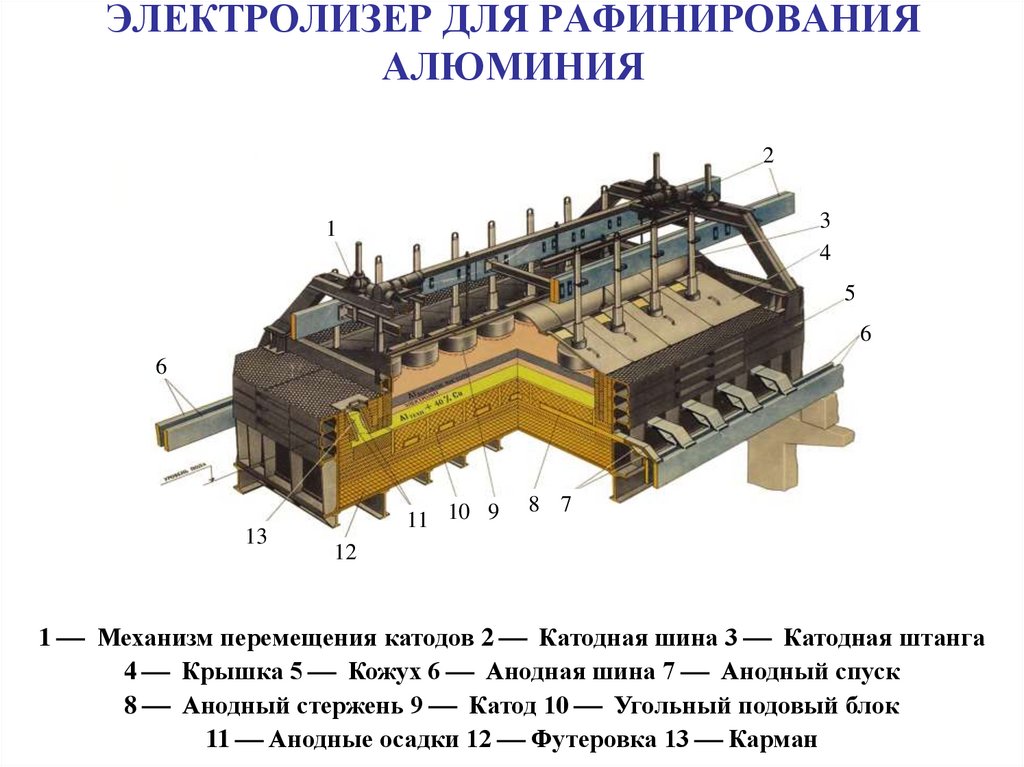
38. ЭЛЕКТРОЛИЗЕР ДЛЯ РАФИНИРОВАНИЯ АЛЮМИНИЯ
23
4
1
5
6
6
13
11 10 9
8 7
12
1 Механизм перемещения катодов 2 Катодная шина 3 Катодная штанга
4 Крышка 5 Кожух 6 Анодная шина 7 Анодный спуск
8 Анодный стержень 9 Катод 10 Угольный подовый блок
11 Анодные осадки 12 Футеровка 13 Карман
39.
40. Состав электролита
• Na3AlF6 – основа электролита(40/45 %)• NaF, AlF3 – для корректировки состава
электролита(КО=1,5/2,2)
• BaCl2 - для увеличение плотности
электролита(55/60 %)
• NaCl – для увеличение
электролитности электролита(2/4 %)
41.
42. Состав анодного сплава
Alпервичный+ 30÷40 % CuРеакции на электродах
A: Al(0) – 3e = Al(3+)
K: Al(3+) + 3e = Al(0)
Примеси
• В электролите – Na, K, Ca, Mg, Ti
• В анодном сплаве – интерметаллиды (Al-Cu-Fe-Si-Ga)
43. Основные показатели процесса
• Выход по току 95÷97 %• Удельный расход энергии 18000 кВт*час/т
Al
• Uраб= 5,5 ÷ 6,0 В
• Т = 750÷810 оС
• i = 0,5 ÷0,6 А/см2
• L = 11÷13 см
44.
45. Сплавы на основе Al
• Al-Mg сплавы обладают высокой коррозионнойстойкостью и хорошо свариваются; из них делают
корпуса быстроходных судов.
• Al-Mn сплавы во многом аналогичны алюминиевомагниевым.
• Al-Cu сплавы ( дюралюминий) можно подвергать
термообработке, что намного повышает их прочность. Но
- термообработанные материалы нельзя сваривать,
поэтому детали самолётов до сих пор соединяют
заклёпками.
Сплав с бо́льшим содержанием меди по цвету внешне
очень похож на золото, и его иногда применяют для
имитации Au.
• Al-Si сплавы (силумины) лучше всего подходят для литья.
Из них часто отливают корпуса разных механизмов.




































 Химия
Химия








