Похожие презентации:
Свойства химических связей
1.
СВОЙСТВАХИМИЧЕСКИХ
СВЯЗЕЙ
2.
Ковалентная связь характеризуетсядлиной,
энергией,
кратностью,
насыщаемостью, направленностью и
полярностью.
Длина ковалентной связи – это
расстояние между ядрами химически
связанных атомов.
Чем больше радиус, тем больше длина
связи.
3.
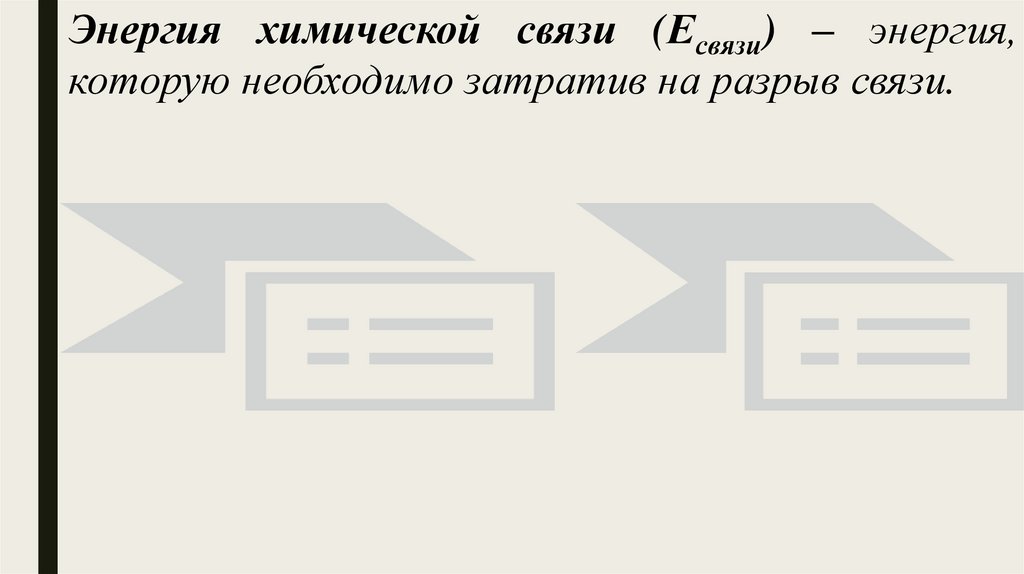
Энергия химической связи (Есвязи) – энергия,которую необходимо затратив на разрыв связи.
4.
Кратность ковалентной связи – число электронных пар,которые участвуют в образовании химической связи между
двумя атомами.
Бывают одинарные, двойные и тройные.
5.
Направленность ковалентных связей – определяется ориентацией в пространствеатомных орбиталей, участвующих в образовании связи.
Благодаря ей и образуются шаростержневые модели молекул.
СТРАНИЦА 79 РИСУНОК 31.
Угол, образованный направлениями химических связей, исходящими из одного атома,
называют валентным углом.
В метане 1090, в этене 1200, в этине 1800.
6.
Полярность связи – характеристика, учитывающаясмещение общей электронной пары к одному из атомов.
Полярность ковалентной связи — значения частичных
зарядов на связанных атомах. Полярность ковалентной
связи зависит от разности электроотрицательностей
этих атомов. Чем сильнее отличаются атомы по
электроотрицательности, тем больше полярность
связи.
7.
Насыщаемость – способность атома образовыватьопределенное число ковалентных связей.
Это число связей определяется валентностью атома.
Насыщаемость – особенность образования ковалентных связей
прежде всего по обменному механизму. Это означает, что если
атом имеет некоторое количество неспаренных электронов в
нормальном или возбужденном состоянии, то все они
участвуют в образовании химических связей. Например, атом
азота имеет 3 неспаренных электрона, а водород – 1. Принцип
насыщаемости указывает на то, что устойчивым соединением
должно быть NH3, а не NH2, NH или NH4.
8.
Параграф14 №2, №4,
№7, №9
.






 Химия
Химия








