Похожие презентации:
Межмолекулярное взаимодействие и водородная связь
1.
МЕЖМОЛЕКУЛЯРНОЕВЗАИМОДЕЙСТВИЕ И
ВОДОРОДНАЯ СВЯЗЬ
2.
Межмолекулярноевзаимодействие
3.
Веществамолекулярного
строения
могут
существовать в трех агрегатных состояниях, но
при этом нужны различные температурные
условия.
Причина этого – различие в силе взаимодействия
между молекулами.
Такое
взаимодействие
межмолекулярным.
называется
4.
Такое взаимодействие существует за счет того, чтоесть силы электростатического притяжения. Такое
взаимодействие имеет электрическую природу и
складывается из сил притяжения (ориентационных,
индукционных и дисперсионных) и сил отталкивания.
Чем сильнее взаимодействие,
температура плавления и кипения.
тем
выше
его
Сила
межмолекулярного
взаимодействия
–
индивидуальная характеристика вещества, она зависит
от электронного строения его молекул.
5.
Молекулаэлектронейтральная,
но
внутри
–
положительно заряженные ядра, вокруг которых
находятся отрицательно заряженные электроны.
В HCl – ковалентная полярная связь, Электронная пара
смещена
больше
к
хлору,
т.к.
он
более
электроотрицательный.
Так и возникают заряды: кто-то положительный, ктото отрицательный.
6.
Слабое притяжение существует и между неполярнымимолекулами.
Величина сил межмолекулярного взаимодействия зависит от
размера молекул: чем больше молекула, тем легче ее внешние
электроны притягиваются к другой молекуле и тем прочнее
можмолекулярное взаимодействие.
Этим и можно объяснить переход из одного агрегатного
состояния в другое.
7.
8.
Водороднаясвязь
9.
При изучении органических веществ можно было наблюдать такуюзакономерность: чем больше масса и размер молекулы, тем выше
температура плавления и кипения молекулярного вещества.
Если про это не забывать, то можно сказать, что между молекулами
воды межмолекулярное взаимодействие слабее, чем между молекулами
водородных соединений других элементов VIA группа.
К воде относится не только понятие
взаимодействие», но и «водородная связь».
«межмолекулярное
Водородная
связь
–
связь,
образованная
в
результате
электростатического взаимодействия между атомом водорода одной
молекулы и более электроотрицательным атомом другой молекулы,
несущим отрицательный заряд и имеющий неподеленную электронную
пару.
10.
Для возникновения водородных связей важно, чтобы вмолекулах вещества были атомы водорода, связанные с
небольшими, но электроотрицательными атомами,
например: O, N, F. Это создает заметный частичный
положительный заряд на атомах водорода. С другой
стороны, важно, чтобы у электроотрицательных
атомов были неподеленные электронные пары. Когда
обедненный электронами атом водорода одной
молекулы (акцептор) взаимодействует с неподеленной
электронной парой на атоме N, O или F другой
молекулы (донор), то возникает связь, похожая на
полярную ковалентную.
11.
Водородные связи междумолекулами
воды
(обозначены пунктиром)
Объемная модель, показывающая
расположение молекул воды,
связанных водородными связями.
12.
Учитывая заметную разницу зарядов на атомах Н и Ососедних молекул, дополнительную прочность этой
межмолекулярной связи придает притяжение
разноименных зарядов. Водородные связи характерны
для таких веществ, как вода H2O, аммиак NH3,
фтороводород HF.
13.
Водородная связь бывают двух типов:межмолекулярная,
возникающая
между
несколькими
молекулами;
внутримолекулярная, возникающая внутри одной молекулы.
однотипными
Способ образования связи в обоих типах одинаковый. Разница только в том, что с
помощью межмолекулярной водородной связи образуются цепочка молекул, а при
внутримолекулярной связи водород «сцепляется» с атомами внутри молекулы.
Например, молекула воды образована одним атомом кислорода и двумя атомами
водорода. За счёт высокой электроотрицательности кислород, на внешнем
энергетическом уровне которого шесть электронов, притягивает единственные
электроны двух атомов водорода. Две пары электронов кислорода остаются
свободными. При этом у водорода освобождается орбиталь. Другая аналогичная
молекула может присоединиться в месте свободных электронных пар атома
кислорода, заполнив освободившуюся орбиталь водорода. Возникает
межмолекулярная водородная связь.
14.
15.
Аналогичным образом соединяются молекулыплавиковой кислоты и аммиака. Однако связь
между азотом и водородом будет слабее, чем
между водородом и кислородом. Также
молекулы плавиковой кислоты сильнее
притягиваются друг к другу, чем молекулы
воды.
Это
объясняется
величиной
электроотрицательности.
16.
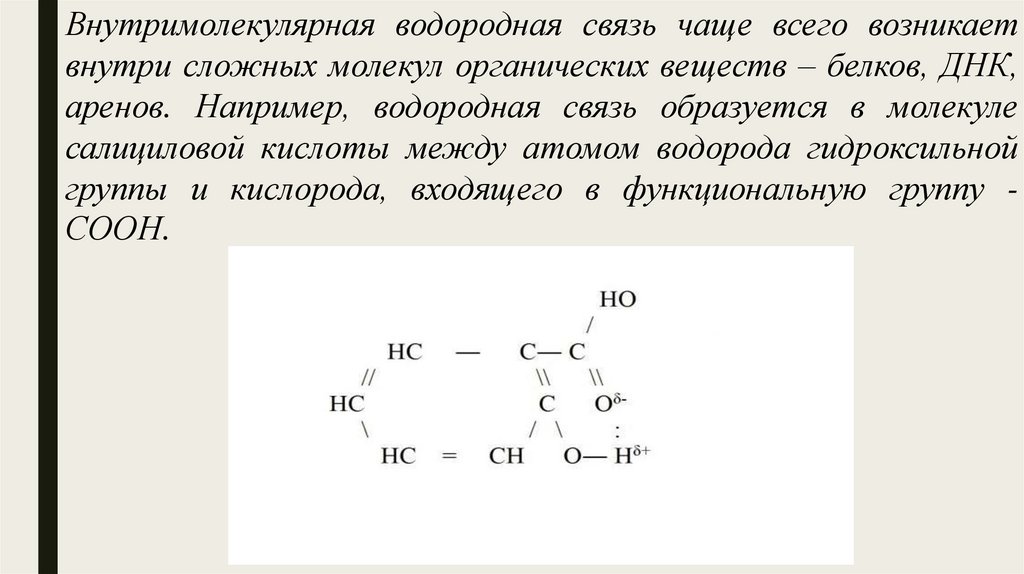
Внутримолекулярная водородная связь чаще всего возникаетвнутри сложных молекул органических веществ – белков, ДНК,
аренов. Например, водородная связь образуется в молекуле
салициловой кислоты между атомом водорода гидроксильной
группы и кислорода, входящего в функциональную группу СООН.
17.
После параграфа17 №1, №3, №9,
№10
18.
Домашнее задание:параграф 17 №2, №5.














 Химия
Химия








