Похожие презентации:
Химические свойства оснований, кислот и солей в свете теории электролитической диссоциации
1.
ХИМИЧЕСКИЕ СВОЙСТВАОСНОВАНИЙ, КИСЛОТ И СОЛЕЙ
В СВЕТЕ ТЕОРИИ
ЭЛЕКТРОЛИТИЧЕСКОЙ
ДИССОЦИАЦИИ
2.
Химические реакции в растворах электролитов – это реакции с участиемионов, образующихся в результате диссоциации электролитов.
Ионные реакции – реакции, протекающие в водных растворах с участием
ионов электролитов.
Условия, при которых протекают такие реакции:
o Образование малодиссоциируемого вещества (осадок);
o Образование воды;
o Выделение газа.
Одно из трех условий должно быть выполнено.
3.
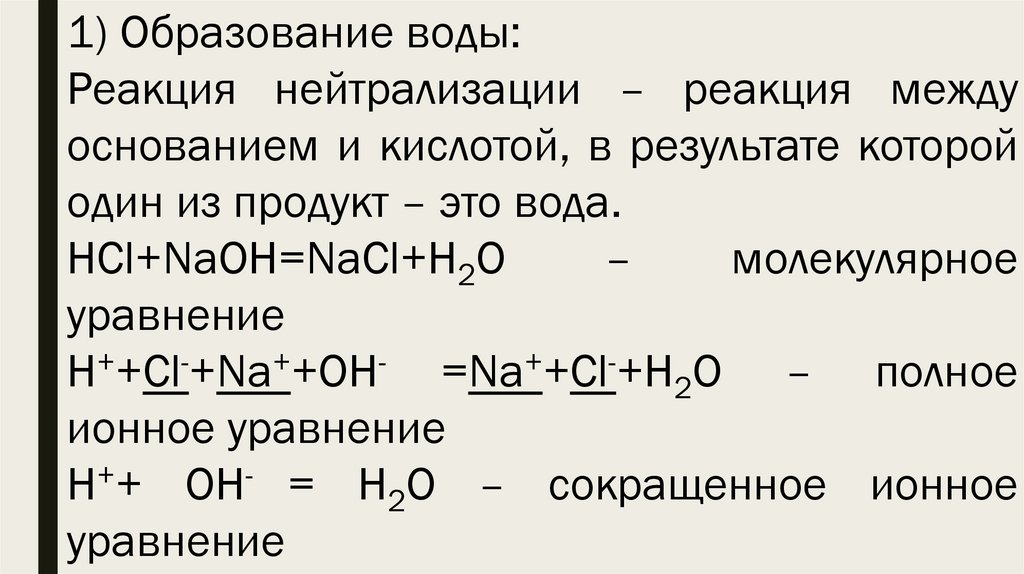
1) Образование воды:Реакция нейтрализации – реакция между
основанием и кислотой, в результате которой
один из продукт – это вода.
HCl+NaOH=NaCl+H2O
–
молекулярное
уравнение
H++Cl-+Na++OH- =Na++Cl-+H2O – полное
ионное уравнение
+
H + OH = H2O – сокращенное ионное
уравнение
4.
2) Образование осадка.Na2SO4+BaCl2=BaSO4+2NaCl– молекулярное
уравнение
2Na++SO42-+ Ba2++ 2Cl- = BaSO4 +2Na++2Cl– полное ионное уравнение
SO42-+ Ba2+= BaSO4 – сокращенное ионное
уравнение
5.
3) Выделение газа:(NH4)2CO3+2HCl=2NH4Cl+H2O+CO2 – молекулярное
уравнение
2NH4++CO32- + 2H++2Cl- = 2NH4++ 2Cl- +H2O+CO2 –
полное ионное уравнение
CO32- + 2H+=H2O+CO2 – сокращенное ионное
уравнение
6.
Кислоты – это электролиты, при диссоциации которых вкачестве катионов образуются только катионы водорода.
7.
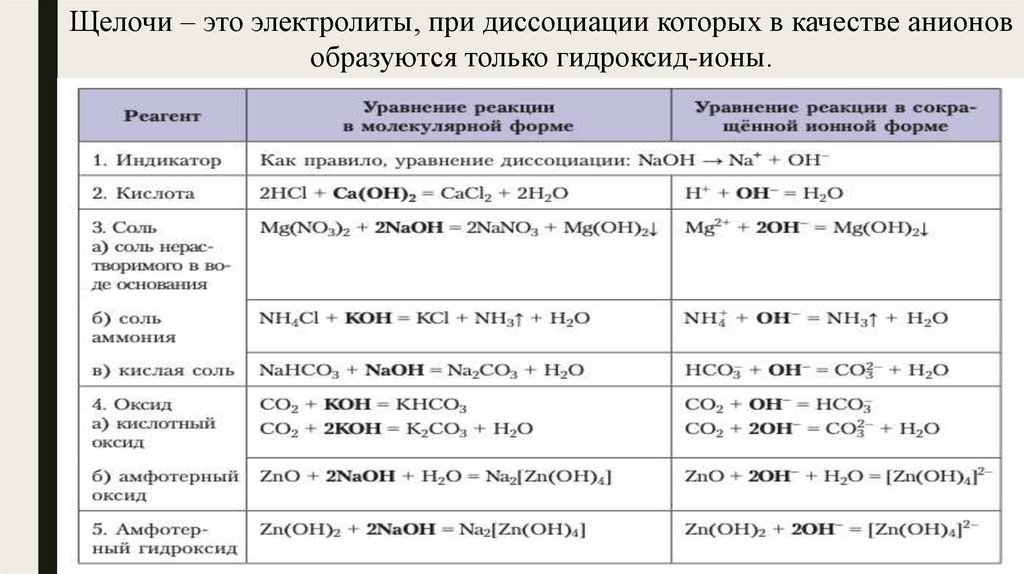
Щелочи – это электролиты, при диссоциации которых в качестве анионовобразуются только гидроксид-ионы.
8.
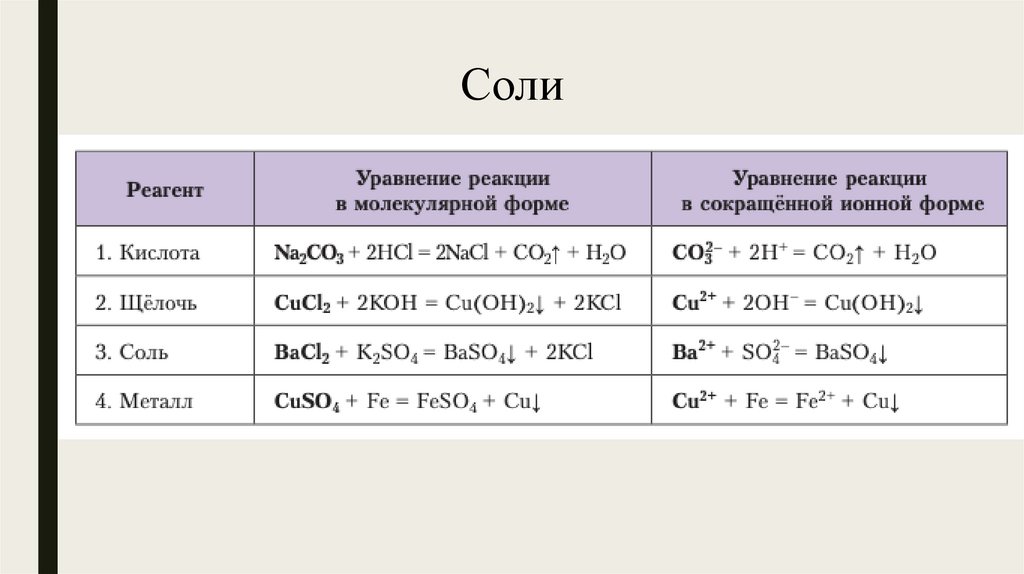
Соли9.
Сборник задач: №182,№185, №193.
10.
Домашнее задание:параграф 27, №3, №5
страница 151.







 Химия
Химия








