Похожие презентации:
Самостоятельная работа по химии
1.
Самостоятельнаяработа
2.
№1 Определите тип химической связи :• K2S, N2, NaCl, SiO2, NH3, H2, CaO,
Cl2, H2O, SO2, O2, KCl, SO3,
• MgCl2, P2O5, Na2O, Br2, I2, KBr,
CO, F2, KF, NO, BaO, NO2, Nal.
• Смотрим презентацию «Химическая связь»
3.
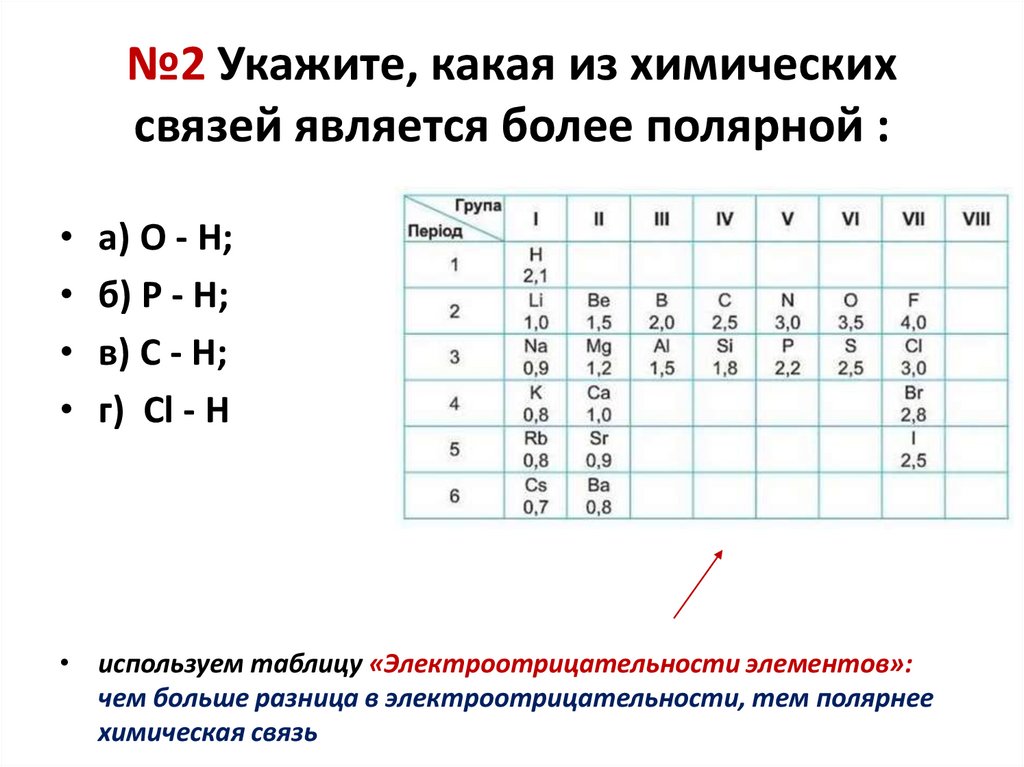
№2 Укажите, какая из химическихсвязей является более полярной :
• а) O - H;
• б) P - H;
• в) C - H;
• г) Cl - H
• используем таблицу «Электроотрицательности элементов»:
чем больше разница в электроотрицательности, тем полярнее
химическая связь
4.
№3 Составьте электронные схемыобразования таких ионов:
2+
2• K+, Ca , Br , S .
Пример:
Атом Nа 1s2 2s2 2p6 3s1 , так как атом
Натрия отдает 1 электрон, он становится
ионом со степенью окисления +1, то есть
Nа+, значит электронная формула иона
Натрия будет такая: Nа+ 1s2 2s2 2p6
Атом О 1s22s22p4 , так ка атом Оксигена
забирает 2 электрона, он становится
ионом со степенью окисления -2, то есть
О-2, значит электронная формула иона
Оксигена будет такая: О-2 1s22s22p6
5.
№4 Определите вид химической связи исоставьте формулы соединений:
• а) Силиция с Хлором;
• б) Нитрогена с Гидрогеном;
• в) Карбона с Флуором;
• г) простого вещества — йода.
6.
№5 Увеличение давления в системе сместитравновесие химической реакции вправо или
нет?
• а) 2Н2О(г) ↔ 2Н2(г) + О2(г)
• б) N2 (г)+ 3Н2(г) ↔ 2NН3(г)
• в) СаСО3 (тв) ↔ СО2 (г) + СаО(тв)
• г) СО(г)+ H2О(г) ↔ СО2(г) + H2(г)
7.
№6 Реакция происходит по уравнению:• 2SO2(г) + О2 (г) ↔ 2SO3 (г) + 284,2 кДж
Предложите, изменение каких параметров
можно достичь смещения равновесия в бок
образования Сульфур (VІ) оксиду.
8.
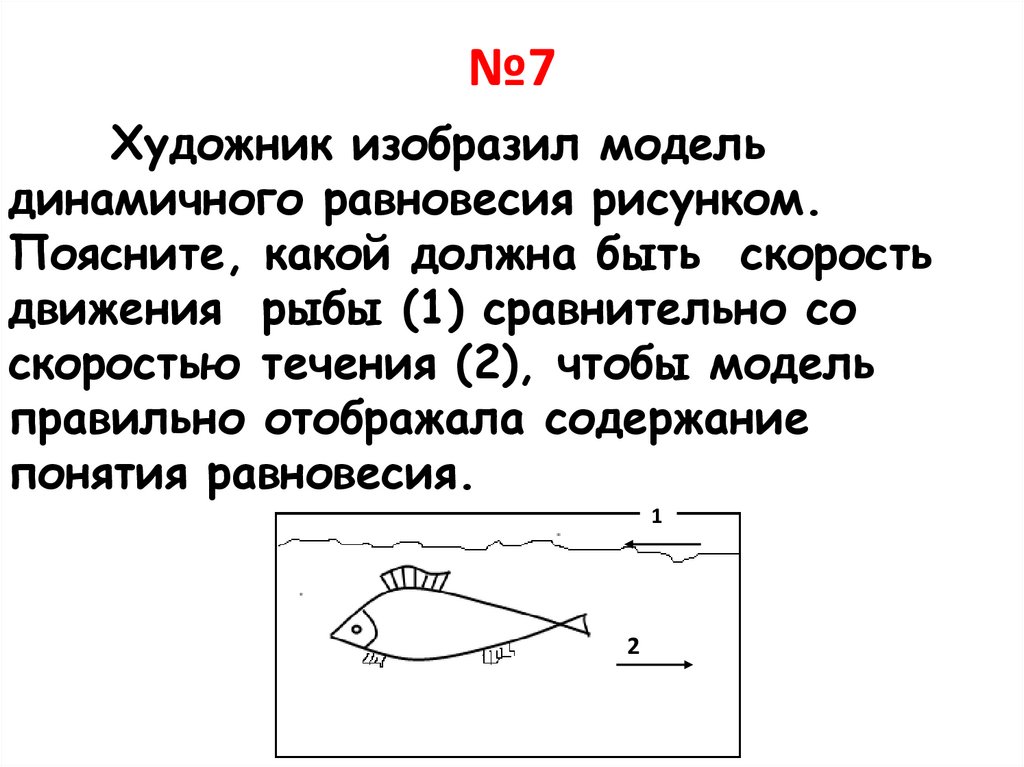
№7Художник изобразил модель
динамичного равновесия рисунком.
Поясните, какой должна быть скорость
движения рыбы (1) сравнительно со
скоростью течения (2), чтобы модель
правильно отображала содержание
понятия равновесия.
1
2






 Химия
Химия








