Похожие презентации:
Обобщение классы неорганических соединений
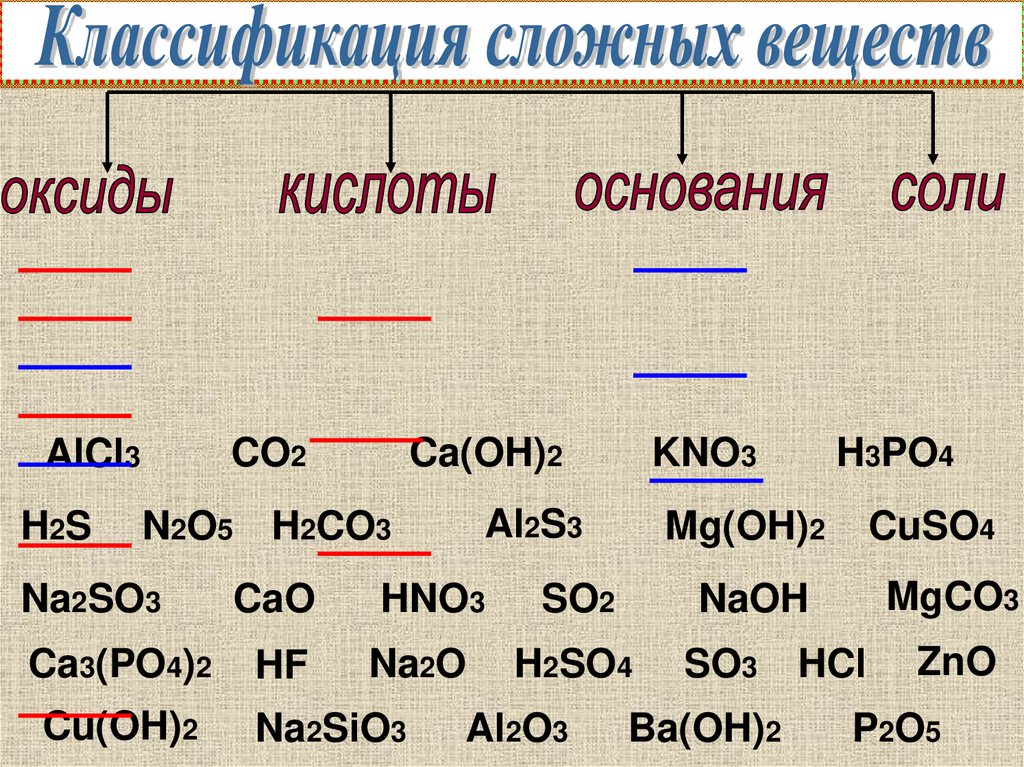
1.
CO2AlCl3
H2S
Ca(OH)2
KNO3
Al2S3
N2O5 H2CO3
H3PO4
Mg(OH)2
CuSO4
Na2SO3
CaO
HNO3
SO2
NaOH
MgCO3
Ca3(PO4)2
HF
Na2O
H2SO4
SO3 HCl
ZnO
Cu(OH)2
Na2SiO3
Al2O3
Ba(OH)2
P2O5
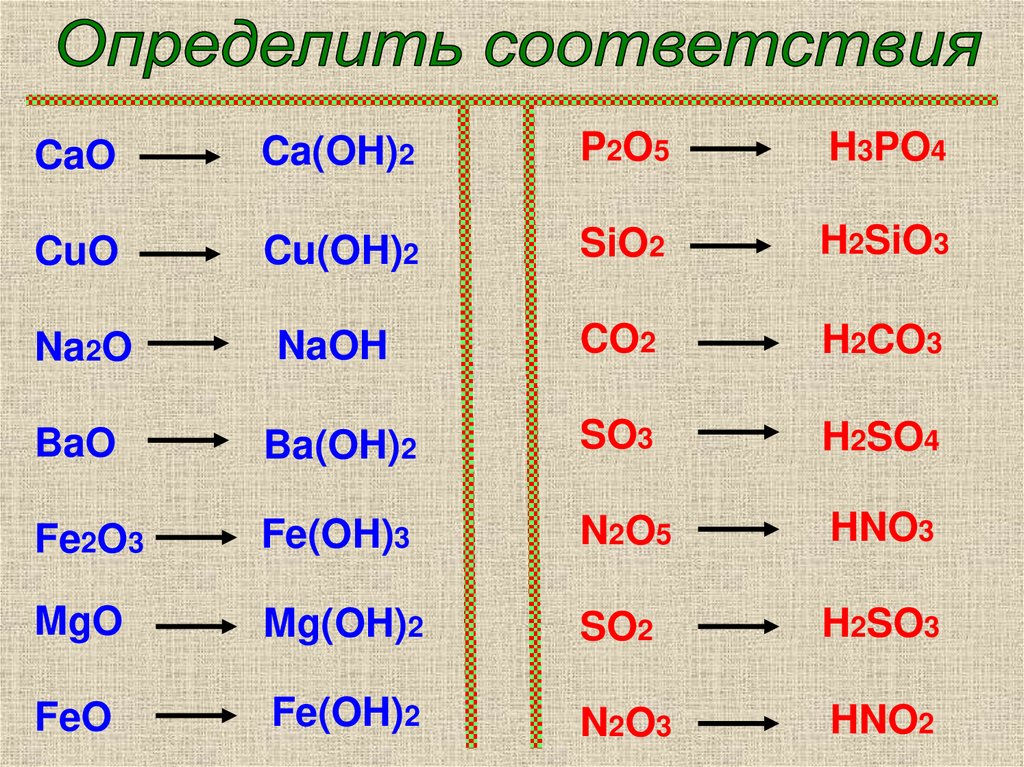
2.
CaOCa(OH)2
P2O5
H3PO4
CuO
Cu(OH)2
SiO2
H2SiO3
Na2O
NaOH
CO2
H2CO3
BaO
Ba(OH)2
SO3
H2SO4
Fe2O3
Fe(OH)3
N2O5
HNO3
MgO
Mg(OH)2
SO2
H2SO3
FeO
Fe(OH)2
N2O3
HNO2
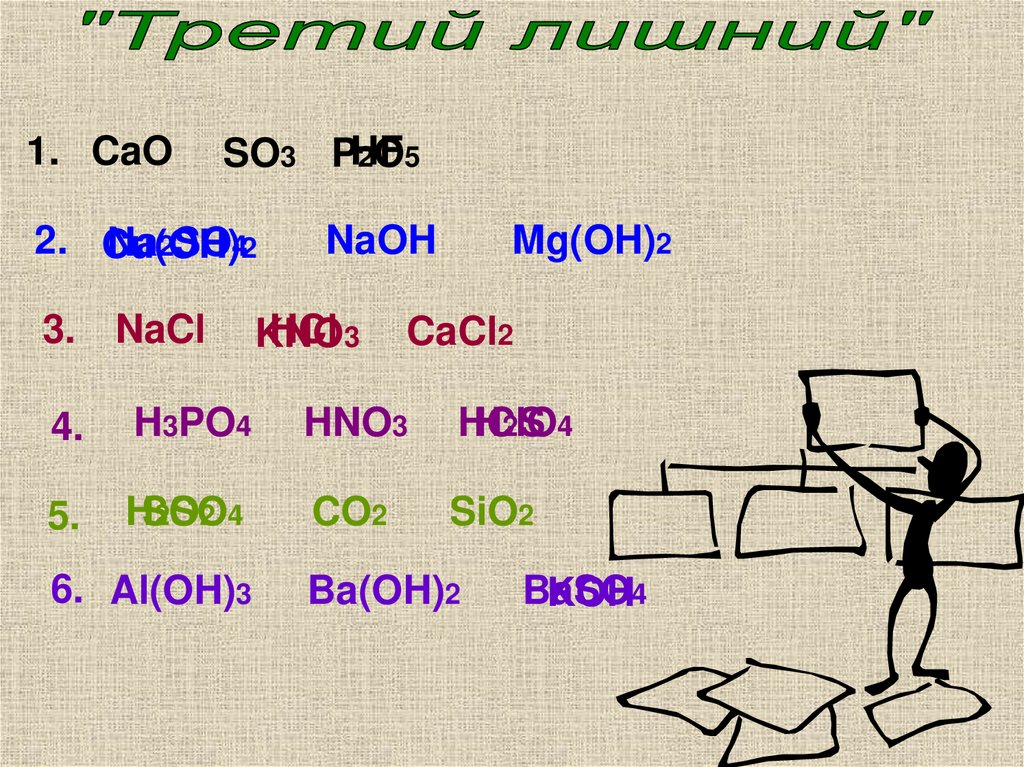
3.
1. CaOSO3 PHF
2O5
2. Cu(OH)
Na2SO42
3. NaCl
NaOH
HCl 3
KNO
Mg(OH)2
CaCl2
4.
H3PO4
HNO3
HClO
H2S 4
5.
HSO
2SO
2 4
CO2
SiO2
6. Al(OH)3
Ba(OH)2
BaSO
KOH4
4.
КИСЛОТЫСОЛИ
ОСНОВАНИЯ
ОКСИДЫ
а Эти сложные вещества в природе встречаются в жидком,
твёрдом и газообразном
состоянии.
о Эти соединения образуются в
результате р-ции нейтрализации, но не вода.
у Эти вещества окрашивают лакмус в красный цвет.
ь Эти вещ-ва окрашивают фенолфталеин в малиновый цвет.
л Хлорид натрия – хорошо растворимая в воде … .
г Эти вещества бывают одно-, двух- и трёхосновными.
я Вещества, состоящие их двух элементов, одним из
которых является кислород, называются …
н В состав этих соединений входит гидроксильная группа.
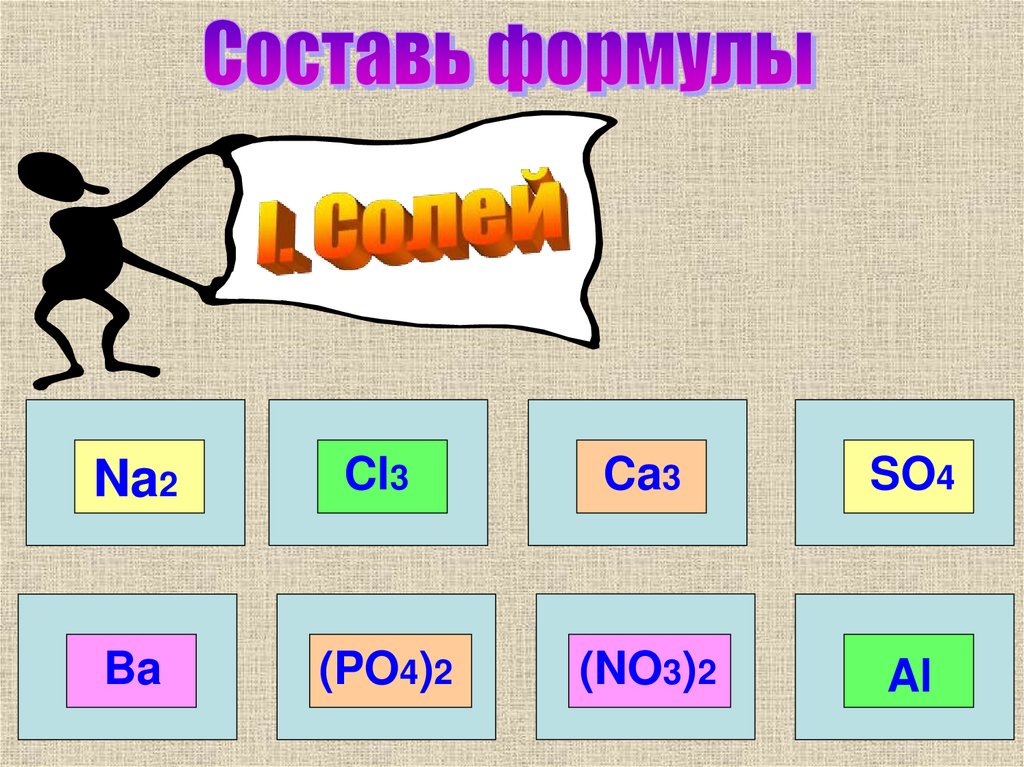
5.
Na2Cl3
Ca3
SO4
Ba
(PO4)2
(NO3)2
Al
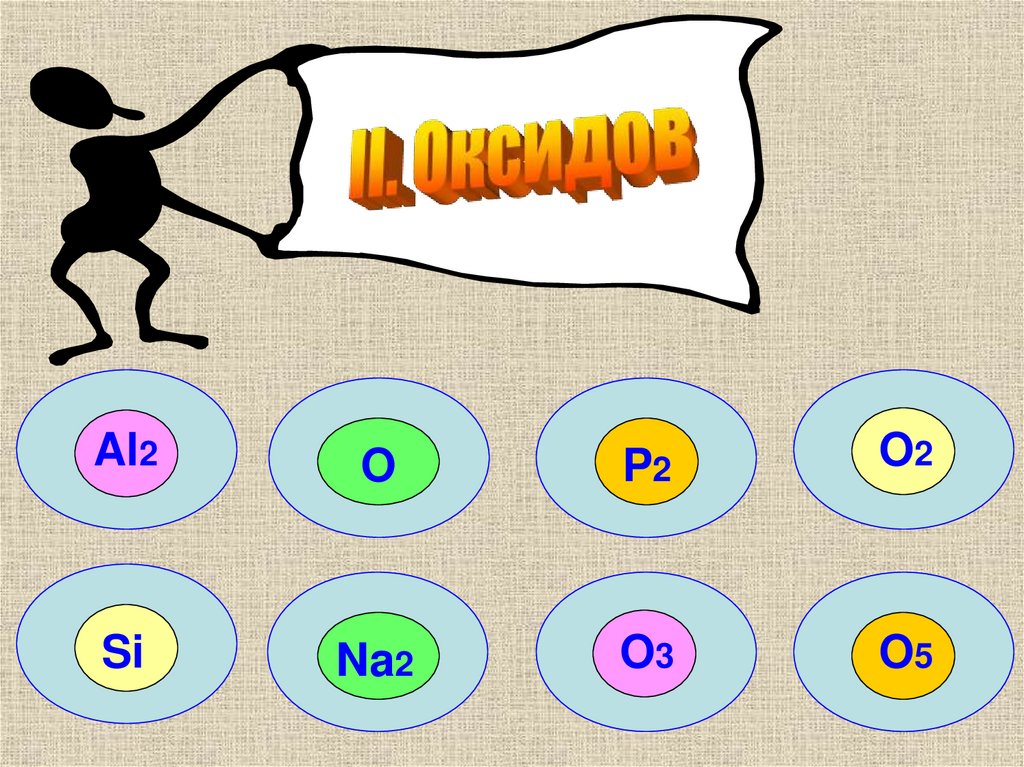
6.
Al2O
P2
O2
Si
Na2
O3
O5
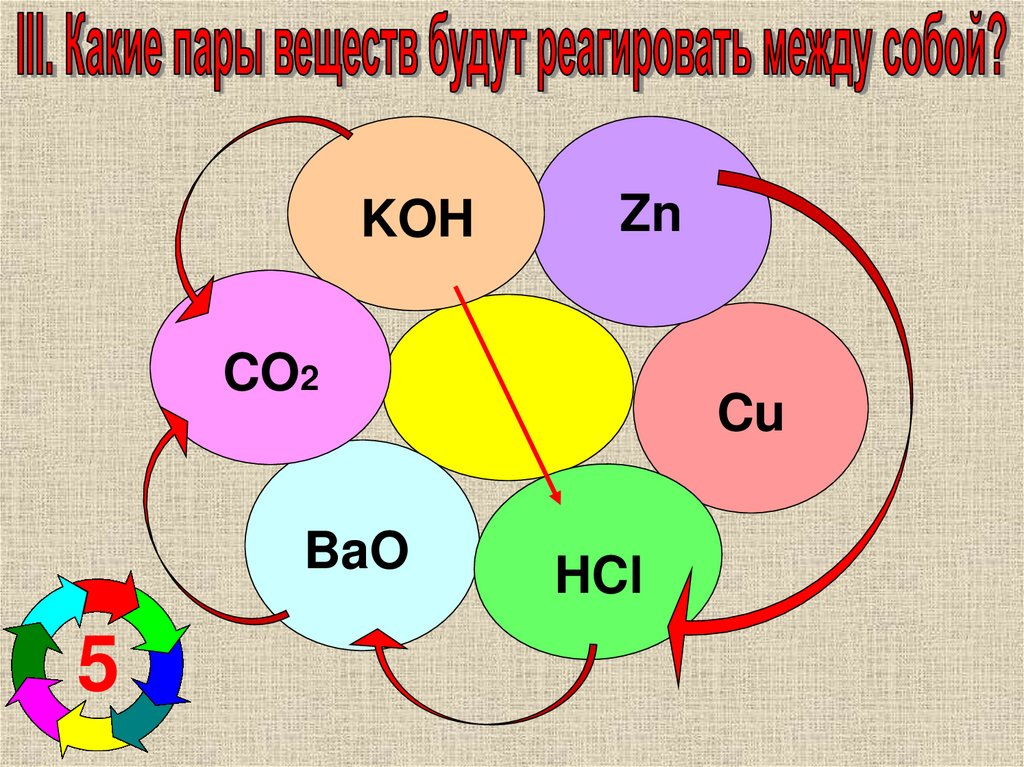
7.
KOHZn
CO2
BaO
5
Cu
HCl
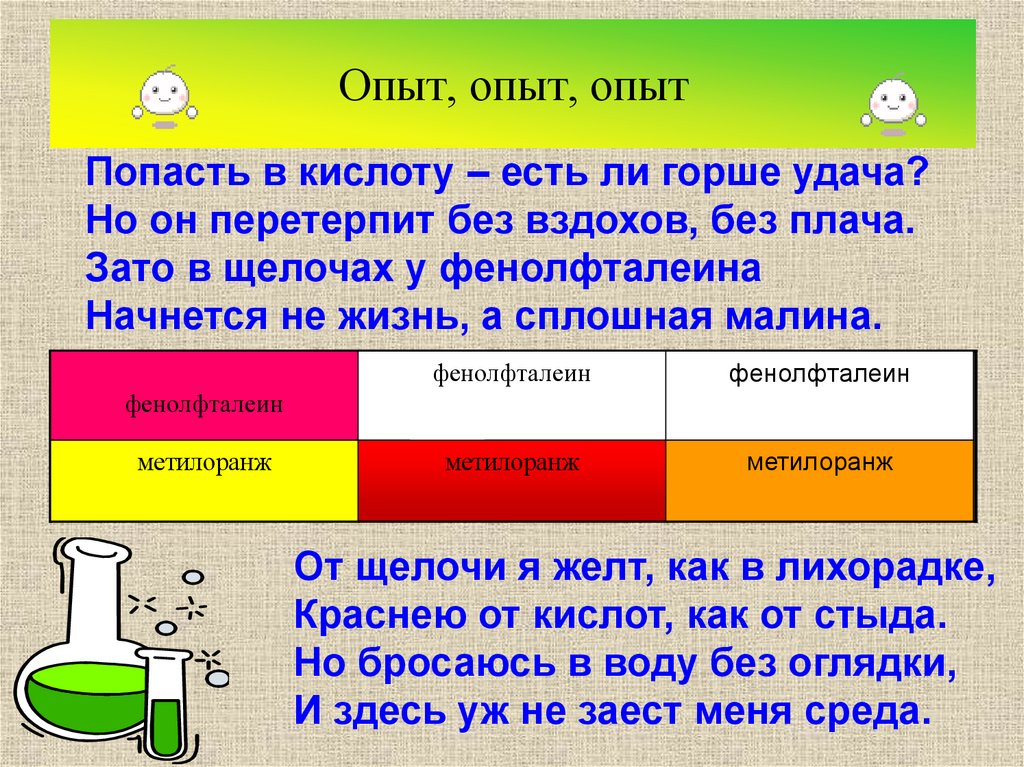
8. Опыт, опыт, опыт
Попасть в кислоту – есть ли горше удача?Но он перетерпит без вздохов, без плача.
Зато в щелочах у фенолфталеина
Начнется не жизнь, а сплошная малина.
фенолфталеин
фенолфталеин
NaOH
метилоранж
HCl
метилоранж
фенолфталеин
Н2О
метилоранж
От щелочи я желт, как в лихорадке,
Краснею от кислот, как от стыда.
Но бросаюсь в воду без оглядки,
И здесь уж не заест меня среда.
9.
1. Zn(OH)… 2
+
2HCl
…
2. Cu(OH)2 →
CuO
…
+
→ ZnCl2 + 2H2O
H…
2O
3.
Fe…
2O3
2O
+ 6HCl → 2FeCl3 + 3 H…
4.
Mg
…
SO4 → MgSO4 + H2
+ H2…
2O
5. 3 CaO
… + 2H3PO4 → Ca3(PO4)2 + 3 H…
2O
6. 2 NaOH
…
+ H2SO4 → Na2SO4 + 2 H…
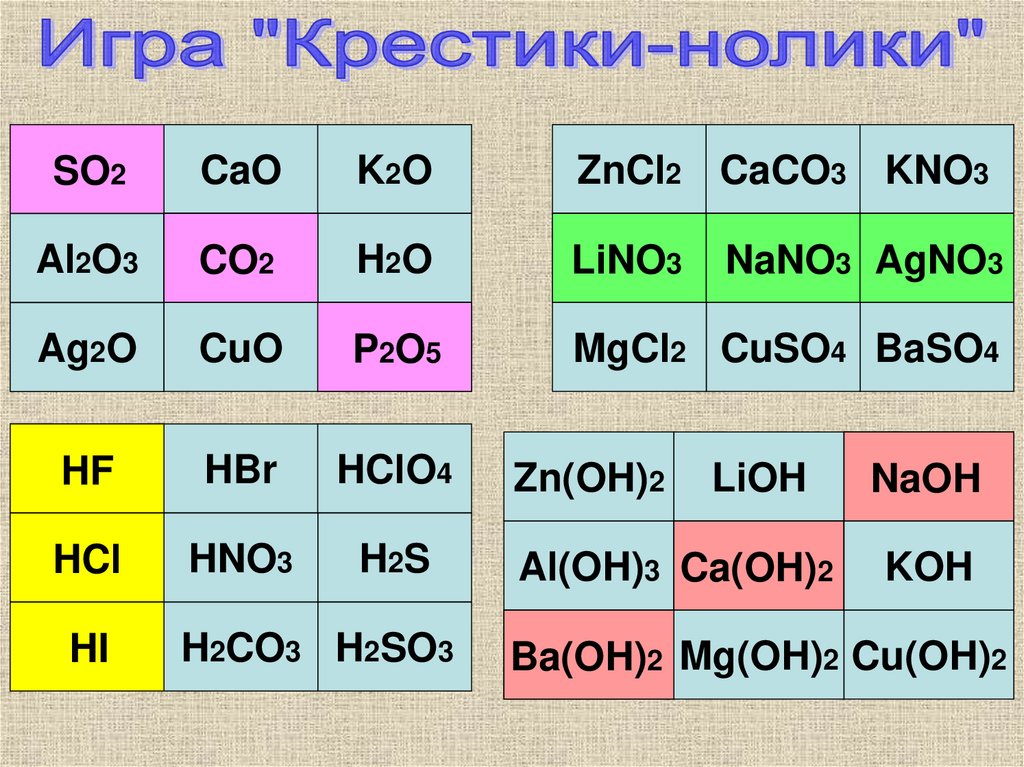
10.
SO2CaO
K2O
ZnCl2 CaCO3 KNO3
Al2O3
CO2
H2O
LiNO3
Ag2O
CuO
P2O5
MgCl2 CuSO4 BaSO4
HF
HBr
HClO4
Zn(OH)2
LiOH
NaOH
HCl
HNO3
H2S
Al(OH)3 Ca(OH)2
KOH
HI
H2CO3 H2SO3
NaNO3 AgNO3
Ba(OH)2 Mg(OH)2 Cu(OH)2
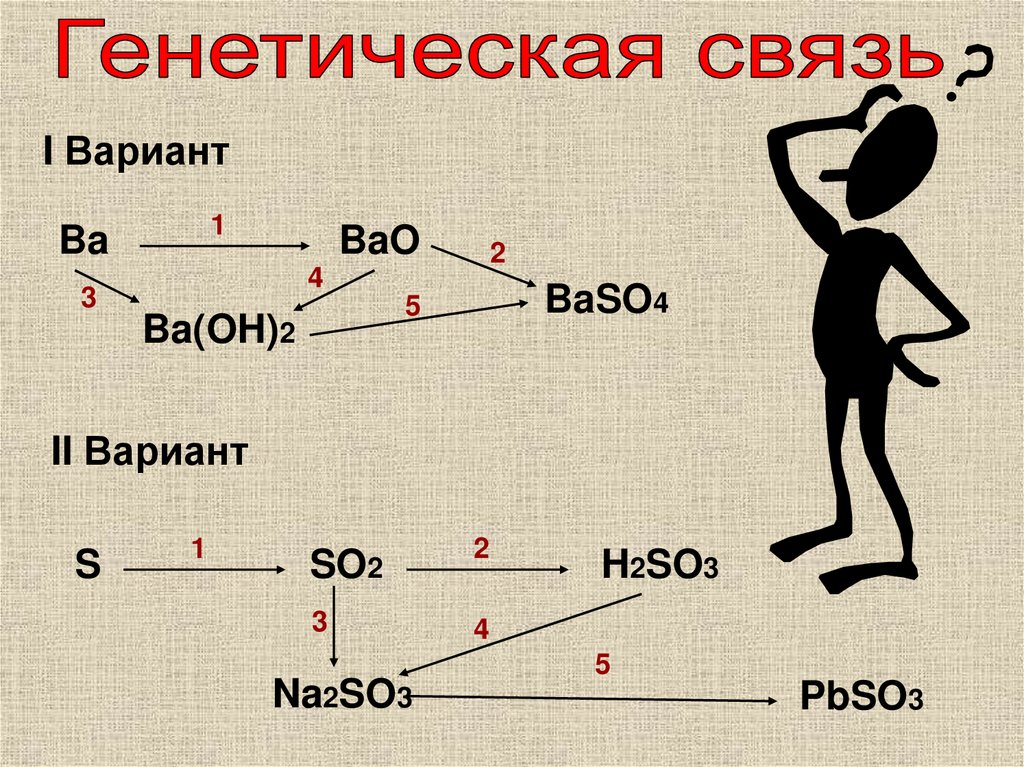
11.
I Вариант1
Ba
BaO
2
4
3
BaSO4
5
Ba(OH)2
II Вариант
S
1
SO2
2
3
4
Na2SO3
H2SO3
5
PbSO3
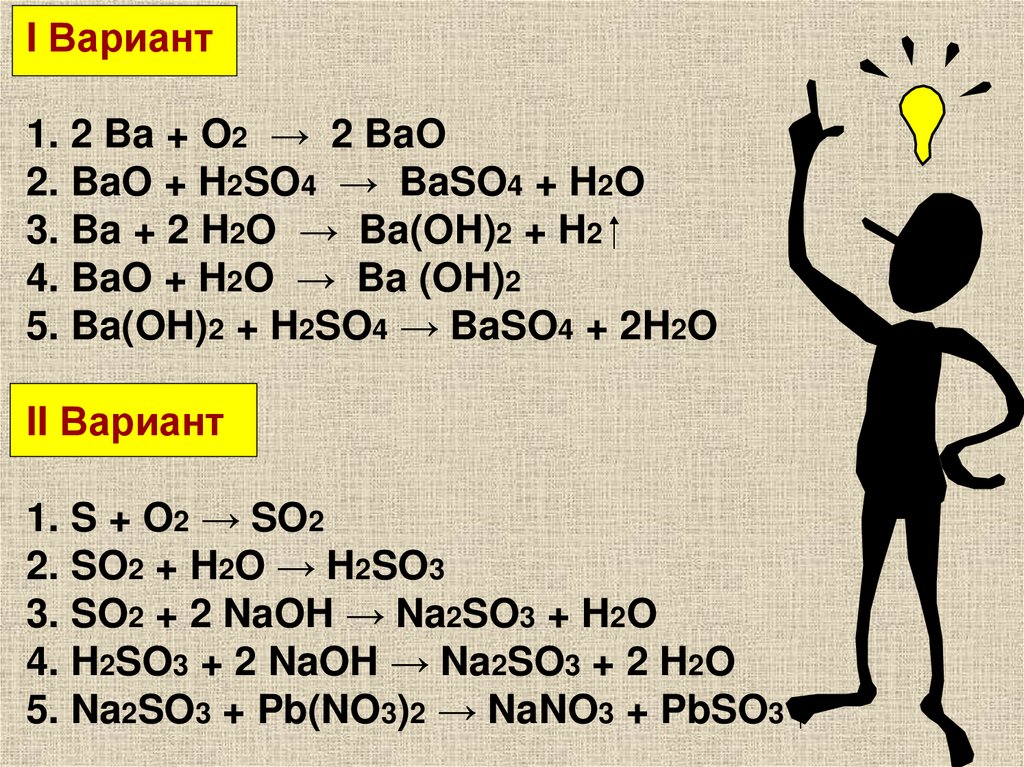
12.
I Вариант1. 2 Ba + O2 → 2 BaO
2. BaO + H2SO4 → BaSO4 + H2O
3. Ba + 2 H2O → Ba(OH)2 + H2
4. BaO + H2O → Ba (OH)2
5. Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
II Вариант
1. S + O2 → SO2
2. SO2 + H2O → H2SO3
3. SO2 + 2 NaOH → Na2SO3 + H2O
4. H2SO3 + 2 NaOH → Na2SO3 + 2 H2O
5. Na2SO3 + Pb(NO3)2 → NaNO3 + PbSO3
13.
Решение задач1. Какая масса соли образуется
при взаимодействии 7,6 г
оксида хрома (III) с
достаточным количеством
раствора серной кислоты?
1. Вычислите массу сульфита
натрия, образовавшегося при
пропускании 6,72 л сернистого
газа через избыток раствора
гидроксида натрия.
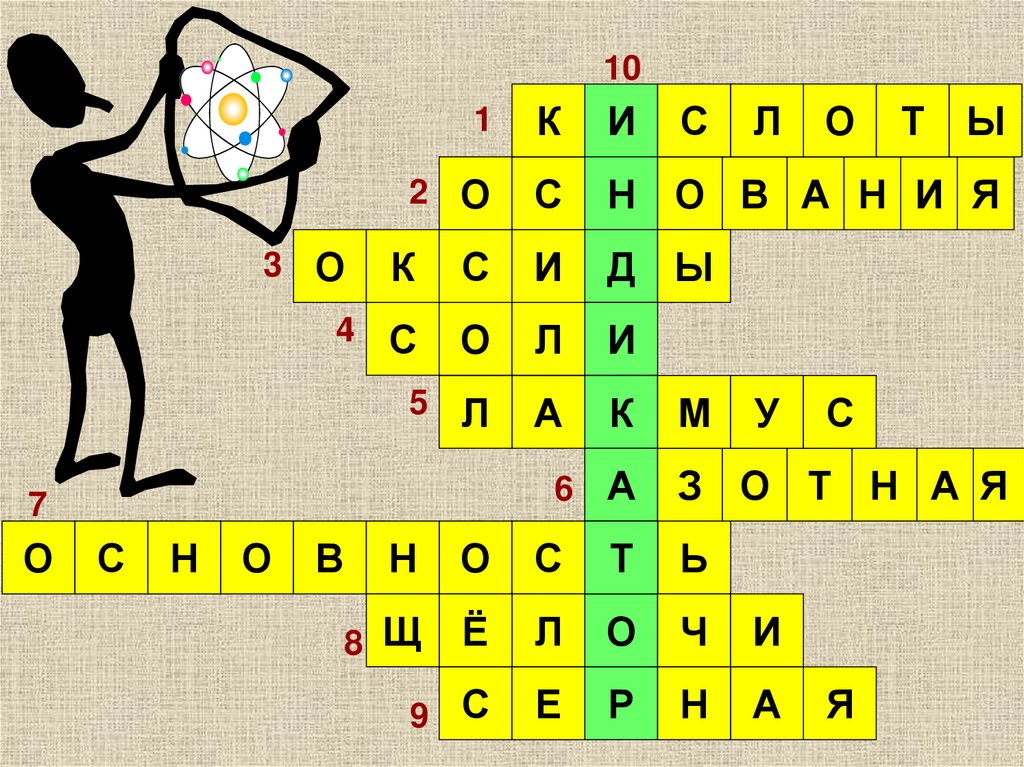
14.
101
К
И
2 О
С
Н О В А Н И Я
К
С
И
Д Ы
4 С
О
Л
И
5 Л
А
К
3 О
7
О
С
Н
О
В
С
М
Л
У
О
Т
Ы
С
6 А
З О Т Н А Я
Н
О
С
Т
Ь
8 Щ
Ё
Л
О
Ч
И
9 С
Е
Р
Н
А
Я



 Химия
Химия








