Похожие презентации:
Аммиак (определение)
1.
ПРЕЗЕНТАЦИЮ ВЫПОЛНИЛУЧЕНИК 9”Б” КЛАССА ИВАНОВ МАКСИМ
2.
СОДЕРЖАНИЕПРЕЗЕНТАЦИИ
1.
Аммиак (определение)
2.
История получения аммиака.
3.
Строение молекулы и физ.свойства
4.
Способы получения аммиака.
5.
Химические свойства.
6.
Образование иона аммония.
7.
Токсичность аммиака.
8.
Применение аммиака.
3.
АММИАКАммиак - это соединение азота и
водорода с формулой NH3.
Стабильный бинарный гидрид и
простейший гидрид пниктогена,
аммиак представляет собой
бесцветный газ с отчетливым резким
запахом. Это распространенные
азотистые отходы, особенно среди
водных организмов, и они вносят
значительный вклад в
удовлетворение потребностей
наземных организмов в питании,
являясь предшественником 45
процентов мирового продовольствия
и удобрений.
4.
ИСТОРИЯ ПОЛУЧЕНИЯАММИАКА
Впервые аммиак был получен в чистом виде в 1774
английским химиком Джозефом Пристли. Он нагревал
нашатырь (хлорид аммония) с гашеной известью
(гидроксид кальция). Реакцию 2NH4Cl + Ca(OH)2 ® NH3 +
CaCl2 до сих пор используют в лабораториях, если
требуется получить небольшие количества этого газа.
Выделявшийся аммиак Пристли собирал над ртутью. Он
назвал его «щелочным воздухом», поскольку водный
раствор аммиака имел все признаки щелочи. В 1784
французский химик Клод Луи Бертолле с помощью
электрического разряда разложил аммиак на элементы и
установил, таким образом, состав этого газа. Официальное
название «аммониак» получил в 1787– от латинского
названия нашатыря – sal ammoniac; эту соль получали
близ храма бога Амона в Египте. Это название сохраняется
и ныне в большинстве западноевропейских языков (нем.
Ammoniak, англ. ammonia, фр. ammoniaque); сокращенное
название «аммиак» которым мы пользуемся, ввел в
обиход в 1801 русский химик Яков Дмитриевич Захаров,
который впервые разработал систему русской химической
номенклатуры.
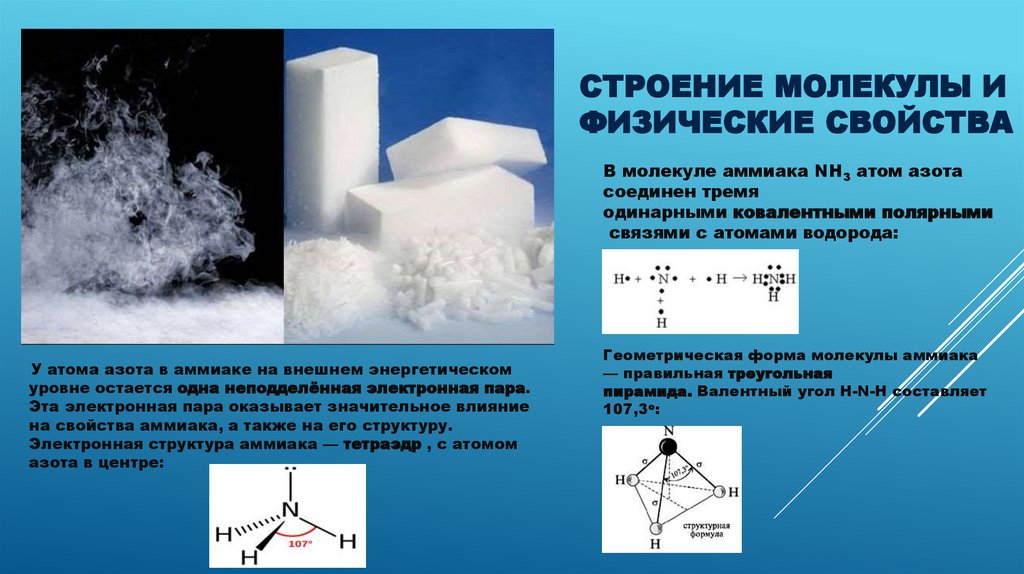
5.
СТРОЕНИЕ МОЛЕКУЛЫ ИФИЗИЧЕСКИЕ СВОЙСТВА
В молекуле аммиака NH3 атом азота
соединен тремя
одинарными ковалентными полярными
связями с атомами водорода:
У атома азота в аммиаке на внешнем энергетическом
уровне остается одна неподделённая электронная пара.
Эта электронная пара оказывает значительное влияние
на свойства аммиака, а также на его структуру.
Электронная структура аммиака — тетраэдр , с атомом
азота в центре:
Геометрическая форма молекулы аммиака
— правильная треугольная
пирамида. Валентный угол H-N-H составляет
107,3о:
6.
СПОСОБЫ ПОЛУЧЕНИЯ АММИАКАВ лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку
аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые
вещества. Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида
кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl
+ Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ
собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная
лакмусовая бумажка синеет в присутствии аммиака.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2
+ 6H2O → ЗСа(OH)2
+
2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом
из водорода и азота.
N2 + 3Н2
⇄
2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза
аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с
добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных
веществ применяют метод циркуляции не провзаимодействовавших реагентов: не вступившие в
реакцию азот и водород вновь возвращают в реактор.
7.
ХИМИЧЕСКИЕСВОЙСТВА АММИАКА
Активен
Вступает в реакции взаимодействия с
разными веществами
Проявляет восстановительные свойства
Степень окисления азота в аммиаке «3»
В присутствии катализатора окисляется
до азота 3
При нагревании аммиака с галогенами,
оксидами тяжелых металлов и
кислородом получает азот
Не имеет кислотных свойств
Имеет неподелённую пару электронов
При взаимодействии с кислотами
образует соли аммония
8.
ОБРАЗОВАНИЕ ИОНА АММОНИЯ9.
ТОКСИЧНОСТЬ АММИАКААммиак относится к токсичным веществам, по ГОСТ 12.1.007-76 его относят к 4-му уровню опасности.
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного
действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое
поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные
покровы[16]. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное
слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля,
покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает
жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при
испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени.
Запах аммиака ощущается при концентрации 37 мг/м³[17].
Предельно допустимая концентрация аммиака в воздухе рабочей зоны производственного помещения
(ПДКр.з.) составляет 20 мг/м3. В атмосферном воздухе населённых пунктов и в жилых помещениях
среднесуточная концентрация аммиака (ПДКс.с.) не должна превышать 0,04 мг/м3 [19]. Максимальная
разовая концентрация в атмосфере — 0,2 мг/м3. Таким образом, ощущение запаха аммиака свидетельствует
о превышении допустимых норм.
Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м3, глаз — 490 мг/м3. При
действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м3 — эритематозный,
21 г/м3 и более — буллёзный дерматит. Токсический отёк лёгких развивается при воздействии аммиака в
течение часа с концентрацией 1,5 г/м3. Кратковременное воздействие аммиака в концентрации 3,5 г/м3 и
более быстро приводит к развитию общетоксических эффектов.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м3) наблюдается на Индо-Гангской
равнине, в Центральной долине США и в Туркестанской (ранее — Южно-Казахстанской) области
Казахстана.
10.
ПРИМЕНЕНИЕАММИАКА
В больших количествах
аммиак применяется
для производства
азотной кислоты и
минеральных
удобрений, а также
красителей и
взрывчатых веществ.
Используется в
холодильных
установках.
Нашатырный спирт
находит применение в
медицине и в быту









 Химия
Химия








