Похожие презентации:
Физическая и коллоидная химия. Электропроводность растворов электролитов
1. Физическая и коллоидная химия
Лекция: Электропроводность растворовэлектролитов.
Пасека Александра Евгеньевна
2. Электропроводность растворов электролитов
Электропроводность (электрическая проводимостьили проводимость) - способность раствора проводить
электрический ток.
Электропроводность растворов электролитов зависит от
природы, концентрации раствора, величины эл. заряда
ионов,
их
размеров,
природы
растворителя,
температуры.
Скорость движения иона в эл. поле:
υ = (ez/R)∙∆U/l,
где e – элементарный эл. заряд; z – заряд иона; ∆U –
разность потенциалов между электродами; l –
расстояние между электродами.
3. Электропроводность растворов электролитов
Если градиент потенциала ∆U/l = 1 В/м, тоскорость движения иона называют
абсолютной скоростью движения иона и
обозначают uº = ez/R.
Единица измерения uº в системе СИ: м2∙В-1∙с-1,
но часто используют см2∙В-1∙с-1.
Абсолютная скорость движения иона в данном
растворе при данной температуре зависят
только от природы иона и его заряда, т.е.
является постоянной для каждого иона.
4. Электропроводность растворов электролитов
Электрическое сопротивление: R = ρ∙l/S = l/χS,χ = l/RS
(1),
где ρ – удельное сопротивление, а величина,
обратная удельному сопротивлению, - удельная
электрическая проводимость: χ = 1 / ρ.
Удельная электропроводность представляет
собой проводимость 1 м3 раствора, помещенного
между параллельными электродами с площадью
равной 1 м2, находящимися на расстоянии 1 м при
градиенте электрического потенциала 1 В/м.
[χ] = См/м (1См = 1 Ом-1) в системе СИ.
5. Электропроводность растворов электролитов
По первому закону Ома: I = U/R(2)
Подставляя R из (2) в (1), получаем: χ = Il/SU
При l = 1 м, S = 1 м2, U = 1 В :
χ = I.
Удельная электропроводность раствора
электролита численно равна току, который
переносится электролитом через раствор
объёмом 1 м3 при расстоянии между
электродами , равном 1 м, и градиенте
потенциала 1 В/м.
6. Электропроводность растворов электролитов
Эл. ток складывается из тока, переносимого катионами ианионами: I = i+ + i-.
i+ = NeαC uº+∙103, i- = NeαC uº-∙103,
где uº+, uº- - абсолютные скорости движения катиона и
аниона; 103 – коэффициент перехода от 1 дм3 к 1 м3.
Тогда χ = I = NeαC uº+∙103 + NeαC uº-∙103 =
= 103 NeαC (uº+∙+ uº-).
Ne = F = 96485 Кл/моль – число Фарадея.
χ = I = 103αC F (uº+ + uº-) = 103αC(Fuº+ + Fuº-),
Fuº+ = λº+, Fuº- = λº-,
где λº+, λº- - предельные подвижности ионов.
χ = I = 103αC(λº+ + λº-) (3).
7. Электропроводность растворов электролитов
Рис. 1. Зависимость удельной электропроводностирастворов электролитов от концентрации
Для выявления удельной
электропроводности от температуры
пользуются эмпирическими
формулами для разбавленных
водных растворов электролитов:
χ = χ25 [1 + a(t – 25) + b(t – 25)2],
χ25 - удельная электропроводность
раствора при 25ºС; а, b – эмпирические
константы, зависящие
от природы электролита.
8. Электропроводность растворов электролитов
. Эквивалентная электропроводность λ – этопроводимость
раствора,
помещенного
между
одинаковыми
электродами,
расположенными
на
расстоянии 1 м, а площадь электродов должна быть такой,
чтобы в объеме раствора между ними содержалась
молярная масса эквивалента вещества (моль).
λ = χ×V = χ∙10-3/С,
(4)
где λ - эквивалентная электропроводность при данном
разведении раствора; V – разведение раствора; χ –
удельная электропроводность раствора.
[λ] = См∙м2/моль или Ом-1∙м2/моль.
Разведением или разбавлением раствора называют
величину, обратную концентрации раствора: V = 1/C,
где С – эквивалентная концентрация раствора, моль/л.
После подстановки (3) в (4) получаем: λ = α∙(λº+ + λº-).
9. Электропроводность растворов электролитов
Эквивалентная электропроводность как сильных, так и слабыхэлектролитов увеличивается с уменьшением концентрации, то есть
с увеличением разбавления раствора, и достигает некоторого
предельного
значения,
называемого
эквивалентной
электропроводностью при бесконечном разведении, и обозначается
λ∞.
Рис.2
Зависимость эквивалентной электропроводности от
разведения растворов электролитов:
1 – СH3COOH; 2 – CuSO4; 3 – KCl; 4 – HCOOH; 5 – KOH.
Рис.3 Зависимость эквивалентной
электропроводности от концентрации
10. Электропроводность растворов электролитов
Предельная эквивалентная электропроводимость λ∞ - этоэлектрическая проводимость гипотетического бесконечно
разбавленного
раствора,
характеризующаяся
полной
диссоциацией
электролита
и
отсутствием
сил
электростатического взаимодействия между ионами:
λ∞ = λº++ λº(5)
Это закон независимого движения ионов (закон Кольрауша):
эквивалентная электрическая проводимость при бесконечном
разведении λ∞ равна сумме электрических подвижностей
катиона λº+ и аниона λº- данного электролита.
В
бесконечно разбавленном растворе ионы движутся
независимо друг от друга.
В бесконечно разбавленном растворе ионы не взаимодействуют и
подвижность становится величиной постоянной, зависящей
только от природы иона и температуры. В стандартных условиях
подвижность – табличная величина.
[λº] = Ом-1м2/моль или См∙ м2/моль.
11. Электропроводность растворов электролитов
Разделим λ = α∙(λº+ + λº-) на λ∞ = λº++ λº-α = λ/ λ∞.
При полной диссоциации электролита α = 1,
λ = λ∞
12. Электропроводность растворов электролитов
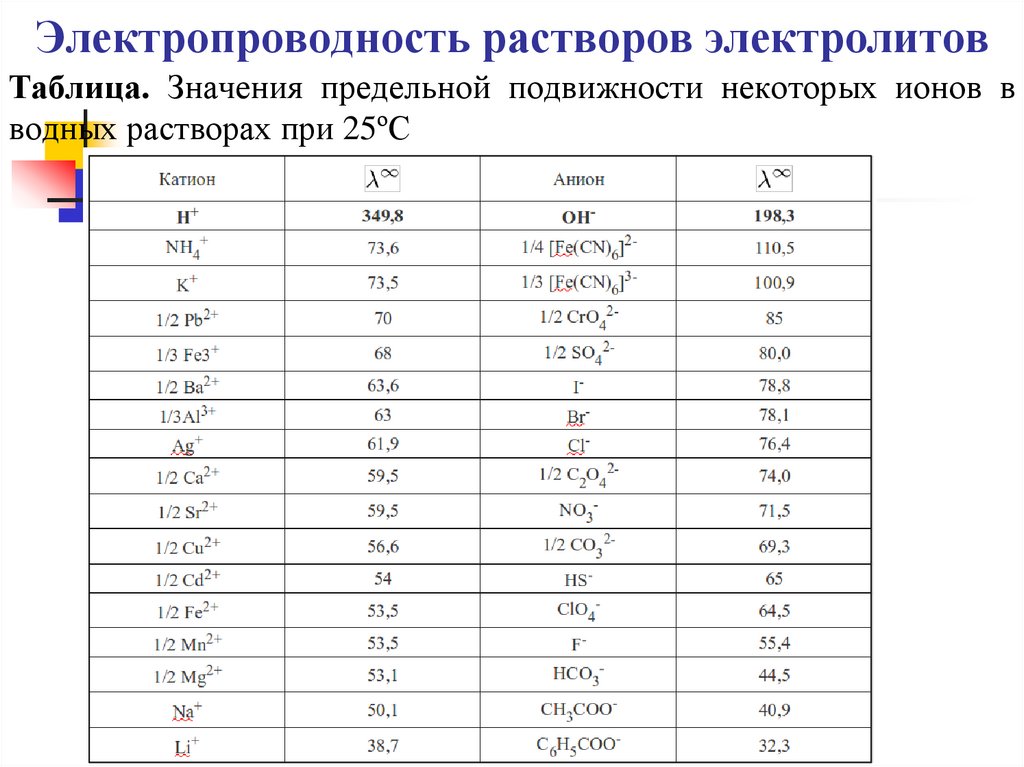
Таблица. Значения предельной подвижности некоторых ионов вводных растворах при 25ºС
13. Электропроводность растворов электролитов
Эстафетный механизм миграции ионов гидроксония игидроксила
Н2О-Н+…….ОН2 → Н2О……Н+-ОН2 →
направление движения к катоду →
Н-О-……Н – О – Н → Н –О – Н……О- – Н
движение ОН- → к аноду
к катоду ← перескок протонов
14. Электропроводность растворов электролитов
Уменьшение эквивалентной электропроводности растворовэлектролитов с увеличением концентрации растворов
λ = λ∞ – ∆λэ – ∆λр,
где ∆λэ и ∆λр – уменьшение эквивалентной электропроводности
раствора сильного электролита за счёт электрофоретического и
релаксационного эффектов.
Электрофоретический эффект.
∆λэ = [Aэ/(ηε1/2 T1/2)]∙I1⁄2,
где Аэ = 41,2(z- + z+)
Релаксационный эффект
∆λр = [Aрλ∞/(ε3/2 T3/2)]∙I1⁄2, где Ар = 8,2∙105 для бинарного
электролита, состоящего из однозарядных ионов.
λ = λ∞ – [Aэ/(ηε1/2 T1/2)]∙I1⁄2 – [Aрλ∞/(ε3/2 T3/2)]∙I1⁄2 = λ∞ – [Aэ/η(ε T)1/2
+ Aрλ∞/(εT)3/2]∙I1⁄2.
λ = λ∞ – АС1/2 – это уравнение Кольрауша.
15. Электропроводность неводных растворов электролитов
Правило Каблукова – Нернста – Томсона:чем
выше
диэлектрическая
проницаемость
растворителя,
тем
больше
степень
электролитической диссоциации растворённого
электролита и электропроводность его раствора.
Эмпирическое правило Писаржевского – Вальдена:
для
разбавленных
растворов
произведение
предельной эквивалентной электропроводности и
вязкости
растворителя
приблизительно
постоянно при постоянной температуре:
λ∞∙η = const.
16. Электропроводность растворов электролитов
Методы кондуктометрииR = 1/ χ∙f∙l/s,
f ∙l/s = Кя
Удельная электропроводность растворов KСl:
17. Электропроводность растворов электролитов
Определение степени и константы диссоциациислабого электролита по электрической
проводимости раствора
α= λ / λ∞, а λ∞ = λº++ λº-.
Предельные подвижности λº+ и λº- находят по
справочникам.
Кс = Сλ2/ λ∞(λ∞ - λ)
18. Электропроводность растворов электролитов
Метод прямой кондуктометрии. Расчет константыдиссоциации по методу Фуосса-Брея.
χ∙10-3=Кс(λ∞)2∙(1/ λ)-Ксλ∞
Кс= tgα/(λ∞)2
19. Электропроводность растворов электролитов
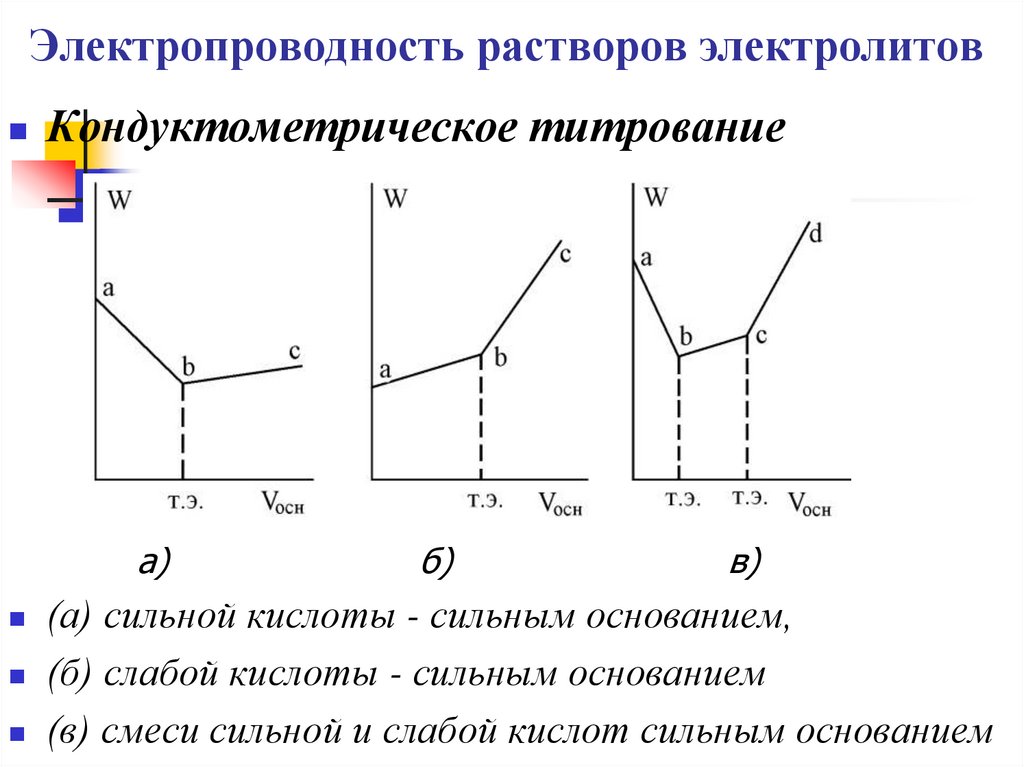
Кондуктометрическое титрованиеа)
б)
в)
(а) сильной кислоты - сильным основанием,
(б) слабой кислоты - сильным основанием
(в) смеси сильной и слабой кислот сильным основанием


















 Физика
Физика Химия
Химия








