Похожие презентации:
Строение атомного ядра
1. Атом – мельчайшая частица вещества, еще являющаяся носителем его химических свойств
2. Открытие протона
В 1913 г. Э. Резерфордвыдвинул
гипотезу,
что
одной из частиц , входящих
в ядро атома любого
химического
элемента
должно быть ядро атома
водорода,
т.к.
было
известно, что массы атомов
химических
элементов
превышают массу атома
водорода в целое число
раз.
Э. Резерфорд
3. Открытие нейтрона.
Английский ученый Дж.Чедвик выдвинул гипотезу о
существовании нейтральных
частиц, близких по размерам
и массе к протонам.
Эти частицы он назвал
нейтронами.
При
прохождении
через
вещество
нейтроны
не
теряют
энергию
на
ионизацию
атомов
вещества, поэтому имеют
огромную
проникающую
способность.
Дж. Чедвик
4.
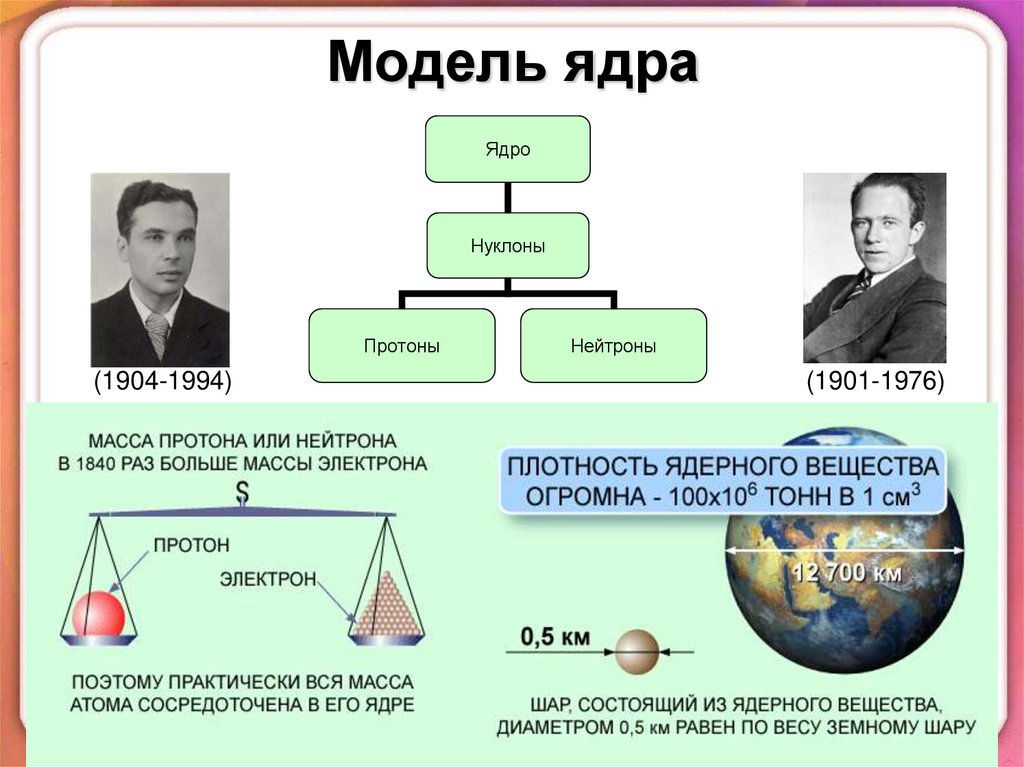
В 1932 году советский физикД. Д. Иваненко и немецкий физик
В.Гейзенберг предложили протоннонейтронную модель ядра: ядро состоит из
протонов и нейтронов (из нуклонов).
Дмитрий
Дмитриевич
Иваненко
(1904-1994)
Вернер Карл
Гейзенберг
(1901-1976)
5. Модель ядра
ЯдроНуклоны
Протоны
(1904-1994)
Нейтроны
(1901-1976)
6. Переписать
7.
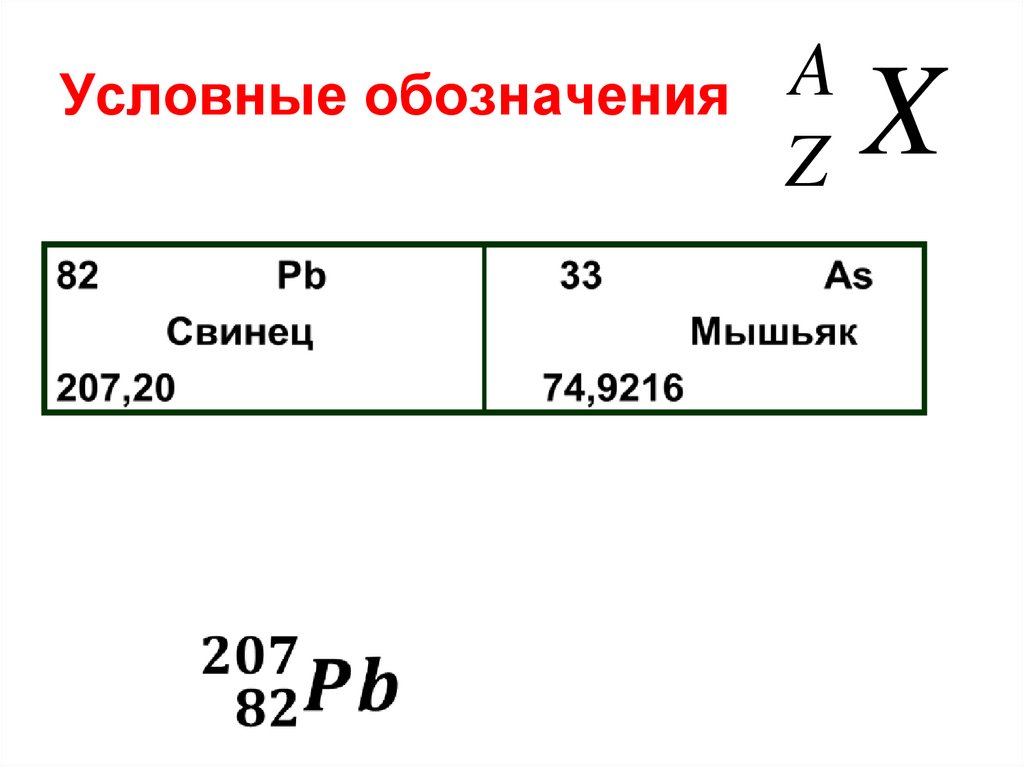
Z – число протонов в составе ядраравно порядковому номеру
химического элемента в таблице
Менделеева;
N – число нейтронов
А = N + Z; N =А – Z;
A – массовое число ядра, равняется
атомной массе химического
элемента, округленной до целого.
А = сумме всех протонов и
нейтронов в ядре. Переписать
8. Условные обозначения
AZ
X
9.
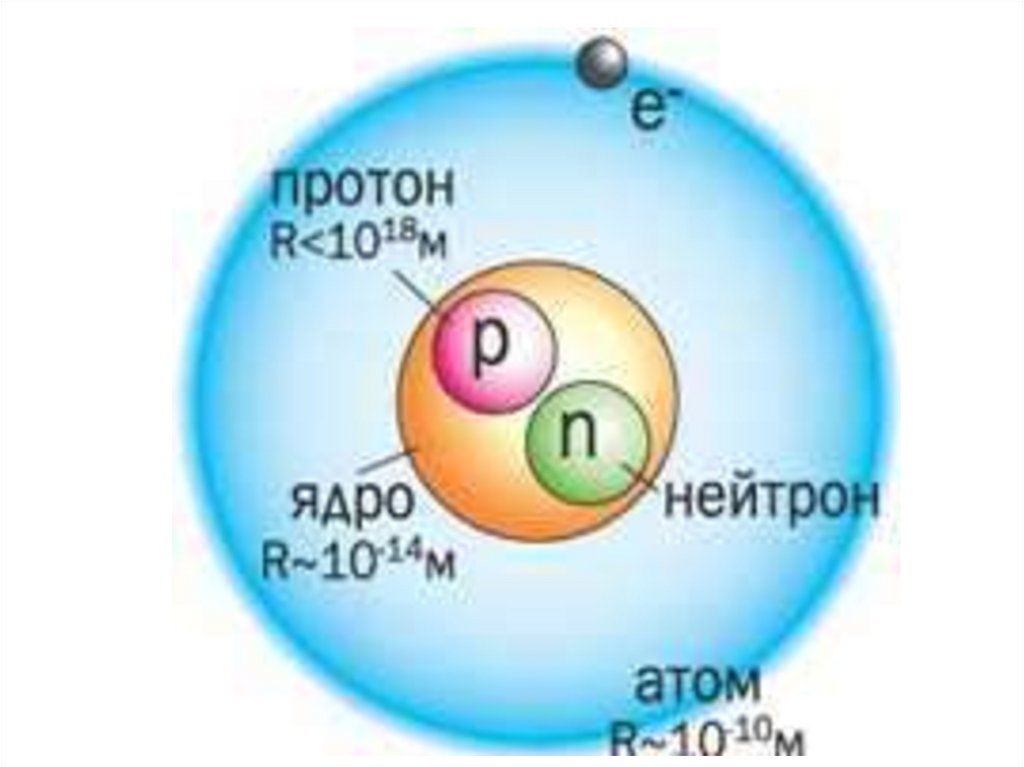
Ядро атома – сложное образованиепримерно сферической формы
1. Размеры ядер тем больше, чем больше в
них нуклонов
2. Плотность нуклонов в ядре велика около
1017 кг/м3
3. Наиболее плотно нейтроны
располагаются в центре ядра, а ближе к
краям плотность убывает
4. Эксперименты подтверждают сложную
структуру протонов и нейтронов и наличие
внутри них точечноподобных центров
10.
Модель подтвержденаисследованиями ядерных
превращений и сегодня является
бесспорной.
С увеличением порядкового номера
радиус ядра увеличивается:
R 1,2 A *10
3
13
см
11. Характеристики атомных частиц
ЧастицаМасса
Заряд
Электрон
9,11 * 10-31кг
-1,67*10-19Кл
Протон
1836mе
1.627*10
Нейтрон
-27
1839me
1,67*10-19Кл
0
12. Модель подтверждена исследованиями ядерных превращений и сегодня является бесспорной.
Для ядер существенны квантовые законыповедения, то они не имеют четко
определенных границ.
Можно говорить только о некотором
среднем радиусе ядра.
С увеличением массового числа радиус
ядра увеличивается:
R 1,2 A *10
3
13
см
13. Величины, характеризующие ядро
Диаметр ядра измеряют в фемтометрах1фм=10-15 м
Для легких ядер – 1фм, тяжелых – до 10 фм
Массы ядер измеряют в атомных единицах массы
1 а.е.м.=1,66·10-27 кг1 МэВ=1,6·10-13Дж
1 а.е.м. соответствует энергия покоя, равная:
Е0=mc2=1,66∙10-27·9∙1016Дж=1,49∙10-10 Дж
Энергетический эквивалент массы – величина 931,5
МэВ, соответствующая 1 а.е.м.
14. В обычных условиях атом не имеет заряда. Значит заряд ядра равен заряду всех электронов. Заряд ядра определяется числом
протонов, следовательно числопротонов равно числу
электронов.
15.
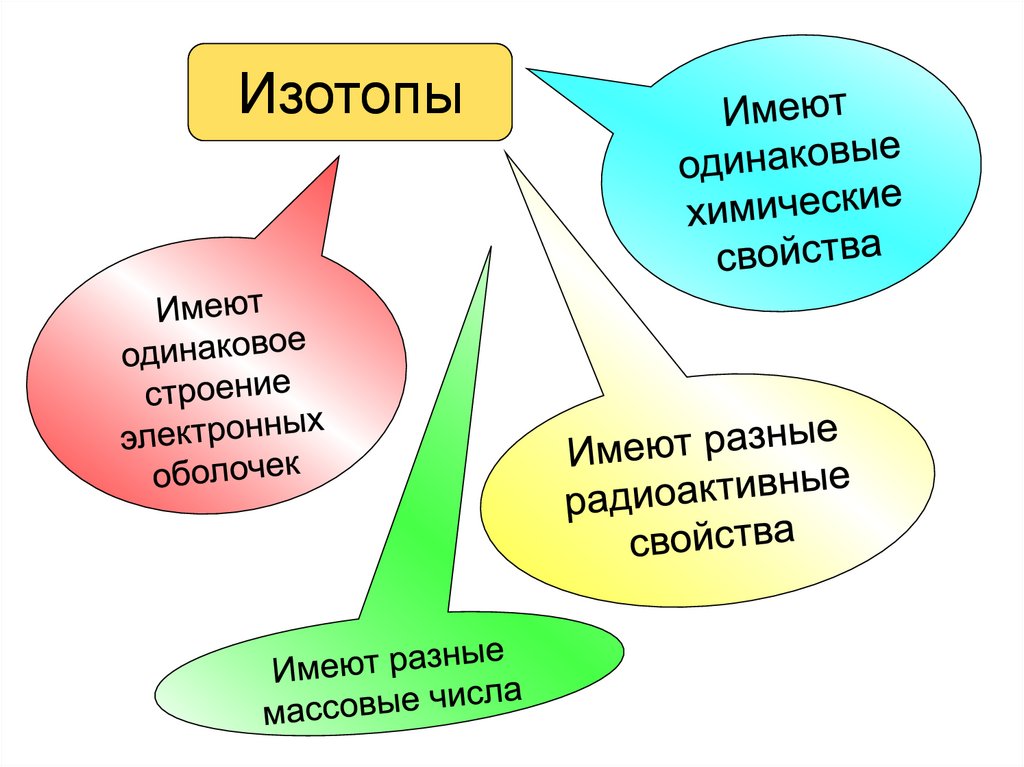
Изотопы - это химические элементы содинаковыми химическими
свойствами, но разными массами и
разной радиоактивности, разными
физическими свойствами.
Ядра изотопов одного элемента
содержат одинаковое число протонов,
но разное число нейтронов, т. е.
имеющие один и тот же Z при разных
N.
Химически чистые элементы
представляют собой смесь их
изотопов, поэтому массовые
числа элементов дробные
Все тела в природе содержат изотопы
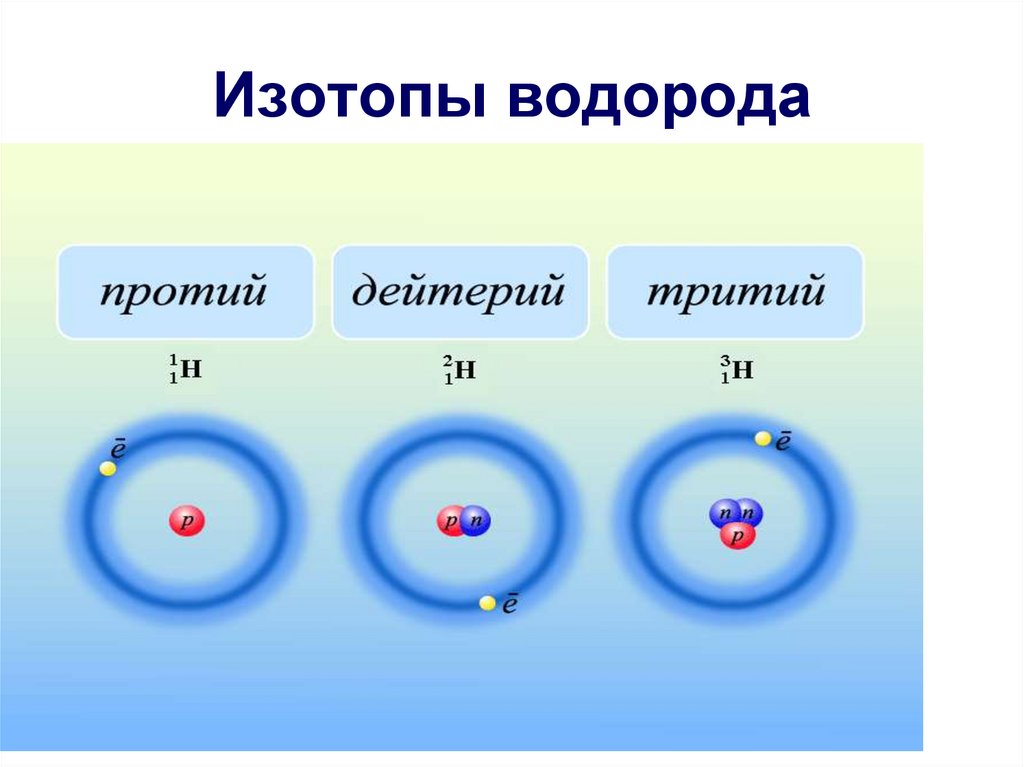
ИЗОТОПЫ
1
1
H
2
1
3
1
H
H
16. Изотопы водорода
17.
Изотопы18.
17С 1906 г. известно
35
17
Cl
Cl
37
17
М = 35,457
Cl
92
U
239
92
U
234
92
U
235
92
U
238
92
U
М = 238,0289
19. ИЗОТОПЫ
20.
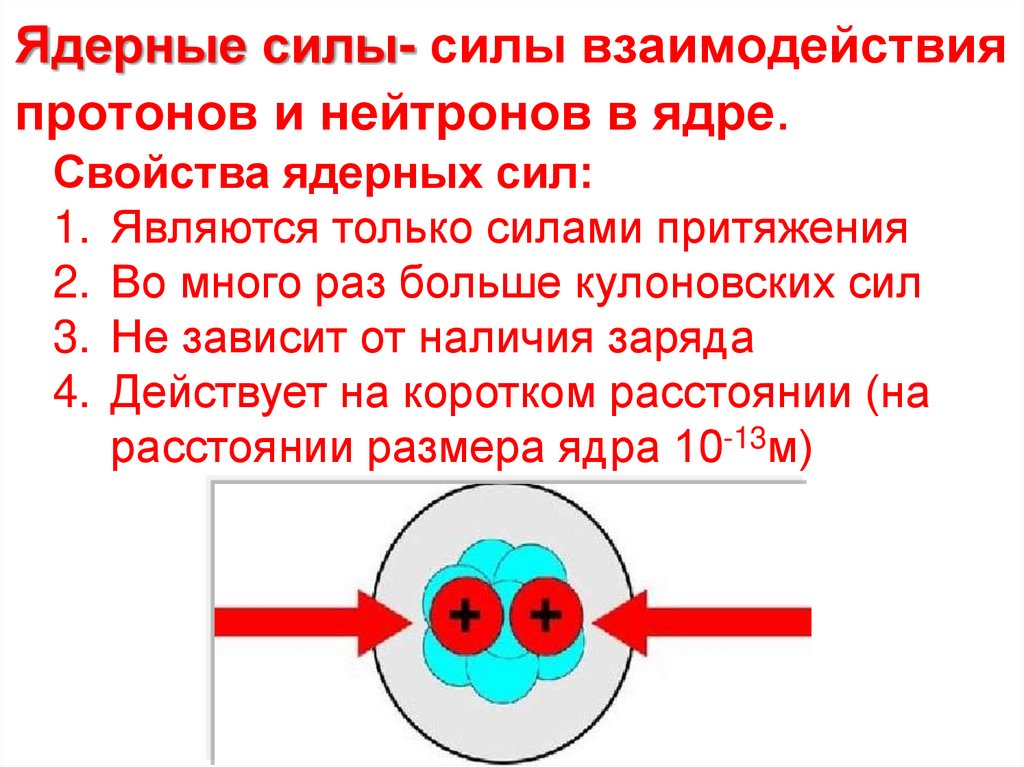
21. Ядерные силы- силы взаимодействия протонов и нейтронов в ядре.
Свойства ядерных сил:1. Являются только силами притяжения
2. Во много раз больше кулоновских сил
3. Не зависит от наличия заряда
4. Действует на коротком расстоянии (на
расстоянии размера ядра 10-13м)
22.
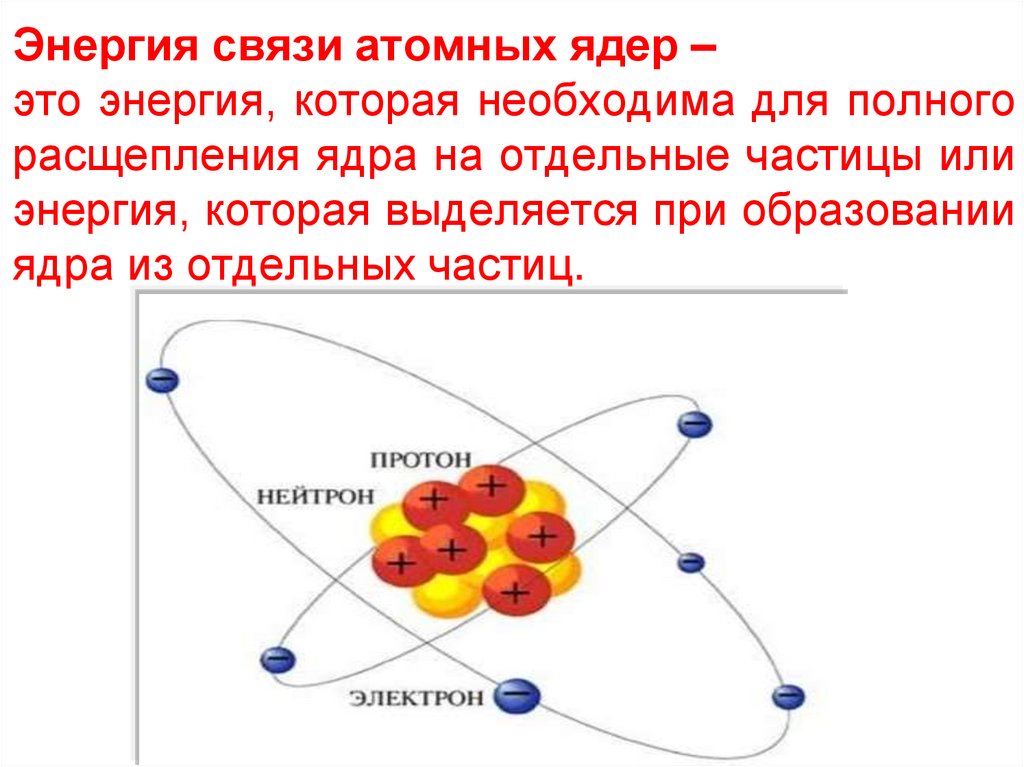
Энергия связи атомных ядер –это энергия, которая необходима для полного
расщепления ядра на отдельные частицы или
энергия, которая выделяется при образовании
ядра из отдельных частиц.
23. При делении ядра: масса покоя ядра всегда меньше суммы масс покоя освободившихся свободных частиц. При образовании ядра: масса
покояобразовавшегося ядра всегда меньше суммы
масс покоя протонов и нейтронов.
Масса покоя ядра Мя всегда меньше суммы
масс покоя слагающих его протонов и
нейтронов:
Дефект массы:
M я Zm p Nmn
Формулы переписать
M Zm p Nmn M я
24. Энергия связи ядер Формулы переписать
25. Энергия ядер элементов дискретна, т.е. квантуется
Нулевой уровень соответствуетосновному (невозбужденному) состоянию,
остальные – возбужденным состояниям
ядра
В возбужденном состоянии ядра
находятся значительно меньше времени,
чем атомы (10-13-10-17 с) после чего ядро
испускает гамма-кванты с длиной волны
10-10-10-14 м – самые короткие волны
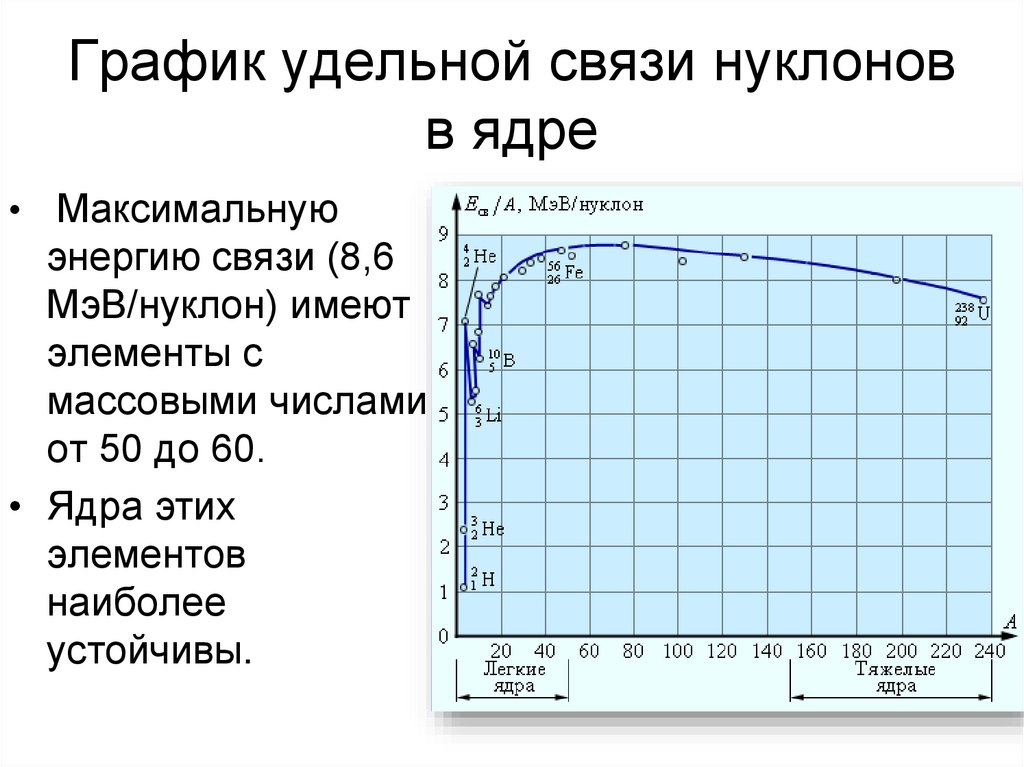
26. Удельная энергия связи
- это энергия связи, приходящаяся на одиннуклон.
- Если не считать самых легких ядер,
удельная энергия связи примерно
постоянна и равна 8 МэВ/нуклон.
27. График удельной связи нуклонов в ядре
• Максимальнуюэнергию связи (8,6
МэВ/нуклон) имеют
элементы с
массовыми числами
от 50 до 60.
• Ядра этих
элементов
наиболее
устойчивы.



















 Физика
Физика








