Похожие презентации:
Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода
1. Нуклеофильное замещение при насыщенном атоме углерода
Лекция 52. Классификация органических реакций
1)По характеру перестройки связей
- гетеролитические (ионные)
Разрыв связей в молекулах происходит без разъединения осуществляющей ковалентную связь
электронной пары
А В
+
А
-
+ В
электрофил
нуклеофил
- гомолитические
Разрыв связей в молекулах происходит с разъединением осуществляющей ковалентную связь
электронной пары
А В
А + В
Свободные радикалы
3. Радикалы
Факторы стабилизации радикалов: стерический эффект, сопряжение.Трифенилметил — стабильный свободный
радикал и первый радикал, описанный
в органической химии. Трифенилметил может
быть получен гомолитическим разложением
трифенилметилхлорида 1 металлами, например,
серебром.
4. Электрофилы
Электрофильные реагенты (Е, Е+) – это частицы, образующиеновые ковалентные связи за счет пары электронов
партнера
- положительно заряженные ионы
+
+
H
Hal
протон
NO2
галоген-катионы
+
нитроний-катион
NO
+
нитрозил-катион
C
+
карбокатион
- нейтральные молекулы, имеющие электронодефицитный центр
δ+
C
Х
Х – группа с – I- и/или
– М-эффектом
SO3
Триоксид серы
BF3, BCl3, FeBr3, AlCl3
Кислоты Льюиса
5. Нуклеофилы
Нуклеофильные реагенты (:Nu, Nu-) – это частицы, образующиеновые ковалентные связи со своим партнером, предоставляя
для этого электронную пару
- отрицательно заряженные ионы
HГидрид-ион
HalГалогенидионы
HOГидроксидион
ROАлкоксид-ион
NΞC-
HS-
Цианид-ион
C
Тиолят-ион
Карбанион
- нейтральные молекулы, имеющие неподеленную пару электронов
HO
2
R OH
R SH
спирты
NH
3
амины
тиолы
- доноры π-электронов
>С=С<
π-связь
Ароматическое кольцо
6. Карбокатион и карбанион
КарбокатионКарбанион
sp2-гибридизация
sp3-гибридизация
8 электронов на валентной
оболочке
6 электронов на валентной
оболочке
7. Карбокатионы
Факторы, увеличивающие стабильность карбокатионов:1) Электронодонорные заместители,
2) Сопряжение,
3) Стерические эффекты
8. Карбокатионы
9. Карбанионы
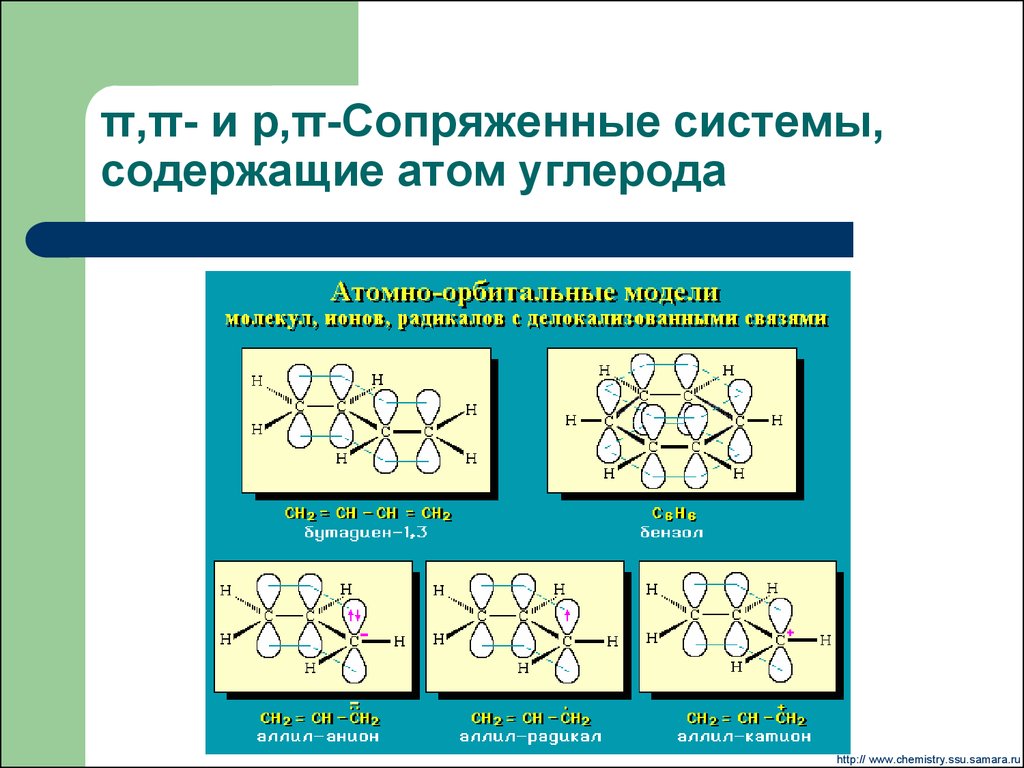
sp3-гибридизация10. π,π- и р,π-Сопряженные системы, содержащие атом углерода
http:// www.chemistry.ssu.samara.ru11. Карбанионы
Карбанионные центры могут находится в состоянии sp3гибридизации, sp2-гибридизации (в сопряженных системах,например, в аллил-, бензил-, циклопентадиенил-анионах) и sp1гибридизации (в ацетиленидах R-С≡C-).
p- -сопряжение, sp2-гибридизация атома углерода.
12. Карбанионы. Факторы стабилизации
1. Пространственный фактор — экранированиереакционного центра.
2. Резонансный фактор — чем больше резонансных
структур имеет карбанион, тем более он стабилен.
3. Природа и положение заместителей в углеродной
цепи — акцепторные заместители стабилизируют
карбанион.
Енолят-ионы стабилизированы за счёт
сопряжения и являются
амбидентантными нуклеофилами
13. Классификация органических реакций по типу частиц, участвующих в реакции
1. Радикальные реакции протекают с участием радикалов (например,радикальное замещение SR, радикальное присоединение AR)
2. Электрофильные реакции протекают с участием электрофилов.
(например, электрофильное замещение SE, электрофильное
присоединение AE).
3. Нуклеофильные реакции протекают с участием нуклеофилов
(например, нуклеофильное замещение SE, нуклеофильное
присоединение AE)
4. “Без механизма”. Реакции, протекающие без образования и
участия радикалов или ионов. Например, реакция Дильса-Альдера:
14. Реакции замещения
Реакции замещения (S) – один или несколько атомов или группатомов в молекуле замещаются на один или несколько иных
атомов или групп атомов; S - substitution
A-Х + Y
A-Y + X
Реакции нуклеофильного замещения (SN)
C-Х + Y
-
нуклеофил
нуклеофуг
C-Y + X
-
15. Механизмы SN-реакций
CH3Y
C
X
1) Мономолекулярный механизм SN1
2) Бимолекулярный механизм SN2
16. Мономолекулярный механизм SN1
CH3C
Y
Двухстадийный процесс
X
R
R
..
R1
C
1
X +Y
C
+
R2
R2
sp3
+X
R1
sp2
карбокатион
1- медленно, лимитирующая стадия
2 - быстро
-
..
+Y
2
R
R1
R
C
Y
+
Y
R2
C
R1
R2
рацемат
17. Изменение энергии системы вдоль координаты реакции при механизме SN1
ЕаR+ - карбокатион
Еа2
Еа1
карбокатион
Координата реакции
Скорость реакции SN1 зависит
только от концентрации
субстрата и не зависит от
концентрации нуклеофила
Первый порядок реакции
18. Эффект общего иона
k1R-X
+
R + X
медленная стадия
R-Y
быстрая стадия
k-1
+
R + Y
-
k2
R+ - карбокатион
[ RX ]
k
[R ]
[
k X ] k [Y- ]
+
1
1
2
-
[ RX ][Y ]
k
k
k [ R ][Y ]
- ] [ -]
[
k X k Y
+
-
1
2
2
1
2
При добавлении в систему Х скорость SN1 реакции уменьшается
19. Бимолекулярный механизм SN2
CH3Одностадийный процесс
C
Y
Y:
X
C
X
δY
δ+
C
δX
sp2
Пентакоординированное
бипирамидальное
Переходное
состояние
-
X + Y
C
20. Изменение энергии системы вдоль координаты реакции при механизме SN2
ЕаСкорость реакции SN2 зависит
от концентрации как субстрата,
так и нуклеофила
Второй порядок реакции
Координата реакции
21. Вальденовское обращение
Если замещение протекает при хиральном атоме углерода,наблюдается инверсия конфигурации
b
Y: +
a
b
b
a
C
d
X
Y
C
d
X
Y
a
C
d
22. Факторы, влияющие на скорость реакции SN
1)Строение субстрата
2)
Природа нуклеофила
3)
Природа уходящей группы
4)
Природа растворителя
5)
Пространственные факторы
6)
Катализаторы
23. Влияние строения субстрата на скорость реакции SN1
Rстабилизация
1) +I-эффект
C
+
R2
R1
карбокатион
Ускорение реакции
SN1
CH3Br < C2H6Br < (CH3)2CHBr <( CH3)3CBr
Увеличение +I-эффекта алкильной группы
2) +М-эффект
CH3Hal < C6H5CH2Hal < (C6H5)2CHHal < (C6H5)3Hal
Увеличение +M-эффекта фенильной группы
C
+
CH
3) Эффект сопряжения
+
24. Влияние строения субстрата на скорость реакции SN2
Электроноакцепторныегруппы
1)
Ускорение реакции SN2
-I-эффект
(СН3)3CХ < (СН3)2CHХ < С2Н5Х < СН3Х
Повышение скорости реакции SN2
2)
-М-эффект
3)
Пространственное строение субстрата (стерический фактор)
4)
Эффект сопряжения
25. Влияние стерического фактора на скорость реакции SN2
1)Алкилирование аминов алкилгалогенидами (реакция Меншуткина):
Четвертичное
аммониевое
основание
2) Объемистый заместитель находится в β–положении:
СН3СН2Х > СН3СН2СН2Х > (СН3)2СНСН2Х > (СН3)3ССН2Х
Понижение скорости реакции SN2
Х - галоген
26. Влияние заместителей
Заменой заместителя можно изменить механизм реакции-M
SN2
+M
SN1
27. Влияние природы нуклеофила на скорость реакции SN1
Скорость реакции SN1 не зависит от концентрации нуклеофила(он не участвует в лимитирующей стадии)
28. Влияние природы нуклеофила на скорость реакции SN2
1) Повышение концентрации нуклеофила приводит к увеличению скоростиреакции
2) Влияние природы нуклеофила (основания Льюиса)
- основность: способность нуклеофила связываться с протоном, т.е.
сродство к протону (влияние на кислотно-основное равновесие)
- нуклеофильность: способность нуклеофила связываться с
углеродом (или другими атомами), т.е. сродство к углероду (или
другим атомам) (влияние на скорость SN2)
Основания Льюиса – доноры пары электронов
29. Сравнительные теории кислот и оснований
30. Примеры взаимодействия кислот и оснований Бренстеда-Лоури
31. Нуклеофильность и основность
Nu- + H+-
Nu +
NuH
+
C X
положение равновесия, определяемое основностью
(основность - термодинамическая характеристика)
-X-
C
Nu
нуклеофильность - параметр, определяющий скорость
реакции (кинетическая характеристика)
Сильный нуклеофил не обязательно сильное основание
Сильное основание не обязательно сильный нуклеофил
32. Нуклеофильность и основность
Нуклеофил = основание, но основность и нуклеофильностьмогут не совпадать!
В протонном растворителе:
_
_
_
_
_
_
_
HO > СN > HS > F > Cl > Br > I
Уменьшение основности
_
_
_
_
_
_
HS > СN > I > HO > Br > Cl > F
Уменьшение нуклеофильности
_
33. Изменение нуклеофильности в периодах и группах
ростосновность
рост
уменьшение
основность
рост
34. Факторы, влияющие на основность
1) Чем больше электроотрицательность атома основного центра, темсильнее удерживается НЭП, тем меньше основность.
Зависимость действует для оснований, имеющих оснόвные центры
представленные атомами одного периода таблицы Менделеева.
Электроотрицательность: N < O < F
основность: NH3 > H2O > HF
то есть аммониевые основания сильнее, чем оксониевые. Амины являются
более сильными основаниями, чем спирты.
2) Электронодонорные заместители увеличивают оснόвность,
электроноакцепторные уменьшают.
35. Влияние природы растворителя на нуклеофильность
Сила нуклеофила в протонном растворителе(вода, аммиак, карбоновые кислоты, спирты)
H-XR
_
_
_
I > Br > Cl > F
RX-H
_
Уменьшение нуклеофильности
H-XR
_
RX-H
Nu
RX-H
RX-H
H-XR
H-XR
Причина: увеличение эффективности сольватации,
приводящей к делокализации заряда
Сила нуклеофила в апротонном растворителе
_
_
_
F > Cl > Br > I
(углеводороды)
_
Уменьшение нуклеофильности
Причина: отсутствие сольватации аниона приводит к увеличению плотности
заряда на анионе
36. Изменение нуклеофильности
Депротонированная форма является более сильным нуклеофилом,чем протонированная:
_
Н2О более слабый нуклеофил, чем ОН
_
ROH более слабый нуклеофил, чем RO
_
NH3 более слабый нуклеофил, чем NH2
Сила нуклеофила увеличивается с его поляризуемостью (с
увеличением размера атома-нуклеофильного центра):
_
_
RO более слабый нуклеофил, чем RS
37. Резюме
Увеличение нуклеофильности повышаетвероятность протекания реакции по
механизму SN2
38. Влияние природы уходящей группы на скорость реакции SN
C-Х + Y-
+
-
C-Y + X
основание
Уходящая группа отщепляется тем легче, чем она лучше
поляризуема и лучше сольватируется, то есть, чем более
слабым основанием она является
39. Влияние природы растворителя на скорость реакции SN: виды растворителей
Присутствуют донорыводорода для Н-связи
Растворители
Вода, аммиак, карбоновые
кислоты, спирты
протонные
полярные
апротонные
Отсутствуют доноры
водорода для Н-связи
Неполярные
апротонные
Отсутствуют доноры
водорода для Н-связи
•Углеводороды
•Третичные амины
O
O
S
ДМСО
H
O
N
ДМФА
ацетон
•Простые и сложные
эфиры
•Пиридин
40. Влияние природы растворителя на скорость реакции SN1
Сольватация карбокатиона молекулами воды:H
H
:
H
R
:O
:
:
O:
O
:
H
H
:
:
O: R2
:
H
H
+
:
C
H
R1 :O
O
H H
(CH 3)3C
Cl
+
H H
растворитель
C2H5OH
трет-бутилхлорид
(CH 3)3C
O
C 2 H5
+
HCl
трет-бутилэтиловый эфир
Растворитель
Н2О
С2Н5ОН (20%)
С2Н5ОН
Относительная реакционная способность
100
14
0,01
Полярные протонные растворители благоприятствуют протеканию
реакции по механизму SN1
41. Влияние природы уходящей группы на скорость реакции SN
Сравнительный факторСкорость реакции
Стереохимический результат
Предпочтительный растворитель
SN1
SN2
k × [RX]
k × [RX] × [Y]
рацемизация
инверсия
полярный протонный
полярный апротонный
Влияние структуры субстрата на скорость реакции
CH3-Х
реакция не идёт
очень хорошо
R-CH2-X
реакция не идёт
хорошо
R2CH-X
реакция идёт
реакция идёт
R3C-X
очень хорошо
реакция не идёт
R-CH=CH-CH2-X
реакция идёт
хорошо
С6H5-CH2-X
реакция идёт
хорошо
R-CO-CH2-X
реакция не идёт
отлично
R-O-CH2-X
отлично
хорошо
R2N-CH2-X
отлично
хорошо
42. Влияние природы растворителя на скорость реакции SN2
Заменарастворителя на
более полярный
_
1)
_
δ
[Y…R…X]
R-X + Y →
→ RY + X
_
_
RBr + HO → ROH + Br
δ+
2)
3)
4)
_
δ
_
δ
[Y…R…X]
+
Распределение заряда в
большем пространстве
_
Уменьшение полярности и
сольватации, снижение скорости
реакции
_
R-X + Y: →
→ RY + X
+
_
R-Br + N(CH3)3 → RN(CH3)3 + Br
+
_
_
δ
δ+
RX + Y → [Y…R…X] → RY + X:
+
_
RN(CH3)3 + I → RN(CH3)2 + CH3I
+
δ+
_
δ
Слабое
замедление
+
Переходное состояние
более полярно и
сольватировано
Сильное
ускорение
Частичная нейтрализация
Уменьшение полярности и
сольватации, снижение
скорости реакции
RX + Y: → [Y…R…X] → RX1 + Y 1
+
+
RS(CH3)2 + N(CH3)3 → RSCH3 + (CH3)4N
Частичная
нейтрализация
Сильное
замедление
Слабое
замедление
43. Основные органические реакции, относящиеся к типу SN
1)2)
3)
4)
5)
6)
7)
8)
9)
10)
Получение алкилгалогенидов
Получение и расщепление простых эфиров в кислых
условиях
Щелочное омыление
Синтез простых эфиров по Вильямсону
Синтез эфиров карбоновых кислот
Синтез меркаптанов
Алкилирование аммиака и аминов
Синтез нитрилов по Кольбе
Синтез нитроалканов
Реакция Финкельштейна
44. Получение алкилгалогенидов в реакциях SN
(CH 3)3COHSN1
+
(CH 3)3CCl
HCl
трет-бутиловый
спирт
+
H2O
трет-бутилхлорид
быстро
медленно
H
(CH 3)3C
..
OH
+
H
+
(H 3C) 3C
O
+
(CH 3)3C
H
-H2O
+
карбокатион
Cl(H 3C) 3C
Cl
45. Примеры реакций
Гидролиз алкилгалогенидов46. Примеры реакций
Алкоголиз алкилгалогенидов47. Примеры реакций
Аммонолиз алкилгалогенидовРеакция алкилгалогенидов с цианидами
48. Примеры реакций
Взаимодействие алкилгалогенидов с солямикислот
















































 Химия
Химия