Похожие презентации:
S-элементы
1.
S-элементы2.
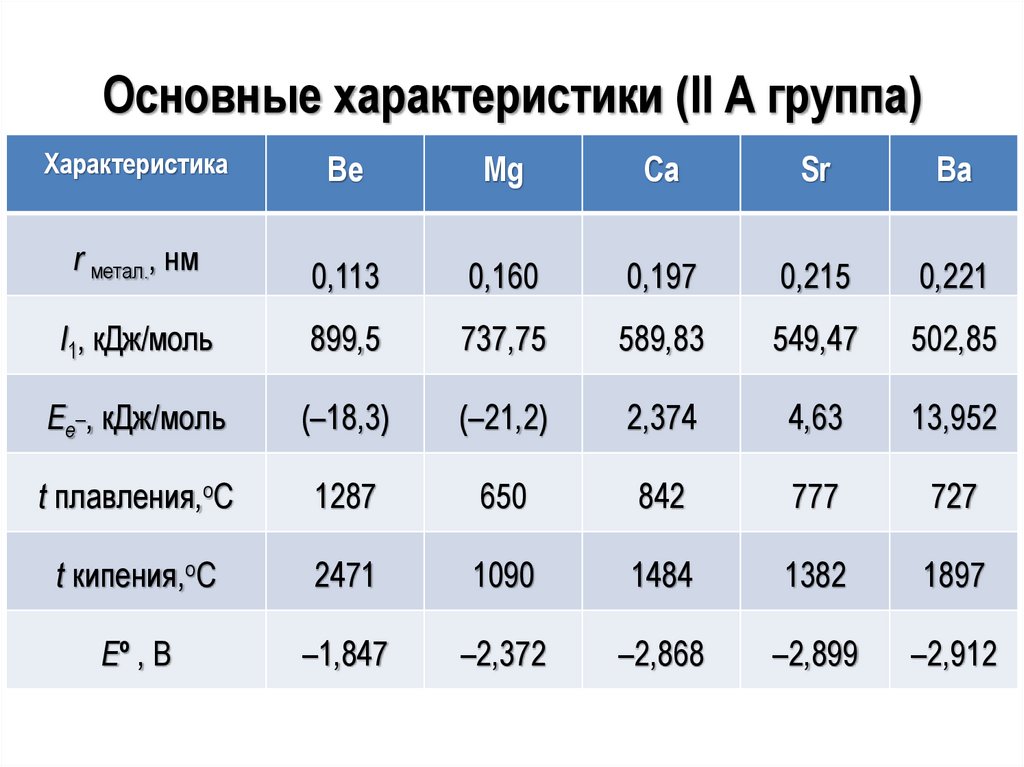
Основные характеристики (II А группа)Характеристика
Be
Mg
Ca
Sr
Ba
r метал., нм
0,113
0,160
0,197
0,215
0,221
I1, кДж/моль
899,5
737,75
589,83
549,47
502,85
Ее_, кДж/моль
(–18,3)
(–21,2)
2,374
4,63
13,952
t плавления,оС
1287
650
842
777
727
t кипения,оС
2471
1090
1484
1382
1897
Еº , В
–1,847
–2,372
–2,868
–2,899
–2,912
3.
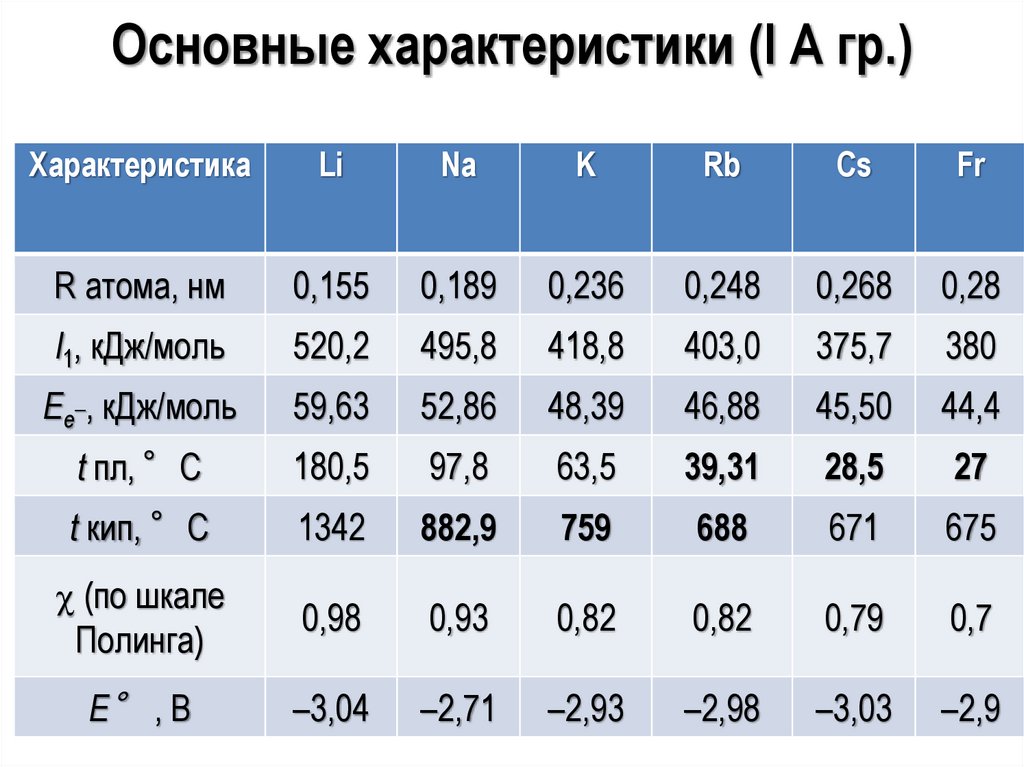
Основные характеристики (I А гр.)Характеристика
Li
Na
K
Rb
Cs
Fr
R атома, нм
0,155
0,189
0,236
0,248
0,268
0,28
I1, кДж/моль
520,2
495,8
418,8
403,0
375,7
380
Ее_, кДж/моль
59,63
52,86
48,39
46,88
45,50
44,4
t пл, °С
180,5
97,8
63,5
39,31
28,5
27
t кип, °С
1342
882,9
759
688
671
675
(по шкале
Полинга)
0,98
0,93
0,82
0,82
0,79
0,7
Е° , В
–3,04
–2,71
–2,93
–2,98
–3,03
–2,9
4.
Получение• Бериллий получают восстановлением фторида:
BeF2 + Mg (t)→ Be + MgF2
• Барий получают восстановлением оксида:
3BaO + 2Al (t)→3Ba + Al2O3
• Остальные s-элементы II группы электролизом
расплавов хлоридов:
катод ⊝: Ca2+ + 2e– = Ca
анод ⊕: 2Cl– – 2e– = Cl2
электролиз
CaCl2
Ca + Cl2
5.
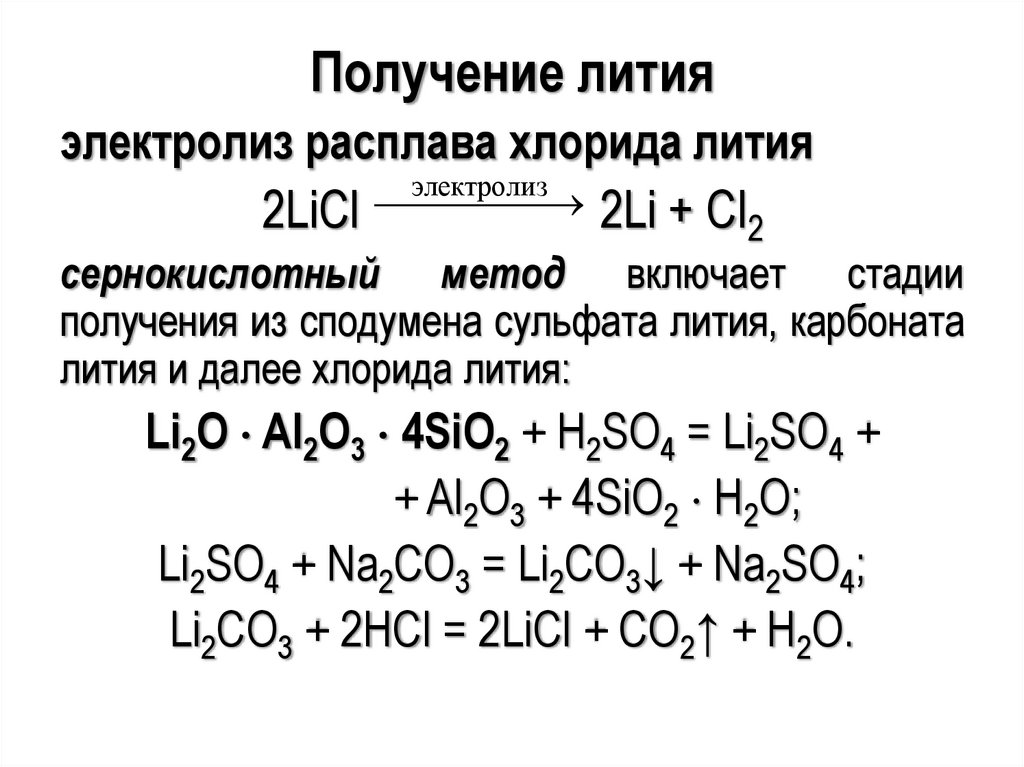
Получение литияэлектролиз расплава хлорида лития
электролиз
2LiCl 2Li + Cl
2
сернокислотный метод включает стадии
получения из сподумена сульфата лития, карбоната
лития и далее хлорида лития:
Li2O Al2O3 4SiO2 + H2SO4 = Li2SO4 +
+ Al2O3 + 4SiO2 H2O;
Li2SO4 + Na2CO3 = Li2CO3↓ + Na2SO4;
Li2CO3 + 2HCl = 2LiCl + CO2↑ + H2O.
6.
Получение лития• Сульфатный метод:
Li2O Al2O3 4SiO2 + K2SO4 (t) =
= Li2SO4 + K2O Al2O3 4SiO2
• Известковый способ
включает стадии
получения алюмината лития, гидроксида лития,
хлорида лития:
Li2O Al2O3 4SiO2 + 4CaCO3 (t)= Li2O Al2O3 +
+ 4(CaO SiO2) + CO2↑;
2LiAlO2 + Ca(OH)2 = 2LiOH + Ca(AlO2)2;
LiOH + HCl = LiCl + H2O
7.
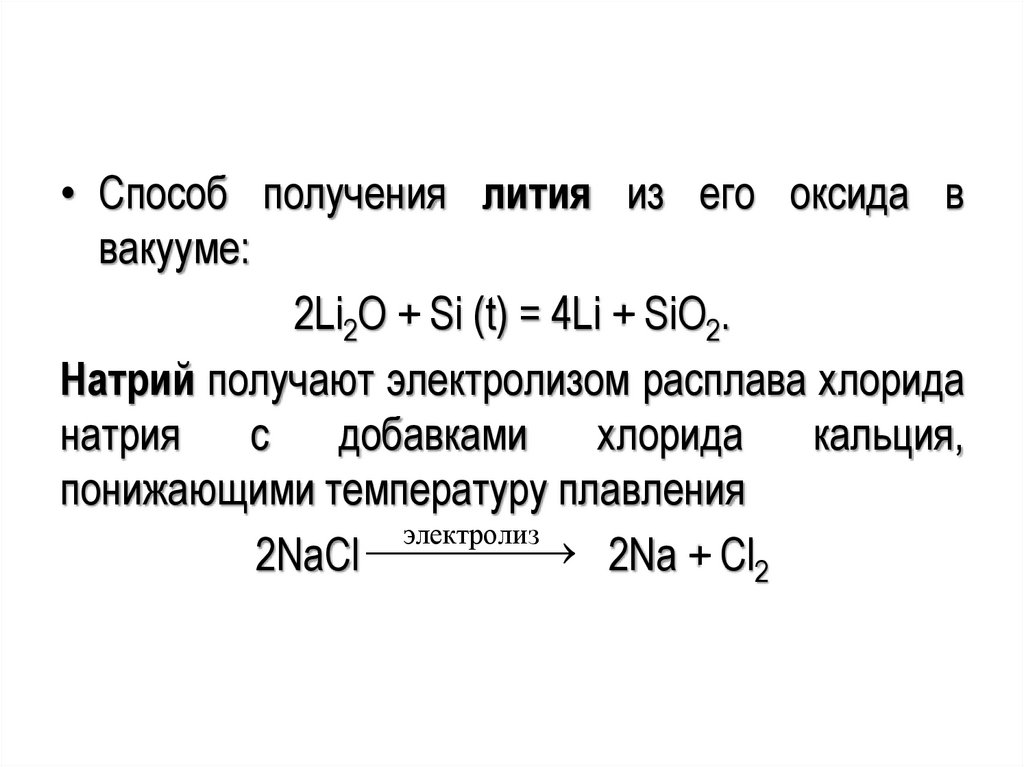
• Способ получения лития из его оксида ввакууме:
2Li2O + Si (t) = 4Li + SiO2.
Натрий получают электролизом расплава хлорида
натрия
с
добавками
хлорида
кальция,
понижающими температуру плавления
электролиз
2Na + Cl
2NaCl
2
8.
• Получение натрия прокаливанием соды с углемв
закрытых
тиглях,
пары
металла
конденсируются на крышке тигля, выход
реакции невысокий:
Na2CO3 + 2C (t) = 2Na↑ + 3CO
9.
Получение калия• пропускание паров натрия через расплав
хлорида калия при 800°С, выделяющиеся
пары калия конденсируют:
KCl + Na (t) = K↑ + NaCl.
• Взаимодействие расплавленного гидроксида
калия и жидкого натрия :
KOH + Na (440°С) = K↑ + NaOH.
10.
Получение рубидия и цезия• Восстановление хлоридов кальцием в вакууме
при 700–800°С:
2RbCl + Ca (t) = 2Rb + CaCl2.
• В качестве восстановителя также используют
Mg, Al, Si, Zr.
11.
Химические свойства• Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
• 3Сa + Cr2O3 (t)→ 2Cr + 3CaO
• 2Ca + SiO2 (t)→ 2CaO + Si
• 2Ca + CO2 (t)→ 2CaO + C
• 3Са + 2NH3(газ) (t)→ Са3N2 + 3H2↑
12.
• 4Li + O2 = 2Li2O–2 (оксид).• 2Na + O2 = Na2O2 (пероксид).
• K + O2 = KO2 (надпероксид).
• K + O3 = KO3 (озонид);
13.
• 2Na + 2H2O = 2NaOH + H2.• 2Li + 2HCl = 2LiCl + H2.
t
• Na + NH3
NaNH2 + ½H2 (амид);
t
• NaNH2 + Na
Na2NH + ½H2 (имид);
t
• Na2NH + Na
Na3N + ½H2 (нитрид).
14.
• Ме2О + Н2О = 2МеОH• K2O2 + 2H2O = 2KOH + H2O2;
• 2KO2 + 2H2O = 2KOH + O2 + H2O2;
• 4KО3 + 2H2O = 4KOH + 5O2.
15.
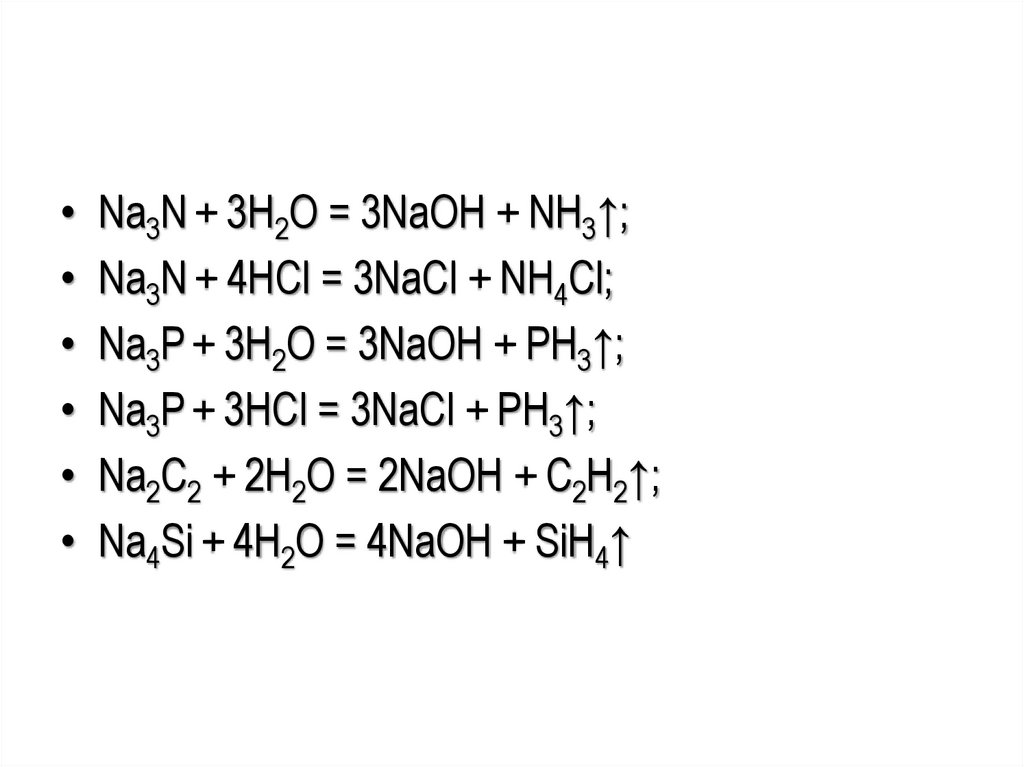
• Na3N + 3H2O = 3NaOH + NH3↑;• Na3N + 4HCl = 3NaCl + NH4Cl;
• Na3P + 3H2O = 3NaOH + PH3↑;
• Na3P + 3HCl = 3NaCl + PH3↑;
• Na2C2 + 2H2O = 2NaOH + C2H2↑;
• Na4Si + 4H2O = 4NaOH + SiH4↑
16.
Качественные реакции• окрашивание пламени:
• кальций – в оранжевый цвет;
• барий – в зеленый.
• Катион Ba2+ можно обнаружить обменной
реакцией с серной кислотой или ее солями:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl;
Ba2+ + SO42- = BaSO4↓.
• Сульфат бария BaSO4 – белый осадок,
нерастворимый в минеральных кислотах.
17.
Окраска пламени:• литий – алая;
• рубидий – сиреневая;
• натрий – желтая;
• цезий – розово-фиолетовая.
• калий – фиолетовая;
18.
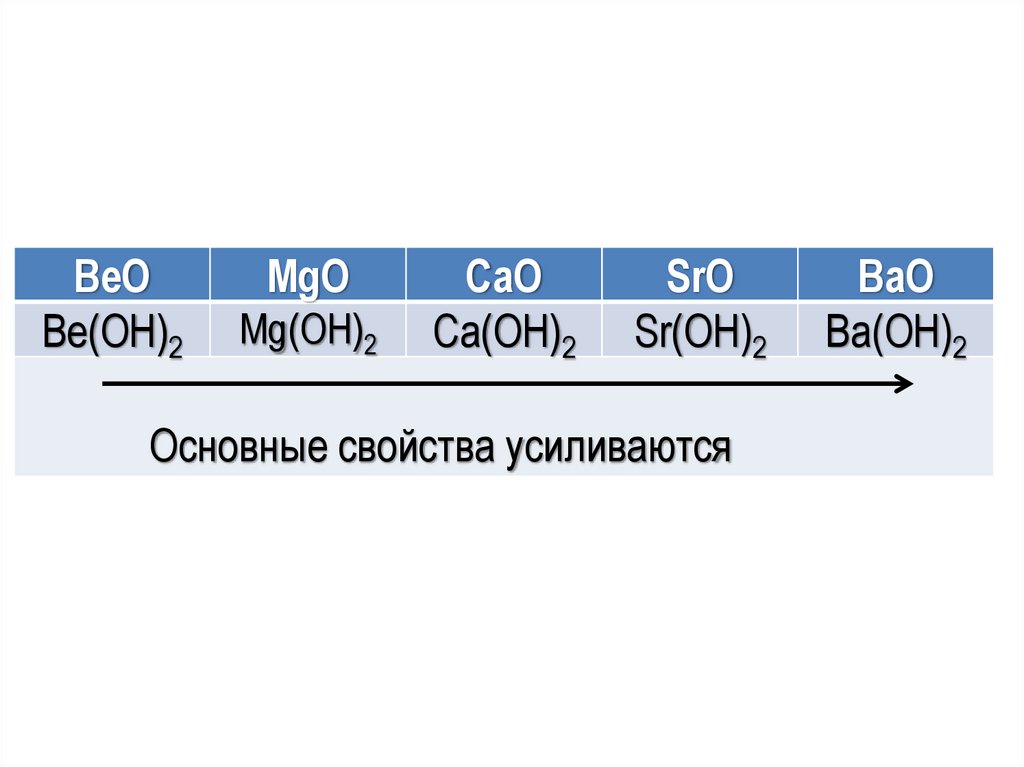
Оксиды и гидроксиды IIA группыОксиды s-элементов IIA группы – белые
тугоплавкие вещества. ВеО в воде не растворим,
MgO растворяется только при нагревании.
Остальные растворимы в воде с образованием
щелочей.
Гидроксиды
–
белые
порошкообразные
вещества,
растворимость
гидроксидов
увеличивается с увеличением порядкового номера
элемента.
19.
BeOBe(OН)2
MgO
Mg(OН)2
CaO
Ca(OН)2
SrO
Sr(OН)2
Основные свойства усиливаются
BaO
Ba(OН)2
20.
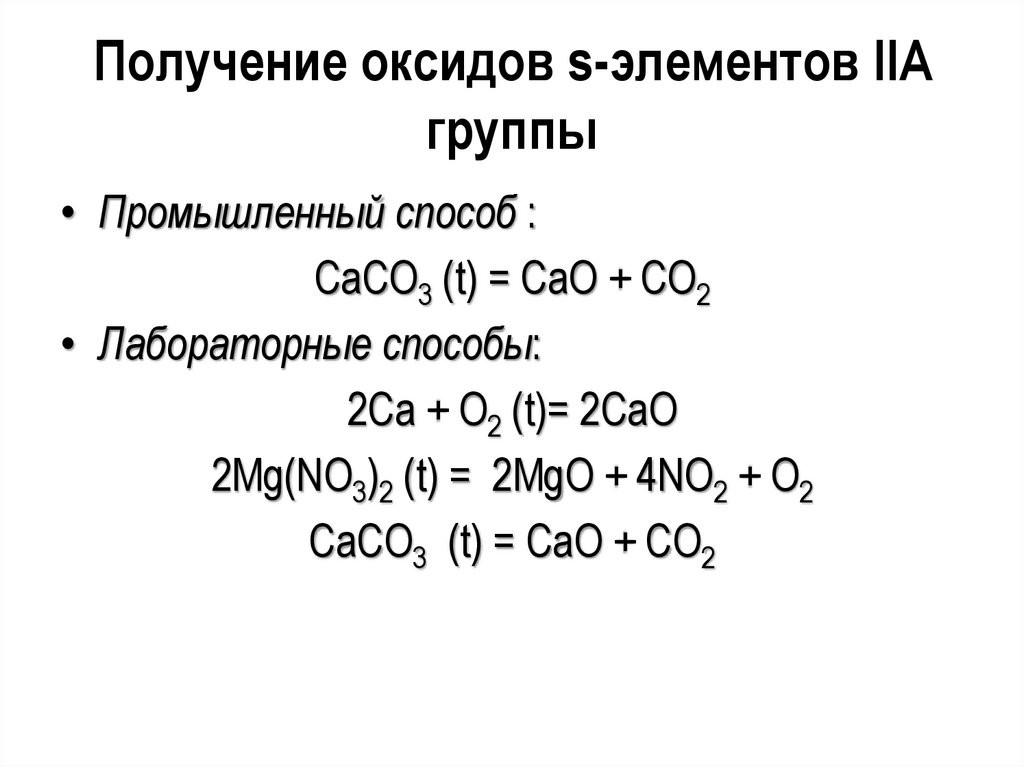
Получение оксидов s-элементов IIAгруппы
• Промышленный способ :
CaCO3 (t) = CaO + CO2
• Лабораторные способы:
2Ca + O2 (t)= 2CaO
2Mg(NO3)2 (t) = 2MgO + 4NO2 + O2
CaCO3 (t) = CaO + CO2
21.
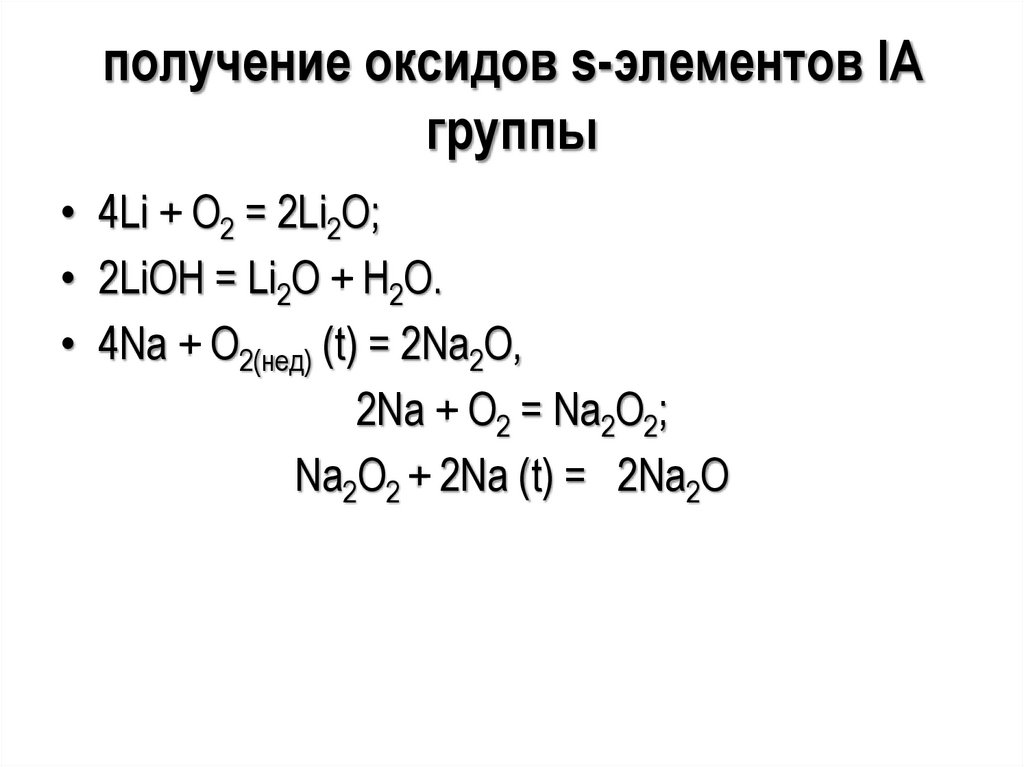
получение оксидов s-элементов IAгруппы
• 4Li + O2 = 2Li2O;
• 2LiOH = Li2O + H2O.
• 4Na + O2(нед) (t) = 2Na2O,
2Na + O2 = Na2O2;
Na2O2 + 2Na (t) = 2Na2O
22.
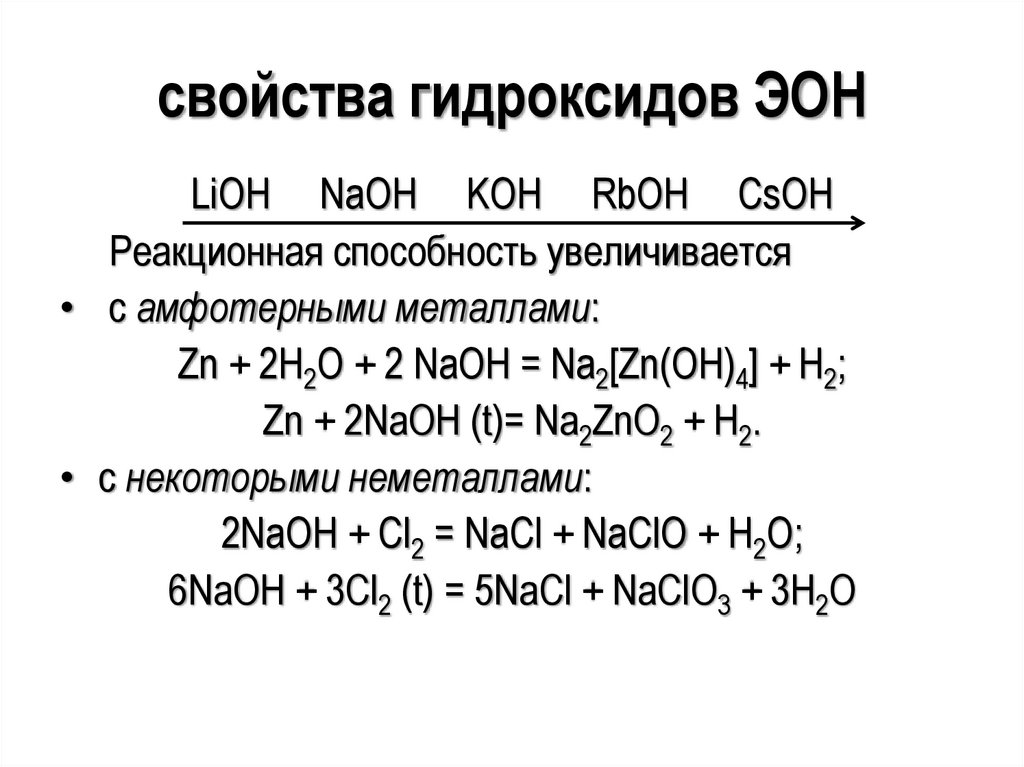
свойства гидроксидов ЭОНLiOH NaOH KOH RbOH CsOH
Реакционная способность увеличивается
• с амфотерными металлами:
Zn + 2H2O + 2 NaOH = Na2[Zn(OH)4] + H2;
Zn + 2NaOH (t)= Na2ZnO2 + H2.
• с некоторыми неметаллами:
2NaOH + Cl2 = NaCl + NaClO + H2O;
6NaOH + 3Cl2 (t) = 5NaCl + NaClO3 + 3H2O
23.
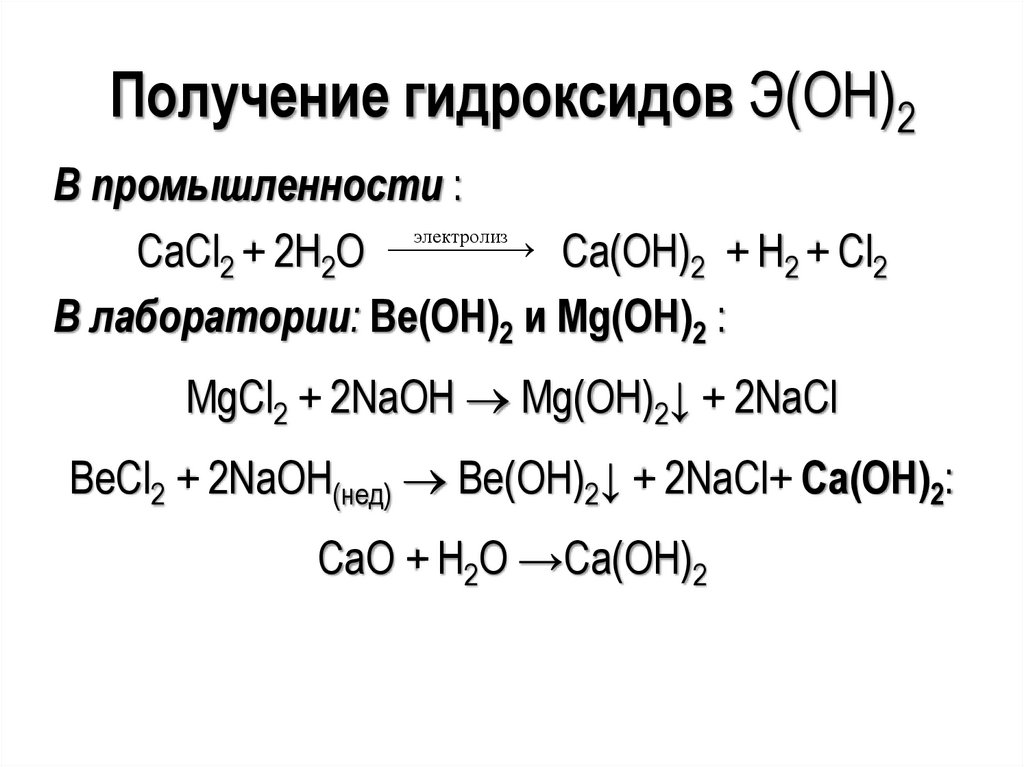
Получение гидроксидов Э(ОН)2В промышленности :
электролиз
Са(ОН) + H + Cl
CaCl2 + 2H2O
2
2
2
В лаборатории: Ве(ОН)2 и Mg(OH)2 :
MgCl2 + 2NaOH Mg(OH)2↓ + 2NaCl
BeCl2 + 2NaOH(нед) Be(OH)2↓ + 2NaCl+ Са(ОН)2:
СаО + Н2О →Са(ОН)2
24.
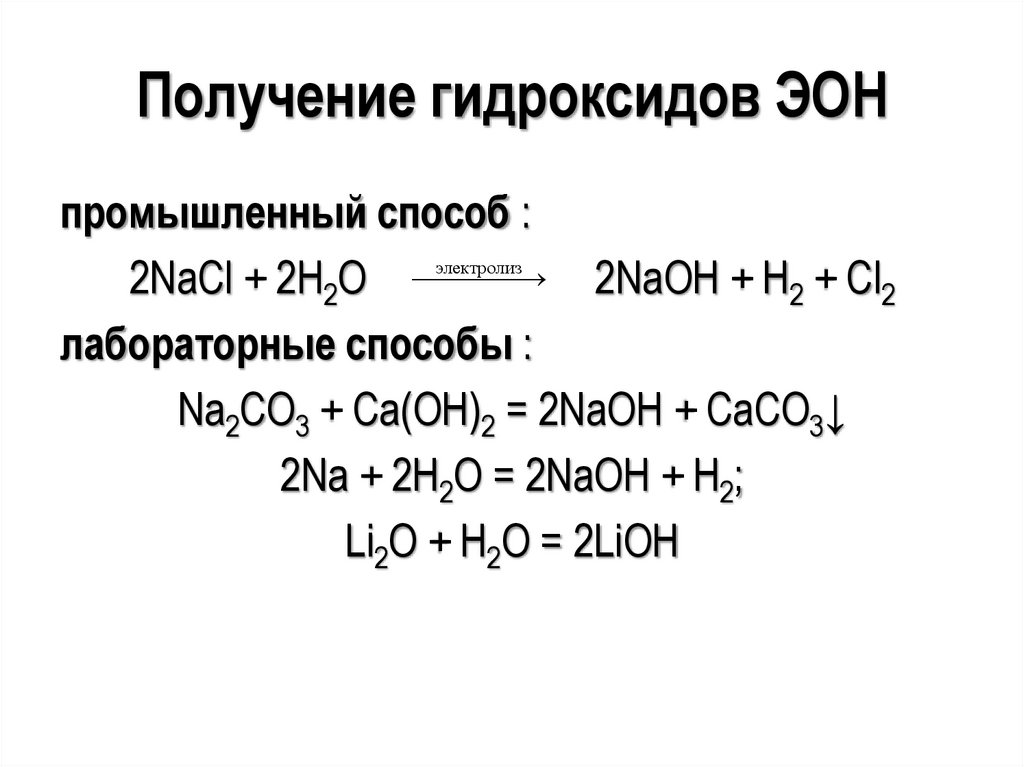
Получение гидроксидов ЭОНпромышленный способ :
электролиз
2NaCl + 2H2O
2NaOH + H2 + Cl2
лабораторные способы :
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓
2Na + 2H2O = 2NaOH + H2;
Li2O + H2O = 2LiOH
25.
Жесткость водыПриродная вода, содержащая ионы Ca2+ и Mg2+,
называется жесткой.
Единицы измерения жесткости - число молей
эквивалентов ионов Са2+ и Mg2+, содержащихся в
1 м3 воды (или число миллимолей эквивалентов
ионов Са2+ и Mg2+в 1 дм3 Н2О).
Жесткость выражается в градусах жесткости (°Ж).
26.
1°Ж соответствует концентрации щелочноземельногоэлемента, равной 1 молю эквивалентов на 1 м3 воды (или
1 миллимолю эквивалентов на 1 дм3 воды).
• – мягкая вода – 4,0°Ж и менее;
• – средняя жесткость – 4,0‒8,0°Ж;
• – жесткая вода – свыше 8,0°Ж.
27.
Виды жесткости• Карбонатная
(временная)
жесткость
обусловлена
присутствием
в
воде
гидрокарбонатов
кальция
и
магния,
некарбонатная (постоянная) жесткость –
хлоридов и сульфатов.
• Общая жесткость воды рассматривается как
сумма карбонатной и некарбонатной.
28.
Способы устранения жесткостиКарбонатная (временная) Сa(HCO3)2, Mg(HCO3)2
• Кипячение:
Сa(HCO3)2 (t) = CaCO3↓ + CO2 + H2O
• Добавление известкового молока:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O
• Добавление соды:
Ca(HCO3)2 + Na2CO3 = CaCO3↓ + 2NaHCO3
• Добавление растворимых фосфатов:
3Ca(HCO3)2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaHCO3
29.
Некарбонатная (постоянная):CaSO4, MgSO4, CaCl2, MgCl2
• Добавление соды:
CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4;
MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl
• Добавление растворимых фосфатов:
3CaSO4+ 2Na3PO4 = Ca3(PO4)2↓ + 3Na2SO4;
3MgCl2 + 2Na3PO4 = Mg3(PO4)2↓ + 6NaCl
• Пропускание через ионнообменную смолу
30.
Временная и постоянная:• Пропускание через ионнообменную смолу:
а) катионный обмен:
2RH + Ca2+ = R2Ca + 2H+;
б) анионный обмен:
2ROH + SO42– = R2SO4 + 2OH–,
где R – сложный органический радикал.
31.
32.
Сода• – общее название технических натриевых солей
угольной кислоты:
• – Na2CO3 (карбонат натрия) – кальцинированная
сода;
• – Na2CO3 · 10H2O (декагидрат карбоната натрия)
– кристаллическая (стиральная) сода;
• – NaHCO3 – пищевая сода, натрий двууглекислый
(устар.), бикарбонат натрия.
• Каустической содой называют (NaOH).
33.
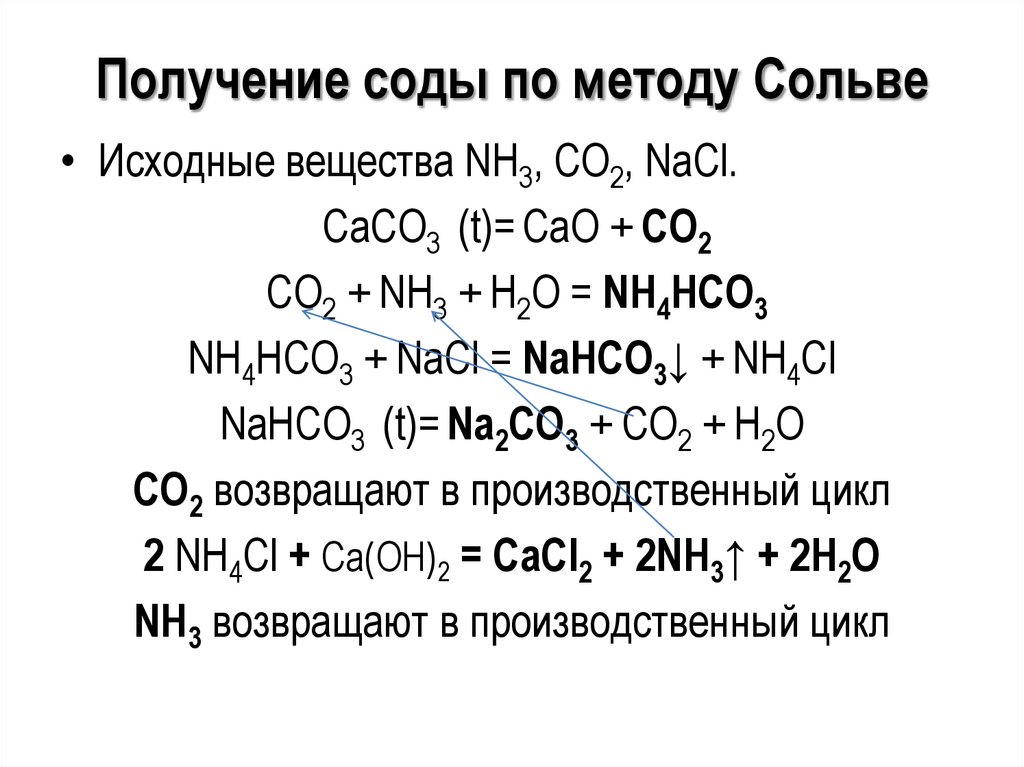
Получение соды по методу Сольве• Исходные вещества NH3, CO2, NaCl.
CaCO3 (t)= CaO + CO2
CO2 + NH3 + H2O = NH4HCO3
NH4HCO3 + NaCl = NaHCO3↓ + NH4Cl
NaHCO3 (t)= Na2CO3 + CO2 + H2O
CO2 возвращают в производственный цикл
2 NH4Cl + Са(ОН)2 = CaCl2 + 2NH3↑ + 2H2O
NH3 возвращают в производственный цикл
34.
• СаО – негашеная известь.• Са(ОН)2 – гашеная известь (известковое молоко).
• СаСО3 –главная составная часть известняка, мела,
мрамора. Служит для производства негашеной,
гашеной и хлорной извести
35.
Гипсовые материалыCaSO4 0,5H2O – жженый гипс или алебастр, получают
обжигом гипса CaSO4 2H2O при 150–180°С:
2(CaSO4 · 2H2O) (t) = 2(CaSO4 · 0,5H2O) + 3H2O
Отвердевание массы при замешивании с H2O:
2(CaSO4 · 0,5H2O) + 3H2O = 2(CaSO4 · 2H2O)
36.
Применение щелочных металлов и ихсоединений
K, Na - теплоносители в атомных реакторах и в
авиационных двигателях; катализаторы в органическом
синтезе…
Получение O2: 2Na2O2 + 2CO2 = 2Na2CO3 + O2
KCl, NaNO3, KNO3, K2SO4 – удобрения
NaНCO3 - кулинарии, в огнетушителях…
NaCl – сырье для получения Na, NaОН, Cl2, HCl
KОН, NaОН, K2CO3, Na2CO3 - для производства бумаги,
мыла, стекла, искусственных волокон, в щелочных
аккумуляторах
37.
Кальцийиграет
важную
роль
в
жизнедеятельности организма. Ионы кальция
необходимы для осуществления процесса
передачи нервных импульсов, для сокращения
скелетных мышц и мышцы сердца, для
формирования костной ткани, для свертывания
крови. Препараты кальция широко используют, в
частности, при лечении переломов, при усиленном
выделении кальция из организма и др.








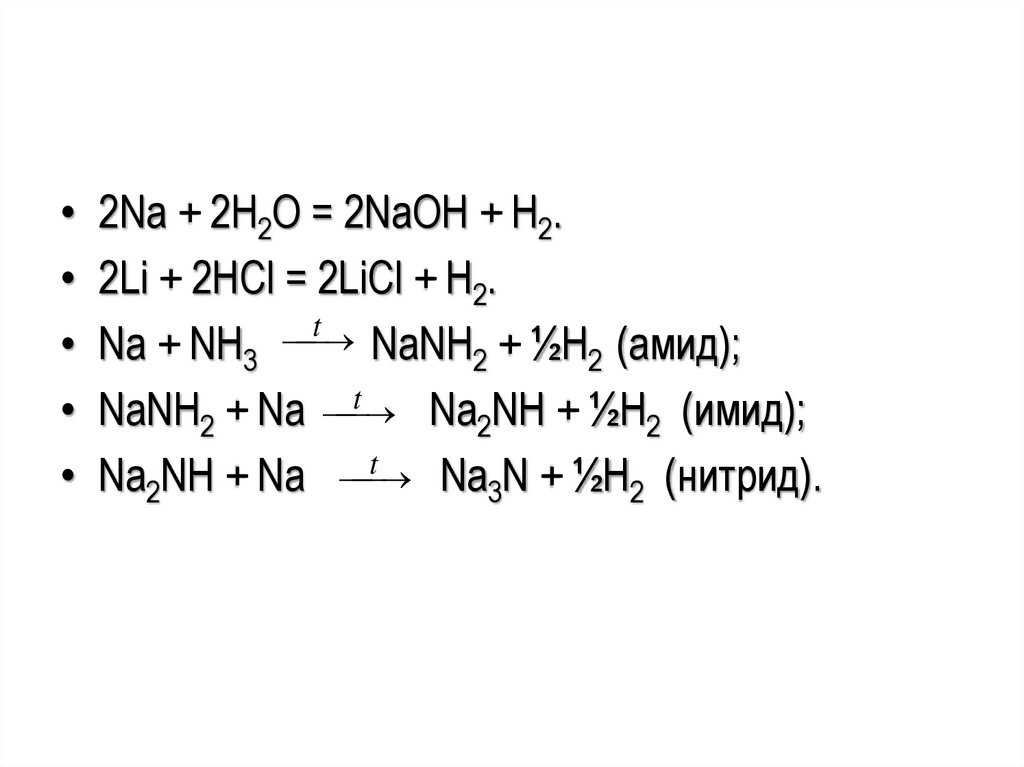
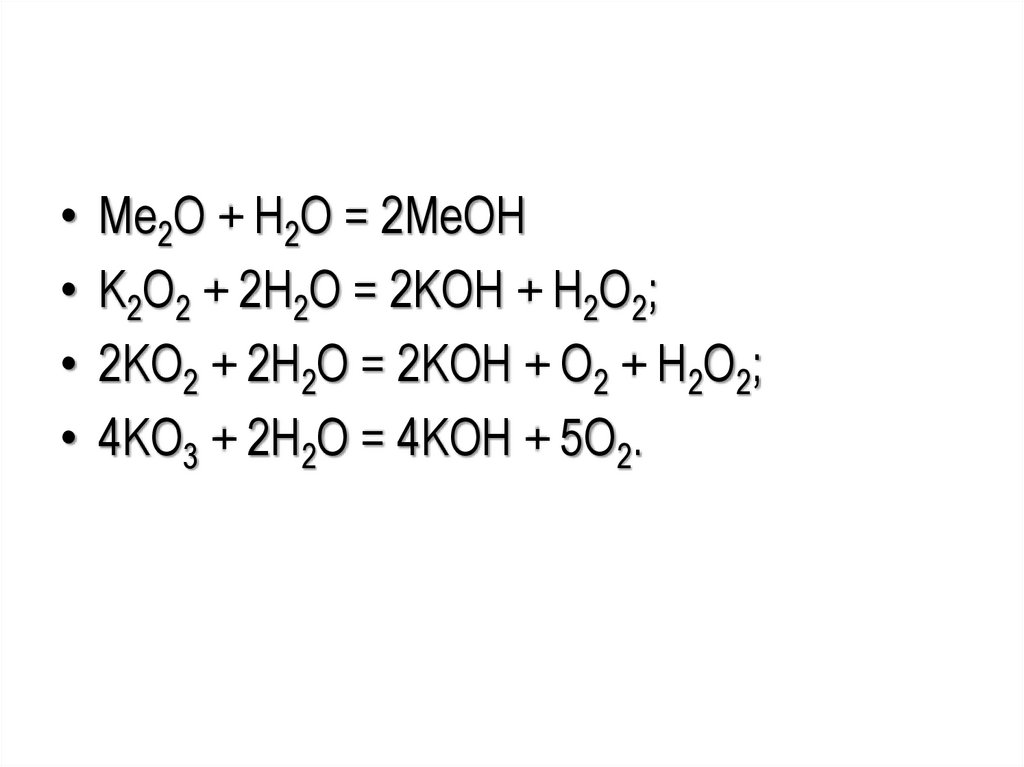















 Химия
Химия








