Похожие презентации:
Домашнее задание по теме «Химические свойства альдегидов, их получение»
1.
Домашнее заданиепо теме
«Химические
свойства альдегидов,
их получение»
2.
1.2.
3.
4.
5.
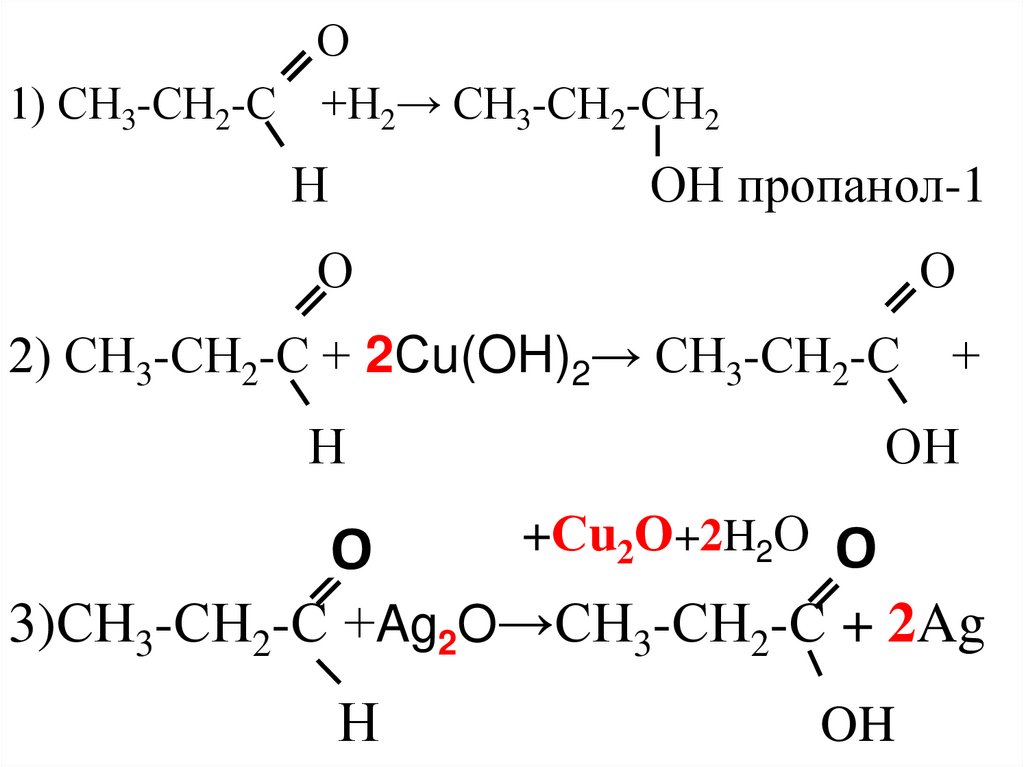
пропаналь + водород →
пропаналь + Сu(OH)2 →
пропаналь + Ag2O →
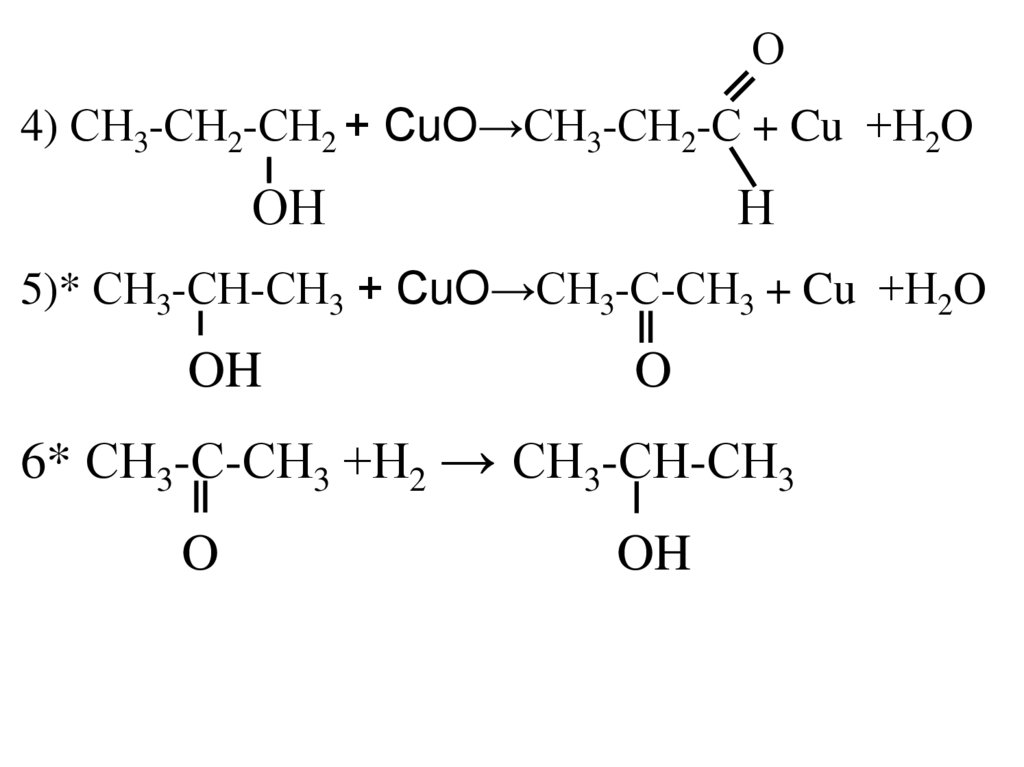
пропанол-1 + СuO →
*пропанол-2 + СuO →для
сдающих ЕГЭ
*пропанон + водород
Составьте уравнения реакций,
назовите органические в-ва
3.
О1) СН3-СН2-С +Н2→ СН3-СН2-СН2
Н
ОН пропанол-1
О
О
2) СН3-СН2-С + 2Сu(OH)2→ СН3-СН2-С +
Н
O
ОН
+Сu2О+2H2О
O
3)СН3-СН2-С +Ag2O→СН3-СН2-С + 2Ag
Н
OH
4.
О4) СН3-СН2-СН2 + СuO→СН3-СН2-С + Cu +Н2O
ОН
Н
5)* СН3-СН-СН3 + СuO→СН3-С-СН3 + Cu +Н2O
OH
O
6* СН3-С-СН3 +Н2 → СН3-СН-СН3
O
OH
5.
6.
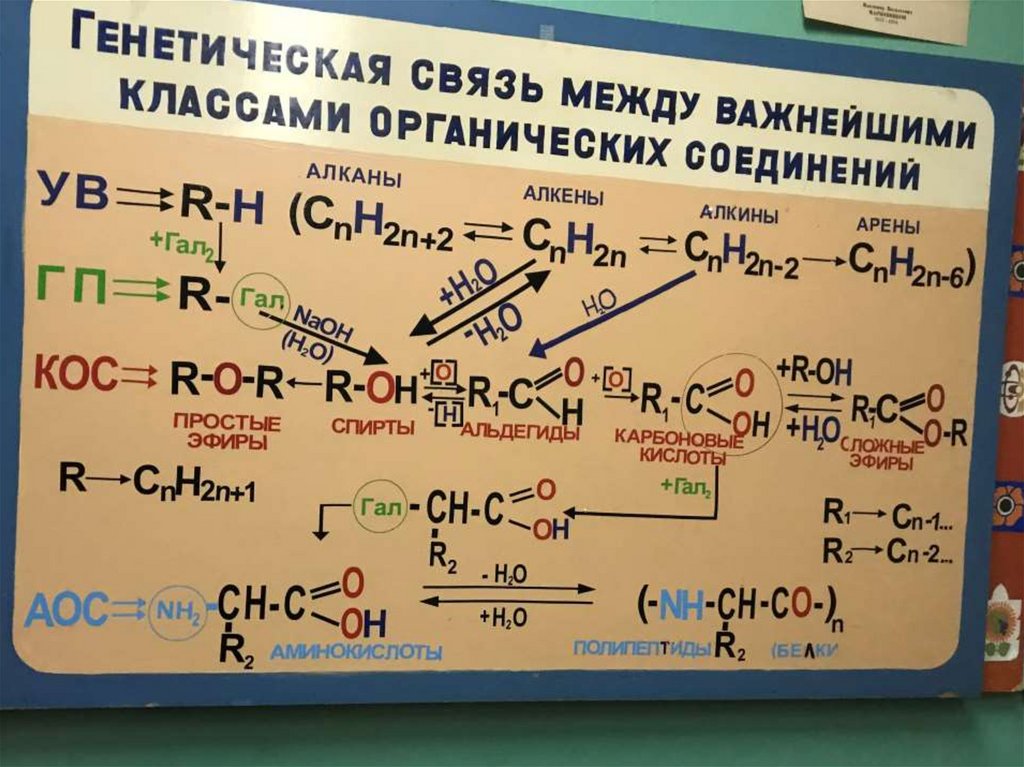
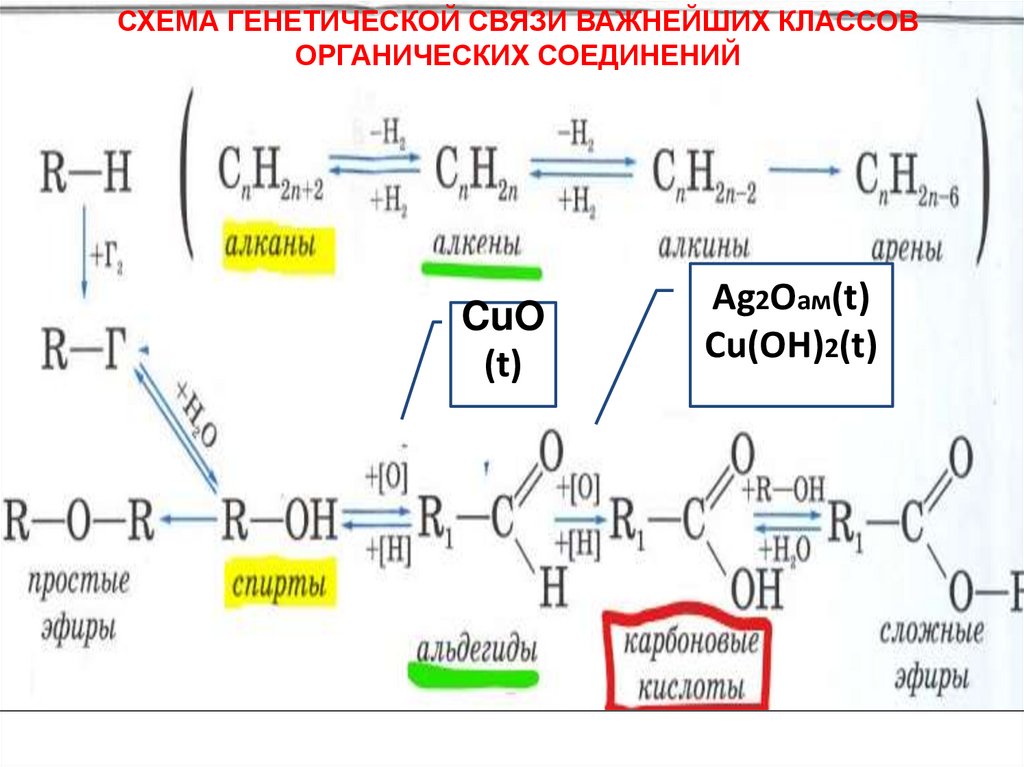
СХЕМА ГЕНЕТИЧЕСКОЙ СВЯЗИ ВАЖНЕЙШИХ КЛАССОВОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
CuO
(t)
Ag2Oам(t)
Cu(OH)2(t)
7.
Давайте вспомним, подумаем , предположим…АЛКАНЫ Cnзнаем
H2n+2
АЛКЕНЫ Cзнаем
nH2n
структ
С=С
Расшифро
АЛКОГОЛЬ
вка
СПИРТЫ
(АЛКАНОЛЫ)
Cnзнаем
H2n+2O
Н
-1
R–C–OH
Н
АЛЬДЕГИДЫ
CnH2nO ДЕГИДРИРОВАННЫЙ
названия
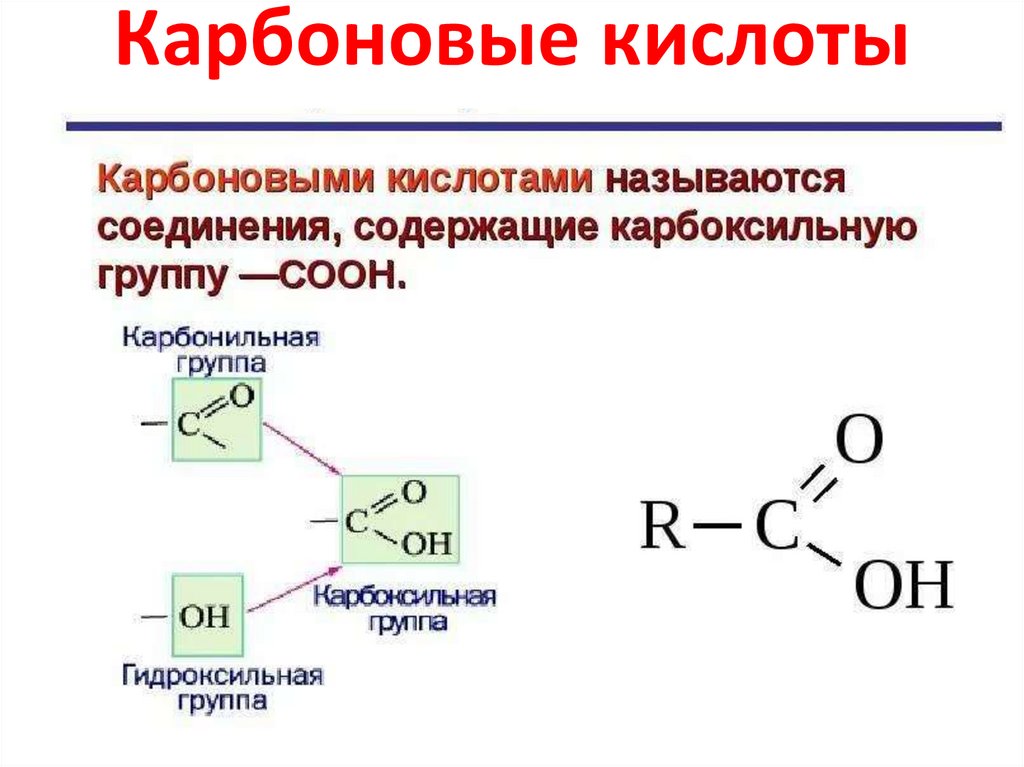
КИСЛОТЫКАРБОНОВЫЕ
какие?
Присоединение
Обмен
соли
Замещение
Этерификация
А
по генетической связи
органических
(со спиртами,
соединений?
сложные
эфиры)
знаем
С=О
Замещение
Дегидрирование
знаем
Дегидратация
химические
свойства
общие формулы
CnH?2nO2
общие формулы
класса
?
гидрирование для
альдегидов
знаем
Окисление
+1
О
R–C
Н
идёт восстановление
+3
?
О
R–C
ОН
идёт окисление
8.
Карбоновые кислоты9.
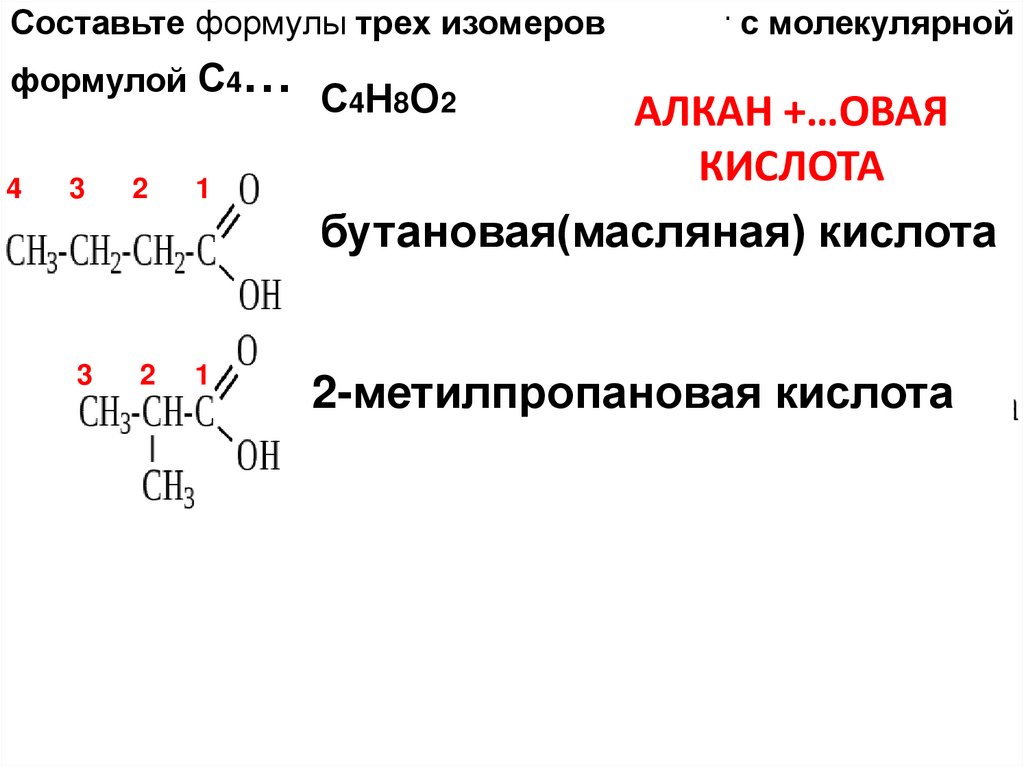
Составьте формулы трех изомеров кислот с молекулярнойформулой С4…
4
3
2
1
3
2
1
С4СсСС
Н8О2
АЛКАН +…ОВАЯ
КИСЛОТА
бутановая(масляная) кислота
2-метилпропановая кислота
10.
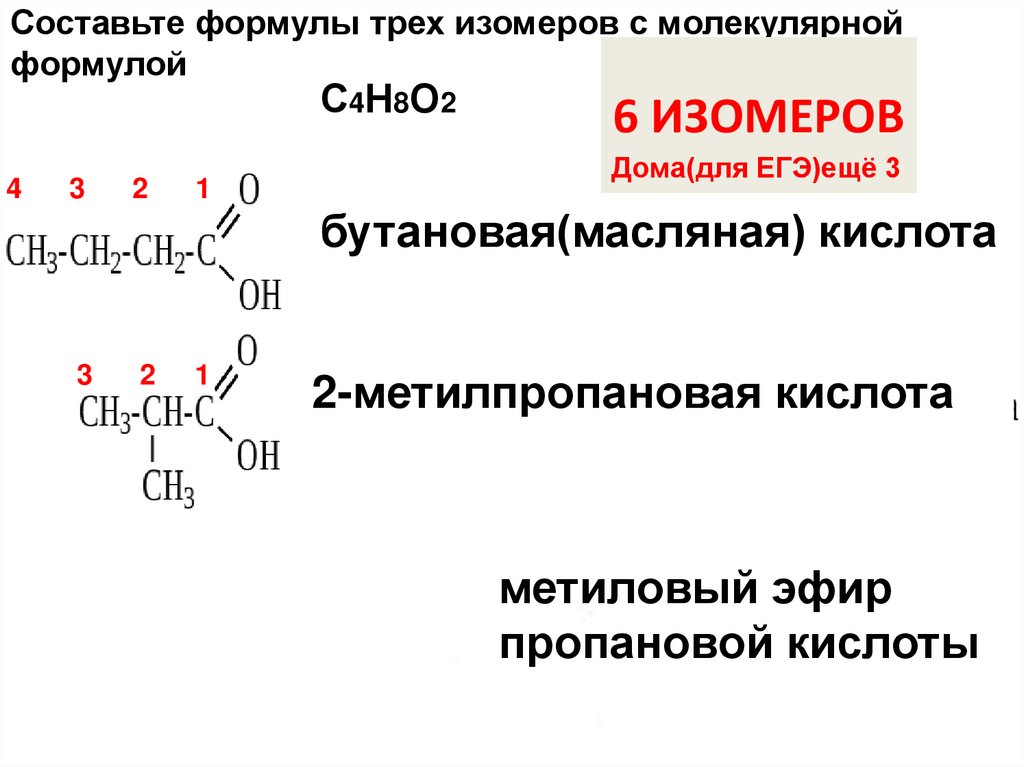
Составьте формулы трех изомеров с молекулярнойформулой
С4СсСС
Н8О2
4
3
2
1
6 ИЗОМЕРОВ
Дома(для ЕГЭ)ещё 3
бутановая(масляная) кислота
3
2
1
2-метилпропановая кислота
метиловый эфир
пропановой кислоты
11.
Установите соответствие между молекулярнойформулой вещества и классом(-ми) веществ,
которым она принадлежит
молекулярная
Класс вещества
формула
А С3Н8О
1 альдегиды (кетоны)
2 Кислоты(сложные эфиры)
3 Спирты (простые эфиры)
Б С3Н6О
В С3Н6О2
Г С3Н8О2
4
? Двухатомные спирты
А
Б
В
Г
3
1
2
3?4 ?
12.
Сравнение t кипения(высокая/низкая) и растворимостиалканов, спиртов, эфиров, альдегидов и кислот
веще
ство
эта
н
этан
ол
димети этилен этаналь уксусная метил
ловый гликоль
кислота фор
эфир
миат
78
-24
197
20
пред
t кип-89
Знаем!Объясняла!
t кип, С
раство н/р Неог н/р
римос
рани
ть
ченно
Неогра р/м
Вспом
ниченно
ните
Растворимость
Знаем! Объясняла!
практику
Водородные связи! О- Н
Причина?
положите
118
32
Неогра
ниченно
м/р
предпо
ложите
С-Н
13.
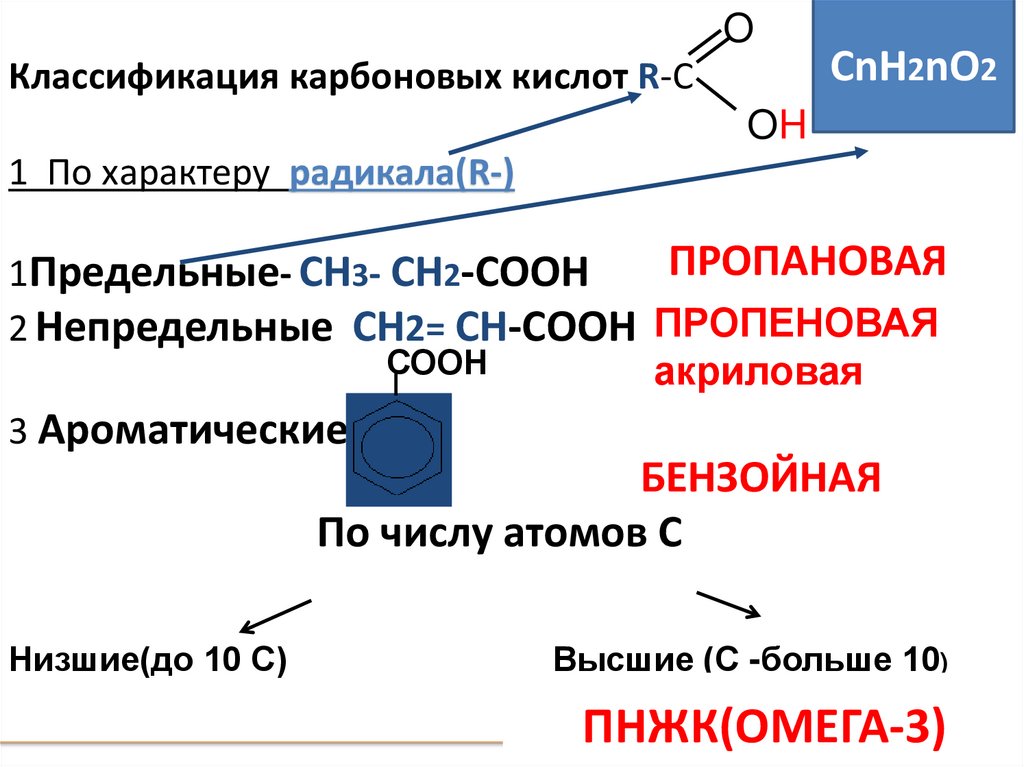
OКлассификация карбоновых кислот R-C
СnH2nO2
OH
1 По характеру радикала(R-)
ПРОПАНОВАЯ
1Предельные- СН3- СН2-СООН
2 Непредельные СН2= СН-СООН ПРОПЕНОВАЯ
СООН
акриловая
3 Ароматические
БЕНЗОЙНАЯ
По числу атомов С
Низшие(до 10 С)
Высшие (С -больше 10)
ПНЖК(ОМЕГА-3)
14.
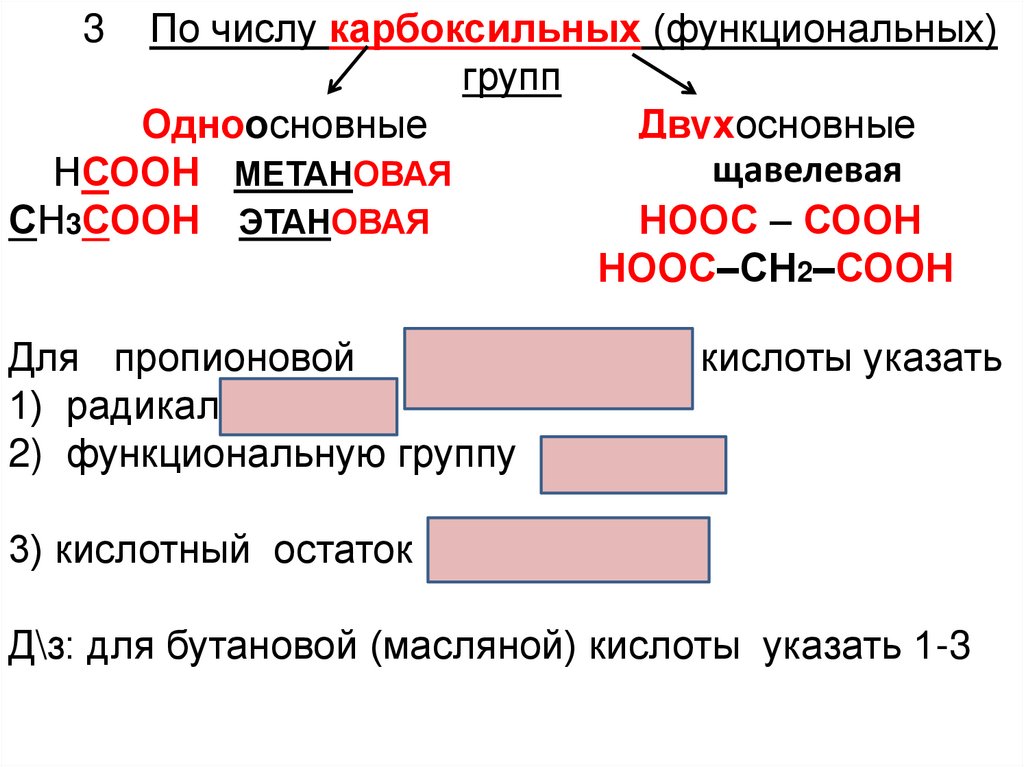
По числу карбоксильных (функциональных)групп
Одноосновные
Двухосновные
ЭТАщавелевая
этандиоваяэ
НСООН МЕТАНОВАЯ
СН3СООН ЭТАНОВАЯ
НООС – СООН
СН3СН2СООН ПРОПАНОВАЯ
НООС–СН2–СООН
3
Для пропионовой СН3СН2СООН кислоты указать
1) радикалСН3-СН22) функциональную группу -СООН
3) кислотный остаток СН3СН2СОО
Д\з: для бутановой (масляной) кислоты указать 1-3
15. Химические свойства кислот
Металлы(до Н)
1- ДЕЙСТВИЕ НА ИНДИКАТОРЫКак
доказать,
что в
ДИССОЦИАЦИЯ
пробирке-кислота?
5
Основные
оксиды
3
НО
H2O
Основания
Кислоты
2
4, ПОЛУЧЕНИЕ
Соили
16.
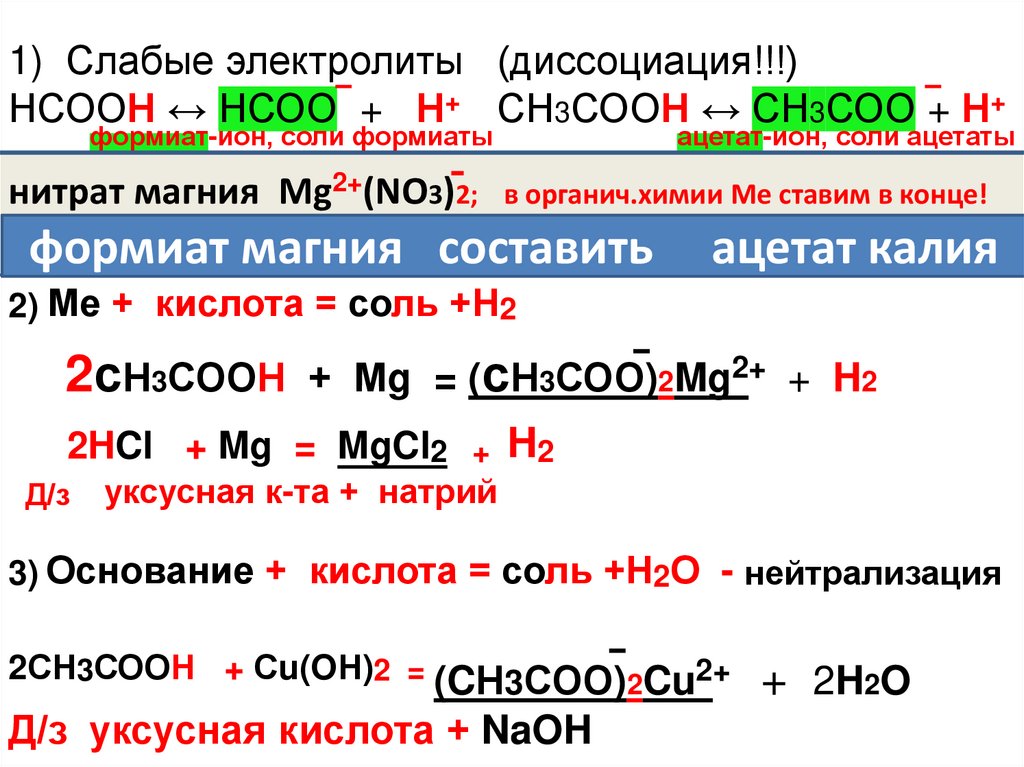
1) Слабые электролиты (диссоциация!!!)НСООН ↔ НСОО + Н+ СН3СООН ↔ СН3СОО + Н+
формиат-ион, соли формиаты
ацетат-ион, соли ацетаты
2+(NO3)2;
2 в органич.химии Ме ставим в конце!
нитрат
магния
Mg
формиат-ион, соли формиаты
2+
2+ ацетат
+
Mg
калия
формиат
магния
(
НСОО)
2
Mg
ацетат
калия
(СН
3
СОО)К
формиат магния составить ацетат калия
2) Ме + кислота = соль +Н2
2сН3СООН
+ Мg = (сН3СОО)2Mg2+ + H2
2HCl + Mg = MgCl2 + H2
Д/з
уксусная к-та + натрий
3) Основание + кислота = соль +Н2О - нейтрализация
2СН3СООН + Сu(OН)2 = (CН3СОО)2Cu2+
Д/з уксусная кислота + NaOH
+ 2H2O
17.
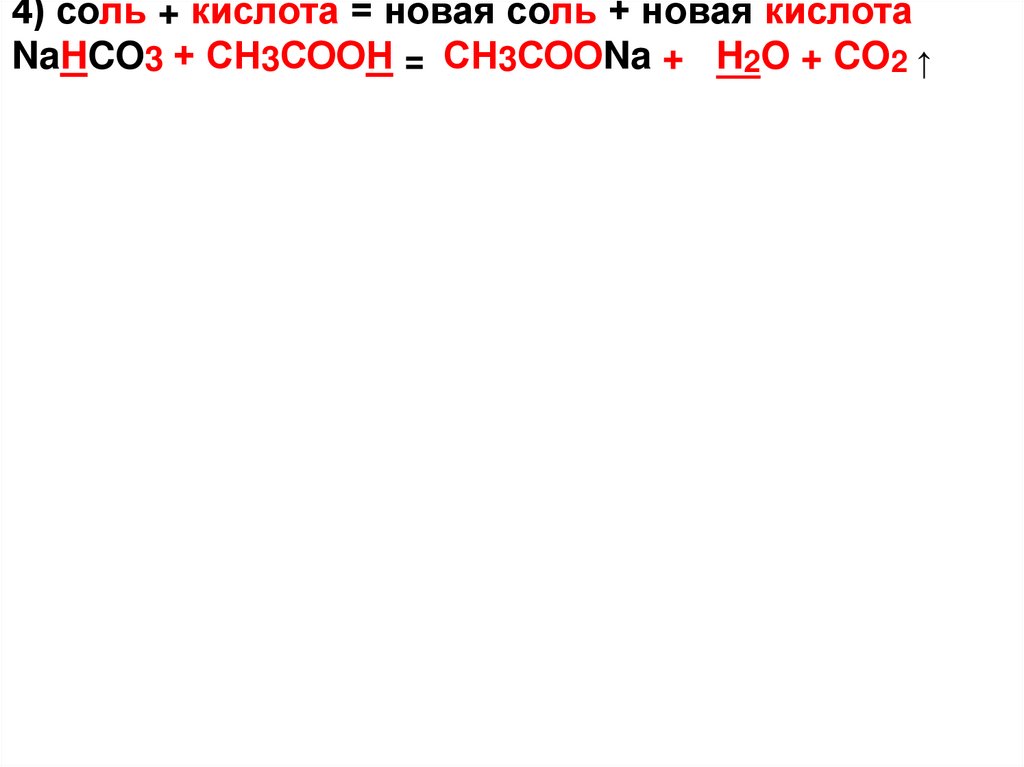
4) соль + кислота = новая соль + новая кислотаNaHCO3 + СН3СООН = СН3СООNa + H2O + CO2 ↑
5) кислота + спирт
сложный эфир и вода
реакция этерификации
о
СН3СН2С + H2O
и неорганические кислоты-гидроксиды! О-СН3
СН3СН2СО[ОН +H]О-СН3
д/з: муравьиная кислота+ пропанол-1
В чём причина сходства свойств
неорганических и органических
кислот?
18.
сстсвойства
Вещества
состав
стсстстроениест
стст
строение
ст
сст
19.
Причина общих свойствнеорганических и органических кислот
– присутствие ионов водорода
в их растворах.
Органические кислоты и их соли- одни
из немногих электролитов среди
органических веществ
А есть ли у органических кислот
свойства, по которым они отличаются
от неорганических? С какими в-вами
будут они реагировать? Тип реакции?
20.
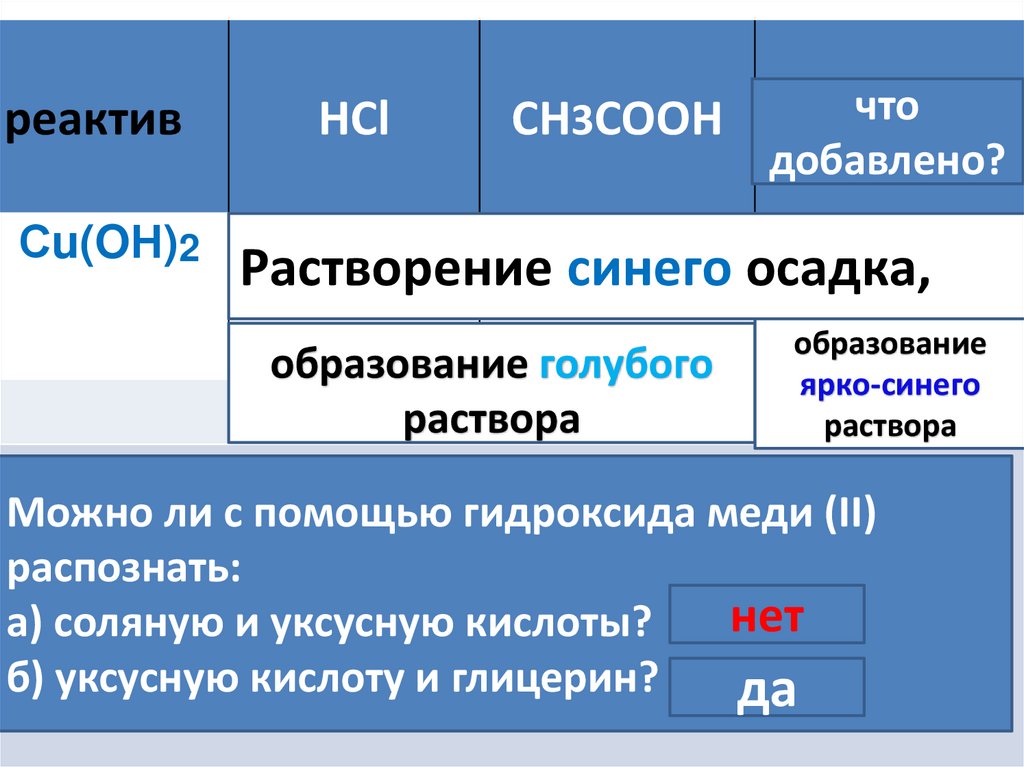
реактивСu(OН)2
HCl
CH3COOH
что
глицерин
добавлено?
Растворение синего осадка,
образование голубого
раствора
образование
ярко-синего
раствора
В
трёх
пробирках
находится
гидроксид
Можно ли с помощью гидроксида меди (II)
меди(II);к
распознать: первым двум добавили
а) соляную и уксусную
кислоты?
соляную
уксусную
кислоты.нет
б) уксусную
кислоту
и глицерин?
да
Что
добавили
в третью
пробирку?
21.
Домашнее задание- в презентации и пар.23 упр 1,
(для сдающих ЕГЭ -ниже)
22.
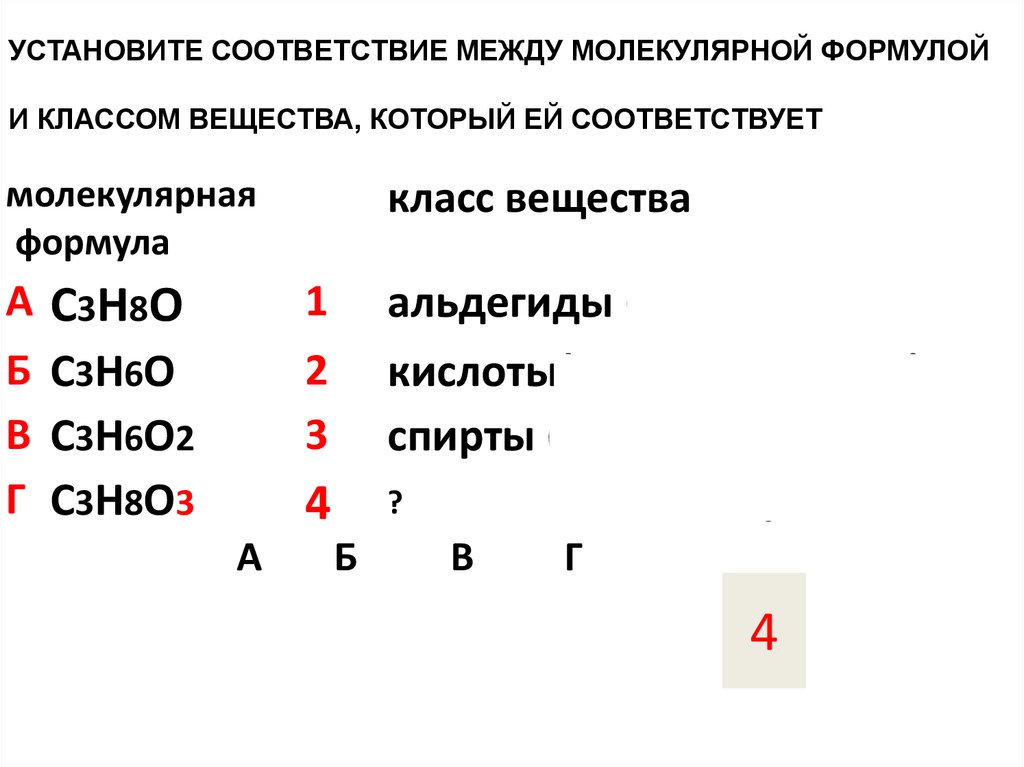
УСТАНОВИТЕ СООТВЕТСТВИЕ МЕЖДУ МОЛЕКУЛЯРНОЙ ФОРМУЛОЙИ КЛАССОМ ВЕЩЕСТВА, КОТОРЫЙ ЕЙ СООТВЕТСТВУЕТ
молекулярная
формула
А С3Н8О
Б С3Н6О
В С3Н6О2
Г С3Н8О3
класс вещества
1
альдегиды (кетоны)
кислоты(сложные эфиры)
спирты (одноатомные)
? ТРЁХатомные спирты
2
3
4
А
Б
В
Г
3
1
2
3 ?
4
23.
Установите соответствие между формулами веществ иреагентом, с помощью которого можно их различить
(для сдающих ЕГЭ)
А* НСООН и СН3СООН
1 натрий
Б С2Н5СООН и С2Н5ОН
2 аммиачный раствор оксида
серебра
В СН3СООН и СН3СНО
3 гидроксид меди (II) без
нагревания
Г СН2=СН2 и СН=СН
4 лакмус
Д СН2(ОН)СН(ОН)СН2ОН и СН3ОН









 Химия
Химия








