Похожие презентации:
Основы химической термодинамики. Лекция №4
1.
Основы химической термодинамикиСистема – тело или группа тел, мысленно выделенных из окружающей среды.
Окружающая среда – все, что находится за пределами системы.
Фаза – часть системы, ограниченная поверхностью раздела.
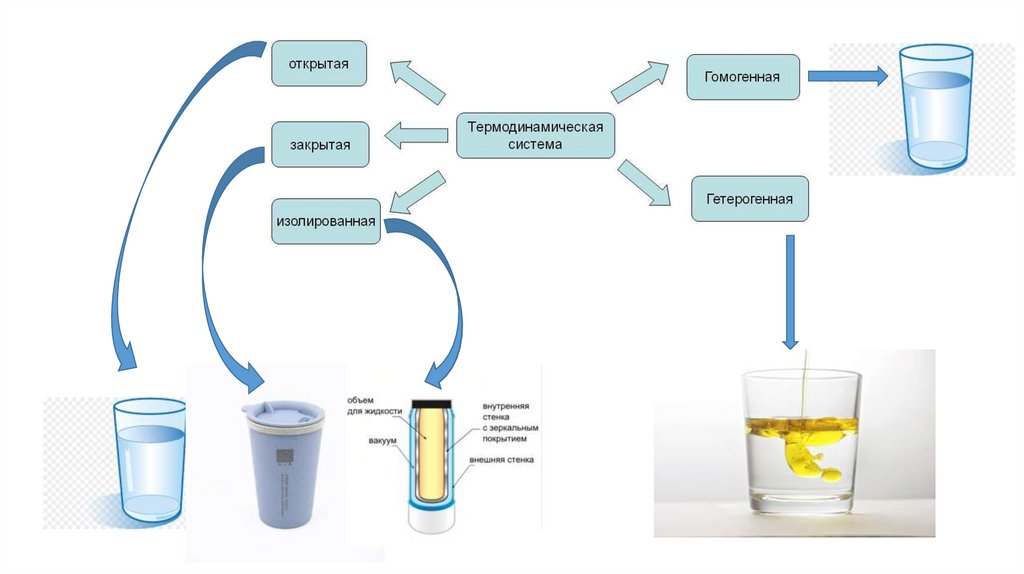
Классификация систем:
1. По отношению к окружающей среде.
Открытая система – обменивается с окружающей средой массой и энергией.
Закрытая система – обменивается с окружающей средой только энергией.
Изолированная система – не обменивается ни массой, ни энергией.
2. По количеству фаз в системе.
Гомогенная система состоит из одной фазы.
Гетерогенная система состоит из двух и более фаз.
2.
3.
Состояние системы - совокупность ее химических и физических свойств,которые подразделяются на термодинамические параметры состояния и
термодинамические функции.
Термодинамические параметры состояния – величины, которые могут быть
непосредственно измерены (давление Р, температура Т, концентрация С, объем V).
Математическое выражение, связывающее параметры состояния, называется
уравнением состояния:
PV = νRT,
где ν – количество вещества.
Уравнение Менделееева-Клапейрона
4.
Энергия системы -мера способности системы совершать работу, качественная мера
движения и взаимодействия материи.
Энергия является неотъемлемым свойством материи.
Полная энергия системы Потенциальная энергия, обусловленная положением тела в поле
некоторых сил (Eп), кинетическая энергия, обусловленная
изменением положения тела в пространстве (Eк) и внутренняя
энергия (U). Единица измерения – Джоуль (Дж).
5.
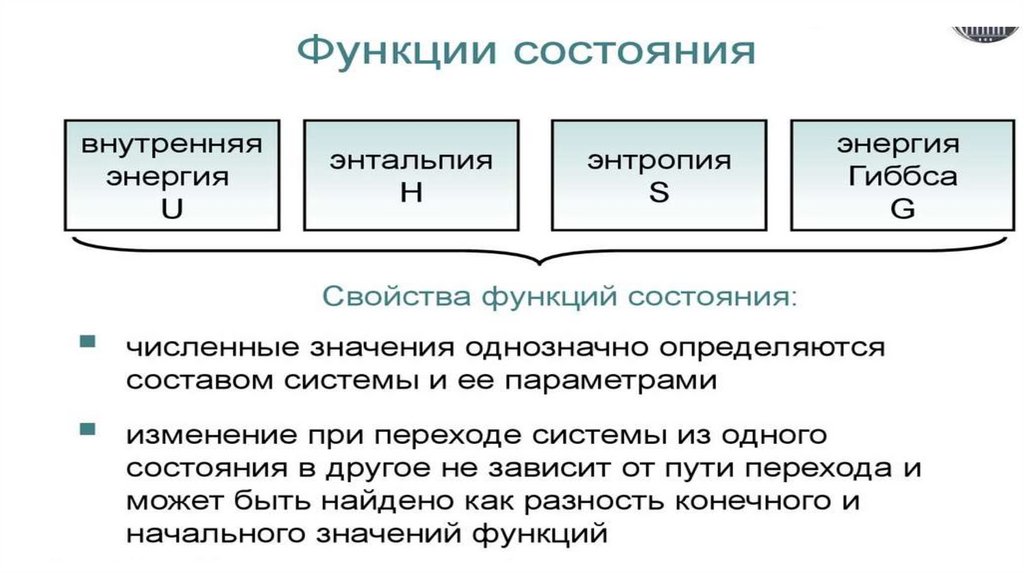
Термодинамические функции– величины, которые не могут быть непосредственно измерены
и зависят от параметров состояния.
Подразделяются
1. На функции состояния (U – внутренняя энергия; Н –
энтальпия; S – энтропия, G – энергия Гиббса, А – изохорноизотермический потенциал).
Измерение функций состояния не зависят от пути и способа
проведения процесса, а зависят только от начального и
конечного состояния системы.
Изменение функции, например, ΔU = U2 − U1, не зависит от того,
как осуществляется процесс.
6.
7.
2. Функции процессаQ – теплота; А – работа). Изменение функций
процесса зависит от того, в каких условиях и каким
путем протекал процесс.
(
8.
Теплота и работа– две разные формы передачи энергии от одной системы к другой или от системы к
окружающей среде.
Теплота — форма передачи энергии путём неупорядоченного движения молекул.
Передача энергии, вызываемая градиентом температуры, называется передачей
теплоты. Теплота не является параметром состояния системы. Например, вода в
стакане может иметь температуру 40 оС, но нельзя сказать, что вода содержит
теплоту. Если нагреть воду до 70 оС, то ей нужно передать некоторую энергию в
форме теплоты. Наоборот, при охлаждении воды до комнатной температуры часть
энергии передается окружающей среде в виде теплоты.
Итак, понятие «теплота» относится не к состоянию системы, а к какому-то процессу
ее передачи, т. е. теплота является функцией процесса. Единица измерения теплоты
– Джоуль (Дж). Если теплота поглощается системой, то величина ее количество в
окружающей среде уменьшается, Q<0. Если теплота выделяется в окружающую
среду, то величина Q>0.
9.
10.
Работа процесса –это энергия, передаваемая одним телом другому при их взаимодействии
и не зависящая от температуры. Система выполняет работу только если она
преодолевает внешнее сопротивление. В этом случае работа положительна
(А>0). Если работа выполняется над системой, то А <0. Пример – процесс
расширения и сжатия газа. То есть, работа также является функцией
процесса.
11.
S – площадьпоршня, Δh = h2
– h1
A = FΔh, F = PS
A = PS Δh = p ΔV
12.
Теплота и работа характеризуют качественно иколичественно две различные формы передачи
движения от данной части материального мира к
другой. Теплота и работа не могут содержаться в
теле. Теплота и работа возникают только тогда,
когда возникает процесс, и характеризуют только
процесс. В статических условиях теплота и работа
не существуют.
13.
14.
Q = ΔU + P ΔV15.
Классификация термодинамических процессовQ = ΔU + P ΔV
1. В зависимости от условий, в которых протекает процесс,
он может быть:
Изохорным – протекает при постоянном объеме системы (V =
const).
Изобарным – протекает при постоянном давлении в системе (Р
= const).
Изотермическим– протекает при постоянной температуре (Т =
const).
Изохорно-изотермическим – (V = const и Т = const).
Изобарно-изотермическим – (Р = const и Т = const).
Адиабатным – система не отдает теплоту в окружающую среду и
не получает теплоты из окружающей среды (Q = 0).
16.
2. В зависимости от способа проведения процесса1. Термодинамически обратимый процесс – после проведения
процесса окружающая среда и система могут вернуться в
первоначальное состояние. В результате такого процесса в
окружающей среде и в системе не происходит никаких
изменений, отсутствуют всякие энергетические потери, и
система совершает максимально возможную работу.
Обратимый процесс допускает возможность возвращения
системы в исходное состояние без того, чтобы в окружающей среде
остались какие-либо изменения. Все реальные процессы
необратимы.
17.
ТермохимияПри химических реакциях А – это работа против внешнего давления, т. е. в первом
приближении А= PΔV, где ΔV – изменение объема системы (V2 – V1). Так как большинство
химических реакций проводят при постоянном давлении, то для изобарно-изотермического
процесса (р=соnst, Т=const) теплота Q будет равна
Qp = ΔU + РΔV;
Qp = (U2 – U1) + p(V2 – V1);
Qp = (U2 + pV2) – (U1+ pV1).
Сумму U + pV обозначим через Н, тогда
Qp = H2 – H1 = ΔH. - энтальпия (теплосодержание)
Энтальпия – функция состояния системы, то есть, ее изменение не зависит от пути
процесса.
18.
19.
Химические реакции,в которых указан
тепловой эффект,
называются
термохимическими
уравнениями.
Приборы для
измерения тепловых
эффектов
называются
калориметрами
20.
21.
22.
23.
24.
25.
Все фазовые переходысопровождаются тепловыми
эффектами.
Тепловые эффекты биологических
процессов
Расход энергии6
Стирка – 10 кДж/мин
Ходьба – 16 кДж/мин
Бег – 40 кДж/мин
В сутки
Мужчины – 9200-12000 кДж
Женщины – 6700-8800 кДж
Калорийность продуктов, кДж/г
Масло – 30,41
Сыр – 16,82
Сахар – 16,80
Капуста – 1,25
Кабачки – 0,92
Пиво – 1,29 х 500 = 650 кДж
26.
Второе начало термодинамикиСамопроизвольные процессы
Не требуют затрат энергии извне (охлаждение, течение реки по склону,
взрывы)
Несамопроизвольные процессы
требуют затрат энергии (подъем тела, нагрев, разложение)
Первый закон термодинамики не описывает возможность и направление
протекания процесса.
Второй закон
•Определяет, какие процессы в данной системе и в данных условиях могут
протекать самопроизвольно
• Устанавливает предел возможного самопроизвольного протекания
процесса
• Дает возможность определить, какими должны быть внешние условия,
чтобы интересующий нас процесс шел в нужном направлении и в нужной
степени.
27.
Самопроизвольными являются такие процессы, которыесопровождаются диссипацией (рассеиванием) энергии без изменения ее
общего количества в мире.
Что такое рассеивание в физическом смысле? Это максимально
равномерное распределение энергии и вещества, при котором выравниваются
интенсивные (не зависящие от числа молей вещества в системе) параметры
системы (температура, давление, электрический потенциал, плотность,
концентрация.
Система с интенсивными параметрами, одинаковыми во всех частях
системы, является равновесной, в ней происходят только обратимые
процессы, ее свойства не меняются во времени. Такое состояние системы
является наиболее вероятным.
28.
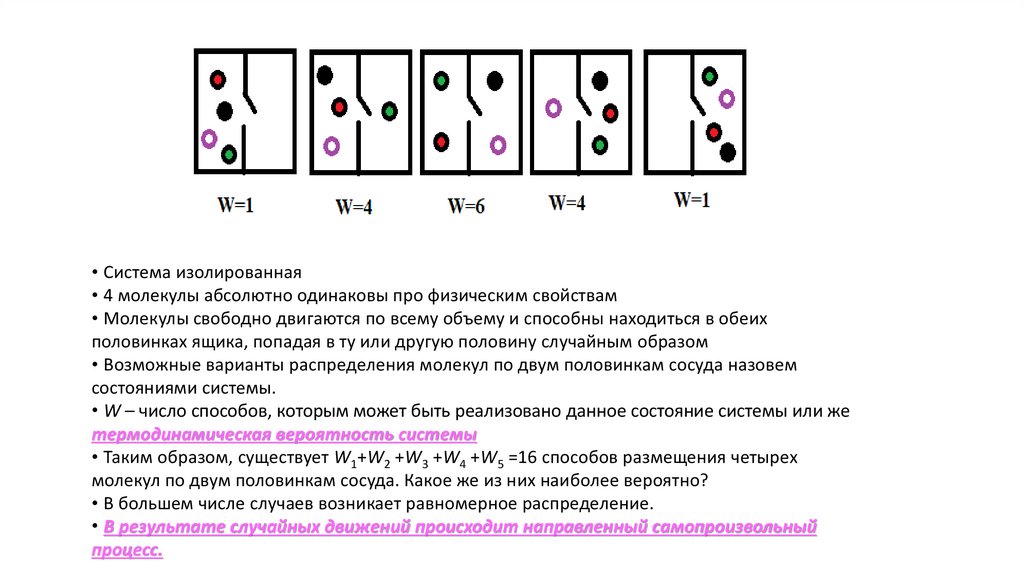
• Система изолированная• 4 молекулы абсолютно одинаковы про физическим свойствам
• Молекулы свободно двигаются по всему объему и способны находиться в обеих
половинках ящика, попадая в ту или другую половину случайным образом
• Возможные варианты распределения молекул по двум половинкам сосуда назовем
состояниями системы.
• W – число способов, которым может быть реализовано данное состояние системы или же
термодинамическая вероятность системы
• Таким образом, существует W1+W2 +W3 +W4 +W5 =16 способов размещения четырех
молекул по двум половинкам сосуда. Какое же из них наиболее вероятно?
• В большем числе случаев возникает равномерное распределение.
• В результате случайных движений происходит направленный самопроизвольный
процесс.
29.
С увеличением числа молекул вероятностьотклонения от равномерного распределения быстро
уменьшается и становится ничтожно малой для
макроскопических систем. Например, в объеме газа
0,2 мкм3 отклонение от средней плотности на 1%
происходит каждые 10-9 с. Вероятность того, что
плотность в объеме газа 1мм3 будет отличаться от
средней на 0,01 %, равна 10-60.
Для реальных веществ величина W = 10n, где n=10
1023 , т. е. W=10240.
Число частиц во Вселенной 10100
30.
Мерой вероятности существования системы в том или другомсостоянии является э н т р о п и я (S), связанная с
термодинамической вероятностью (W) уравнением Больцмана.
S = klnW ,
где k – это константа Больцмана, одна из фундаментальных
мировых констант;
k = 1,38 10-23 Дж/К.
Обратите внимание на порядок численного значения. Сравним
с числом Авогадро NA = 6,02 1023. Фундаментальные константы
показывают нам, что все в мире взаимосвязано.
31.
С увеличением термодинамической вероятности увеличивается и энтропия. Тоесть тенденция к равномерному распределению частиц, наблюдаемая в
самопроизвольных процессах, связана с увеличением энтропии (ΔS>0).
Чем меньшим числом способов описывается система, тем выше в ней порядок.
Следовательно, увеличение энтропии является мерой увеличения беспорядка в
системе.
при повышении температуры энтропия возрастает. Повышение температуры
определяется сообщением системе некоторого количества теплоты. В этом
случае изменение энтропии описывается формулой

































 Химия
Химия








